Как называют вирусы поражающие бактерии в чем особенности их строения
Журнал для профессионалов аптечного бизнеса
Регистрация
Вирусы против бактерий
Бактериофаги – одни из самых загадочных препаратов аптечного ассортимента. Сейчас они переживают второе рождение – и в нашей стране, и за рубежом снова возник к ним интерес, в журналах появляется не только пересмотр старых результатов, но и масса новых публикаций. Что можно рассказать покупателю, который заинтересовался именно этими средствами?
Вехи истории
Ученые обнаруживали следы жизнедеятельности бактериофагов задолго до того, как возникла вирусология. Британский бактериолог Эрнест Ханкин еще в 1896 году обратил внимание, что некий агент, способный проходить через очень тонкий фарфоровый фильтр, убивает возбудителя холеры. Развитию науки в новом направлении помешала Первая мировая, поскольку финансирование было перенаправлено разработчикам боевых газов, взрывчатых веществ и других более актуальных вещей.
Первооткрывателями бактериофагов считаются два исследователя – британский бактериолог Фредерик Творт, описавший странный фильтрующийся агент в 1915 году, и канадский микробиолог французского происхождения Феликс Д’Эрелль, независимо от Творта сообщивший о точно такой же находке в 1917-м.
За рубежом бактериофагами интересовались в первую очередь микробиологи, так что их находки не имели прикладного значения. Очень долгое время, например, фаг считался не вирусом, а ферментом. В СССР работы изначально велись медиками, в Грузии в 1923 году был создан будущий Всесоюзный центр фаготерапии, собравший на пике своего расцвета коллекцию из более чем 3 тыс. образцов. Однако затем и у нас, и за рубежом дело фаготерапии было практически уничтожено появившимися антибиотиками. Их массовое распространение после Второй мировой создавало впечатление, что изобретена панацея против инфекций и остальные направления исследований – тупиковые.
О бактериофагах ученые вспомнили, когда перед ними в полный рост встала проблема антибиотикорезистентности. Вирусы снова стали объектом экспериментов, в них увидели реальную альтернативу морально и иногда даже физически устаревшим противомикробным препаратам.
Натуральный враг
Бактериофаг, как следует хотя бы из названия, – вирус, пожирающий бактерии. По сути, это такой «грипп бактерий», только летальные исходы случаются куда чаще, чем в человеческом варианте.
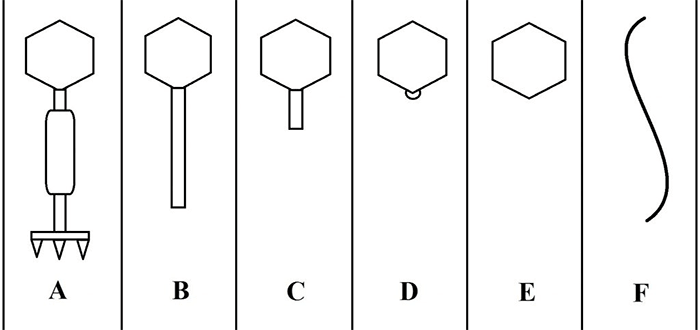
Фаги гораздо разнообразнее, чем какие-либо другие известные вирусы, нельзя сказать, что они выглядят однотипно. Чаще всего в качестве иллюстрации используется изображение вирусов группы А по классификации Бредли, она же – группа V по классификации Тихоненко. Такие вирусы устроены сложнее всего, в них имеется головка и отросток с множеством дополнительных элементов (рис. 1). Всего групп выделяют шесть, только в одной из них геном фага представлен одноцепочечной РНК, во всех остальных случаях – это одна- или двухцепочечная ДНК.
Бактериофаги нельзя назвать гигантами, но по своим размерам они, скорее, относятся к крупным и занимают промежуточное положение между самыми большими вирусами табачной мозаики и вирусом иммунодефицита человека 1-го типа (рис. 2).
Вирусы группы А (V) вводят свою ДНК в клетку-мишень очень красиво, процесс чем-то напоминает посадку исследовательского модуля на поверхность Луны или Марса – точно так же он сначала «присаживается» на «опоры», а затем прижимается к мембране бактерии своей базальной пластиной, «пробуравливает» оболочку жертвы и впрыскивает в цитоплазму свой геном. После этого бактериофаг можно считать мертвым, если так вообще можно сказать о вирусах.
Быстро или помучиться?
По механизму действия все бактериофаги можно разделить на две большие группы. Первая – литические, или вирулентные фаги, которые в 100% случаев убивают инфицированную клетку сразу. В случае, показанном на рисунке 3, вирус сразу же уничтожает геном бактерии, используя его исключительно для целей собственной репликации. После наработки максимально возможного числа новых вирусных частиц микроб либо сразу гибнет в момент их выхода, просто разрываясь на части, либо погибает в ближайшее время из-за того, что все критически важные внутренние механизмы физически уничтожены.
Вторая группа – лизогенные, или умеренные фаги. Их геном встраивается в геном носителя и может существовать там в стелс-режиме долгое время, передаваясь из поколения в поколение. Активируется эта «бомба с замедленным действием» под влиянием различных неблагоприятных внешних факторов вроде дефицита питательных веществ. Единичные фаги умеют сочетать оба варианта, отпочковываясь и не разрушая бактериальную клетку сразу, лишь используя часть ее мембраны в качестве оболочки, одновременно оставляя «закладку» в ее геноме. На одного микроба могут напасть сразу несколько фагов с разными механизмами взаимодействия.
Плюсы и минусы
По той же причине у фагов либо меньше побочных эффектов, либо их совсем нет. С резистентностью история схожая, она если и развивается, то только у конкретной бактерии-мишени. С помощью генной инженерии реально перепрограммировать вирус и натравить его на какого-нибудь другого возбудителя, еще не знакомого с вирусом.
Немаловажным фактором в пользу бактериофагов можно считать дешевизну и простоту их производства, особенно по сравнению с новыми перспективными антибиотиками. Действительно получается не менее, а иногда и более эффективная альтернатива с кратно меньшими вложениями.
Недостатки тоже есть, и они тесно связаны с вирусной природой фагов. Прежде всего, их сложно хранить и перевозить, они весьма требовательны к условиям содержания. Кроме того, фаги способны нападать только на свободно плавающие бактерии, внутрь человеческих клеток их никто не пустит. Агрессивная среда желудка уничтожает многие вирусы, не разбирая, кто пришел с миром, а кто нет. И главное, для достижения максимального эффекта терапии бактерию-возбудителя нужно фаготипировать, то есть выделить и в лабораторных условиях доказать, что против нее может быть применен вот этот конкретный вирус.
Факты
В СССР активно изучали медицинское применение бактериофагов, но публикации были либо на русском, либо на грузинском языках, поэтому мировая наука о них не знала и с удивлением изучает и цитирует их уже в наше время.
Работы по бактериофагам удостоены Нобелевской премии. В 1969 году она была присуждена американским исследователям Максу Дельбрюку, Альфреду Херши и Сальвадору Лурия за открытия, касающиеся механизма репликации и генетической структуры вирусов.
В ГРЛС зарегистрированы и обращаются на российском рынке следующие разновидности бактериофагов: брюшнотифозный, дизентерийный, против клебсиелл и отдельно – против клебсиеллы пневмонии, против кишечной палочки, протейный, сальмонеллезный, стафилококковый и против синегнойной палочки. Самый часто используемый в амбулаторной практике препарат – стафилококковый фаг.
Вирусы
Анастасия Шунаева
«Квантик» №10, 2013
Рис.1. Мумия Рамзеса V
Что нам в первую очередь приходит в голову, когда мы слышим про вирусы? Вы наверняка подумали о компьютерных вирусах — вредоносных программах, которые портят компьютер. Но ведь не просто так говорят заболевшему, скажем, гриппом: «Это вирусное, потому и температура 39!». Наверное, настоящие вирусы связаны с болезнями и эпидемиями, а компьютерные так назвали по аналогии. А вот кто такие эти настоящие — сейчас будем разбираться.
Кстати, первую вакцинацию провели именно против оспы, в 1796 году. Английский врач Эдвард Дженнер заметил, что доярки, переболевшие коровьей оспой (это не смертельное для человека заболевание), от чёрной оспы никогда не умирали. Тогда ему в голову пришло привить от этого смертельного заболевания восьмилетнего мальчика, Джеймса Фиппса, никогда не болевшего чёрной оспой (рис. 2). У заболевших коровьей оспой на коже образуются пустулы, или, по-другому, гнойные пузырьки. Дженнер внёс в ранку мальчика жидкость из пустул больной доярки. Пустулы появились и у Джеймса, но скоро исчезли. Тогда врач заразил мальчика чёрной оспой. «Смелый», надо сказать, поступок — результат был непредсказуем! Но Джеймс выжил и приобрёл иммунитет, а Эдвард Дженнер и термин «вакцинация» (от лат. «vacca», что означает «корова») вошли в историю.
Но и Дженнер не имел представления о том, что является причиной заболевания оспой. В XIX веке все болезнетворные организмы и вещества без разбора называли вирусами. Лишь благодаря опытам отечественного биолога Дмитрия Иосифовича Ивановского прекратилась эта путаница! Он пропускал экстракт заражённых табачной мозаикой 1 растений через бактериальные фильтры, сквозь которые не проходят даже самые мелкие бактерии. Выяснилось, что экстракт оставался по-прежнему заразным для других растений. Значит, возбудителями табачной мозаики были организмы, меньшие по размеру, чем бактерии; их назвали фильтрующимися вирусами. Вскоре бактерии перестали называть вирусами, а сами вирусы выделили в отдельное царство живых организмов. Дмитрий Ивановский же во всём мире по праву считается основателем вирусологии — науки о вирусах.
Рис. 2. Дженнер прививает Джеймса Фиппса от оспы
Но что мы пока поняли про вирусы? Только то, что они меньше бактерий. Чем же вирусы так не похожи на другие организмы? И почему понадобилось вдруг их выделять в отдельное царство? А вот почему. В отличие от других живых организмов, вирусы не имеют клеточного строения, а значит, и всех характерных для клетки структур. А ещё они единственные, кто не умеет самостоятельно производить белок, главный строительный материал всего живого. Поэтому их размножение невозможно вне заражённой клетки. Из-за этого многие учёные не без оснований считают вирусы внутриклеточными паразитами.
Жертвами различных вирусов становятся представители всех без исключения существующих царств живых организмов! Так, есть вирусы растений — вирус табачной мозаики (рис. 3, слева), вирус мозаики костра (это растение изображено на рисунке 3, справа), вирус желтухи свёклы, вызывающий иногда даже эпидемии. Кстати, в растение вирус просто так не проникнет. Заражение происходит при травмах растительных тканей. Типичный пример: тля пьёт сок из стебля и для этого протыкает покровные ткани — а вирус тут как тут.
Рис 3. Слева: листья табака, поражённые вирусом табачной мозаики. Справа: костёр (лат. Brómus) — род многолетних травянистых растений семейства Злаки. Если посмотреть на заросли костра в ветреную погоду, его крупные метёлки, склоняясь под ветром то в одну, то в другую сторону, отсвечивают красноватым светом в солнечных лучах, очень напоминая языки пламени. Отсюда, вероятно, и произошло русское название этого растения
Грибы тоже поражаются вирусами, вызывающими, например, побурение плодовых тел у шампиньонов или изменение окраски у зимнего опёнка. Причиной многих опасных заболеваний животных и человека тоже служат вирусы: вирус гриппа, ВИЧ (вирус иммунодефицита человека), вирус Эбола, вирус бешенства, герпеса, клещевого энцефалита и т. д.
Как же «живёт» вирус? В действительности, среди учёных до сих пор ведутся споры по поводу того, считать ли вирусы живыми организмами или нет. Сейчас поймём, почему. Вирус существует в двух формах. Вне хозяйской клетки все части вируса собраны в устойчивую конструкцию — вирион. Он не проявляет признаков жизни, однако «переживает» неблагоприятные условия среды, и довольно успешно. Если такой вирион проникает в клетку-мишень, то он там «раздевается». Раздевается — значит разваливается на части и эксплуатирует клетку для создания новых частиц — своего потомства. «Собранные» клеткой новые вирусные частицы затем покидают её в виде тех самых вирионов.
Рис. 4. Слева: вирус табачной мозаики. В центре: вирус мозаики костра похож на футбольный мяч (справа)
Рис. 5. Слева направо: вирус герпеса, аденовирус А человека, бактериофаг
Такая затейливая оболочка должна, наверно, служить защитой для чего-то? И правда, за ней скрывается наследственная информация вируса — её он передаёт потомству. Заражая клетку, некоторые вирусы не только размножаются там, но и безнадёжно её «портят». В итоге клетка или погибает, или ведёт себя неправильно. Пример такого неправильного поведения — раковая опухоль. Клетки в ней бесконтрольно делятся, тогда как нормальные клетки всегда способны вовремя остановиться. Вирусы могут служить причиной развития рака.
Рис. 6. Маленькие вирусы-спутники внутри гигантского мимивируса
Но не стоит думать, что вирусы причиняют исключительно вред другим организмам! Так, исследователи из Пенсильванского университета показали, что безвредный для человека вирус AAV2, встречающийся почти у всех людей, убивает самые разные виды раковых клеток. При этом здоровые клетки организма вирус не заражает.
А совсем недавно стало известно, что вирусы тоже болеют. Мимивирус, поражающий амёбу Acanthamoeba polyphaga, сам страдает от другого вируса-спутника (рис. 6). Он, кстати, так и называется — Спутник. Этот вирус-спутник использует механизмы воспроизводства мимивируса для собственного размножения, мешая ему нормально развиваться в клетке амёбы. По аналогии с бактериофагами, он был назван вирофагом, то есть пожирающим вирусы. Можно сказать, что присутствие вируса-спутника в амёбе обеспечивает ей больше шансов на выживание в борьбе с мимивирусом.
Уф. на этом месте предлагаю пока остановиться. Итак, узнав чуть больше про вирусы, мы, надеюсь, не станем судить их очень строго, понимая, что иногда они могут быть полезны, и не только нам! А вообще вирусология — молодая наука. Многое, конечно, уже известно, но сколько всего ещё предстоит узнать! Присоединяйтесь!
1 Распространённое вирусное заболевание растений табака.
2 Бактериофáги, или фáги (от др.-греч. φαγω — «пожираю») — вирусы, избирательно поражающие бактериальные клетки.
Пожиратели бактерий: убийцы в роли спасителей
Пожиратели бактерий: убийцы в роли спасителей
«Враг моего врага — мой друг» — это утверждение как нельзя лучше выражает главную причину интереса человека к вирусам бактерий. Фото фагов: Claudius Schulze.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Сегодня в связи с нарастающей проблемой антибиотикорезистентности ученые всего мира ведут поиски новых антибиотиков и способов борьбы с инфекционными заболеваниями. И всё больше ученые оглядываются на естественный, но почти забытый метод — фаготерапию. Бактериофаги — природные враги бактерий, существовавшие задолго до появления человека. Почему же мы не используем их вместо антибиотиков, которые привели к такой глобальной проблеме, как резистентность бактерий, ну или хотя бы в дополнение к ним? Что это за диковинные создания и могут ли они быть полезны человеку? Безопасны ли они? В этом обзоре мы попытались собрать воедино имеющиеся данные о бактериофагах и показать вам, насколько красив и многообразен их невидимый мир.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2016.
Спонсор номинации — Future Biotech, проект, объединяющий профессионалов и энтузиастов в области биологии и биотехнологий.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Спонсор публикации этой статьи — Виктор Татарский.
ХХ столетие называют веком атома, нейлона и антибиотиков. С началом массового применения пенициллина в 1943 году медики всего мира получили мощнейший механизм для защиты организма от атак, казалось бы, всех болезнетворных бактерий. И ученые, подхватив знамя антибиотикотерапии, ринулись на поиски и разработку новых антибактериальных средств. Но если мирный атом и синтетические материалы с лихвой оправдали возложенные на них ожидания, то надежды на всемогущество антибиотиков, увы, постепенно тают: резистентность бактерий к ним становится всё шире. 16 сентября 2000 года на Всемирном дне резистентности в Торонто была принята Декларация по борьбе с бактериальной резистентностью [1], а годом позже ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, в тексте которой есть такие строки: «Без согласованных действий всех стран многие великие открытия, сделанные учеными-медиками за последние 50 лет, могут утратить свое значение из-за распространения антибиотикорезистентности» [2]. Означает ли это, что мы в скором времени вновь окажемся бессильны перед бактериями? Существуют ли альтернативные подходы к борьбе с инфекционными заболеваниями? К счастью, да. Один из них — применение бактериофагов, самых многочисленных, древних и распространенных на нашей планете вирусов [3], существующих на Земле свыше 3 млрд лет и неоправданно заброшенных исследователями в 1960–1970-е годы на фоне успехов антибиотикотерапии.
Открытие
Несомненно, многие бактериологи наблюдали и описывали проявления действия фага на бактериальные культуры. В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальное действие воды индийских рек, пришел к выводу о существовании агента, проходящего через бактериальные фильтры и вызывающего лизис холерных вибрионов. По некоторым данным, российский микробиолог Н.Ф. Гамалея в 1897 году наблюдал лизис бацилл сибирской язвы. Однако первая научная публикация о фагах — статья 1915 года английского микробиолога Ф. Туорта, в которой он описал инфекционное поражение стафилококков, значительно изменявшее морфологию колоний. Инфекционный агент свободно проходил через бактериальные фильтры, и его можно было переносить из одной колонии в другую. Туорт выдвинул несколько гипотез, объясняющих это явление, в частности — гипотезу о фильтрующемся вирусе, подобном вирусам растений и животных. Однако его работа не привлекла внимания ученых, а Туорт забросил ее из-за службы в армии: началась Первая мировая.
В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщил об открытии вируса, «пожирающего» бактерий, — бактериофага [4]. Микробиологи того времени считали, что чума свиней вызывается совместным действием микроба и вируса. Д’Эрелль предположил, что схожая этиология и у дизентерии. С помощью свечей Шамберлана он отфильтровал фекалии больных дизентерией и добавил их в пробирки с культурами шигелл, намереваясь ввести смесь бактерий и предполагаемого вируса экспериментальным животным. Однако на следующие сутки он обнаружил, что бульон, в котором росли шигеллы, стал прозрачным, что свидетельствовало о гибели бактерий. Профильтровав бульон из этих пробирок, он снова заразил полученными фильтратами культуры шигелл. И вновь на следующие сутки он обнаружил, что бульон стал прозрачным. Полученное «литическое начало» можно было бесконечно пассировать от одной культуры к другой, что привело Д’Эрелля к мысли о существовании вируса, разрушающего бактерии. В дальнейшем он обнаружил фаги стафилококка, холерного вибриона и сальмонеллы. Учитывая эффективность фагов против патогенных микроорганизмов и их широкое распространение в природе, Д’Эрелль предположил, что они играют определенную роль в развитии иммунитета к инфекционным заболеваниям и выздоровлении.
В 1920–1940-е годы было проведено множество исследований по клиническому применению бактериофагов, однако стабильных результатов получено не было, и на Западе бактериофаги стали в основном объектом изучения биологов. В 1931 году Совет фармации и химии Американской медицинской ассоциации опубликовал обзор 150 работ по фаготерапии, в котором M. Итон и С. Бэйн-Джонс [5] утверждали, что природа фага неживая; возможно, это фермент, и ошибочно связывать воздействие фага на бактерии или его терапевтический эффект с его жизнедеятельностью. Такие выводы способствовали существенному сокращению капиталовложений в исследования по медицинскому применению фагов на Западе.
В СССР в ранние годы бактериофагам уделяли достаточно внимания. В 1923 грузинский микробиолог Г.Г. Элиава, ученик Д’Эрелля, основал в Тбилиси Институт бактериофагов, ставший впоследствии Всесоюзным центром фаготерапии, коллекция которого на сегодняшний день составляет около 3000 фаговых штаммов. Однако успешное применение антибиотиков в 1960–1970-е годы практически похоронило идеи фаготерапии. Так, например, в Большой советской энциклопедии указано: «Антибиотики и другие химиотерапевтические средства оказались эффективнее фагов, в связи с чем их применение с лечебной целью сузилось».
Происхождение
Вопросом о природе бактериофага задавался еще Туорт в своей первой статье. Д’Эрелль в своем фундаментальном труде выдвинул несколько теорий (гипотез) происхождения фагов, из которых две сохранили значение до настоящего времени: «теория вируса» и «регрессивная теория».
В рамках вирусной теории бактериофаги, подобно вирусам растений и животных, рассматриваются как прямые потомки неких очень примитивных форм, существовавших еще до появления клеток, и представляют собой автономные агенты, являющиеся облигатными паразитами бактерий. Этой теории придерживался Д’Эрелль в самом начале своих исследований, и ее принимало как нечто само собой разумеющееся большинство вирусологов. Но эта концепция, по сути, мало что дает, так как в применении к вирусам такие термины, как автономность и паразитизм, трудно поддаются определению, а сама гипотеза сложно доказуема, поскольку нет ископаемых останков вирусов, а их родственные связи можно изучать только методами молекулярной филогенетики [6].
Согласно регрессивной теории, фаги постепенно развивались из более сложных форм жизни путем утраты всей протоплазмы, ненужной для присущего бактериофагу способа существования. Эта гипотеза лучше вписывается в современную биологию, так как промежуточные стадии процесса дегенерации довольно легко себе представить, а постепенную утрату бактериями способности к синтезу можно изучать экспериментально.
Вполне возможно, что бактериофаги произошли из примитивного полового аппарата бактерий, первоначально развившегося для передачи генетического материала от одной бактериальной клетки к другой. Это могло бы объяснить, почему некоторые фаги и в настоящее время способны выполнять эту функцию путем лизогенной конверсии. Теория предполагает, что генетический материал фагов — это редуцированный и модифицированный нуклеоид бактерий, сохранивший гомологию с «прародителем» и потому способный с ним рекомбинировать или даже частично замещать его. Это могло бы объяснить свойства умеренных фагов, способных встраиваться в определенные локусы ДНК клетки-хозяина, становясь частью бактериального наследственного аппарата. В процессе эволюции умеренные фаги могли путем дальнейших мутаций, влияющих на спектр литического действия [7], необратимо превращаться в вирулентные, поражающие хозяев, с которыми они не имели генетического родства. Согласно этой теории, различные штаммы фагов филогенетически не связаны друг с другом, и определенный фаг даже может быть филогенетически ближе клетке-хозяину, нежели другим фагам. Отсюда следует, что если данная теория верна, то между бактериофагами и вирусами животных и растений нет никакого родства, а фенотипическое сходство — чисто внешнее, обусловленное сходной экологией.
Тем не менее биоинформатические подходы — сравнения огромных массивов геномов и фолдингов белков, а особенно «архитектуры» фаговых частиц — всё же позволяют находить у бактериофагов, фагов архей и вирусов в целом филогенетически общие признаки [3], [8].
Строение и классификация
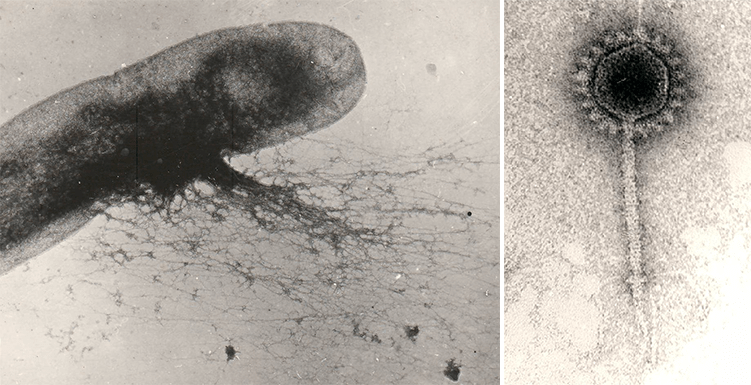
На протяжении почти 70 лет бактериофаги, как и другие вирусы, были для биологов такими же невидимыми, как атомы для физиков, в силу их субмикроскопических размеров. И только в 1942 году, с помощью недавно изобретенного (М. Кнолль, Э. Руска, 1931 г.) электронного микроскопа, будущий нобелевский лауреат С. Лурия (Колумбийский университет) и Т. Андерсон (RCA-лаборатория, Камден, Нью-Джерси) получили первые фотографии бактериофага Т2, или «анти-коли РС», как его называли Лурия и Андерсон (рис. 1).
Рисунок 1. Изображения бактериофага Т2, полученные С. Лурия и Т. Андерсоном с помощью просвечивающего электронного микроскопа: а — первая в мире фотография бактериофага (2 марта 1942 г.); б — бактериофаг Т2 в культуре Escherichia coli (2 марта 1942 г.); в — Т2 «крупным планом» (29 марта 1962 г.).
[42] (фото а и б)
Рисунок 2. Микрофотография фага Т2, полученная с помощью сканирующего электронного микроскопа.
Фаги весьма разнообразны по морфологии — в отличие от вирусов животных и растений. Все известные в настоящее время вирусы эукариот имеют либо форму многогранника (икосаэдра), либо спиралевидный тип симметрии. Что же касается фагов, то среди них тоже встречаются формы со спиралевидным или кубическим типами симметрии, но подавляющее число изученных к настоящему времени фагов сочетает в одной частице оба типа: кубический — у головки, а спиралевидный — у отростка (рис. 2). Столь своеобразное строение фагов, отличающее их от других вирусов, объясняется наличием у бактерий ригидной клеточной стенки, которая исключает возможность проникновения вирионов в клетку путем пиноцитоза или виропексиса. Такая структурная особенность бактерий способствовала формированию у фагов других способов инфицирования, что и нашло отражение в их облике.
Именно морфология легла в основу современной классификации бактериофагов. Казалось бы, целесообразнее разделять фаги по принципу их связи с определенным видом микроорганизма, который они поражают, — что и легло в основу первых классификаций. Но этот принцип не обеспечивает необходимой точности, так как один штамм фага может поражать разные микроорганизмы, то есть иметь широкий литический спектр. И наоборот, один вид бактерий может поражаться несколькими фагами, различающимися между собой по целому ряду свойств, в том числе морфологически, тогда как фаги, активные в отношении разных видов и даже родов микроорганизмов, могут быть морфологически тождественны.
Были попытки классифицировать фаги и по сумме признаков (антигенных, физиологических, биохимических, физико-химических, морфологии негативных колоний, спектру литического действия и т. п.).
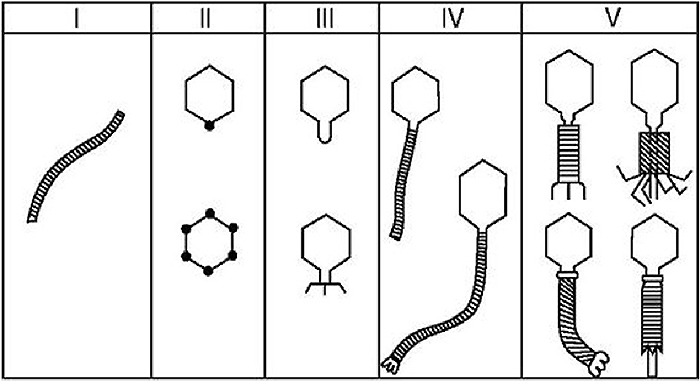
С развитием электронной микроскопии появилась возможность классифицировать фаги по морфологии. Дэвид Бредли в 1967 году предложил разделить фаги на шесть морфологических групп: с A по F (табл. 1, рис. 3). Вторая используемая классификация, предложенная А.С. Тихоненко в 1968, объединяет фаги групп D и E в одну (табл. 1, рис. 4). Микрофотографии фагов, относящихся к разным морфогруппам, представлены на рисунках 5 и 6.
| Группа по Бредли | Группа по Тихоненко | Морфология | Тип нуклеиновой кислоты |
|---|---|---|---|
| A | V | С сокращающимся отростком | Двухцепочечная ДНК |
| B | IV | С длинным несокращающимся отростком | Двухцепочечная ДНК |
| C | III | С коротким несокращающимся отростком | Двухцепочечная ДНК |
| D | II | Без отростка, с капсомерами | Одноцепочечная ДНК |
| E | II | Без отростка и капсомеров | Одноцепочечная РНК |
| F | I | Нитевидные | Одноцепочечная ДНК |
Рисунок 3. Схематическое изображение фаговых морфогрупп по Бредли (1967).
рисунок автора статьи
Рисунок 4. Схематическое изображение фаговых морфогрупп по Тихоненко (1968)
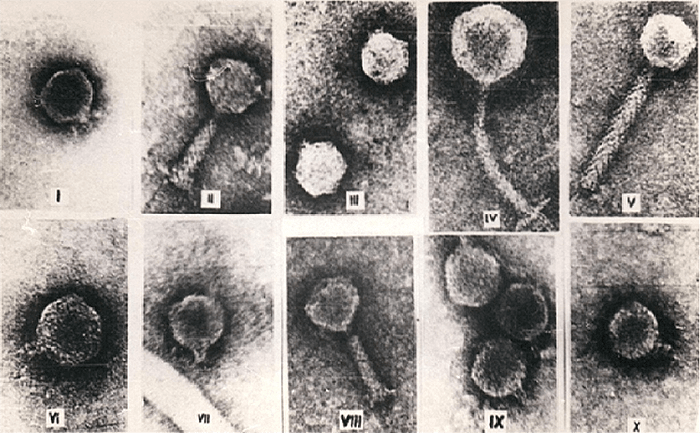
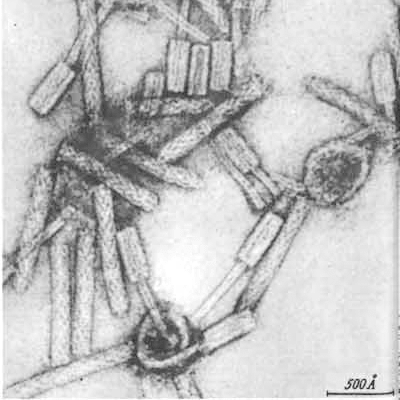
Рисунок 5. Различные морфоварианты бактериофагов.
микрофотографии автора статьи
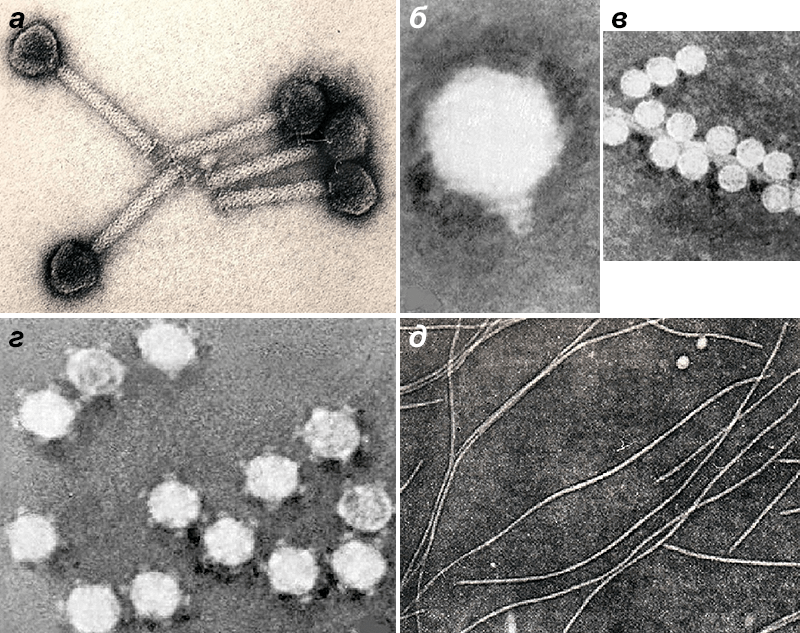
Рисунок 6. Микрофотографии бактериофагов из разных морфогрупп: а — фаг 1997 Yersinia enterocolitica с длинным несокращающимся чехлом; б — фаг Т3 с коротким отростком; в — фаг МS2 без отростка; г — фаг Х174 без отростка, с капсомерами; д — нитчатый фаг Fd.
микрофотографии автора статьи
Рисунок 7. Схема строения вириона фага семейства Myoviridae
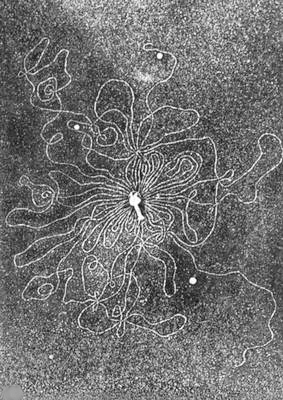
Большинство фагов состоит из головки диаметром 45–140 нм и отростка («хвоста») толщиной 10–40 нм и длиной 100–200 нм (рис. 7). Так выглядят представители порядка Caudovirales («хвостатых фагов»), и именно их образ обычно извлекается из памяти при упоминании термина «бактериофаг». Содержимое головки состоит преимущественно из плотно упакованной молекулы ДНК или (реже) РНК, длина которой во много раз превышает размеры головки и достигает 60–70 мкм (рис. 8), и иногда небольшого количества белка — например, ферментов, которые осуществляют первичную транскрипцию генетического материала фага или способствуют ей. Капсид представляет собой белковую или (не у Caudovirales) липопротеиновую оболочку, собранную из множества копий одного или двух белков. Капсид может быть икосаэдрическим, сферическим, лимоновидным или плеоморфным [9], и именно он, по сути, определяет размер фагового генома.
Рисунок 8. Микрофотография бактериофага с высвободившейся нитью ДНК.
Отросток представляет собой белковую трубку, окруженную у ряда бактериофагов (семейства Myoviridae, типовой представитель которого — фаг Т4) чехлом, состоящим из сократительных белков, подобных мышечным, благодаря чему он способен сокращаться, обнажая часть стержня. С головкой отросток стыкуется с помощью белкового кольца — «портала» («воротничка»). На противоположном конце, в основании, отросток содержит лизоцим (как домен белка, пронзающего клеточную стенку), служащий для точечного растворения пептидогликана. Возможно и нахождение в основании отростка АТФазы, обеспечивающей энергией инъекции нуклеиновой кислоты в бактерию [10]. Там же у фагов такого типа имеется гексагональная базальная пластинка с несколькими шиповидными выростами и тонкими длинными нитями, с помощью которых фаг распознает рецепторы «своих» бактерий и прикрепляется к ним.
Нитевидные фаги имеют размеры 8×800 нм и лишены выраженных «органов».
Бактериофаги довольно устойчивы к воздействию различных химических и физических факторов. Они выдерживают колебания рН в пределах 5,0–8,0; большинство резистентно к действию холодных водных растворов глицерина и этанола, а также цианидов, фторидов, динитрофенола, хлороформа, тимола и фенола. Бактериофаги хорошо сохраняются в лиофилизированном состоянии, но разрушаются при кипячении, УФ-облучении, действии некоторых химических дезинфектантов (в частности, кислот и формалина). Фаги хорошо сохраняются при низких температурах (до −200 °С в глицерине), но быстро инактивируются при 65–70 °С [10].
Взаимодействие с бактериями
Фаги — облигатные внутриклеточные паразиты, так как у них нет механизмов для выработки энергии и рибосом для синтеза белка. Размножение фага происходит только внутри бактерии-хозяина и посредством ее синтетической машинерии. Важным свойством бактериофагов является их специфичность: фаги могут поражать определенный вид бактерий (моновалентные фаги) или же только избранные штаммы/варианты внутри вида (типовые фаги, например, фаги V. cholerae classica и El Tor), но некоторые не столь разборчивы и поражают бактерий разных видов и даже родов (поливалентные фаги) [11]. Тем не менее очень сложно судить о специфичности фагов в природных условиях, поскольку там действуют многочисленные методологические ограничения и популяционные закономерности, и порой один и тот же фаг можно принять как за «генералиста», так и за «специалиста» [12].
По характеру действия на бактерии различают вирулентные и умеренные фаги.
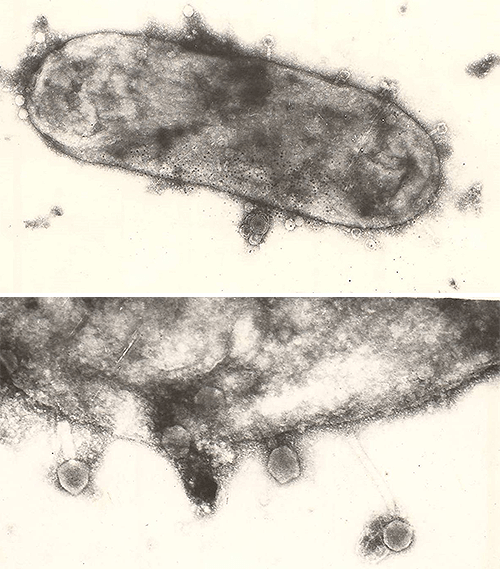
Рисунок 9. Адсорбция фага PIcmlclr 100ts на поверхности Yersinia pestis.
микрофотографии автора статьи
Рисунок 10. Лизис E. coli и выход фаговых частиц. Справа — зрелая форма бактериофага.
микрофотографии автора статьи
Но некоторые фаги способны покидать клетку без лишнего шума. Так делает, например, фаг L2, паразитирующий в бактериях рода Acholeplasma, лишенных клеточной стенки (их знаменитые родственники — микоплазмы). Вначале он проходит все стадии, соответствующие определению «литический цикл» — но за исключением собственно лизиса хозяина: вирионы как бы отпочковываются от бактерии, захватывая небольшие участки ее мембраны, которые становятся оболочкой фага. После такого деликатного литического цикла L2 может приступить к лизогенизации [20].
Рисунок 11. Дефектные фаги — пиоцины (бактериоцины Pseudomonas aeruginosa). Многие бактерии (особенно γ-протеобактерии) экспонируют на своей поверхности тейлоцины (tailocins) — «перевернутых безголовых фагов». Эти фаговые хвосты незаменимы в конкурентной борьбе бактерий с близкими родственниками (такие структуры называют бактериоцинами), а иногда служат для поражения эукариотических клеток (PLTS, фагоподобные структуры для транслокации белков). Гены тейлоцинов бактерии заимствовали у различных профагов семейств Myoviridae и Podoviridae, причем ДНК одной бактерии может содержать несколько генетических кластеров разных тейлоцинов наряду с полноценными родственными либо неродственными профагами, кодирующими все «запчасти» вириона [43]. Размножаться «дефектные фаги» не могут из-за отсутствия головки с ДНК, однако множественные отростки на поверхности клетки-хозяина способны подобно шприцам с токсичным содержимым повреждать клетки жертв.
микрофотография автора статьи
Бактериальный иммунитет
Казалось бы: если бактериофаги атакуют любых бактерий и их численность настолько велика (фаги — самые многочисленные вирусные формы в биосфере Земли, их общее количество — 10 30 –10 32 фаговых частиц [21], что примерно равно количеству бактерий, 4–6×10 30 ), то почему они до сих пор не уничтожили всех бактерий? Ответ очевиден: в процессе эволюционного соразвития бактерии выработали своего рода иммунитет против фагов. Причем иммунитет многослойный. Во-первых, бактерия может быть изначально лишена рецепторов к тому или иному фагу или лишиться их посредством мутаций. Во-вторых, бактерия может быть иммунизирована уже «прописавшимися» в ней профагами, которые с помощью специфических репрессоров просто не дадут вновь прибывшим сородичам размножиться. В-третьих, бактерия (или ее мобильные генетические элементы) кодирует рестрикционно-модификационные системы, которые просто рубят на кусочки нуклеиновые кислоты, не содержащие особых метильных меток — подписей «я свой».
А в-четвертых. В 2005 году стало известно, что функциональной основой бактериального иммунитета является система CRISPR [22], двумя годами позже — что для ее работы критически важен белок Cas, а в 2012-м уже появилась возможность создания инженерных систем на основе CRISPR-Cas9 Streptococcus pyogenes [23]. Работа системы CRISPR-Cas основана на том, что небольшой фрагмент, вырезанный из проникшей в бактериальную клетку фаговой ДНК, вставляется в специальный участок (локус CRISPR) генома бактерии. Каждый локус CRISPR содержит множество таких вставок (спейсеров, разделенных особыми короткими нуклеотидными повторами), представляющих собой фрагменты ДНК встреченных когда-либо фагов и плазмид. На основе спейсеров синтезируются молекулы РНК, комплементарные соответствующему участку фагового (или плазмидного) генома. Эти РНК в комплексе с белками Cas затем опознают и обезвреживают мишень — чужеродную ДНК с комплементарной последовательностью нуклеотидов. Таким образом, если в клетку однажды проникла фаговая ДНК, но клетка выжила и встроила фрагмент чужеродного генома в свой нуклеоид, то последующие попытки таких же фагов эксплуатировать клетку или ее потомков будут неэффективны [24].
Впрочем, бактериофаги за счет случайных мутаций и отбора умеют обходить системы CRISPR-Cas. Чтобы конкретный спейсер потерял эффективность, достаточно даже незначительного изменения комплементарного ему фрагмента фагового генома. Поэтому фаги успешно и довольно быстро преодолевают приобретенный иммунитет бактерий за счет точечных мутаций. С другой стороны, системы CRISPR очень широко распространены у бактерий и, судя по всему, обеспечивают своим обладателям надежную защиту. Эффективность CRISPR обеспечивается тем, что даже две разные бактерии одного и того же штамма встраивают в свой геном разные спейсеры, соответствующие разным участкам генома фага. В результате популяция бактерий быстро приобретает генетическое разнообразие, что значительно повышает их шансы на выживание. Точечные мутации, «обезвреживающие» один спейсер, позволят фагам заразить только небольшую часть бактериальной популяции. К тому же, бактериофаг не может определить заранее, какие спейсеры имеются у конкретной клетки. Поэтому большинство фагов в полиморфной популяции бактерий погибает даже при высокой скорости появления точечных мутаций.
Такой феномен коллективного бактериального иммунитета был продемонстрирован на бактериях P. aeruginosa и фагах DMS3vir [28]. Для начала ученые убедились, что система CRISPR действительно защищает бактерий от данной разновидности фагов, а культуры бактерий с отключенной CRISPR-системой активно этим фагом поражаются, хотя и выработали иную форму защиты: у них распространились мутации, меняющие рецептор, к которому прикрепляется фаг. Такой способ защиты оказался менее эффективным, так как по истечении 30 суток эксперимента бактериофаги всё еще находились в популяции. Чтобы доказать, что разнообразие спейсеров системы CRISPR-Cas — основа эффективности коллективной иммунной защиты, ученые сравнили устойчивость к фагам у бактериальных популяций с разным уровнем разнообразия спейсеров. Оказалось, что фаги в монокультурах бактерий уже в первые сутки приобретали мутации, нейтрализующие соответствующие спейсеры. У фагов же в популяциях, составленных из нескольких клонов бактерий с различными спейсерами, устойчивость формировалась лишь в немногих случаях. В популяциях, сформированных из 24–48 клонов, фаги не смогли преодолеть защиту CRISPR-Cas.
Отсюда следует, что в монокультуре единичная мутация фаговой ДНК, обеспечивающая защиту от конкретного спейсера, позволяет фагу заразить любую бактерию, а в полиморфной культуре из 48 клонов точно такая же мутация обеспечивает успех с вероятностью лишь 1/48. Даже при условии, что ДНК фага встроится в бактерию, защиту которой он преодолел, его потомки снова столкнутся с той же проблемой, и она будет усугубляться по мере снижения численности бактерий, чувствительных к этому фагу.
Таким образом, точечные мутации и отбор — недостаточно эффективная для вирусов эволюционная стратегия, что объясняет успешность систем CRISPR-Cas и их широкое распространение у бактерий. Но тогда почему бактериофаги до сих пор не «вымерли» — раз эта система так эффективна? Не так давно у них обнаружили особые гены, подавляющие работу CRISPR [29]. А что же могут противопоставить бактерии? Ответ, опять же, в разнообразии: существует много разных вариантов системы CRISPR, каждый из которых уязвим только для некоторых анти-CRISPR-генов и защищен от других. Содержать же в своем геноме множество подобных генов бактериофаги не могут, так как отбор у них ведется преимущественно в направлении компактизации генома — в угоду увеличению скорости размножения.
Такая антагонистическая коэволюция фагов и бактерий, протекающая параллельно на разных уровнях и в разных временных масштабах (формирование новых спейсеров бактериями — точечные мутации фагов, выработка новых генов анти-CRISPR — формирование новых вариантов системы CRISPR) позволяет соблюдать баланс в системе «бактериофаг — бактерия» на уровне одной популяции и биоценоза в целом [28], [30].
Получение бактериофагов
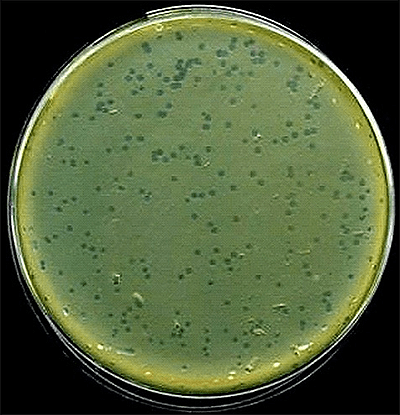
Рисунок 12. Фаговые бляшки (зоны лизиса на культуре E. coli).
Бактериофаги широко распространены в природе. Везде, где есть бактерии — есть фаги. Их можно выделить из открытых полостей организма человека и животных, водоемов, сточных вод, почвы, из соответствующих культур бактерий и т.д. Большое количество бактериофагов находится в выделениях больных людей и животных, особенно в период выздоровления от инфекционных заболеваний.
Таким образом, поиск и выделение новых фагов не представляет трудности. Для выделения бактериофага исследуемый материал (воду, испражнения, гной, почву и др.) засевают в жидкую питательную среду, инкубируют в термостате, и через сутки помутневшую жидкость пропускают через бумажный, а затем через бактериальный фильтры, асбестовые пластины, керамические свечи. Полученный фильтрат исследуют на наличие бактериофага путем совместного посева с подходящей микробной культурой на плотные или в жидкие питательные среды. Если бактериофаг выделился, то после 18-часовой инкубации на поверхности агара вырастает сплошной газон культуры с прозрачными бляшками — зонами лизиса (рис. 12). В бульоне бактериофаг обусловливает просветление среды.
Для выделения чистой культуры бактериофага материал из отдельной бляшки переносят бактериологической иглой в суспензию молодой микробной культуры.
Материал из вновь возникшего стерильного пятна засевают вместе с фагочувствительными микробами в жидкую питательную среду. После 6–18 часов инкубации среду фильтруют и получают чистую культуру бактериофага.
Для изготовления серийного препарата бактериофага применяют только апробированные штаммы и культуры микробов, обладающие типичными морфологическими, биохимическими и серологическими свойствами. Штаммы бактериофагов должны быть музейными и рабочими. Музейные производственные штаммы ежегодно обновляются путем выделения новых или пассажами имеющихся фаговых штаммов через организм больного, а также адаптацией к свежевыделенным, резистентным к данному бактериофагу культурам.
Промышленное получение бактериофага в настоящее время осуществляют в специальных аппаратах — реакторах емкостью 250–1000 л, с применением аэрации как фактора, стимулирующего развитие микроорганизмов. В реактор наливают жидкую питательную среду, которую стерилизуют при температуре 110 °С в течение 40 минут. После стерилизации среду охлаждают до 39 °С и засевают соответствующей микробной культурой и бактериофагом одновременно. Для засева используют 18-часовые агаровые культуры, которые прибавляют из расчета 50 млн микробных клеток на миллилитр среды. Бактериофаг добавляют в количестве не более 0,3 % по отношению к объему питательной среды. Среду с бактериальной культурой и фагом оставляют при температуре 37 °С на 6–18 часов. Фаги активно размножаются внутри бактериальных клеток и вызывают их лизис, что внешне проявляется полным просветлением среды. К полученному лизату добавляют в качестве консерванта хинозол (0,01 %) или фенол (0,25 %) и не позже чем через два часа после этого фильтруют содержимое реактора через бактериальные фильтры для удаления оставшихся микробных клеток.
Полученный препарат бактериофага должен иметь вид совершенно прозрачной жидкости желтого цвета. Он проходит контроль на стерильность, безвредность и литическую активность. Безвредность препарата проверяют путем введения животным. Например, брюшнотифозный и дизентерийный бактериофаги вводят подкожно трем мышам по 1 мл, либо внутривенно одному кролику 5 мл. За животными наблюдают в течение 3–4 суток. Литическую активность бактериофага определяют титрованием в жидкой питательной среде методом Аппельмана, на плотной питательной среде — методом Отто. За титр бактериофага при определении методом Аппельмана принимают то его наибольшее разведение, которое вызывает полный лизис тестовой культуры микроорганизмов.
После проведения контрольных исследований препарат разливают во флаконы нейтрального стекла. Помимо жидких препаратов бактериофага могут изготавливать и сухие. Для их получения фаголизат осаждают сернокислым аммонием, осадок отделяют от жидкой части, добавляют к нему стабилизатор (9 % глюконат кальция), смесь тщательно растирают и лиофилизируют [31].
Биологическое значение бактериофагов
Бактериофаги играют важную роль в круговороте углерода и энергии, контроле численности микробных популяций и эволюции бактерий. Бактериофаги, будучи подвижными генетическими элементами, служат мощным фактором изменчивости бактерий. Например, они осуществляют процесс трансдукции — перенос бактериальных генов из одной клетки в другую: вырезаясь из генома одной бактерии, они могут прихватывать с собой в капсид ее гены и, инфицируя другую клетку, передавать их новому хозяину. Есть все основания предполагать, что большинство бактерий содержит профаги. Многие культуры несут 2–4 и даже более умеренных фагов, то есть являются полилизогенными. Например, многие актиномицеты и клубеньковые бактерии содержат в геноме четырех и более профагов.
Способность фагов менять фенотип бактерий путем привнесения чужеродных (и фаговых в том числе) генов может быть одновременно залогом процветания для бактерий и источником больших проблем для человечества: так бактерии могут приобретать факторы вирулентности и устойчивости — к другим фагам, антибиотикам и прочим воздействиям (если фаг, например, награждает бактерию способностью формировать биопленки) [32]. В 1951 году была описана фаговая конверсия Corinebacterium diphtheriae: оказалось, что ген tox, кодирующий дифтерийный токсин, в геном нетоксигенных бактериальных штаммов привносится умеренным фагом β. В результате коринебактерия производит сильнейший токсин, инактивирующий в человеческих клетках один из компонентов трансляционного аппарата — EF-2 (эукариотический фактор элонгации 2). Подавление синтеза белка проявляется своеобразной дифтерийной симптоматикой. Аналогичные механизмы приобретения патогенных свойств позже выявили у холерных вибрионов, сальмонелл, клостридий и др.
Лабораторное и промышленное применение бактериофагов
Способность фагов к внесению в клетку определенного количества генетического материала, упакованного в капсид, широко эксплуатируется в генной инженерии: их часто используют в качестве векторов различного назначения. Например, для создания библиотек генов нередко конструируют векторы на основе бактериофага λ, содержащего двухцепочечную ДНК. Левое и правое плечи ДНК фага содержат гены, необходимые для литического цикла, а среднюю — несущественную для размножения — часть молекулы можно заменять крупным (примерно до 24 т.п.н.) фрагментом чужеродной ДНК, включая эукариотическую. Такую рекомбинантную ДНК упаковывают в вирионы и заражают ими подходящую культуру бактерий, которая затем многократно воспроизводит фаговую ДНК с интересующими человека фрагментами.
Из-за высокой специфичности многие фаги служат диагностическими инструментами для идентификации бактериальных культур в медицинской, ветеринарной, технической микробиологии и фитопатологии. Метод фаготипирования, основанный на исключительной специфичности определенных фаговых штаммов, позволил распределить на фаготипы ряд штаммов бактерий, неотличимых друг от друга по другим признакам. Фаготипирование с успехом применяют для идентификации типов кишечной палочки, сальмонелл (включая возбудителя брюшного тифа), стафилококков и др. Этот метод дает эпидемиологам возможность отследить цепочку случаев заболевания и определить источник инфекции.
Бактериофаги прекрасно подходят для быстрого обнаружения небольших количеств патогенных бактерий во внешней среде: появляются и множатся хозяева — нарастает титр специфического бактериофага. Определение колифагов стало одним из ключевых мероприятий в санитарном контроле вод, поскольку позволяет выявить фекальное загрязнение даже при малом количестве кишечной палочки, не определяемом бактериологическими методами.
Фаги применяются и в борьбе с бактериальными вредителями различных технических брожений, и в производстве ферментов с помощью бактериальных культур. В то же время, заражая промышленные культуры, бактериофаг вредит «полезным» производственным штаммам (вакцинным, продуцентам антибиотиков, возбудителям молочнокислого, ацетонобутилового и некоторых других брожений), чем вызывает серьезные нарушения технологического процесса.
Применение бактериофагов в медицине
Первый отчет об успешной фаготерапии был опубликован в 1921 году фламандцами Р. Бранохе и Ж. Майсином, которые использовали бактериофаг для лечения кожной стафилококковой инфекции [33].
Как уже было упомянуто, западная медицина c середины ХХ века практически отказалась от использования бактериофагов в терапевтических целях [5], однако в СССР фаги довольно широко применялись. Одним из самых, пожалуй, масштабных примеров практического применения фагов является использование комплексного препарата бактериофагов в Сталинграде во время Великой Отечественной войны. З.В. Ермольева во время работы в Ташкентском институте вакцин и сывороток разработала препарат, содержащий 19 видов бактериофагов, в том числе холерный, брюшнотифозный и дифтерийный. Во время Сталинградской битвы в связи с угрозой эпидемии холеры было налажено производство холерного фага в самом Сталинграде, и препарат ежедневно принимали около 50 тысяч человек [34].
После войны в СССР приступили к промышленному производству фаговых препаратов, которое действует и в настоящее время. В России производством бактериофагов занимаются в основном филиалы НПО «Микроген»: «Иммунопрепарат» (г. Уфа), «ИмБио» (г. Нижний Новгород), «Биомед» (г. Пермь).
На данный момент в РФ зарегистрировано и производится 13 фаговых препаратов (табл. 2).
| Препарат | Применение* | Состав |
|---|---|---|
| Секстафаг®, пиобактериофаг поливалентный жидкий | Для лечения и профилактики заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками | Стерильный фильтрат фаголизатов бактерий Staphylococcus, Streptococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, Klebsiella pneumoniae, энтеропатогенных Escherichia coli |
| Интести-бактериофаг | Для лечения и профилактики заболеваний, вызванных стафилококками, стрептококками, протеями, клебсиеллами, синегнойной и кишечной палочками | Смесь стерильных фильтратов фаголизатов Shigella flexneri (сероваров 1, 2, 3, 4, 6), Shigella sonnei, Salmonella enterica (сероваров Paratyphi A, Paratyphi B, Typhimurium, Infantis, Choleraesuis, Oranienburg, Enteritidis), энтеропатогенных Escherichia coli (серогрупп, наиболее значимых в этиологии кишечных инфекций), Proteus vulgaris, Proteus mirabilis, Enterococcus, Staphylococcus, Pseudomonas aeruginosa |
| Пиобактериофаг поливалентный очищенный | Для лечения и профилактики различных форм гнойно-воспалительных заболеваний и инфекций ЖКТ | Стерильный фильтрат фаголизатов Staphylococcus, Streptococcus, Proteus mirabilis, Proteus vulgaris, Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae |
| Пиобактериофаг комплексный жидкий | Для лечения гнойно-воспалительных заболеваний, обработки операционных и свежеинфицированных ран | Смесь стерильных фильтратов фаголизатов Staphylococcus, Streptococcus, Enterococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, энтеропатогенных Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca |
| Бактериофаг стрептококковый | Для лечения и профилактики заболеваний, вызванных стрептококками | Стерильные фаголизаты Streptococcus spp. |
| Бактериофаг дизентерийный | Для лечения и профилактики дизентерии | Смесь стерильных фильтратов фаголизатов Shigella flexneri (сероваров 1, 2, 3, 4, 6) и Shigella sonnei |
| Бактериофаг стафилококковый | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний, вызванных стафилококками | Стерильные фаголизаты Staphylococcus spp. |
| Бактериофаг псевдомонас аеругиноза (синегнойный) | Для лечения и профилактики заболеваний, вызванных синегнойной палочкой | Стерильные фаголизаты Pseudomonas aeruginosa |
| Бактериофаг сальмонеллезный групп A,B,C,D,E | Для лечения заболеваний, вызванных сальмонеллами | Стерильный фильтрат фаголизатов наиболее распространенных сероваров Salmonella enterica (Paratyphi А и В, Typhimurium, Choleraesuis, Infantis, Oranienburg, Enteritidis) |
| Бактериофаг клебсиелл поливалентный очищенный | Для лечения и профилактики заболеваний, вызванных клебсиеллами | Стерильная смесь очищенных фильтратов фаголизатов Klebsiella (K. pneumoniae, K. ozaenae, K. rhinoscleromatis) |
| Бактериофаг коли | Для лечения и профилактики заболеваний, вызванных кишечной палочкой | Стерильный фильтрат фаголизатов патогенных штаммов Escherichia coli |
| Бактериофаг протейный жидкий | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний, вызванных протеями | Стерильный фильтрат фаголизатов Proteus vulgaris и Proteus mirabilis |
| Бактериофаг колипротейный | Для лечения и профилактики гнойно-воспалительных и кишечных заболеваний | Смесь стерильных фильтратов фаголизатов Proteus vulgaris, Proteus mirabilis и энтеропатогенных серогрупп Escherichia coli |
| * Производитель предупреждает, что препараты должны применяться после оценки чувствительности возбудителей болезни к фагам, что означает еще и необходимость идентификации бактерии-возбудителя. Кроме того, в случае тяжелых инфекций фаготерапия допустима только как часть комплексного лечения | ||
Отдельно стоит осветить вопрос применения фаготерапии в странах Запада. Как известно, после открытия антибиотиков работы, связанные с медицинским применением фагов, там были полностью свернуты. Однако в последние годы в связи с тревожной динамикой распространения внутрибольничных инфекций, резистентных к большинству известных антибиотиков, многие биотехнологические компании сделали резкий поворот к изучению возможности создания лекарств на основе бактериофагов. Однако, несмотря на существенные технологические преимущества, для создания эффективных препаратов необходима коллекция бактериофагов, действующих на клинически значимые штаммы возбудителей, и соответствующий опыт их клинического применения, чем эти компании пока не обладают.
С терапевтической целью бактериофаги применяют, например, в России, Грузии и Польше, причем самыми разными способами. Для коррекции кишечных дисбиозов жидкие препараты применяют внутрь или per rectum при помощи клизмы. Таблетированные формы принимают внутрь, возможно использование бактериофагов и в составе ректальных свечей. При кожных и раневых инфекциях их применяют в виде примочек на очаги поражения. При фарингитах, ларингитах и тонзиллитах препараты используют для орошения или полосканий, при отитах — закапывают в уши. Для лечения абсцессов в их полость вводят ватный шарик, пропитанный препаратом. Больным, страдающим хроническими остеомиелитами, препарат вводят непосредственно в пораженный участок кости. Также препараты можно вносить в брюшную, плевральную и суставные полости, а также применять в форме аэрозолей при поражениях легких. При инфекциях мочевыводящих путей бактериофаги вливают непосредственно в пораженный орган с помощью зонда. При гинекологических заболеваниях препарат вливают в матку либо применяют влагалищные тампоны, пропитанные фаговым раствором.
А еще их используют в методике под названием фаговый дисплей, которая, в частности, позволяет находить новые антитела для диагностики и терапии заболеваний: «Враг моего врага — мой друг. Как бактерии и вирусы помогают создавать антитела для лечения человека» [39]. — Ред.
Преимущества бактериофагов перед антибиотиками достаточно очевидны.
К сожалению, недостатков бактериофаги тоже не лишены.
Заключение
Прошло уже 100 лет с момента открытия бактериофагов. Неоправданно забытые на Западе и чудом сохранившиеся в России, они полвека пребывали в тени успеха антибиотиков. Но эпоха триумфа антибиотиков выявила и важнейшую проблему их активного применения — угрожающий рост резистентности к ним среди опасных патогенов, и многие ученые и врачи видят именно в фагах альтернативу антибиотикам. Если на сегодняшний день мы имеем штаммы бактерий, устойчивые даже к антимикробным препаратам «последней надежды», то фаги, благодаря описанным выше механизмам коэволюции с бактериями, никогда не утратят актуальности. За 100 лет они были детально изучены, признаны безопасными и стали незаменимым инструментом в генетике и биоинженерии, санитарной микробиологии и эпидемиологии, промышленности, медицине и даже в космической сфере (да-да, бактерии с профагом используют для оценки защиты обшивки космических кораблей от радиации). И как нельзя лучше характеризует значение фагов для человека древняя пословица: «Враг моего врага — мой друг».