Как называются изотопы водорода как обозначаются что образуют
Изотопы водорода
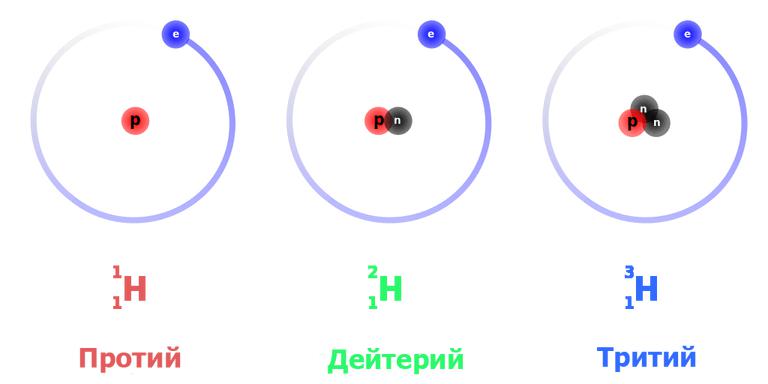
Известно несколько изотопов водорода: дейтерий ( 2 H) с одним протоном и одним нейтроном в ядре, тритий ( 3 H) с одним протоном и двумя нейтронами в ядре и очень неустойчивые тяжелые изотопы 4 H, 5 H, 6 H и 7 H. Ядра протия и дейтерия стабильны, а ядра трития подвергаются бета-распаду:
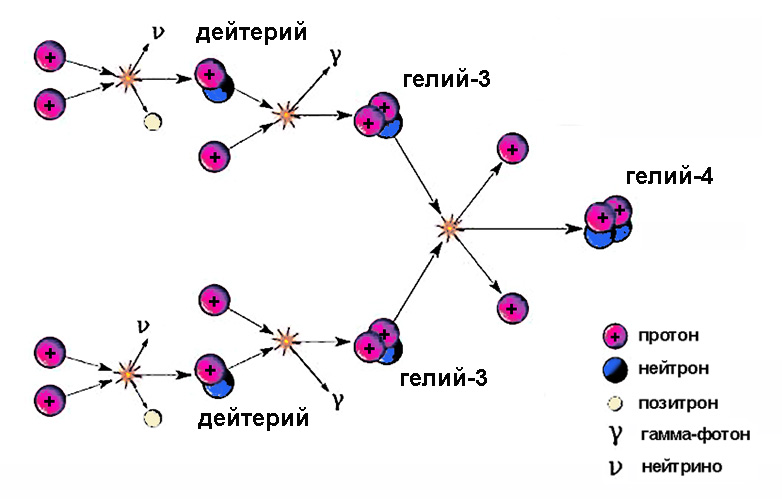
Предполагают, что эта реакция является главным источником изотопа гелия-3 в атмосфере.
Время жизни атомов остальных изотопов составляет ничтожные доли секунды.
Таблица изотопов водорода:
Содержание изотопов водорода в природе:
Массовая доля (в %) в природной смеси:
1 H – 99,9849 2 H – 0,0139 3 H – 0,0012
Нормальный изотопный состав природных соединений водорода соответствует отношению D : H=1 : 6800
3·10-18 % (мольные доли). Очевидно, он образуется в результате ядерных реакций, вызванных действием космических лучей.
Получение изотопов водорода
В настоящее время дейтерий получают ректификацией жидкого водорода и пот так называемому двухтемпературному сероводородному методу, в основе которого лежит реакция изотопного обмена:
Константа равновесия которой при 30 и 120 °C равна соответственно 2,31 и 1,86.
Тритий синтезируют, действуя на 6 Li3 нейтронами, получаемыми в ядерном реакторе:
Для водорода, как ни для какого другого элемента, относительное различие изотопных масс достигает значительной величины. Поэтому, несмотря на одинаковую электронную структуру, все изотопы заметно различаются не только физическими, но и химическими свойствами. Вследствие резкого преобладания протия влияние тяжелых изотопов сказывается незначительно и может быть зафиксировано лишь в очень точных экспериментах. Поэтому можно считать, что свойства природного водорода соответствуют свойствам чистого протия.
Небольшие различия свойств, называемые изотопным эффектом, обусловлены различием масс изотопных атомов, которое в первую очередь сказывается на частоте колебаний атомов в молекулах и твердых телах. Так, колебательная энергия молекул T2 и D2 меньше, чем H2. А это, в свою очередь, сказывается на термодинамических свойствах: теплоемкости, температуре плавления и кипения, энтальпии плавления и испарения, давлении насыщенного пара и т.д. Так, D2 по сравнению с обычным водородом обладает меньшей теплоемкостью, теплопроводностью и скоростью диффузии. Таким образом, для изотопных соединений характерна термодинамическая неравноценность, а, следовательно, неравноценность активных комплексов при химических реакциях, в результате чего имеет место различие в скоростях протекания реакций, т.е. наблюдается кинетический изотопный эффект. Он выражается отношением констант скоростей химических реакций для различных изотопных соединений. Например, отношение констант скоростей синтеза HBr и DBr равно 5. Такие значительные отличия физических и химических свойств изотопов одного и того же элемента уникальны и не имеют аналогов в периодической системе. Все это в какой-то мере оправдывает применение для каждого изотопа водорода собственного названия (особенно для протия и дейтерия).
| Eдис(H2) = 436 кДж/моль | dH-H = 0,07414 нм |
| Eдис(D2) = 439,56 кДж/моль | dD-D = 0,07417 нм |
| t°пл(D2O) = 3,82 °C | t°кип(D2O) = 101,42 °C | ρ = 1,1050 г/см 3 (20 °C) |
Заметно с H2O различаются также энтальпия растворения солей, константы диссоциации кислот и другие характеристики растворов. Реакции в D2O идут медленнее, поэтому она является биологическим ядом.
Содержание
Список изотопов
Водород-1 (протий)
1 ЧАС (атомная масса 1.007 825 032 241 (94) Да ) является наиболее распространенным изотопом водорода с содержанием более 99,98%. Поскольку ядро этого изотопа состоит только из одного протон, ему дается официальное имя протий.
Распад протона никогда не наблюдался, поэтому водород-1 считается стабильным изотопом. Немного теории великого объединения предложенные в 1970-х годах предсказывают, что распад протона может происходить с периодом полураспада 10 28 и 10 36 лет. [10] Если это предсказание окажется верным, то водород-1 (и действительно все ядра, которые сейчас считаются стабильными) только наблюдательно стабильный. На сегодняшний день эксперименты показали, что минимальный период полураспада протона превышает 10 34 лет.
Водород-2 (дейтерий)
2 ЧАС (атомная масса 2.014 101 778 11 (12) Да ), другой стабильный изотоп водорода, известен как дейтерий и содержит в своем ядре один протон и один нейтрон. Ядро дейтерия называется дейтроном. Дейтерий составляет 0,0026–0,0184% (по численности населения, а не по массе) образцов водорода на Земле, причем меньшее количество обычно обнаруживается в образцах газообразного водорода, а более высокое обогащение (0,015% или 150 частей на миллион) типично для океанской воды. Дейтерий на Земле был обогащен в отношении его начальной концентрации в Большом взрыве и внешней части Солнечной системы (около 27 ppm, по атомной доле) и его концентрации в более старых частях галактики Млечный Путь (около 23 ppm). Предположительно, разная концентрация дейтерия во внутренней части Солнечной системы связана с более низкой летучестью газа и соединений дейтерия, обогащающих фракции дейтерия в кометах и планетах, подвергшихся значительному воздействию солнечного тепла на протяжении миллиардов лет эволюции Солнечной системы.
Дейтерий не радиоактивен и не представляет значительной опасности токсичности. Вода, обогащенная молекулами, в состав которых входит дейтерий вместо протия, называется тяжелая вода. Дейтерий и его соединения используются в качестве нерадиоактивной метки в химических экспериментах и в растворителях для 1 ЧАС-ЯМР-спектроскопия. Тяжелая вода используется как замедлитель нейтронов и теплоноситель для ядерных реакторов. Дейтерий также является потенциальным топливом для коммерческих термоядерная реакция.
Водород-3 (тритий)
Когда-то тритий обычно использовался в экспериментах по химической и биологической маркировке в качестве радиоактивная метка, который стал менее распространенным в последнее время. D-T термоядерная реакция использует тритий в качестве основного реагента, наряду с дейтерий, высвобождая энергию за счет потери массы, когда два ядра сталкиваются и сливаются при высоких температурах.
Водород-4
4 ЧАС (атомная масса является 4.026 43 (11) Да ) содержит в своем ядре один протон и три нейтрона. Это очень неустойчивый изотоп водорода. Он был синтезирован в лаборатории путем бомбардировки тритий с быстро движущимся дейтерий ядра. [12] В этом эксперименте ядро трития захватило нейтрон из быстро движущегося ядра дейтерия. Присутствие водорода-4 было установлено путем регистрации испускаемых протонов. Он разлагается нейтронное излучение в водород-3 (тритий) с период полураспада около 139 ± 10 йоктосекунды (или (1.39 ± 0.10) × 10 −22 секунд). [13]
В сатирическом романе 1955 г. Ревущая мышь, название квадиум был передан изотопу водорода-4, который питал Q-бомба что Герцогство Гранд Фенвик захвачен из США.
Водород-4.1
Водород-5
5 ЧАС является крайне нестабильным изотопом водорода. Ядро состоит из протона и четырех нейтронов. Он был синтезирован в лаборатории путем бомбардировки трития быстро движущимися ядрами трития. [12] [15] В этом эксперименте одно ядро трития захватывает два нейтрона от другого, становясь ядром с одним протоном и четырьмя нейтронами. Оставшийся протон может быть обнаружен, и можно сделать вывод о существовании водорода-5. Он разлагается вдвое нейтронное излучение в водород-3 (тритий) и имеет период полураспада не менее 910 йоктосекунд (9,1 × 10 −22 секунд). [13]
Водород-6
6 ЧАС распадается либо на тройной нейтронное излучение в водород-3 (тритий) или учетверенное излучение нейтронов в водород-2 (дейтерий) и имеет период полураспада 290 йоктосекунд (2,9 × 10 −22 секунд). [13]
Водород-7
7 ЧАС состоит из протон и шесть нейтроны. Впервые он был синтезирован в 2003 году группой российских, японских и французских ученых в г. RIKENс Завод радиоактивных изотопов бомбардировкой водород с участием гелий-8 атомы. В результате реакции все шесть нейтронов гелия-8 были переданы ядру водорода. Два оставшихся протона были обнаружены телескопом RIKEN, устройством, состоящим из нескольких слоев датчиков, расположенным за целью циклотрона RI Beam. [3] Водород-7 имеет период полураспада 23 йоктосекунды ( 2.3 × 10 −23 s ), [16] который является самым коротким периодом полураспада, известным для любого изотопа любого элемента (см. Список радиоактивных нуклидов по периодам полураспада)
Цепи распада
Большинство тяжелых изотопов водорода распадаются непосредственно на 3 H, который затем распадается на стабильный изотоп 3 Он. Однако, 6 Иногда наблюдалось, что H распадается прямо на стабильную 2 ЧАС.
Время распада в йоктосекунды для всех изотопов, кроме 3 H, который выражается в годах.
Изотопы водорода: свойства, характеристика и применение
Любой химический элемент имеет разновидности природного или искусственного происхождения, называемые изотопами. Различие между ними заключается в неодинаковом количестве нейтронов в ядрах и, следовательно, в атомном весе, а также в степени стабильности. Что касается количества протонов, то оно одинаково, благодаря чему элемент, собственно, и остается самим собой. В этой статье мы обратимся к изотопам водорода – самого легкого и распространенного элемента во Вселенной. Нам предстоит рассмотреть их свойства, роль в природе и область практического применения.
Сколько разновидностей имеет водород
Ответ на этот вопрос зависит от того, какие изотопы водорода имеются в виду.
Для этого элемента установлено три природных изотопных формы: протий – легкий водород, тяжелый дейтерий и сверхтяжелый тритий. Все они обнаружены в естественном виде.
Таким образом, всего на сегодняшний день у водорода известно семь изотопных разновидностей. На трех из них, имеющих практическое значение, мы и сосредоточим свое внимание.
Легкий водород
Это наиболее просто устроенный атом. Изотоп водорода протий с атомной массой 1,0078 а. е. м. обладает ядром, в состав которого входит только одна частица – протон. Поскольку он стабилен (теоретически время жизни протона оценивается не менее чем в 2,9×10 29 лет), то стабилен и атом протия. При записи ядерных реакций он обозначается как 1 H1 (нижний индекс – это атомный номер, то есть число протонов, верхний – общее число нуклонов в ядре), иногда просто p – «протон».
Легкий изотоп – это почти 99,99 % всего водорода; лишь чуть более одной сотой процента приходится на остальные формы. Именно протий вносит решающий вклад в распространенность водорода в природе: во Вселенной в целом – около 75 % массы барионного вещества и приблизительно 90 % атомов; на Земле – 1 % массы и целых 17 % атомов всех элементов, входящих в состав нашей планеты. Вообще, протий (точнее сказать, протон как один из главных компонентов Вселенной) смело можно назвать важнейшим элементом. Он обеспечивает возможность термоядерного синтеза в недрах звезд, в том числе и Солнца, и за счет него образуются прочие элементы. Кроме того, легкий водород играет важную роль в построении и функционировании живого вещества.
В молекулярной форме водород вступает в химические взаимодействия при высоких температурах, поскольку для расщепления его достаточно прочной молекулы нужно много энергии. Атомарный водород характеризуется очень высокой химической активностью.
Дейтерий
Тяжелый изотоп водорода имеет более сложно устроенное ядро, состоящее из протона и нейтрона. Соответственно атомная масса дейтерия вдвое больше – 2,0141. Принятое обозначение – 2 H1 или D. Эта изотопная форма также стабильна, так как в процессах сильного взаимодействия в ядре протон и нейтрон постоянно превращаются друг в друга, и последний не успевает претерпеть распад.
На Земле водород содержит от 0,011% до 0,016% дейтерия. Концентрация его различна в зависимости от среды: в морской воде этого изотопа больше, а в составе, например, природного газа – существенно меньше. На других телах Солнечной системы отношение дейтерия к легкому водороду может быть иным: так, лед некоторых комет содержит большее количество тяжелого изотопа.
Дейтерий плавится при 18,6 К (легкий водород – при 14 К), а кипит при 23,6 К (соответствующая точка протия – 20,3 К). Тяжелый водород проявляет, в общем, те же химические свойства, что и протий, образуя все характерные для этого элемента типы соединений, однако ему присущи и некоторые особенности, связанные с серьезной разницей в атомной массе – ведь дейтерий тяжелее в 2 раза. Следует заметить, что по этой причине изотопным формам водорода свойственны наибольшие химические различия из всех элементов. В целом для дейтерия характерны более низкие (в 5 – 10 раз) скорости протекания реакций.
Роль дейтерия в природе
Ядра тяжелого водорода принимают участие в промежуточных стадиях термоядерного цикла. Солнце светит благодаря этому процессу, на одном из этапов которого образующийся изотоп водорода дейтерий, сливаясь с протоном, рождает гелий-3.
Вода, в состав которой входит, кроме протия, один атом дейтерия, называется полутяжелой и имеет формулу HDO. В молекуле тяжелой воды D2O дейтерий полностью заменяет легкий водород.
Тяжелая вода характеризуется замедленным течением химических реакций, вследствие чего в больших концентрациях она вредна для живых организмов, особенно высших, таких как млекопитающие и в том числе человек. Если в составе воды четверть водорода замещена дейтерием, длительное употребление ее чревато развитием бесплодия, анемии и других заболеваний. При замещении 50% водорода млекопитающие погибают через неделю употребления такой воды. Что касается кратковременных повышений концентрации тяжелого водорода в воде, она практически безвредна.
Как получают тяжелый водород
Удобнее всего получать этот изотоп в составе воды. Есть несколько способов обогащения воды дейтерием:
Тритий
Сверхтяжелый изотоп водорода, в ядре которого наличествуют протон и два нейтрона, имеет атомную массу 3,016 – примерно втрое больше, чем у протия. Тритий обозначается символом Т либо 3 H1. Он плавится и кипит при еще более высоких температурах: 20,6 К и 25 К соответственно.
Это радиоактивный нестабильный изотоп с периодом полураспада 12,32 года. Образуется он при бомбардировке ядер атмосферных газов, например, азота, частицами космических лучей. Распад изотопа происходит с испусканием электрона (так называемый бета-распад), при этом один нейтрон в ядре претерпевает превращение в протон, а химический элемент повышает атомный номер на единицу, становясь гелием-3. В природе тритий присутствует в следовых количествах – его очень мало.
Сверхтяжелый водород образуется в тяжеловодных ядерных реакторах при захвате дейтерием медленных (тепловых) нейтронов. Часть его доступна для извлечения и служит источником трития. Кроме того, его получают как продукт распада лития при облучении последнего тепловыми нейтронами.
Тритий характеризуется малой энергией распада и представляет некоторую радиационную опасность только в случаях, когда попадает внутрь организма с воздухом или пищей. Для защиты кожных покровов от бета-излучения достаточно резиновых перчаток.
Применение изотопов водорода
Легкий водород используется во множестве отраслей: в химической промышленности, где с его помощью ведется производство аммиака, метанола, соляной кислоты и других веществ, в нефтепереработке и металлургии, где он необходим для восстановления тугоплавких металлов из оксидов. Также он применяется на некоторых стадиях производственного цикла (в производстве твердых жиров) в пищевой и косметической промышленности. Водород служит одним из видов ракетного топлива и используется в лабораторной практике в науке и на производстве.
Дейтерий незаменим в ядерной энергетике как прекрасный замедлитель нейтронов. Он применяется в этом качестве, а также как теплоноситель в тяжеловодных реакторах, позволяющих использовать природный уран, что снижает затраты на обогащение. Он также, наряду с тритием, является компонентом рабочей смеси в термоядерном оружии.
Химические свойства тяжелого водорода позволяют использовать его в производстве медицинских препаратов в целях замедления выведения их из организма. И, наконец, дейтерий (как и тритий) имеет перспективы в качестве топлива в термоядерной энергетике.
Итак, мы видим, что все изотопы водорода так или иначе «находятся при деле» как в традиционных, так и в высокотехнологичных, имеющих прицел на будущее отраслях техники, технологии и научных исследований.
Изотопы водорода
Изото́пы водорода — разновидности атомов (и ядер) химического элемента водорода, имеющие разное содержание нейтронов в ядре. На данный момент известны 7 изотопов водорода.
Таблица изотопов водорода
Примечания
Полезное
Смотреть что такое «Изотопы водорода» в других словарях:
ИЗОТОПЫ ВОДОРОДА В ГЕОЛОГИИ — водород состоит из двух изотопов Н, или протия, и Н2, или дейтерия (Д), отношение которых в нормальном водороде Н/Д = 6000. Различие в массах изотопов водорода велико, и в ходе неорг. и орг. процессов происходит существенное фракционирование его… … Геологическая энциклопедия
изотопы — ов; мн. (ед. изотоп, а; м.). [от греч. isos равный и topos место] Спец. Разновидности одного и того же химического элемента, различающиеся массой атомов. Радиоактивные изотопы. Изотопы урана. ◁ Изотопный, ая, ое. И. индикатор. * * * изотопы (от… … Энциклопедический словарь
Изотопы гелия — разновидности атомов (и ядер) химического элемента гелия, имеющие разное содержание нейтронов в ядре. Всего известно на данный момент времени 8 изотопов, но только два из них стабильны. Природный гелий состоит из двух стабильных изотопов: 4He… … Википедия
ИЗОТОПЫ — ИЗОТОПЫ, хим. элементы, расположенные в одной и той же клетке периодической системы и следовательно обладающие одинаковым атомным номером или порядко вым числом. При этом И. не должны, вообще говоря, обладать одинаковым атомным весом. Различные… … Большая медицинская энциклопедия
ИЗОТОПЫ — разновидности данного хим. элемента, различающиеся по массе ядер. Обладая одинаковыми зарядами ядер Z, но различаясь числом нейтронов, И. имеют одинаковое строение электронных оболочек, т. е. очень близкие хим. св ва, и занимают одно и то же… … Физическая энциклопедия
Изотопы кислорода — В конце жизни массивной звезды, H оболочке и He оболочке Изотопы кислорода разновидности атомов (и ядер) … Википедия
ИЗОТОПЫ — (от изо. и греч. topos место), нуклиды одного хим. элемента, т. е. разновидности атомов определенного элемента, имеющие одинаковый атомный номер, но разные массовые числа. Обладают ядрами с одинаковым числом протонов и разл. числом нейтронов,… … Химическая энциклопедия
ИЗОТОПЫ — (от греч. ísos одинаковый и tópos место), разновидности одного химического элемента, занимающие одно и то же место в периодической системе элементов Д. И. Менделеева, то есть имеющие одинаковый заряд ядра, но отличающиеся массами… … Ветеринарный энциклопедический словарь
Атом водорода — Атом водорода физическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра может входить протон или… … Википедия
Как называются изотопы водорода как обозначаются что образуют
Наука
Страницы
Изотопы ядер химического элемента водорода
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 88,6 % всех атомов (около 11,3 % составляют атомы гелия, доля всех остальных вместе взятых элементов — порядка 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца
6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Водород — самый лёгкий газ, он легче воздуха в 14,4 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов H2 на 1 объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: