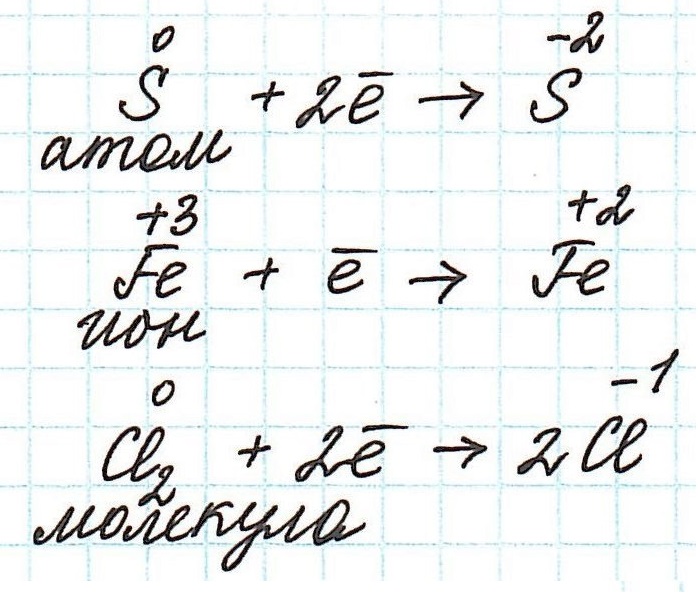Как определить что реакция окислительно восстановительная
Как определить окислительно-восстановительную реакцию
Прежде чем научиться определять окислительно-восстановительную реакцию, необходимо понять, что подразумевается под окислительно-восстановительной реакцией. Окислительно-восстановительные реакции рассм
Содержание:
Прежде чем научиться определять окислительно-восстановительную реакцию, необходимо понять, что подразумевается под окислительно-восстановительной реакцией. Окислительно-восстановительные реакции рассматриваются как реакции переноса электронов. Он включен в органическую и неорганическую химию. Он получил свое название «Redox», потому что окислительно-восстановительная реакция состоит из реакции окисления и реакции восстановления. Определение степени окисления является ключевым моментом при определении окислительно-восстановительной реакции. В этой статье обсуждаются типы окислительно-восстановительных реакций, приводятся примеры для каждой окислительно-восстановительной реакции, половинные реакции в окислительно-восстановительной реакции, а также разъясняются правила определения степени окисления и изменения в степени окисления.
Что такое окислительно-восстановительная реакция
Реакции кислотных оснований характеризуются процессом переноса протона, аналогично окислительно-восстановительные или окислительно-восстановительные реакции включают процесс переноса электрона. Окислительно-восстановительная реакция имеет две половинные реакции, а именно реакцию окисления и реакцию восстановления. Реакция окисления включает потерю электронов, а реакция восстановления включает принятие электронов. Следовательно, окислительно-восстановительная реакция содержит два вида: окислитель подвергается окислительной половине реакции, а восстановитель подвергается восстановительной половине реакции. Степень снижения окислительно-восстановительной реакции равна степени окисления; это означает, что количество электронов, потерянных от окислителя, равно количеству электронов, принятых восстановителем. Это сбалансированный процесс с точки зрения обмена электронами.
Как определить окислительно-восстановительную реакцию
Найдите число окисления:
Чтобы определить окислительно-восстановительную реакцию, сначала нам нужно знать степень окисления каждого элемента в реакции. Мы используем следующие правила для присвоения номеров окисления.
• Свободные элементы, которые не объединены с другими, имеют степень окисления ноль. Таким образом, атомы в H2, Руб.2, Na, Be, Ca, K, O2 и P4 имеют одинаковую степень окисления ноль.
• Для ионов, состоящих только из одного атома (одноатомных ионов), степень окисления равна заряду на ионе. Например:
• В нейтральной молекуле сумма всех чисел окисления равна нулю.
• В многоатомном ионе сумма всех чисел окисления равна заряду на ионе.
• Числа окисления не должны быть только целыми числами.
Определите реакцию окисления и реакцию восстановления:
Рассмотрим следующую реакцию.
Шаг 1: Определить окислитель и восстановитель. Для этого нам нужно определить их степень окисления.
Шаг 2: Напишите полуреакции для окисления и восстановления. Мы используем электроны для уравновешивания зарядов в обе стороны.
Шаг 3: Получение окислительно-восстановительной реакции. Добавляя (1) и (2), мы можем получить окислительно-восстановительную реакцию. Электроны в полуреакциях не должны появляться в сбалансированной окислительно-восстановительной реакции. Для этого нам нужно умножить реакцию (1) на 2, а затем добавить ее к реакции (2).
Выявление окислительно-восстановительных реакций
Пример: рассмотрим следующие реакции. Какой из них напоминает окислительно-восстановительную реакцию?
В окислительно-восстановительной реакции степень окисления изменяется в реагентах и продуктах. Должны быть окисляющие и восстанавливающие виды. Если степень окисления элементов в продуктах не изменяется, это не может рассматриваться как окислительно-восстановительная реакция.
Это не окислительно-восстановительная реакция. Потому что реагенты и продукты имеют одинаковые степени окисления. H (+1), Cl (-1), Na (+1) и O (-2)
Типы окислительно-восстановительных реакций
Существует четыре различных типа окислительно-восстановительных реакций: реакции сочетания, реакции разложения, реакции вытеснения и реакции диспропорционирования.
Комбинированные реакции:
Реакции разложения:
В реакциях разложения соединение распадается на два или более компонентов. Это противоположность сочетания реакций.
Реакции смещения:
В реакции замещения ион или атом в соединении заменяется ионом или атомом другого соединения. Реакции смещения имеют широкий спектр применения в промышленности.
Все щелочные металлы и некоторые щелочные металлы (Ca, Sr и Ba) замещаются водородом из холодной воды.
Некоторые металлы в элементарном состоянии могут замещать металл в соединении. Например, цинк заменяет ионы меди, а медь может заменять ионы серебра. Реакция смещения зависит от ряда активности места (или электрохимического ряда).
Ряд активности для реакций вытеснения галогена: F2 > Cl2 > Br2 > Я2, По мере продвижения по галогеновой серии мощность окислительной способности уменьшается.
Диспропорциональные реакции:
Это особый тип окислительно-восстановительной реакции. Элемент в одной степени окисления одновременно окисляется и восстанавливается. В реакции диспропорционирования один реагент должен всегда содержать элемент, который может иметь по меньшей мере три степени окисления.
Здесь степень окисления в реагенте равна (-1), она увеличивается до нуля в O2 и уменьшается до (-2) в H2О. Степень окисления в водороде не изменяется в реакции.
Окислительно-восстановительные реакции рассматриваются как реакция переноса электрона. В окислительно-восстановительной реакции один элемент окисляется и выделяет электроны, а один элемент восстанавливается за счет выделения высвобождаемых электронов. Степень окисления равна степени восстановления с точки зрения обмена электронов в реакции. В окислительно-восстановительной реакции есть две половины реакции; они называются окислительной полуреакцией и восстановительной полуреакцией. Увеличивается степень окисления при окислении, аналогично степень окисления уменьшается при восстановлении.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
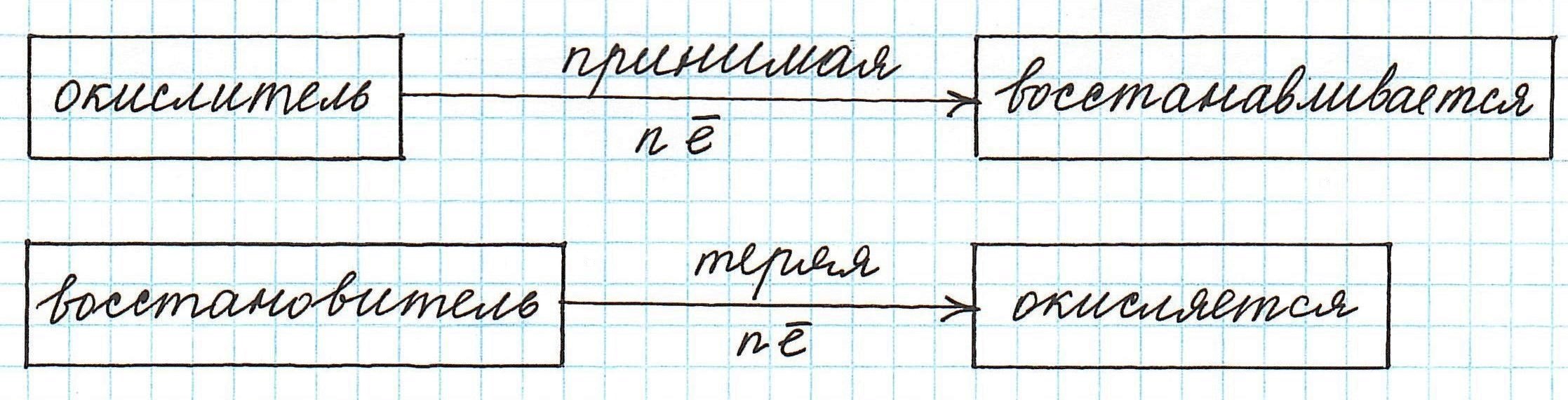
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
Типичные восстановители – это, как правило:
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители :
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
C 0 + 4H N +5 O3(конц) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
KMnO4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
Схема восстановления хроматов/бихроматов
Соединения хрома VI окисляют:
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании до 150 о С под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Взаимодействие металлов с серной кислотой
Например :
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Cu 0 + 2H2 S +6 O4(конц) = Cu +2 SO4 + S +4 O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S 2- (в зависимости от температуры, степени измельчения и активности металла).
Пероксид водорода
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например :
ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ В ХИМИЧЕСКИХ РЕАКЦИЯХ
Окислители и восстановители в химии — интересный, но очень часто вызывающий затруднения, вопрос.
К примеру, превращение с помощью нитрифицирующих бактерий атмосферного азота в легко усваиваемую растениями форму, фотосинтез, дыхание живых организмов (от бактерий до высших растений и животных) — это ОВР в природе.
А вот выплавка стали, промышленное получение аммиака из азота и водорода, гальванические процессы, электролиз – эти и огромное количество других процессов являются примерами ОВР в технике.
Так что же такое окислительно-восстановительные реакции (процессы)?
Понятие окислительно-восстановительной реакции
Окислительно-восстановительные реакции (ОВР) – это процессы, в ходе которых изменяются степени окисления атомов химических элементов.
Окисление и восстановление сопровождают друг друга. Один процесс без другого просто не существует. Почему?
Изменение степени окисления всегда означает переход электронов от одних частиц к другим. То есть одни частицы отдают электроны в ходе химического или электрохимического взаимодействия, а другие частицы принимают. Здесь срабатывает закон сохранения материи.
Окислители, восстановители. Окисление, восстановление
Итак, окисление – это процесс, в ходе которого частица передает свои электроны другой частице. В качестве таких частиц могут выступать отдельные атомы или ионы, а также молекулы.
Переход электронов принято показывать с помощью полуреакций:
Как не сложно заметить из представленных полуреакций, окислительный процесс приводит к увеличению степени окисления.
Частица, принимающая электроны, является окислителем.
Восстановление всегда сопровождается уменьшением степени окисления!
Способность к окислению и восстановлению: как определить
Существует несколько закономерностей, которые помогают определить наличие у частицы (атома, иона, молекулы) способности окисляться или восстанавливаться. Обратимся к периодической таблице химических элементов.
1) В периодах слева направо (т.е. с повышением порядкового номера элемента) восстановительные свойства простых веществ уменьшаются, а окислительные увеличиваются:
То есть в начале периода находятся явные восстановители, а в конце – окислители. Например, в III периоде активным восстановителем является натрий, а активным окислителем – хлор.
А причина данной закономерности кроется в строении атомов элементов.
У атомов элементов одного периода:
В связи с этим растет и сила притяжения электронов к ядру. В результате радиус атома уменьшается.
У элементов конца периода эта сила велика. Поэтому атомы очень трудно отдают свои электроны в химических взаимодействиях и легче принимают их от других атомов, стремясь завершить внешний энергетический уровень. Так проявляются их окислительные свойства.
Атомам элементов начала периода для завершения внешнего уровня до устойчивого 8-электронного состояния легче отдать свои немногочисленные электроны, проявив тем самым восстановительные свойства.
2) Элементы побочных подгрупп (это металлы четных рядов больших периодов) на внешнем уровне имеют 2 или 3 (реже 1 в случае «провала») электрона, поэтому легко могут их отдавать, являясь, таким образом, восстановителями:
3) Элементы одной главной подгруппы имеют одинаковое число электронов на внешнем энергетическом уровне (например, элементы VI группы – шесть электронов). Число же энергетических уровней увеличивается и, соответственно, радиусы атомов тоже увеличиваются. Это приводит к тому, что электроны внешних уровней удаляются от ядра и притяжение их к нему ослабевает.
Вот именно поэтому, восстановительная способность (способность отдавать электроны) у элементов главных подгрупп сверху вниз растет, а окислительная способность (способность принимать электроны) снижается:
Так, среди элементов главной подгруппы VI группы окислительная способность сильнее всего проявляется у кислорода, а теллур в некоторых взаимодействиях способен проявлять восстановительные свойства.
4) Определить, чем будет являться частица (или вещество, в состав которого она входит) в окислительно-восстановительном процессе, можно по значению степени окисления (с.о.).
Если атомы имеют самую наименьшую с.о., то проявят они восстановительные свойства. Если самую высокую – то окислительные. А если с.о. является промежуточной по значению, то проявят как те, так и другие свойства (в зависимости от конкретных условий химической реакции). Например:
Сильные или слабые окислители и восстановители: как определить
Часто говорят: сильный окислитель, слабый окислитель, сильный восстановитель, слабый восстановитель. А что это значит? И как определить эту самую силу?
Мерой окислительно-восстановительной способности вещества служит значение стандартного электродного потенциала: чем оно больше, тем и окислительные свойства проявляются сильнее.
Обратимся к таблице стандартных электродных потенциалов. В ней значения потенциалов расположены в порядке уменьшения:
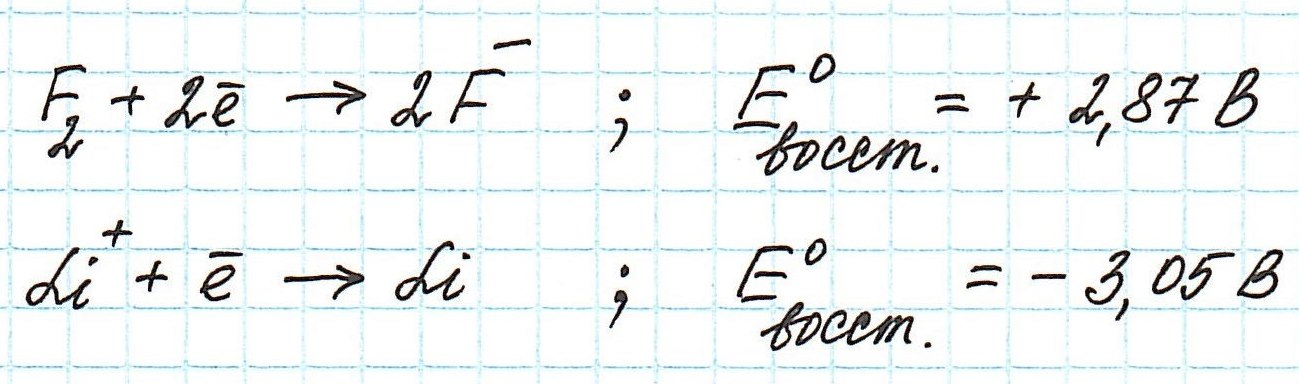
Окислительные потенциалы фтора и лития будут иметь противоположные значения.
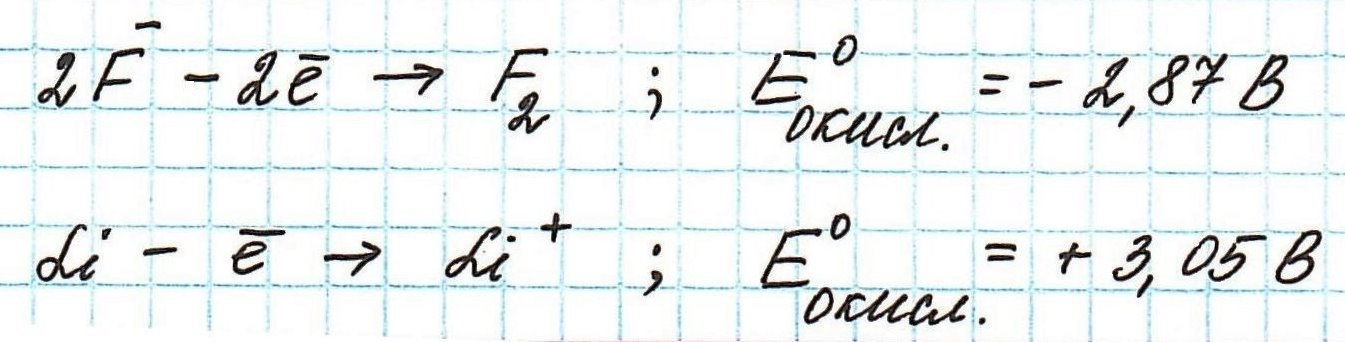
Пример . Используя таблицу стандартных электродных потенциалов, определите, какая из частиц проявляет более сильные окислительные свойства:
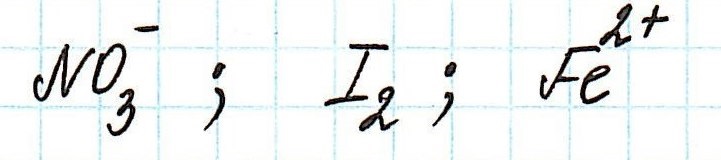
Наиболее сильным окислителем будет та частица, которая лучше всего восстанавливается, а, значит, имеет более высокий восстановительный электродный потенциал.
Сравним значения восстановительных потенциалов:
Таким образом, наиболее сильным окислителем из представленных является нитрат-ион.
Основные окислители и восстановители в химии
В технике применяется огромное количество окислителей и восстановителей с разной окислительной и восстановительной способностью.
Важнейшие из них представлены в таблице:
Итак, окисление и восстановление – два взаимосвязанных процесса. Они широко представлены в природе и играют огромную роль в промышленных производствах. Окислители и восстановители очень разнообразны. Чем будет являться частица (или вещество, в состав которого она входит): окислителем или восстановителем, – можно определить, используя некоторые закономерности.