Как определить что является электролитом
Неэлектролиты и электролиты: характеристика и свойства
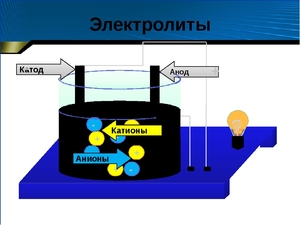
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. Это можно наблюдать с помощью простого прибора. Он состоит из угольных стержней (электродов), присоединенных проводами к электрической сети. В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Но она ярко загорится, если их опустить в раствор хлорида натрия.
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
Неэлектролиты
Неэлектролиты находятся в растворе в виде неполярных или малополярных молекул.
Электролиты
Электролиты распадаются в растворе или расплаве на ионы, и именно наличие ионов способствует прохождению электрического тока. Процесс этот — распада на ионы — называют диссоциацией, а теория, описывающая данные процессы — теорией электролитической диссоциации. В растворе распад на ионы происходит по причине разрыва связей вещества, что является результатом взаимодействия с молекулами воды (то есть происходит гидратация электролита).
Ионы (атомы или их группы, обладающие отрицательным или положительным зарядом) под действием электрического тока начинают двигаться по направлению к одному из электродов, что и обуславливает электропроводимость.
Молекула электролита, способная диссоциировать на большее, чем два, количество ионов, будет диссоциировать постадийно. Примером может служить диссоциация многоосновной кислоты.
Подробнее познакомиться с теорией электролитической диссоциацией вы сможете, посмотрев это видео.
Степень диссоциации
Понятие, количественно характеризующее, насколько полно произошёл распад электролита на ионы, называют степенью диссоциации. Этот показатель рассчитывается как отношение количества продиссоциировавших молекул к общему числу молекул вещества в растворе и фактически показывает долю (процент) распавшихся на ионы молекул в общем количестве.
Следующие факторы могут влиять на степень электролитической диссоциации:
Температура
Зависимость от температуры достаточно сложна. Если распад на ионы экзотермический, то повышение температуры степень диссоциации будет уменьшать, а если эндотермический, повышение температуры приведёт к увеличению степени диссоциации. В целом же для каждого электролита есть определённые температурные условия, в которых он в максимальной степени будет распадаться на ионы.
Изменение показателя константы диссоциации (характеризует способность распадаться на ионы) для уксусной кислоты при изменении температуры можно привести в качестве примера:
максимальная ионизация раствора, как видно, наступает при 25 °C, а при температурах выше и ниже этого значения диссоциация происходит в меньшей степени.
Что такое степень диссоциации? Подробный ответ вы найдете в этом видео.
Природа растворителя и электролита
Стадия процесса диссоциации
Если молекула распадается на ионы постадийно, то каждая следующая стадия имеет примерно в 1000−10 000 раз меньший эффект, чем предыдущая.
Экспериментально определить степень диссоциации можно по электропроводности растворов, т. к. она прямо зависит от концентрации движущихся ионов. Истинное значение при этом получить нельзя, такое значение называют кажущимся. Оно меньше истинного, так как при движении к электродам ионы могут сталкиваться, что частично уменьшает их подвижность. При высокой концентрации может возникать притяжение между ионами, обусловленное электростатическими силами, они чаще сталкиваются, теряя свою подвижность, что влияет на показания электропроводности.
Например, в растворе соляной кислоты (1 моль/л) измерения покажут степень распада на ионы равной 0,78 (78%), но фактически раствор не будет содержать 22% недиссоциированных молекул, так как практически все молекулы диссоциированы.
Сильные и слабые проводники
По величине показателя степени диссоциации, выделяют электролиты сильные и слабые. К сильным условно относят вещества, значение степени диссоциации у которых больше 30%, если данный показатель ниже 5%, то к слабым, остальные считаются электролитами средней силы.
Сильные электролиты:
Видео
Из этого видео вы узнаете о свойствах электролитов.
Шпаргалка «Электролиты и неэлектролиты»
Краткий вариант материала по теме «Электролиты и неэлектролиты». Позволяет быстро ориентироватся в теме, т.к. представлен в виде таблицы с определениями и примерами. Поможет систематизировать знания, подготовится к проверочным и тестовым работам.
Просмотр содержимого документа
«Шпаргалка «Электролиты и неэлектролиты»»
По способности проводить ток в водном растворе или расплаве
проводят ток в растворе или расплаве
проводники второго рода
не проводят ток в растворе или расплаве
(т.к. не образуют ионы)
ионной или сильно полярной ковалентной связью
неполярной или слабо полярной ковалентной связью
органические соединения (углеводороды, сахароза,спирты),
степень диссоциации больше 30%
степень диссоциации меньше 3%
все соли – как растворимые, так и плохо растворимые;
сильные основания (LiOH, KOH, NaOH, Ba(OH)2))
слабые основания – нерастворимые гидроксиды металлов и NH4OH.
. Степень диссоциации зависит от концентрации вещества в растворе, поэтому некоторые слабые электролиты при разбавлении могут стать сильными.
Степень диссоциации (α) – отношение числа молекул, распавшихся на ионы (Nрасп.) к общему числу растворенных молекул (Nобщ.)
По способности проводить ток в водном растворе или расплаве
проводят ток в растворе или расплаве
проводники второго рода
не проводят ток в растворе или расплаве
(т.к. не образуют ионы)
ионной или сильно полярной ковалентной связью
неполярной или слабо полярной ковалентной связью
органические соединения (углеводороды, сахароза,спирты),
степень диссоциации больше 30%
степень диссоциации меньше 3%
все соли – как растворимые, так и плохо растворимые;
сильные основания (LiOH, KOH, NaOH, Ba(OH)2))
слабые основания – нерастворимые гидроксиды металлов и NH4OH.
. Степень диссоциации зависит от концентрации вещества в растворе, поэтому некоторые слабые электролиты при разбавлении могут стать сильными.
Степень диссоциации (α) – отношение числа молекул, распавшихся на ионы (Nрасп.) к общему числу растворенных молекул (Nобщ.)
Определение сильных и слабых электролитов
Что такое электролиты — общие понятия
Электролиты — это вещества, которые могут проводить электрический ток после распада на ионы (или диссоциации). Это происходит в растворах и расплавах или, если электролит является твердым, — в кристаллических решетках. Примеры электролитов:
Для электролитов характерна сильно полярная ковалентная или ионная химическая связь. В противном случае вещество не способно распадаться на ионы в растворах и расплавах, вследствие чего они не проводят электрический ток. К неэлектролитам в химии относят вещества с ковалентной слабо полярной связью (в основном, это органические соединения, например, глицерин, сахароза и т.д.) и вещества с ковалентной неполярной связью (простые вещества неметаллы, например, водород, сера и т.д.)
Впервые теорию электролитической диссоциации (распада электролитов на ионы) предложил шведский физик и химик С. Аррениус. Он обнаружил, что в растворах, проводящих ток, содержится больше частиц и сделал вывод о том, что в растворах и расплавах эти виды веществ распадаются на ионы.
Наблюдая за движением частиц, ученый также установил, что они обладают различными зарядами. Так положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами.
Определение сильных и слабых, как распознать
Аррениус является автором теории электролитической диссоциации. Под этим понятием подразумевается процесс, при котором вещество распадается на отдельные ионы. Степень диссоциации зависит от характера электролита и вычисляется по формуле:
α = ( N д и с ) / ( N о б щ ) × 100 %
Краткий вид формулы:
α = ( N д и с ) / ( N о б щ )
Если этот показатель превышает 30% (или 0,3), то электролит считается сильным. В уравнении их распада ставится знак «→», поскольку процесс необратимый. К подобным относятся:
Если степень диссоциации меньше 3% (или 0,03), то такие электролиты называют слабыми. Реакции с ними обратимы, поэтому используется знак «⇄» или «↔». К подобным относятся:
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
NaCl = Na + + Cl –
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
Сильные и слабые электролиты, отличия, примеры
электролиты они представляют собой вещества, которые образуют электропроводящий раствор при растворении в полярном растворителе, таком как вода. Растворенный электролит разделяется на катионы и анионы, которые диспергированы в указанном растворе. Если к раствору приложен электрический потенциал, катионы будут прилипать к электроду, который содержит большое количество электронов..
Напротив, анионы в растворе будут связываться с электрически дефектным электродом. Вещество, которое распадается на ионы, приобретает способность проводить электричество. Большинство солей, кислот и растворимых оснований представляют собой электролиты.
Некоторые газы, такие как хлористый водород, могут действовать как электролиты при определенных условиях температуры и давления. Натрий, калий, хлорид, кальций, магний и фосфат являются хорошими примерами электролитов.
Какие сильные и слабые электролиты?
Чтобы лучше дифференцировать эти два типа электролитов, можно сказать, что в растворе сильного электролита основными компонентами (или разновидностями) являются образующиеся ионы, тогда как в растворе слабого электролита основным компонентом является само соединение. ионизировать.
Сильные электролиты делятся на три категории: сильные кислоты, сильные основания и соли; в то время как слабые электролиты делятся на слабые кислоты и слабые основания.
Все ионные соединения являются сильными электролитами, поскольку при растворении в воде они разделяются на ионы..
Даже самые нерастворимые ионные соединения (AgCl, PbSO4, CaCO3) являются сильными электролитами, потому что небольшое количество, которое растворяется в воде, происходит главным образом в форме ионов; то есть в полученном растворе отсутствует диссоциированная форма или количество соединения.
Эквивалентная проводимость электролитов уменьшается при более высоких температурах, но ведет себя по-разному в зависимости от их прочности.
Сильные электролиты имеют более низкое снижение своей проводимости при более высоких концентрациях, в то время как слабые электролиты имеют большую скорость снижения проводимости при более высоких концентрациях.
различия
Важно знать, как распознать формулу и определить ее классификацию (ионная или составная), поскольку это будет зависеть от стандартов безопасности при работе с химическими веществами..
Как указывалось ранее, электролиты могут быть определены как сильные или слабые в зависимости от их ионизационной способности, но иногда это может быть более очевидным, чем кажется.
Большинство кислот, оснований и растворимых солей, которые не представляют кислоты или слабые основания, считаются слабыми электролитами..
Фактически, следует предположить, что все соли являются сильными электролитами. Напротив, слабые кислоты и основания, помимо азотсодержащих соединений, считаются слабыми электролитами..
Методы выявления электролитов
Существуют методы, облегчающие идентификацию электролитов. Далее используется шестиступенчатый метод:
Как указано в предыдущем разделе, проводимость электролита изменяется в зависимости от его концентрации в растворе, но также это значение зависит от силы электролита..
При более высоких концентрациях сильные и промежуточные электролиты не будут уменьшаться в значительных интервалах, но слабые будут сильно уменьшаться до достижения значений, близких к нулю при более высоких концентрациях..
Существуют также промежуточные электролиты, которые могут диссоциировать в растворах с более высоким процентным содержанием (менее 100%, но более 10%), в дополнение к неэлектролитам, которые просто не диссоциируют (соединения углерода, такие как сахара, жиры и спирты)..