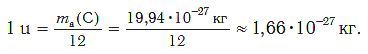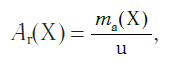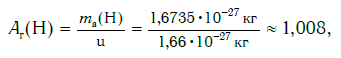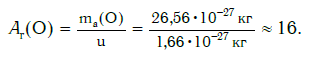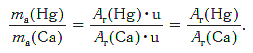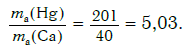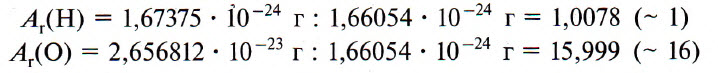Масса атома что это
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
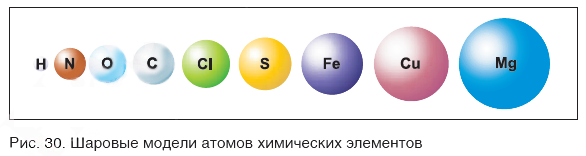
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
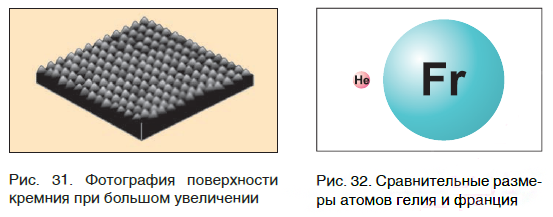
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
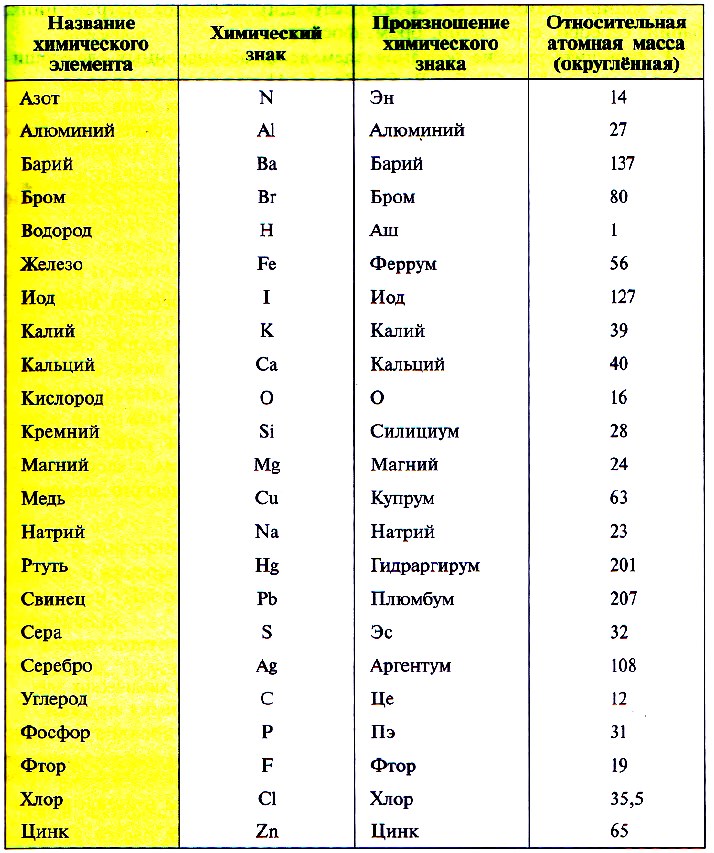
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Молекулярная физика. Атомная единица массы. Атомная масса.
Атомная единица массы.
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 12 С:
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества Mr, в единицу массы СИ (кг), пользуются формулой:

Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы:

где Mr — относительная молекулярная (атомная) масса; m0 — масса молекулы (атома), выраженная в единицах СИ (кг); m0С — масса молекулы изотопа углерода 12 С, выраженная в тех же единицах, что и m0.

Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов.
Атомные массы всех химических элементов точно измерены.
Масса атома что это
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Формула, используемая для преобразования:
Атомная масса атомов, ионов или атомных ядер немного меньше суммы масс составляющих их протонов, нейтронов и электронов из-за потери массы энергии связи (на E = mc 2 ).
СОДЕРЖАНИЕ
Относительная изотопная масса
Относительную изотопную массу (свойство отдельного атома) не следует путать со средней атомной массой (см. Выше), то есть средним значением для многих атомов в данном образце химического элемента.
Похожие термины для разных количеств
Атомная масса (относительная изотопная масса) определяется как масса отдельного атома, который может быть только одним изотопом (нуклидом) за раз, и не является средневзвешенным по содержанию, как в случае относительной атомной массы / атомной массы. масса. Следовательно, атомная масса или относительная изотопная масса каждого изотопа и нуклида химического элемента является числом, которое в принципе может быть измерено с высокой точностью, поскольку ожидается, что каждый образец такого нуклида будет точно идентичен любому другому образцу. поскольку ожидается, что все атомы данного типа в одном и том же энергетическом состоянии и каждый образец определенного нуклида будут точно идентичны по массе любому другому образцу этого нуклида. Например, ожидается, что каждый атом кислорода-16 будет иметь точно такую же атомную массу (относительную изотопную массу), что и любой другой атом кислорода-16.
В случае многих элементов, которые имеют один встречающийся в природе изотоп ( мононуклидные элементы ) или один доминирующий изотоп, разница между атомной массой наиболее распространенного изотопа и (стандартной) относительной атомной массой или (стандартной) атомной массой может быть небольшой. или даже nil, и не влияет на большинство массовых вычислений. Однако такая ошибка может существовать и даже быть важной при рассмотрении отдельных атомов для элементов, которые не являются мононуклидами.
Для немононуклидных элементов, которые имеют более одного общего изотопа, численное различие в относительной атомной массе (атомном весе) даже от наиболее распространенной относительной изотопной массы может составлять половину единицы массы или более (например, см. Случай хлора, где атомарный вес) масса и стандартная атомная масса около 35,45). Атомная масса (относительная изотопная масса) необычного изотопа может отличаться от относительной атомной массы, атомного веса или стандартного атомного веса на несколько единиц массы.
Относительные изотопные массы всегда близки к целым числам, но никогда (за исключением случая углерода-12) точно целым числам по двум причинам:
Отношение атомной массы к массовому числу (числу нуклонов) варьируется от 0,998 838 1346 (51) для 56 Fe до 1.007 825 031 898 (14) для 1 H.
Массовые дефекты в атомных массах
Вот некоторые значения отношения атомной массы к массовому числу:
| Нуклид | Отношение атомной массы к массовому числу |
|---|---|
| 1 ч | 1,007 825 031 898 (14) |
| 2 ч | 1,007 050 888 9220 (75) |
| 3 ч | 1,005 349 760 440 (27) |
| 3 Он | 1,005 343 107 322 (20) |
| 4 Он | 1.000 650 813 533 (40) |
| 6 Ли | 1,002 520 481 24 (26) |
| 12 С | 1 |
| 14 с.ш. | 1.000 219 571 732 (17) |
| 16 O | 0,999 682 163 704 (20) |
| 56 Fe | 0,998 838 1346 (51) |
| 210 По | 0,999 918 4461 (59) |
| 232 Чт | 1.000 164 0242 (66) |
| 238 U | 1.000 213 3905 (67) |
Измерение атомных масс
Связь между атомной и молекулярной массами
| Молярная масса of CH 4 | |||
|---|---|---|---|
| Стандартный атомный вес | Число | Общая молярная масса (г / моль) или молекулярная масса (Да или г / моль) | |
| C | 12,011 | 1 | 12,011 |
| ЧАС | 1,008 | 4 | 4,032 |
| CH 4 | 16,043 | ||
| Молекулярная масса 12 C 1 H 4 | |||
| Масса нуклида | Число | Общая молекулярная масса (Da или u) | |
| 12 С | 12.00 | 1 | 12.00 |
| 1 ч | 1,007825 | 4 | 4,0313 |
| CH 4 | 16.0313 | ||
История
В 1860-х годах Станислао Канниццаро уточнил относительные атомные массы, применив закон Авогадро (особенно на Конгрессе в Карлсруэ 1860 года). Он сформулировал закон для определения относительных атомных масс элементов: различные количества одного и того же элемента, содержащиеся в разных молекулах, являются целыми кратными атомному весу, и определил относительные атомные массы и молекулярные массы, сравнивая плотность пара в совокупности газов с молекулы, содержащие один или несколько рассматриваемых химических элементов.
В 20-м веке, до 1960-х годов, химики и физики использовали две разные шкалы атомных масс. Химики использовали шкалу «атомных единиц массы» (а.е.м.), так что естественная смесь изотопов кислорода имела атомную массу 16, в то время как физики присвоили то же число 16 только атомной массе наиболее распространенного изотопа кислорода ( 16 O, содержащий восемь протонов и восемь нейтронов). Однако, поскольку кислород-17 и кислород-18 также присутствуют в природном кислороде, это привело к двум различным таблицам атомных масс. Единая шкала, основанная на углероде-12, 12 C, удовлетворила потребность физиков основывать шкалу на чистом изотопе, будучи численно близкой к шкале химиков. Это было принято как «единая атомная единица массы». Текущая международная система единиц (СИ) рекомендует в качестве названия этой единицы использовать дальтон и символ «Да». Название «единая атомная единица массы» и символ «u» являются признанными названиями и символами для одной и той же единицы.
В 1979 году в качестве компромисса был введен термин «относительная атомная масса» как вторичный синоним атомного веса. Двадцать лет спустя приоритет этих синонимов изменился, и теперь термин «относительная атомная масса» стал предпочтительным.
Однако термин « стандартные атомные веса» (относящийся к стандартным ожидаемым атомным весам различных образцов) не был изменен, поскольку простая замена «атомного веса» на «относительную атомную массу» привела бы к термину «стандартный относительный атомный вес». масса «
Атомная масса
Полезное
Смотреть что такое «Атомная масса» в других словарях:
АТОМНАЯ МАССА — масса атома, выраженная в атомных единицах массы. Атомная масса меньше суммы масс, составляющих атом частиц (протонов, нейтронов, электронов), на величину, обусловленную энергией их взаимодействия (см., напр., Дефект массы) … Большой Энциклопедический словарь
Атомная масса — Atomic mass масса атома химического элемента, выраженная в атомных единицах массы (а.е.м.). За 1 а.е.м. принята 1/12 часть массы изотопа углерода с атомной массой 12. 1 а.е.м.=1,6605655·10 27 кг. Атомная масса складывается из масс всех протонов и … Термины атомной энергетики
атомная масса — – масса атомов элемента, выраженная в атомных единицах массы. Масса такого количества элемента, в котором содержится то же число атомов, что и в 12 г изотопа 12C. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
АТОМНАЯ МАССА — безразмерная величина. А. м. масса атома хим. элемента, выраженная в атомных единицах (см.) … Большая политехническая энциклопедия
АТОМНАЯ МАССА — (устаревший термин атомный вес), относительное значение массы атома, выраженное в атомных единицах массы (а. е. м.). А. м. меньше суммы масс составляющих атом ч ц на дефект масс. А. м. была взята Д. И. Менделеевым за осн. хар ку элемента при… … Физическая энциклопедия
атомная масса — — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] Тематики электротехника, основные понятия EN atomic weight … Справочник технического переводчика
Атомная масса — Эту статью следует викифицировать. Пожалуйста, оформите её согласно правилам оформления статей. Атомная масса, относительная атомная масса (устаревшее название атомный вес) значение масс … Википедия
атомная масса — масса атома, выраженная в атомных единицах массы. За атомную массу химического элемента, состоящего из смеси изотопов, принимают среднее значение атомной массы изотопов с учётом их процентного содержания (эта величина приведена в периодической… … Энциклопедический словарь
АТОМНАЯ МАССА — Понятие об этой величине претерпевало длительные изменения в соответствии с изменением представления об атомах. Согласно теории Дальтона (1803), все атомы одного и того же химического элемента идентичны и его атомная масса это число, равное… … Энциклопедия Кольера
атомная масса — santykinė atominė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Cheminio elemento vidutinės masės ir nuklido ¹²C atomo masės 1/12 dalies dalmuo. atitikmenys: angl. atomic mass; atomic weight; relative atomic mass vok. Atommasse … Penkiakalbis aiškinamasis metrologijos terminų žodynas
атомная масса — santykinė atominė masė statusas T sritis Standartizacija ir metrologija apibrėžtis Vidutinės elemento atomų masės ir 1/12 nuklido ¹²C atomo masės dalmuo. atitikmenys: angl. atomic mass; atomic weight; relative atomic mass vok. Atommasse, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas