Матрица в биологии что это такое
Транскрипция и трансляция
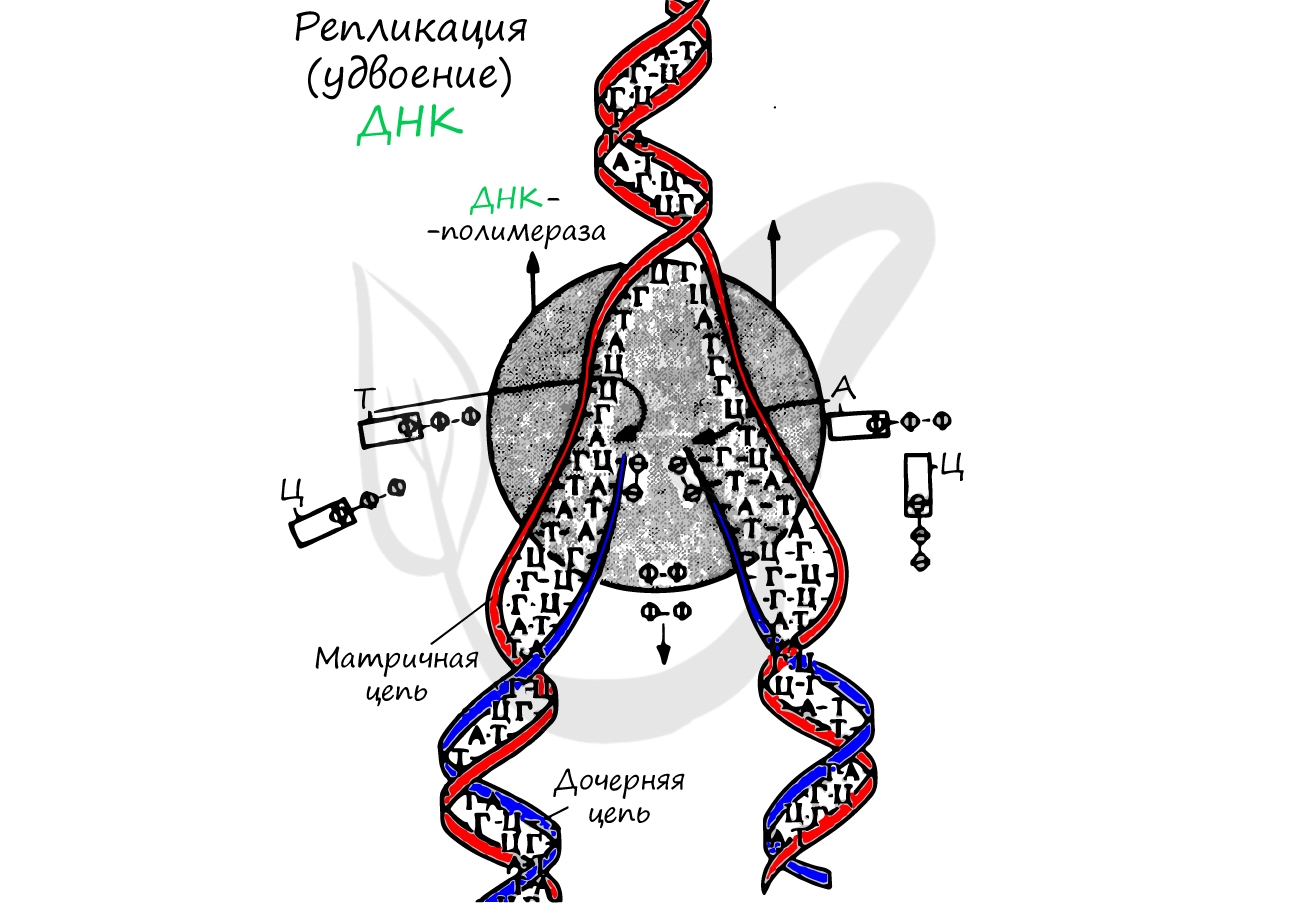
Удвоение ДНК происходит в синтетическом периоде интерфазы. При этом общее число хромосом не меняется, однако каждая из них содержит к началу деления две молекулы ДНК: это необходимо для равномерного распределения генетического материала между дочерними клетками.
Транскрпиция (лат. transcriptio — переписывание)
Образуется несколько начальных кодонов иРНК.
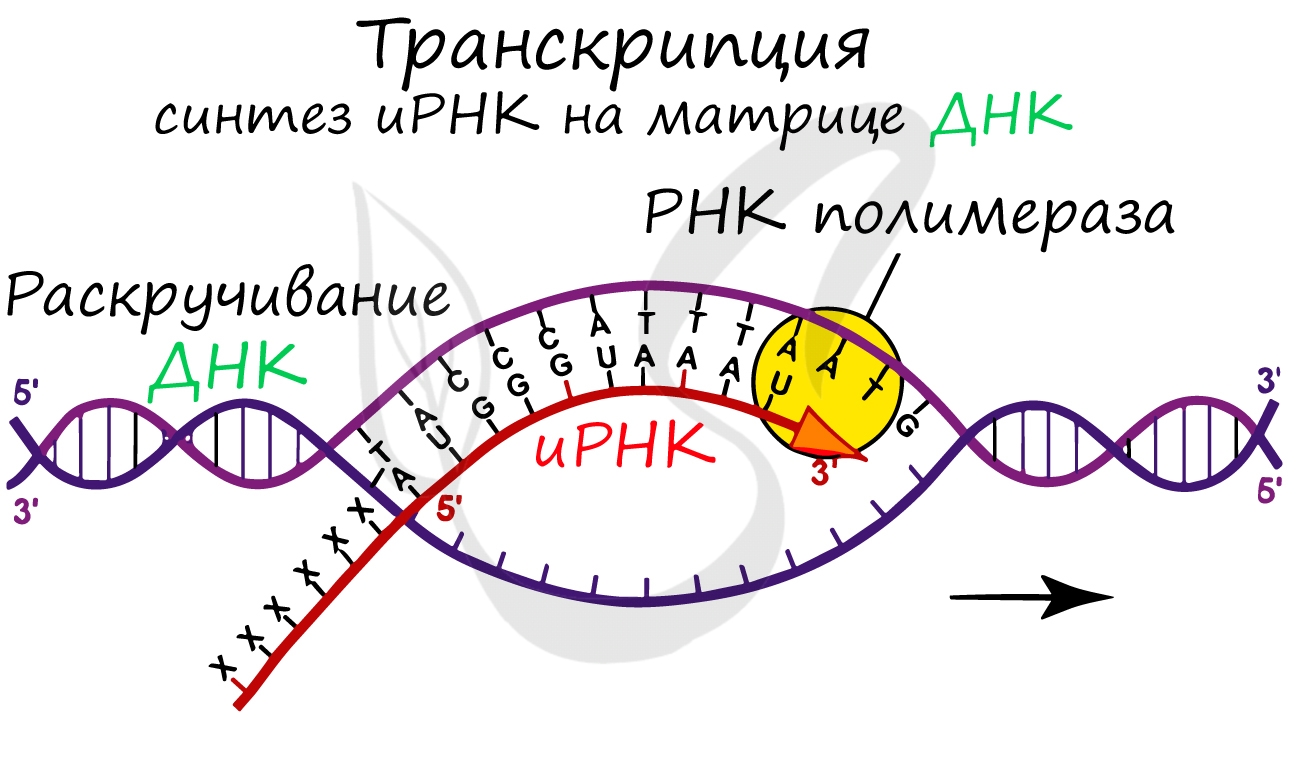
Нити ДНК последовательно расплетаются, освобождая место для передвигающейся РНК-полимеразы. Молекула иРНК быстро растет.
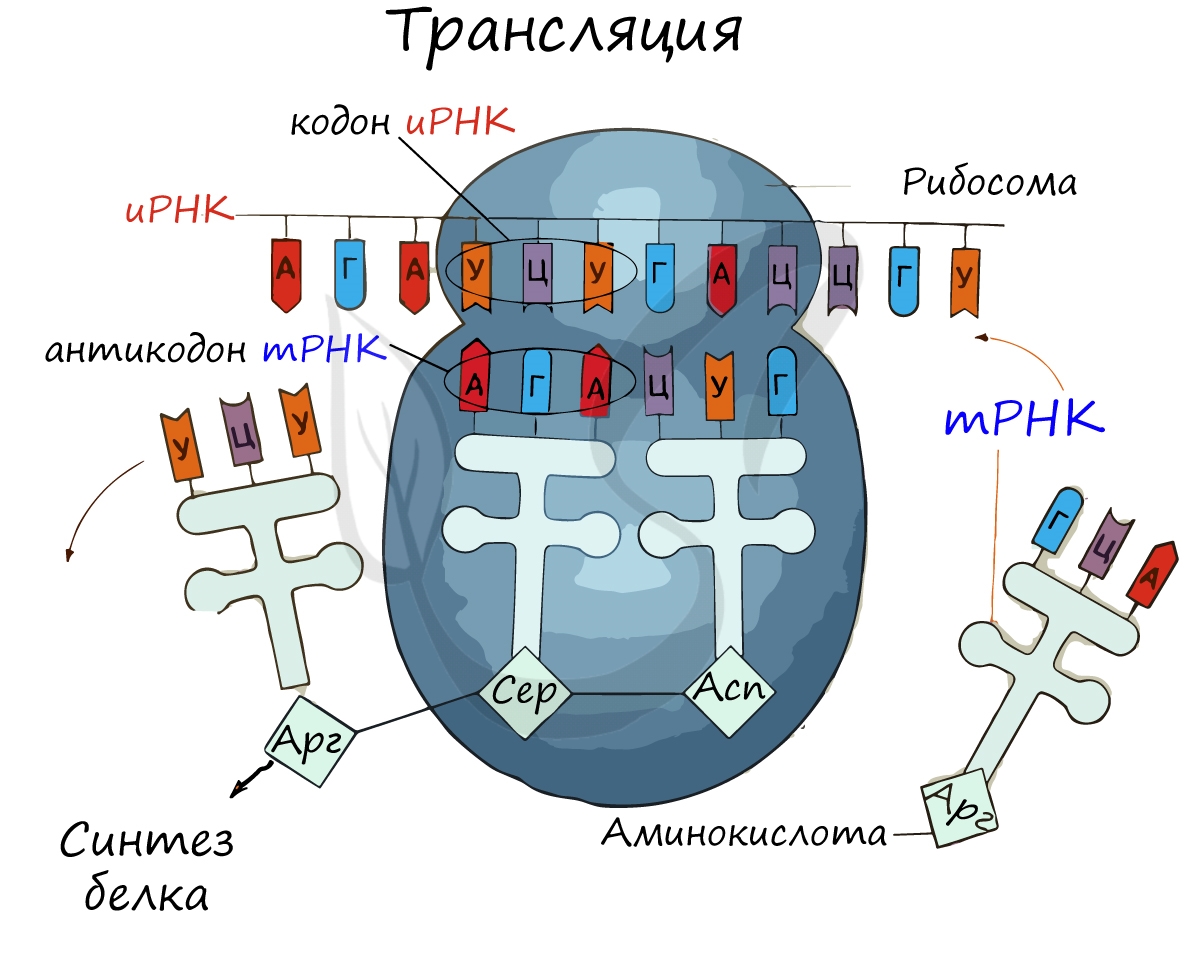
Трансляция (от лат. translatio — перенос, перемещение)
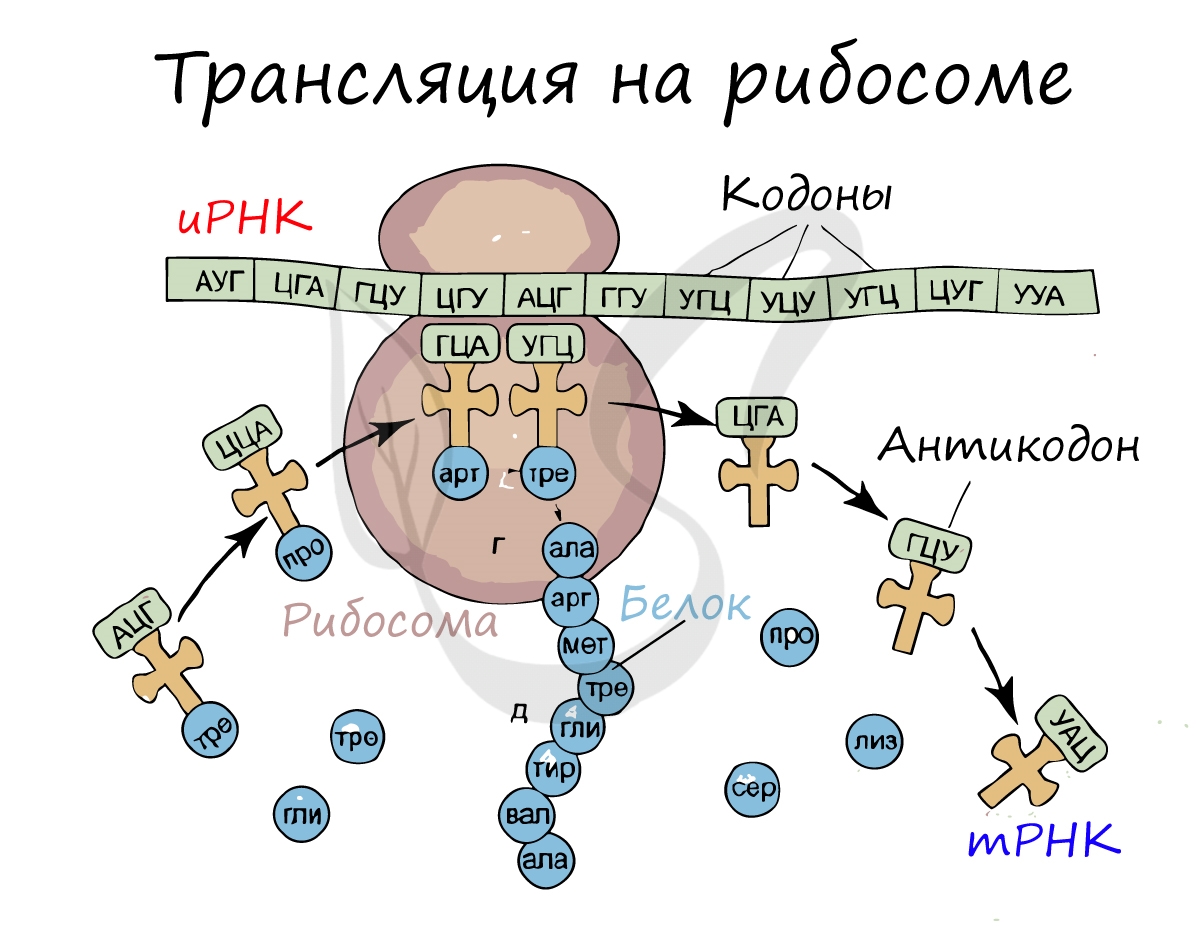
Рибосома делает шаг, и иРНК продвигается на один кодон: такое в фазу элонгации происходит десятки тысяч раз. Молекулы тРНК приносят новые аминокислоты, соответствующие кодонам иРНК. Аминокислоты соединяются друг с другом: между ними образуются пептидные связи, молекула белка растет.
Примеры решения задачи №1
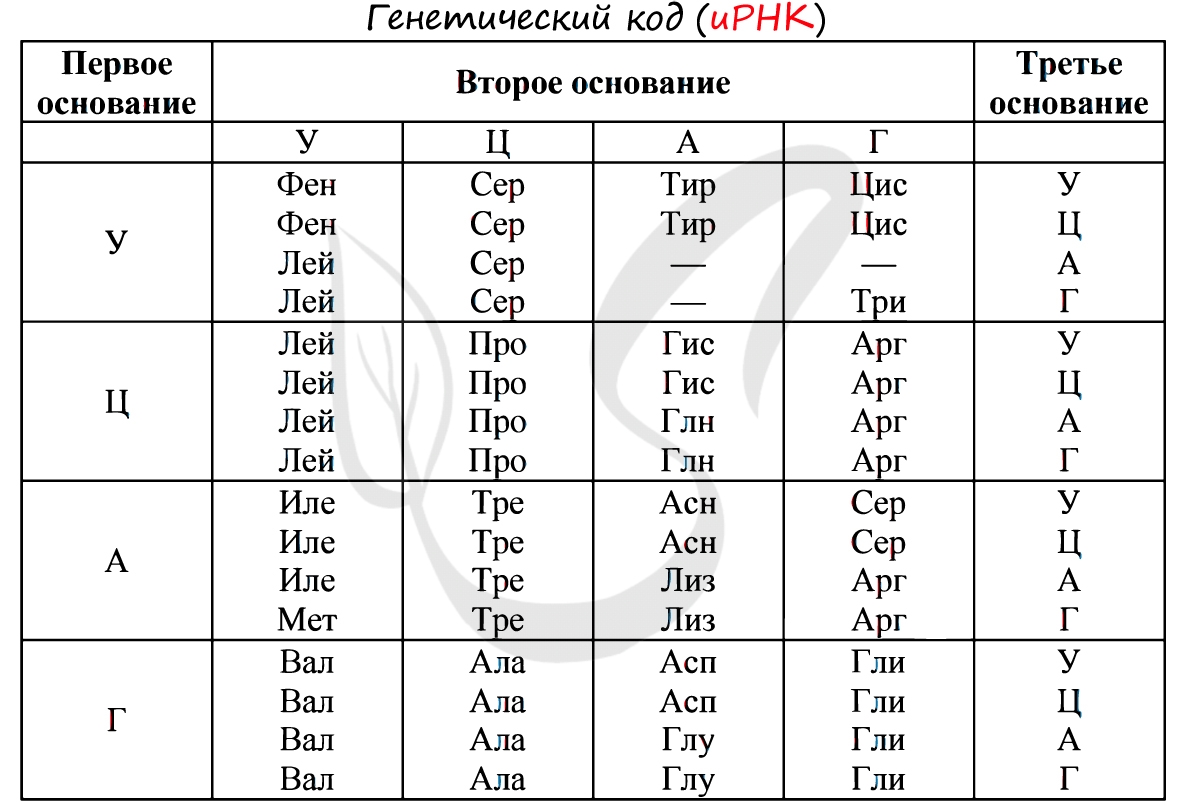
Без практики теория мертва, так что скорее решим задачи! В первых двух задачах будем пользоваться таблицей генетического кода (по иРНК), приведенной вверху.
«Фрагмент цепи ДНК имеет следующую последовательность нуклеотидов: ЦГА-ТГГ-ТЦЦ-ГАЦ. Определите последовательность нуклеотидов во второй цепочке ДНК, последовательность нуклеотидов на иРНК, антикодоны соответствующих тРНК и аминокислотную последовательность соответствующего фрагмента молекулы белка, используя таблицу генетического кода»
По принципу комплементарности мы нашли вторую цепочку ДНК: ГЦТ-АЦЦ-АГГ-ЦТГ. Мы использовали следующие правила при нахождении второй нити ДНК: А-Т, Т-А, Г-Ц, Ц-Г.
Вернемся к первой цепочке, и именно от нее пойдем к иРНК: ГЦУ-АЦЦ-АГГ-ЦУГ. Мы использовали следующие правила при переводе ДНК в иРНК: А-У, Т-А, Г-Ц, Ц-Г.
Зная последовательность нуклеотидов иРНК, легко найдем тРНК: ЦГА, УГГ, УЦЦ, ГАЦ. Мы использовали следующие правила перевода иРНК в тРНК: А-У, У-А, Г-Ц, Ц-Г. Обратите внимание, что антикодоны тРНК мы разделяем запятыми, в отличие кодонов иРНК. Это связано с тем, что тРНК представляют собой отдельные молекулы (в виде клеверного листа), а не линейную структуру (как ДНК, иРНК).
Пример решения задачи №2
«Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой синтезируется участок центральной петли тРНК, имеет следующую последовательность нуклеотидов: ТАГ-ЦАА-АЦГ-ГЦТ-АЦЦ. Установите нуклеотидную последовательность участка тРНК, который синтезируется на данном фрагменте, и аминокислоту, которую будет переносить эта тРНК в процессе биосинтеза белка, если третий триплет соответствует антикодону тРНК»
Пример решения задачи №3
Длина фрагмента молекулы ДНК составляет 150 нуклеотидов. Найдите число триплетов ДНК, кодонов иРНК, антикодонов тРНК и аминокислот, соответствующих данному фрагменту. Известно, что аденин составляет 20% в данном фрагменте (двухцепочечной молекуле ДНК), найдите содержание в процентах остальных нуклеотидов.
Теперь мы украсили теорию практикой. Что может быть лучше при изучении новой темы? 🙂
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Биологические матрицы и биосинтез белка
Как видно из названия этой статьи, речь сегодня пойдет о биологических матрицах — молекулах нуклеиновых кислот.
Причиной, побудившей меня, репетитора биологии по Скайпу, обсуждать с вами данную тему, явилось вот что.
Любые базисные понятия «устройства» жизни могут быть хорошо поняты лишь основываясь на двух четких взаимообусловливающих представлениях:
«что из чего состоит» и «какие функции выполняет». Так вот, что касается состава и строения нуклеиновых кислот — ДНК и РНК — это учащимися обычно выучивается (или вызубривается), а именно, что все нуклеиновые кислоты это гетерополимерные молекулы, мономерами которых являются разные нуклеотиды.
Но мне, как репетитору по биологии, хорошо известно, что, как правило, у многих из вас нет четкого представления о том:
как и почему именно такое строение нуклеиновых кислот обеспечивает выполнение возлагаемых на них природой функций.
За долго до обнаружения нуклеиновых кислот человек изобрел книгопечатание. Какой принцип используется при создании множества одинаковых копий книг? Правильно, принцип матричного копирования.
Один раз созданная, типографическая матрица набранного текста позволяет создать бесчисленное количество своих копий. Причем же здесь, спросите вы, нуклеиновые кислоты?
А вот причем. Для воспроизводства всего живого в природе используется тот же самый матричный принцип. Молекула какой-либо ДНК, созданная один раз, способна создавать свои копии бесчисленное количество раз.
Вы хорошо знаете, что этот процесс в клетке называется репликацией (редупликацией) ДНК или самоудвоением ДНК. На каждой нити материнской ДНК идет синтез дочерних нитей согласно принципу комплементарности азотистых оснований нуклеотидов.
Это помогает понять как из одной материнской молекулы ДНК образуется две молекулы ДНК — совершенно идентичные материнской:
И вот сейчас, пожалуй, самое главное.
Когда в клетке происходит репликация ДНК
Правильно, лишь при подготовке ее к будущему делению (митозу или мейозу). Кстати, и это чаще всего упускается из виду: жизнь клетки не сводится к делению ее ядра при митозе, а, наоборот, митоз — лишь совсем непродолжительный этап жизненного цикла клетки.
Основная же по времени жизнь клетки — это первая стадия интерфазы предсинтетического периода, когда молодая клетка, образовавшаяся в результате деления материнской, сначала растет, а потом начинает выполнять все возложенные на неё функции. Продолжительность этого периода зависит от того, к какому типу ткани эта клетка относится.
Таким образом, всего один раз в жизни клетки, ДНК является матрицей для копирования самой себя.
Основная же функция ДНК в течение жизни самой клетки — это осуществление (на основе её генов) биосинтеза белковых молекул.
Что такое жизнь клетки? Какие основные процессы должны происходить в ней практически постоянно?
Жизнь клетки — это постепенная реализация генетической информации (по крайней мере её части) заложенной в ДНК. И эта реализация тоже происходит по принципу матричного синтеза. Только при жизни клетки копируется не вся ДНК, как перед её делением, а отдельные ее части, называемые генами.
Для чего они копируются? Для того, чтобы создавались в клетке соответствующие, необходимые ей на данный момент белки, от которых зависит всё всё в клетке и организме в целом.
Сами гены ДНК непосредственно не могут служить основой для синтеза белков. ДНК находится в ядре клетки, а биосинтез белков протекает в эндоплазматической сети (ЭПС) цитоплазмы на специализированных структурах — рибосомах.
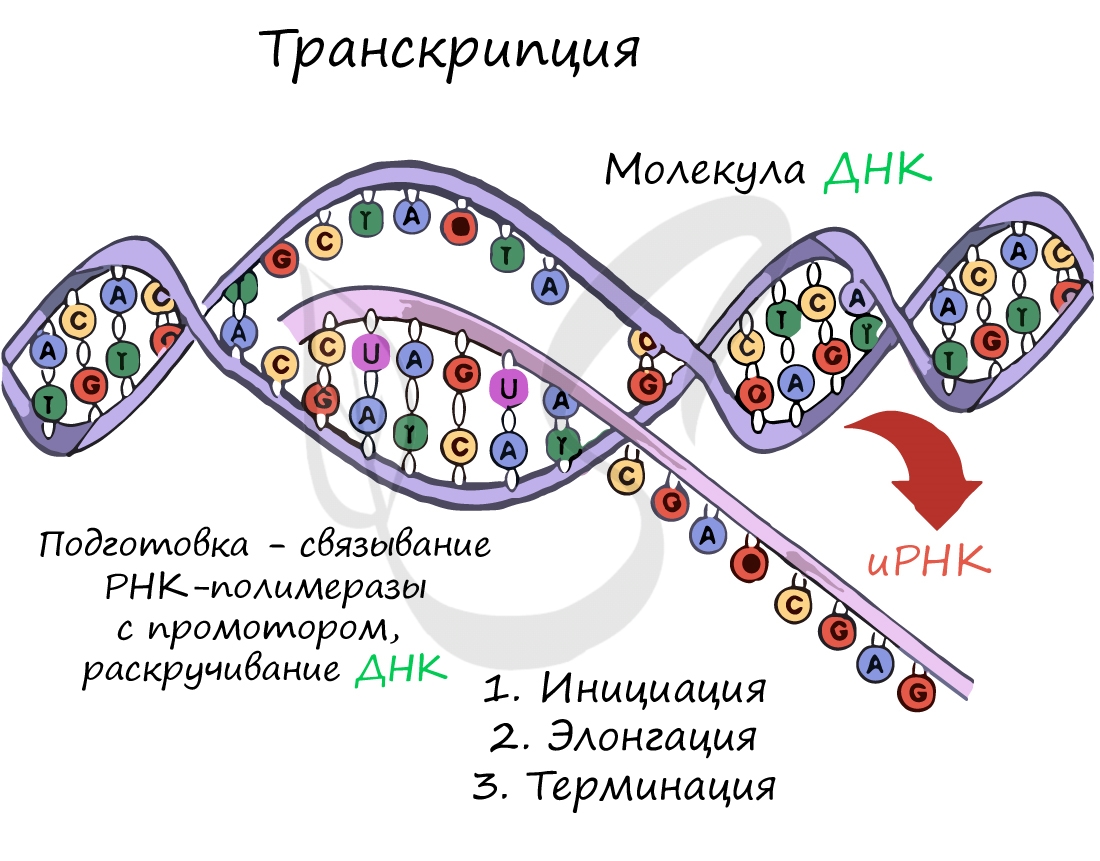
Поэтому сначала информация с отдельных участков ДНК просто переписывается (транскрибируется) на все три вида РНК, необходимые уже для самого процесса синтеза белка.
Специально выделил «три вида РНК»,
потому что по учебникам учащиеся запоминают, что транскрипция — это процесс синтеза только лишь и-РНК.
Пишу «просто» переписывается, потому что она фактически не изменяется. Была записана на языке нуклеотидов ДНК и переписывается на основе правила комплементарности азотистых оснований на язык тех же нуклеотидов, но уже разных видов РНК.
Итак, этот процесс называется транскрипцией. Как репетитор по биологии, хочу обратить на это ваше внимание, так как часто не могут просто запомнить, что означают сами термины…
…………. Термин «транскрипция» (переписывание) путают с «трансляцией«
Трансляция — это уже третье применение клеткой матричного синтеза, только теперь биологической матрицей выступает не ДНК, а информационная (или матричная) РНК. И, что самое важное, этот процесс уже не является простым переписыванием (транскрипцией) с языка нуклеотидов на тот же самый язык нуклеотидов. Здесь намного сложнее:
В результате трансляции, информация записанная последовательностью нуклеотидов и-РНК, должна подвергнуться предварительно расшифровке, декодированию, при помощи антикодонов молекул т-РНК, чтобы превратиться в последовательность аминокислотных звеньев синтезируемой молекулы белка.
Конечно, главное свойство генетического кода, как и любого другого кода вообще — его однозначность: определенному триплету нуклеотидов при синтезе белка соответствует строго определенная (единственная) молекула аминокислоты (триплетом называют три рядом расположенных нуклеотида и-РНК).
Именно трансляцией называется процесс перевода информации в рибосомах, записанной последовательностью нуклеотидов и-РНК, в последовательность аминокислотных звеньев синтезируемой молекулы белка.
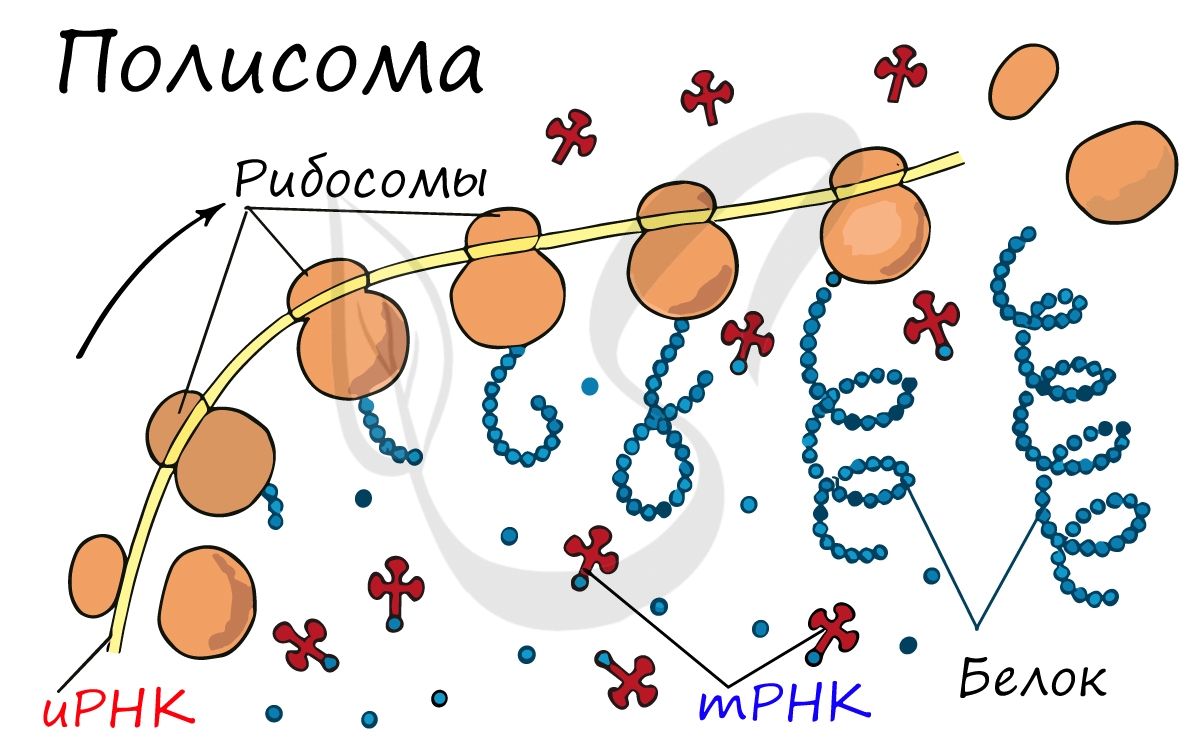
Таким образом, словом трансляция (а оно, обратите внимание, при написании короче, чем слово транскрипция) обозначается в биологии самый сложный и важный процесс, происходящий в клетке — процесс сборки аминокислот на рибосомах в полипептидные цепи, процесс, называемый синтезом (или биосинтезом) белка.
Надо понимать, что сам процесс биосинтеза белка это трансляция, но которой должна предшествовать транскрипция (синтез трех видов РНК: и-РНК, т-РНК и р-РНК).
Вот так, мы поговорили о трех возможностях матричного синтеза в клетке. Что биологические матрицы — это молекулы ДНК и и-РНК, но затронули еще и вопрос как не путать терминологически названия процессов транскрипции и трансляции.
Уважаемые посетители блога, у кого возникнут вопросы к репетитору биологии по Скайпу, пишите в комментариях.
Для подготовки к сдаче ЕГЭ или ОГЭ, у меня на блоге вы можете приобрести ответы на все тесты Открытого Банка Заданий ФИПИ за все годы проведения экзаменов по ЕГЭ и ОГЭ (ГИА).
Что такое внеклеточный матрикс и почему его все изучают
Внеклеточный матрикс — неотъемлемая часть любой ткани.
Автор
Редакторы
Внеклеточный матрикс (ВКМ) — многокомпонентная субстанция, в которую погружены все клетки нашего организма. В последнее десятилетие интерес к внеклеточному матриксу значительно возрос. Это связано с установлением его роли в старении, клеточной дифференцировке, успешной терапии рака и лечении некоторых наследственных заболеваний. Мы подготовили цикл статей, в котором расскажем об организации внеклеточного матрикса, болезнях, связанных с его патологиями, роли ВКМ в старении и подходах к корректировке возрастных изменений.
В первой статье цикла мы рассказываем о компонентах и функциях внеклеточного матрикса, разбираемся, какую практическую пользу может принести его изучение, а также вкратце освещаем самые важные открытия в этой области, совершенные за последний год.
Редакция благодарит Татьяну Голубеву за экспертные консультации и комментарии при подготовке статьи.
Что такое внеклеточный матрикс?
Внеклеточный матрикс (ВКМ, extracellular matrix, ECM) объединяет разрозненные клетки в единый многоклеточный организм. ВКМ похож на государство, в котором живут граждане-клетки: он отвечает за благополучие клеток и управляет всеми аспектами их жизни — от питания и размножения до смерти. Для клеток ВКМ — это и квартира, и магазин, и интернет, и общественный транспорт.
ВКМ: основные игроки
Создатели ВКМ. Компоненты ВКМ синтезируют специализированные клетки. В соединительной ткани наиболее распространены фибробласты, однако создавать ВКМ умеют и другие клетки: в хрящах, например, это хондроциты, а в костях — остеобласты. Компоненты матрикса могут синтезировать и клетки прилегающих органов: например, клетки эпителия сосудов производят компоненты рыхлой соединительной ткани.
Разрушители ВКМ. Порядок в ВКМ наводят белки — разрушители его компонентов. Наиболее важные из них, металлопротеиназы, «расчищают путь» клеткам, которые движутся в ВКМ, и уничтожают старые и «сломанные» компоненты матрикса.
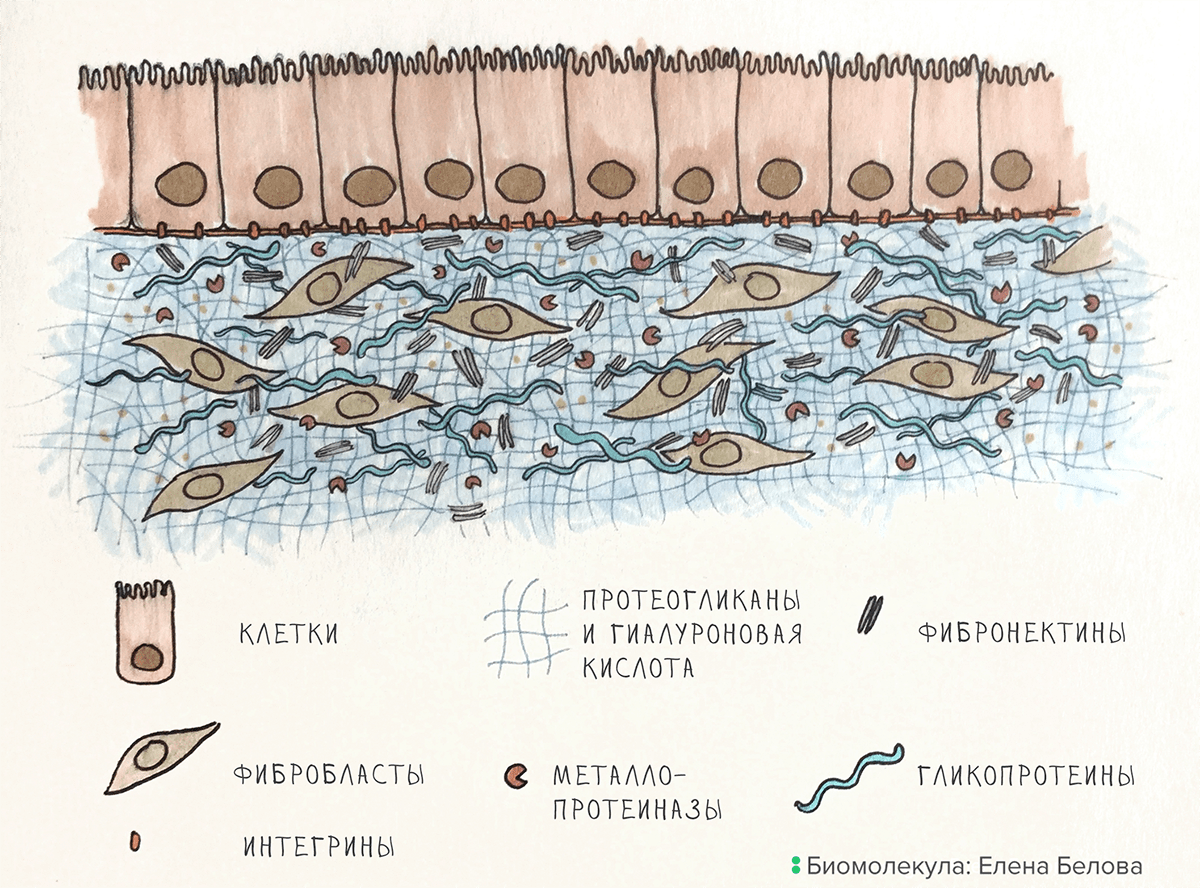
Основное вещество ВКМ. Основу матрикса формируют гиалуроновая кислота и особые белки: гликопротеины и протеогликаны (рис. 1). В состав ВКМ входит и множество других белков со специфической функциональной нагрузкой — интегрины, фибронектины, эластин, — о них мы поговорим в следующем разделе.
Тем, кто хочет узнать больше о построении и разрушении ВКМ, советуем почитать замечательный обзор на эту тему — «Кто рубит коллагеновый лес» [1].
Рисунок 1. Организация ВКМ на примере кожи. Фибробласты создают ВКМ, металлопротеиназы его разрушают. Клетки эпидермиса связаны с ВКМ при помощи интегринов.
Компоненты ВКМ
Выделяют два подкласса белков, содержащих углеводы, — протеогликаны и гликопротеины. Оба подкласса входят в состав ВКМ, однако между ними есть существенные различия.
В гликопротеинах доля углеводов не превышает 20%, углеводные цепи короткие, имеют нерегулярное строение и не содержат уроновых кислот.
К гликопротеинам относятся такие важные структурные белки, как коллаген и эластин. За счет самого распространенного структурного белка в организме — коллагена — ВКМ приобретает прочность, а за счет эластина — гибкость и эластичность.
Протеогликаны — сложные белки с высокой степенью гликозилирования, часто имеющие в своем составе уроновые кислоты. В отличие от гликопротеинов, около 90–95% массы такой молекулы составляют длинные углеводные цепи регулярного строения, а на белки приходится лишь 5–10%. Такое строение обуславливает высокую молекулярную массу протеогликанов. Например, у аггрекана, белка хрящевой ткани, она может достигать 5 МДа [2]! Протеогликаны запасают воду и полезные вещества, то есть работают как «магазин», из которого клетки получают необходимые «продукты». Например, они могут фиксировать ионы кальция в очагах оссификации. Кроме того, они играют роль межтканевых прослоек и смазочного материала в суставах.
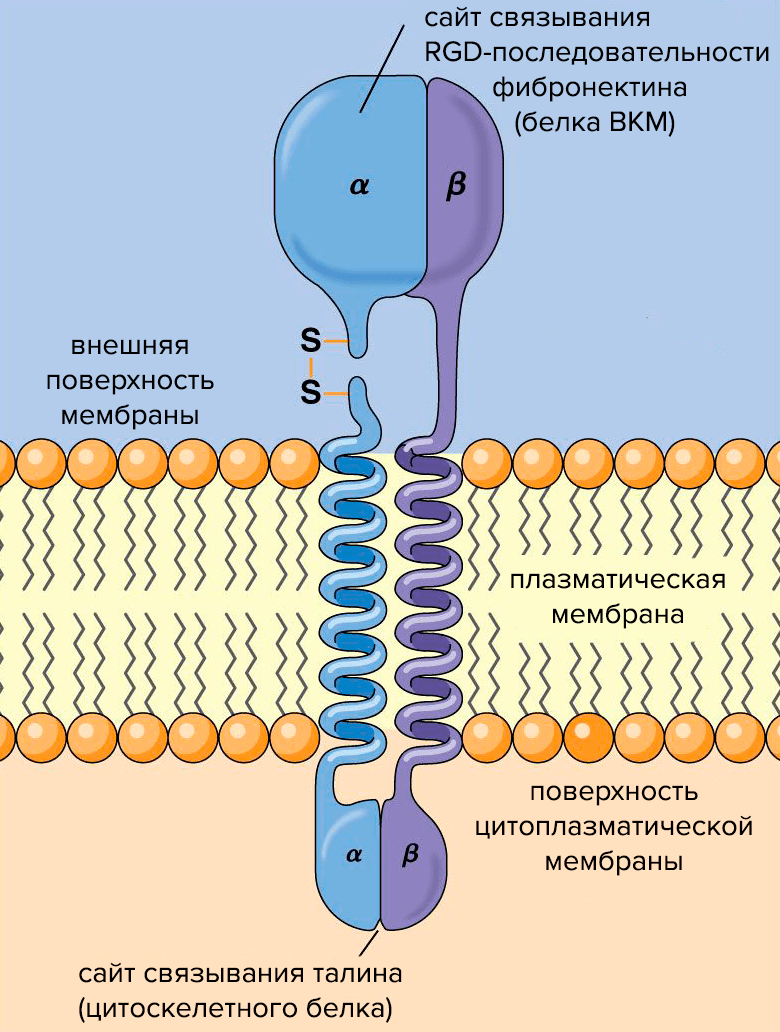
Рисунок 2. Схема строения молекулы интегрина. Субъединицы интегрина (α и β) пронизывают плазматическую мембрану, связывая клетку с внешней средой.
Интегрины — трансмембранные клеточные рецепторы, которые взаимодействуют с ВКМ и участвуют в межклеточной коммуникации. В результате этих взаимодействий в клетках активируются сигнальные каскады, регулирующие экспрессию генов, отвечающие за пролиферацию и дифференцировку клеток, их выживание или апоптоз. То есть система интегрины—ВКМ — нечто среднее между «интернетом» и «рабочим чатом».
Структурно интегрины представляют собой облигатные гетеродимеры: каждый состоит из одной α- и одной β-субъединицы (рис. 2). Альфа-субъединицы определяют специфичность интегрина к лиганду — молекуле, способной образовывать комплекс с интегрином и таким образом воздействовать на клетку. Бета-субъединицы связаны с компонентами цитоскелета и обеспечивают передачу сигнала в клетке. О работе интегринов подробно рассказано в статье «Клетки под давлением» [3].
Интегрины улавливают химические и физические сигналы из внеклеточного матрикса и проводят их в клетку. Сигнал от интегринов передается в ядро через белки цитоскелета и сигнальные белки — так ВКМ управляет экспрессией генов и регулирует клеточную пролиферацию. При посредничестве белков цитоскелета ВКМ также управляет формой и движениями клеток.
Фибронектины — это белки клеточной адгезии. Растворимые предшественники фибронектинов синтезируюся внутри клеток и затем попадают в ВКМ. Интегрины превращают фибронектины в нерастворимые нити — компоненты внеклеточного матрикса [4]. Они помогают клеткам закрепляться на поверхностях и отвечают за их рост и перемещение в ВКМ [5].
Гиалуроновая кислота (ГК) синтезируется встроенными в мембрану белками и затем «выдавливается» через нее в межклеточное пространство. По составу ГК похожа на углеводную часть протеогликана и представляет собой полимер из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. ГК помогает интегринам проводить сигналы в клетку, регулирует клеточный ответ на эти сигналы и, подобно фибронектину, дает клеткам возможность закрепляться на различных поверхностях [6]. Образно говоря, ГК выполняет задачи «интернет-провайдера» и «билета на общественный транспорт».
Почему так важно изучать внеклеточный матрикс?
Внеклеточный матрикс присутствует во всех тканях организма, поэтому сбои в его функционировании ведут к развитию болезней соединительной ткани, преждевременному старению и гибели клеток. Самый очевидный стимул для изучения ВКМ — необходимость лечения заболеваний, связанных с нарушениями структуры соединительной ткани. Таких болезней много, они могут протекать тяжело и значительно ухудшать качество жизни пациентов. Вот несколько примеров.
Мутации в генах, отвечающих за синтез структурных белков ВКМ, приводят к врожденным патологиям [7]. Поскольку соединительная ткань — основа всех систем организма, пострадать от генетических нарушений может любой орган. Такие нарушения приводят:
Преждевременное разрушение ВКМ — еще одна серьезная проблема. Здоровый внеклеточный матрикс постоянно обновляется и реструктурируется. За это отвечает семейство металлопротеиназ, белков — разрушителей ВКМ.
Металлопротеиназы — ферменты, в каталитический центр которых входят ионы металлов, в основном цинка. Отсюда и название с приставкой «металло-». Помимо каталитического центра, который отвечает за разрушение ВКМ, у металлопротеиназ есть регуляторный продомен, оберегающий фермент от преждевременной активации и ложного срабатывания.
Как именно металлопротеиназы разрушают коллаген и «отцепляют» клетки от волокон внеклеточного матрикса, рассказано в статье «Кто рубит коллагеновый лес» [1]. Сейчас же нам важно понять, что если металлопротеиназы «выходят из-под контроля», то они начинают буквально сметать всё на своем пути. Бесконтрольное разрушение ВКМ приводит к фиброзу и может вызвать рак [8] — например, рак предстательной железы [9].
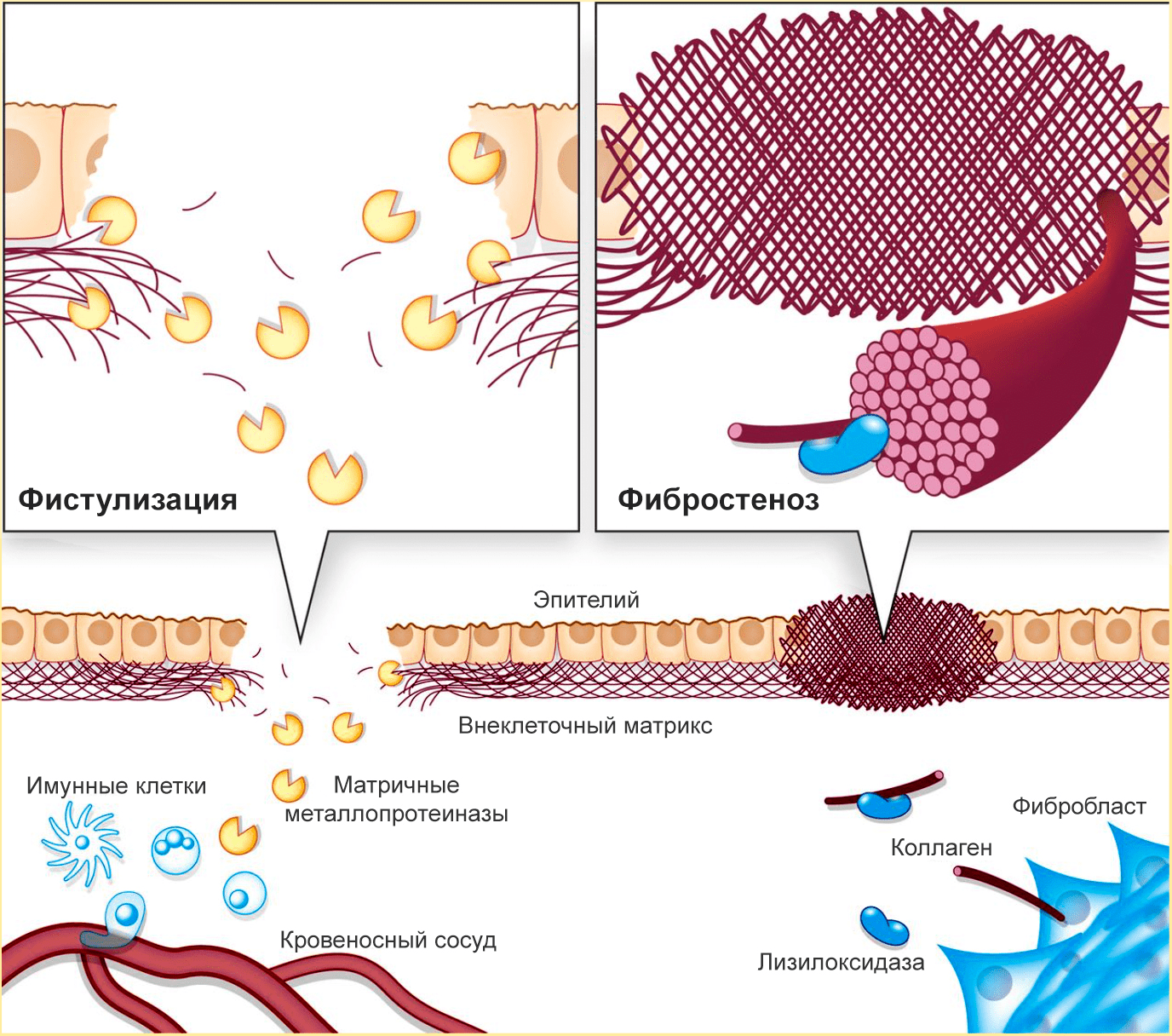
Еще одна патология, вызываемая нарушениями в процессах разрушения и формирования ВКМ, — болезнь Крона (хроническое воспаление кишечника) [10]. По мере ее развития возникает фистулизация и фибростеноз кишечника (рис. 3).
Рисунок 3. При болезни Крона происходит фистулизация и фибростеноз кишечника. Из-за избыточного разрушения ВКМ в кишечной стенке образуются отверстия, а из-за избыточного синтеза коллагена сужается просвет кишечника.
Фистулизация — образование отверстий в кишечной стенке. Этот процесс связан с неконтролируемой активностью металлопротеиназ, разрушающих коллаген слизистой оболочки кишечника. Так как целостность слизистой нарушается, иммунные клетки из кровеносных сосудов проникают в кишечную стенку — так развивается воспаление, а через некоторое время появляется отверстие в стенке кишечника.
Фибростеноз — сужение кишечника. Реагируя на повреждения, фибробласты интенсивно производят коллаген. Затем активируется лизилоксидаза — внеклеточный медьсодержащий фермент, катализирующий образование сложных поперечный связей в коллагене и эластине. Лизиолоксидаза необходима для формирования зрелых коллагеновых волокон, но при ее избытке начинаются проблемы. Этот фермент создает прочную коллагеновую сеть, «запечатывающую» поврежденные кишечные стенки, но из-за избыточной жесткости коллагеновых «печатей» фиброз только усиливается. В результате возникают воспаление и (иногда) непроходимость кишечника. Фистулизация усиливает фибростеноз: неуправляемое разрушение коллагена стимулирует его столь же неуправляемый синтез.
Избыточный синтез ВКМ часто говорит о том, что у человека рак и у этого рака плохой прогноз [11]. Кроме того, сам ВКМ может способствовать росту опухоли и распространению метастазов — это доказано для опухоли головного мозга. Особенно неприятно, что существующие методы лечения — например, лучевая терапия — способны заставить ВКМ послать клеткам сигнал, который может привести к рецидиву опухоли мозга [12].
Состав ВКМ головного мозга уникален: в нём очень много гиалуроновой кислоты и при этом гораздо меньше коллагена, фибронектина и других компонентов, характерных для ВКМ всех остальных тканей. Несмотря на важность ГК для нормальной работы тканей, в некоторых случаях она помогает проводить в клетки опухоли сигналы, делающие их более агрессивными. О том, как именно ГК «дразнит» раковые клетки, мы поговорим в разделе «Что нового мы узнали о внеклеточном матриксе за последний год?»
Лучевая терапия стимулирует работу мембранных белков HAS2, которые отвечают за синтез ГК. В результате они синтезируют больше гиалуроновой кислоты, а чем больше ГК, тем агрессивнее становятся опухолевые клетки. Получается, что лучевая терапия может стимулировать метастазирование опухоли. Таким образом, из-за особенностей ВКМ лучевая терапия помогает только на время: опухоль часто возвращается, становясь еще более опасной. Отчасти по этой причине некоторые виды опухолей мозга так плохо поддаются лечению.
Проблемы с ВКМ — важная причина старения
Первые признаки старения, которые сразу бросаются в глаза, — слабость, хрупкость костей, появление морщин и старческих пятен. Многие из этих проблем связаны с необратимыми изменениями во внеклеточном матриксе.
Одна из причин старения кожи — нарушение работы фибробластов (клеток, синтезирующих компоненты внеклеточного матрикса). При этом благополучие фибробластов зависит от состояния внеклеточного матрикса — получается замкнутый круг.
Рисунок 4. Микрофотография коллагеновых нитей в коже. а — «Целый» коллаген в молодой коже. б — Фрагментированный коллаген в стареющей коже. Стрелки указывают на старые, «разорванные» на кусочки нити коллагена.
Чтобы фибробласты хорошо себя чувствовали, им нужно цепляться за интактные, целые коллагеновые нити. Но со временем эти нити фрагментируются, и фибробластам становится не к чему крепиться, чтобы создать новый, целый коллаген (рис. 4) [13]. Если бы мы научились разрывать этот замкнутый круг, то нам, вполне возможно, больше никогда не понадобились бы антивозрастные услуги косметологов и пластических хирургов.
Старение костной ткани чаще всего связано с нарушением работы остеобластов. Эти клетки создают костный ВКМ, синтезируя коллаген и особые гликопротеины, которые участвуют в первом этапе минерализации коллагена. На втором этапе коллаген превращается в прочный внеклеточный матрикс — основу кости [14].
С течением лет старые остеобласты погибают, а новые делятся хуже и хуже. Оставшимся в живых стареющим клеткам становится всё сложнее справляться с созданием внеклеточного матрикса. Из-за этого кости у пожилых людей становятся очень хрупкими и плохо заживают после переломов.
Если бы мы могли заставить остеобласты делиться или хотя бы выяснили, как помочь им эффективнее минерализовать соединительную ткань, у пожилых людей появилась бы возмножность быстрее восстанавливаться после переломов. Такие работы уже ведутся!
В одной из подобных работ исследователи взяли коллагеновый гель, добавили к нему два неколлагеновых белка, ответственных за минерализацию коллагена (остеокальцин и остеопонтин), и создали на их основе искусственный внеклеточный матрикс. Этот исусственный ВКМ исследователи «предложили» остеобластам, полученным из стволовых клеток костного мозга. В результате активизировалось деление остеобластов, и эти остеобласты начали производить больше компонентов внеклеточного матрикса — правда, пока только в лабораторных условиях [14]. Чтобы искусственный ВКМ появился в кабинете травматолога и оказал содействие в восстановлении костей реальных пациентов, потребуется провести еще много исследований.
Что нового мы узнали о внеклеточном матриксе за последний год?
Над изучением ВКМ работают сотни исследовательских групп по всему миру, и каждый день появляется множество публикаций по этой теме. Давайте рассмотрим несколько свежих работ, чтобы получить представление о ключевых направлениях современных исследований. Вот что мы узнали о компонентах ВКМ в 2018 году.
Металлопротеиназы
Когда металлопротеиназы преждевременно разрушают эластин и коллаген легких, возникает соединительнотканное заболевание легких — эмфизема. Ученые давно стремились узнать, какой генетический компонент влияет на чрезмерную активность металлопротеиназ при этом заболевании.
Исследователи из немецкого Общества имени Макса Планка [15] связали чрезмерную активность металлопротеиназ в легких со снижением активности гена Myh10. Если этот ген «отключали» в мышиных легких, их внеклеточный матрикс формировался неправильно, разрушались межальвеолярные перегородки, с укрупнением альвеол сокращалась суммарная площадь их поверхности, а значит, должен был страдать газообмен. То есть события развивались по сценарию, типичному для человеческой эмфиземы лёгких. Кроме того, авторы работы выявили снижение экспрессии гена MYH10 в легких людей, страдающих эмфиземой.
Не исключено, что в будущем мы научимся управлять процессами, которые протекают в матриксе, используя редактирование генома и генную терапию.
Гликопротеины и металлопротеиназы
Яркий пример коварства металлопротеиназ — образование аневризм. Так, при аневризме брюшной аорты матриксные металлопротеиназы разрушают компоненты, из которых строится ВКМ этого крупного сосуда. Вскоре эта область воспаляется благодаря деятельности иммунных клеток — макрофагов. Механизмы, заставляющие металлопротеиназу разрушать аорту, долгое время оставались неизвестными.
Американским исследователям удалось выяснить, что макрофаги синтезируют нетрин-1 — белок, активирующий клетки гладких мышц сосудов [16]. Под воздействием нетрина-1 гладкомышечные клетки активируют свободные металлопротеиназы, разрушающие соединительную ткань сосуда.
Возможно, когда-нибудь мы научимся использовать иммунные клетки, чтобы управлять разрушением внеклеточного матрикса.
Интегрины и фибронектины
Южноафриканские исследователи обнаружили, что на синтез и деградацию фибронектина влияет внутриклеточный белок теплового шока Hsp90. Этот белок воздействует на фибронектин посредством рецептора LRP1 [4]. Если заблокировать этот рецептор, количество фибронектина, который накапливается во внеклеточном матриксе, уменьшается. И это очень хорошо — ведь из-за избыточного накопления фибронектина развиваются многие патологии ВКМ.
Не исключено, что если мы обнаружим подобные рецепторы в клетках разных тканей и научимся на них воздействовать, то сможем предотвращать болезни, связанные с накоплением ВКМ — например, фиброз легких.
Гиалуроновая кислота
Как компонент внеклеточного матрикса гиалуроновая кислота участвует в передаче сигнала от ВКМ в клетку и даже может превратить здоровую клетку в злокачественную [17]. Гиалуроновая кислота воздействует на клетки через рецептор CD44.
Удалось выяснить, что интенсивность сигнала, запускающего злокачественный процесс в клетке и определяющего, насколько опасна будет получившаяся раковая клетка, зависит от концентрации гиалуроновой кислоты и от ее молекулярной массы.
Гиалуроновая кислота управляет раковыми клетками, связываясь с трансмембранным белком — интегрином CD44. Активация рецептора CD44 подавляет апоптоз, из-за чего клетка становится «бессмертной», то есть раковой. Чем больше гиалуроновой кислоты, тем больше активируется рецепторов CD44 и тем, соответственно, опаснее и агрессивнее будут раковые клетки.
Если мы научимся управлять гиалуронидазами — ферментами, которые отвечают за модификацию и деградацию гиалуроновой кислоты, — мы сможем предотвращать развитие рака и появление метастазов.
Как создавать ВКМ
Когда мы усовершенствуем технологии создания искусственного ВКМ, мы сможем производить полноценные ткани и использовать их в регенеративной медицине. Работы в этом направлении ведутся уже давно, и в прошлом году удалось сделать несколько важных шагов на пути к технологии искусственного ВКМ.
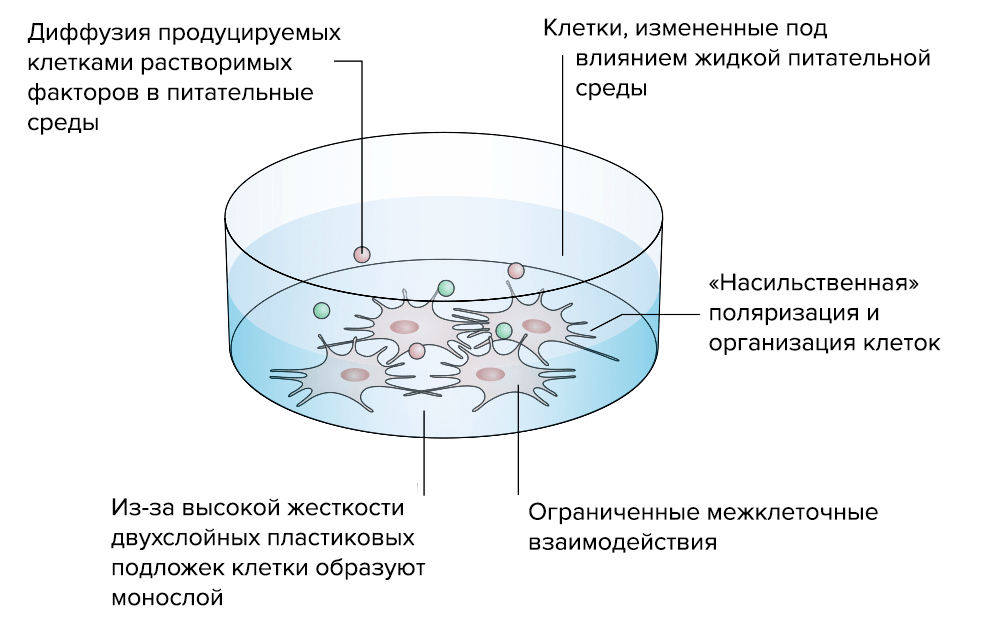
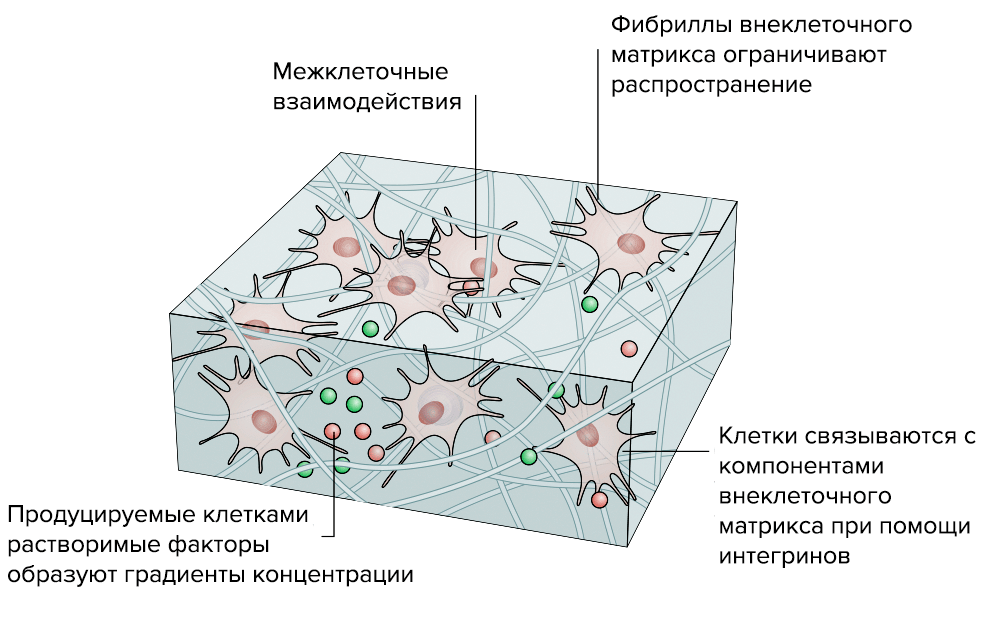
Исследователи уже научились создавать рабочие 3D-модели ВКМ (рис. 5). В отличие от традиционных 2D-моделей, которые, по сути, представляли собой клеточную культуру в чашке Петри, 3D-модели позволяют создать работающий объемный «макет» нужной нам ткани [18].
Рисунок 5а. Преимущества «объемной» 3D-модели соединительной ткани перед стандартной «плоской» 2D-моделью. 2D-модель. Клетки, выращенные на двумерной пластиковой подложке, ведут себя неестественно: нарастают в один слой, из-за чего нарушается межклеточное взаимодействие.
Рисунок 5б. Преимущества «объемной» 3D-модели соединительной ткани перед стандартной «плоской» 2D-моделью. 3D-модель. «Живой макет» ведет себя почти так же, как функциональная ткань: клетки растут и располагаются так, как им «нравится», поэтому у них сохраняется способность к полноценному межклеточному взаимодействию.
3D-модели можно модифицировать и дорабатывать. Уже созданы первые гидрогели — биосовместимые синтетические полимеры, способные удерживать воду. С появлением гидрогелей появилась и теоретическая возможность печатать внутренние органы.
Перед тем как первые напечатанные в лаборатории 3D-органы поступят в больницу, ученым придется решить еще множество проблем. Например, исследователям только предстоит разобраться с тем, как «подвести» к искусственным органам кровеносные сосуды. В этом тоже может помочь понимание биологии ВКМ — ведь мы уже знаем, что внеклеточный матрикс управляет в том числе и ростом сосудов [19].
Заключение
Внеклеточный матрикс — огромная тема, которую очень сложно охватить в одной статье. Ясно одно: если мы сумеем разобраться, как ВКМ функционирует и влияет на клетки, медицина сделает огромный шаг вперед.
Новые открытия в области изучения ВКМ помогут нам:
Судя по всему, ждать прорыва в изучении ВКМ осталось недолго.