Менингорадикулолиз позвоночника это что
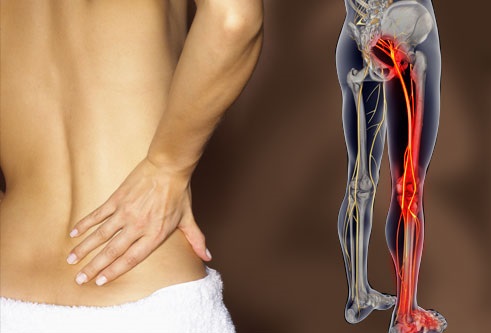
Корешковый синдром поясничного отдела
Причины
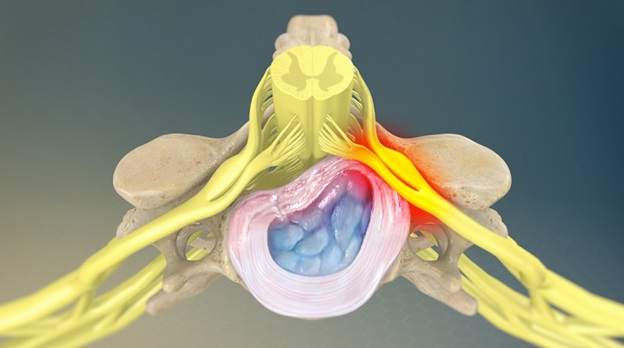
Любые морфологические образования или патологические процессы, которые приводят к компрессионному воздействию на нервный корешок, могут стать причиной корешкового синдрома.
Основными причинами поясничной радикулопатии являются:
У пациентов моложе 50 лет наиболее частой причиной корешкового синдрома в поясничном отделе позвоночника является грыжа межпозвоночного диска. После 50 лет корешковая боль часто вызвана дегенеративными изменениями позвоночника (стеноз межпозвоночного отверстия).
Факторы риска развития поясничной радикулопатии:
Симптомы
Симптомы, возникающие в результате корешкового синдрома (радикулопатии), локализуются в зоне иннервации конкретного корешка.
Паттерны боли
Начало появления симптомов у пациентов с пояснично-крестцовой радикулопатией (корешковым синдромом) часто бывает внезапным и включает боль в пояснице.
Сидение, кашель или чихание могут усугубить боль, которая распространяется от ягодицы по задней поверхности голени, лодыжки или стопы.
Необходимо быть бдительным при наличии определенных симптомов (красных флажков). Такие красные флажки могут означать более тяжелое состояние, требующее дальнейшего обследования и лечения (например, опухоль, инфекция). Наличие лихорадки, потери веса или ознобов требует тщательного обследования.
Возраст пациента также является фактором при поиске других возможных причин симптоматики у пациента. Лица моложе 20 лет и старше 50 лет подвержены повышенному риску возникновения более серьезных причин боли (например, опухоли, инфекции).
Диагностика
Первичный диагноз корешкового синдрома пояснично-крестцового отдела позвоночника выставляется на основании симптоматики истории болезни и данных физического обследования (включая тщательное изучение неврологического статуса). Тщательный анализ моторной, сенсорной и рефлекторной функций позволяет определить уровень поражения нервного корешка.
Если пациент сообщает о типичной односторонней иррадиирущей боли в ноге и есть один или несколько положительных результатов неврологического теста, то тогда диагноз радикулопатии очень вероятен.
Тем не менее, существует ряд состояний, которые могут проявляться схожими симптомами. Дифференциальную диагностику необходимо проводить со следующими состояниями:
Для постановки клинически достоверного диагноза, как правило, требуются инструментальные методы диагностики:
Лечение
Лечение корешкового синдрома пояснично-крестцового отдела позвоночника будет зависеть от тяжести симптоматики и клинических проявлений. Чаще всего, используется консервативное лечение, но в определенных случаях бывает необходимо хирургическое лечение.
Консервативное лечение:
Иглорефлексотерапия. Этот метод широко используется в лечении корешкового синдрома в пояснично-крестцовом отделе позвоночника и помогает как снизить симптоматику в остром периоде, так и входит в комплекс реабилитации.
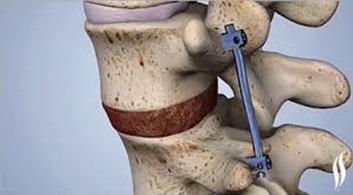
Хирургическое лечение
Оперативные методы лечения корешкового синдрома в пояснично-крестцовом отделе позвоночника необходимы в тех случаях, когда есть устойчивость к консервативному лечению или имеются симптомы, свидетельствующие о выраженной компрессии корешка такие как:
Некоторые хирургические процедуры, используемые для лечения поясничной радикулопатии:
Прогноз
В большинстве случаев удается лечить корешковый синдром в пояснично-крестцовом отделе позвоночника консервативно (без хирургического вмешательства) и восстановить трудоспособность. Продолжительность лечения может варьироваться от 4 до 12 недель в зависимости от тяжести симптомов. Пациентам обязательно необходимо продолжать в домашних условиях выполнять упражнения для улучшения осанки, а также на растяжение, усиление и стабилизацию. Эти упражнения необходимы для лечения состояния, вызвавшего корешковый синдром.
Менингорадикулолиз позвоночника это что
Остеохондроз пояснично-крестцового отдела позвоночника — одно из наиболее распространенных хронических заболеваний. В случае развития стойкого болевого синдрома, неврологического дефицита, вызванного вертеброгенной компрессией невральных структур, хирургическое вмешательство нередко является единственным методом лечения. Оно позволяет значительно улучшить качество жизни больных, возвращая их к нормальной жизнедеятельности. Эффективность хирургического лечения достаточно высока, что достигается совершенствованием микрохирургической техники, применением новых физиологических имплантов, коррекцией образа жизни перенесшего операцию пациента. Последний фактор имеет не меньшее значение, чем технически правильно проведенное вмешательство, однако даже при его качественном выполнении и соблюдении больными правильного образа жизни у 10—20% из них оперативное лечение оказывается неэффективным. У данной категории пациентов имеет место так называемый синдром оперированного позвоночника (СОП: синоним «синдром неудачной операции на позвоночнике»). Существует также термин «постламинэктомический синдром». но он является устаревшим, так как большинство операций по поводу остеохондроза поясничного отдела позвоночника проводят с сохранением дужки позвонка. СОП — закономерное отсроченное следствие хирургического лечения. К нему не относятся такие периоперационные осложнения, как повреждение невральных структур или твердой мозговой оболочки с ликвореей, массивная кровопотеря, анестезиологические осложнения и т. д. Спорным является отнесение к СОП случаев технически некорректно выполненной операции (невыполнение стабилизации при нестабильности позвонков, недостаточная секвестрэктомия при удалении грыжи межпозвонкового диска (ГМД), недостаточная декомпрессия позвоночного канала при его стенозе, неправильная установка имплантов, ошибка при выборе уровня операции и т. д.).
Спектр проявлений СОП включает 1. Рецидив ГМД; 2. Стеноз позвоночного канала и нестабильность на оперированном уровне; 3. Синдром смежного уровня позвоночника; 4. Дисцит и раневую инфекцию; 5. Фасеточный синдром; 6. Фиброзную атрофию мышц; 7. Рубцово-спаечный эпидурит, арахноидит, посткомпрессионную изолированную радикулопатию; 8. Эпидуральную гематому; 9. Поломку, смещение имплантов, резорбцию кости в области установки импланта.
Учитывая, что оперированные пациенты на уровне амбулаторного звена находятся под наблюдением неврологов, необходимо, чтобы эти специалисты были широко осведомлены о СОП.
Цель настоящего обзора — обобщение современных данных, касающихся перечисленных выше проявлений СОП после хирургического лечения остеохондроза поясничного отдела позвоночника.
Рецидив ГМД
Данное осложнение стоит на первом месте среди причин СОП. К истинному рецидиву ГМД относят ситуацию, когда у пациента после операции несколько месяцев был безболевой период. При его отсутствии наиболее вероятно предположение о нерадикальной секвестрэктомии. Вне зависимости от правильности выбора тактики оперативного лечения риск рецидива ГМД составляет 3,5—7% [1] и зависит от вида операции — при эндоскопическом удалении он в 2 раза выше, чем при открытой микрохирургической операции [2]. Риск рецидива после микродискэктомии повышается с увеличением размера дефекта фиброзного кольца более 6 мм [3, 4]. В таких случаях дефект может быть закрыт специальным имплантом [5, 6], разрабатываются способы восстановления межпозвонкового диска методами генной инженерии [7—9].
Отношение к ожирению как фактору риска рецидива ГМД неоднозначно: по некоторым данным, ожирение — значимый фактор риска рецидива, однако по другим — нет [10—12]. Выполнение кюретажа диска в дополнение к секвестрэктомии снижает риск рецидива ГМД на 3%. Клинически он проявляется возобновлением болевого синдрома, имевшего место до операции. Диагноз подтверждают магнитно-резонансной томографией (МРТ) позвоночника. В случае стойкого болевого синдрома, сдавления невральных структур показано хирургическое лечение в объеме стандартной микродискэктомии. Есть данные, что микродискэктомию при рецидиве ГМД необходимо дополнять фиксацией сегмента [13]. При проведении микродискэктомии без фиксации повторный рецидив ГМД явно свидетельствует о скрытой нестабильности сегмента.
Стеноз позвоночного канала и нестабильность позвонков на оперированном уровне
После микродискэктомии на оперированном уровне возможно развитие истинного стеноза позвоночного канала, вызванного гипертрофией суставов, дужек, желтой связки, а не гипертрофированным эпидуральным рубцом. Возможно развитие как латерального, так и центрального стеноза. В доступной литературе нам не удалось найти данных о развитии центрального стеноза, хотя на собственном опыте мы сталкивались с ним. Оно связано с перегрузкой и гипертрофией суставно-связочного аппарата в оперированном сегменте. Имеются данные [14—16] о развитии латерального стеноза после микродискэктомии, в том числе фораминального, в остроченном послеоперационном периоде он встречается у 10—30% больных. При микрохирургической декомпрессии позвоночного канала по поводу стеноза возможен рестеноз [17]. Особенно часто он возникает после проведения микрохирургической декомпрессии без стабилизации позвонков у больных со спондилолистезом [18, 19]. Поэтому важным аспектом микрохирургической декомпрессии позвоночного канала является сохранение суставов, так как в случае их разрушения возможно развитие нестабильности и соответственно рестеноза. Факторами риска развития спондилолистеза в этой ситуации являются тропизм (ассимметрия) фасеточных суставов и параспинальных мышц в оперированном сегменте [20]. Дополнение микрохирургической декомпрессии установкой межостистого фиксатора позволяет частично разгрузить суставы и снизить риск рестеноза. Тактика лечения такая же, как и при первичном стенозе, в случае значимого сдавления невральных структур необходима хирургическая декомпрессия позвоночного канала.
Синдром смежного уровня позвоночника
Синдром поражения смежного уровня является типичным отсроченным осложнением спондилодеза. Провоцирующим фактором его развития является увеличение нагрузки на смежный сегмент после выключения подвижности в спондилодезном сегменте [21, 22]. Показано [23], что после спондилодеза нагрузка на диск верхнесмежного уровня увеличивается на 45%. По данным МРТ, через 1 год после проведения спондилодеза у 58% больных отмечаются начальные дегенеративные изменения вышележащего диска в виде дегидратации [24]. Осложнения при синдроме смежного уровня позвоночника включают гипертрофию суставов с развитием стеноза (у 14—45% больных), поражение диска (у 28—40%), спондилолистез (у 17%) [25—28]. Клиническая картина определяется типом поражения позвоночника. Манифестация синдрома смежного уровня начинается через 4 года после спондилодеза и, как правило, вовлекает верхнесмежный сегмент. До 20% больных с синдромом смежного уровня необходимо повторно оперировать. Выделены два основных фактора риска его развития. Первый — поражение смежного сегмента, существовавшее еще до спондилодеза, в первую очередь это касается дегенерации суставов [29—32]. Вторым является формирование спондилодезного сегмента в положении гиполордоза [33—36]. В настоящее время существуют два пути профилактики синдрома смежного уровня: 1) установка динамической системы фиксации с сохранением подвижности на оперированном уровне; 2) одновременное укрепление смежного сегмента во время спондилодеза; эффективность данной методики была доказана в рандомизированном исследовании [37].
Дисцит и раневая инфекция
Послеоперационный дисцит — воспалительный процесс ядра ГМД, замыкательных хрящевых пластинок, смежных кортикальных слоев тел позвонков [38]. Дисцит может быть как асептическим, так и инфекционным [39]. Дисцит и раневая инфекция встречаются у 2—3% пациентов, перенесших микродискэктомию [40]. Описаны случаи [41] дисцита после лазерной вапоризации межпозвонкового диска. Обычно его манифестация начинается через 2—4 нед после операции. Основное проявление — люмбалгия с мышечно-тоническим синдромом; боль может иррадиировать в ягодицы, бедро, пах. В случае включения в воспалительный процесс корешка возможна радикулярная симптоматика. Факторами риска развития дисцита являются сахарный диабет и другие коморбидные заболевания, приводящие к снижению иммунитета. При рентгеновской компьютерной томографии (КТ) визуализируют эрозию замыкательных и кортикальных пластинок; на МРТ в этих зонах отмечают понижение сигнала на Т1 и повышение — на Т2 [42]. Различать асептический и инфекционный дисцит с использованием методов нейровизуализации невозможно [43]. В пользу инфекционного генеза служат воспалительные изменения в анализах крови, положительный бактериологический анализ пунктата межпозвонкового диска. Профилактикой инфекционного дисцита является периоперационное введение антибиотиков. Лечение обычно консервативное — курс антибиотикотерапии широкого спектра в течение 3—6 нед. Вопрос о хирургическом лечении возникает в случае развития и распространения гнойного процесса с риском повреждения невральных структур (эпидуральный абсцесс, остеомиелит с расплавлением тел позвонков и т. д.). Дисцит и раневая инфекция обычно являются самостоятельными процессами и редко сочетаются друг с другом. Раневая инфекция проявляется типичными внешними воспалительными изменениями раны. При наличии гнойного отделяемого из раны показаны опорожнение гнойного очага и его санация. Профилактика инфекционного дисцита и раневой инфекции включает тщательное соблюдение правил асептики во время операции и перевязок. Важным аспектом профилактики является исключение воспалительных очагов при планировании операции.
Фасеточный синдром
Представляет собой комплекс симптомов, обусловленных поражением межпозвонковых суставов. Его развитие после микродискэктомии связано со снижением высоты диска в оперированном сегменте и увеличением осевой нагрузки на фасеточные суставы. Снижение высоты диска часто наблюдается после так называемой «агрессивной микродискэктомии», при которой секвестрэктомию дополняют кюретажем межпозвонкового диска. Обычное клиническое проявление — боль в нижнепоясничном отделе позвоночника, часто с иррадиацией в ягодичную область, бедро, как правило, боль не иррадиирует ниже уровня колена. Она наиболее интенсивна в утреннее время после вставания, усиливается при разгибании и уменьшается при сгибании. Диагноз подтверждается тестовой блокадой фасеточных суставов анестетиком. МРТ и КТ позвоночника позволяют визуализировать дегенеративные изменения фасеточных суставов в виде артроза, гипертрофии, изменения конгруентности суставных поверхностей. Фасеточный синдром развивается у 8% пациентов, перенесших микродискэктомию [44]. Важным направлением его профилактики является курс консервативного послеоперационного лечения — физиотерапия, ЛФК, массаж. Во время операции целесообразно ограничиваться секвестрэктомией с ревизией корешка без кюретажа диска (так называемая неагрессивная микродискэктомия), в этом случае значимого снижения высоты межпозвонкового диска не происходит и риск развития фасеточного синдрома отсутствует. В случае значимого снижения высоты диска еще до операции или невозможности отказаться от кюретажа (большой дефект в задней стенке диска, подвижные секвестры в его полости) необходимо рассмотреть возможность имплантации межостистого фиксатора. Еще одна хирургическая методика, способствующая профилактике развития фасеточного синдрома после микродискэктомии, — закрытие дефекта в фиброзном кольце имплантом [45]. Лечение фасеточного синдрома включает физиотерпию, назначение противоболевых препаратов, блокаду фасеточных суставов. В случае неэффективности консервативного лечения применяют радиочастотную денервацию. Обезболивающий эффект данного метода продолжается около 1 года, в случае рецидива боли возможно повторное вмешательство, при котором он более продолжителен [46, 47]. Существуют также методики химической денервации фасеточных суставов и фасетопластика — введение в полость суставов специального геля. Хирургическое лечение фасеточного синдрома включает имплантацию межостистого фиксатора, который частично разгружает фасетки [48].
Фиброзная атрофия мышц
Боль в парапозвоночных мышцах — обычное проявление рефлекторного мышечно-тонического синдрома при ГМД, фасеточном синдроме, стенозе позвоночного канала или нестабильности позвонков. При операции на позвоночнике параспинальные мышцы отделяют от позвонков и отводят для доступа к проблемному позвоночно-двигательному сегменту. В этот момент возможна прямая травма мышцы в результате излишней тракции или нарушение ее иннервации. Интраоперационная травма парапозвоночных мышц значимо усиливает болевой синдром в ближайшем послеоперационном периоде. Обычно мышцы повреждаются при более обширных операциях, когда отсепаровываются от кости на значительном протяжении — например при открытой транспедикулярной фиксации [49]. Поэтому при миниинвазивных методиках, например эндоскопических, повреждение мышц минимальное [50].
Одним из методов профилактики повреждения мышц во время операции является периодическое ослабление их тракции, при микродискэктомии это позволяет уменьшить болевой синдром в послеоперационном периоде [51]. Данных о том, может ли быть источником боли сама атрофированная мышца, в литературе нам найти не удалось. Изучение хронической вертеброгенной поясничной боли при консервативном лечении продемонстрировало корреляцию болевого синдрома со степенью атрофии парапозвоночных мышц [52]. Это связано с прямой зависимостью между выраженностью развития параспинальных мышц и нагрузкой на соответствующий позвоночно-двигательный сегмент — чем лучше развита мышца, тем меньше нагрузка. Это является аксиомой для всех больных с поясничным остеохондрозом и требует от них поддержания параспинальных мышц в должном тонусе путем регулярных тренировок. Атрофия парапозвоночных мышц легко определяется при физикальном осмотре. Данные К.Т., МРТ позволяют определить степень фиброза и жирового перерождения.
Рубцово-спаечный эпидурит, арахноидит, посткомпрессионная радикулопатия
Рубцово-спаечный эпидурит (эпидуральный фиброз) — частое (встречается у 10—20% оперированных больных) осложнение после микродискэктомии [53]. Морфологически проявляется развитием гипертрофированного фиброзного рубца, спаянного с твердой мозговой оболочкой, обычно в рубец замурован и корешок. Фактором риска развития эпидурального фиброза является послеоперационная эпидуральная гематома. Также установлена индивидуальная предрасположенность к эпидуральному фиброзу в виде особенностей иммунитета, например при аутоиммунных заболеваниях [54]. Эпидуральный фиброз может вызывать латеральный и/или центральный стеноз позвоночного канала с соответствующей неврологической симптоматикой. На нативной МРТ, КТ-миелографии фиброз может выглядеть как рецидив ГМД. Диагноз верифицируют при проведении МРТ с контрастированием, при котором отмечают выраженное накопление контраста в зоне фиброза, чего не наблюдается при ГМД. Интересно, что у некоторых пациентов с выраженным фиброзом в области операции по данным МРТ может отсутствовать неврологическая симптоматика. При наличии болевого синдрома начинают консервативное лечение. Применяется эпидуральное введение нестероидных противовоспалительных препаратов (НПВП), глюкокортикоидов, ферментов [55—58]. Хирургическое лечение заключается в менингорадикулолизе, устранении гипертрофированного рубца. Применяют также эндоскопический адгезиолизис [59]. Пути профилактики послеоперационного эпидурита активно изучаются. В послеоперационном периоде через 5 дней после операции пациент делает специальное упражнение — махи больной ногой в сагиттальной плоскости (если позволяет болевой синдром). Теоретическое обоснование такого упражнения — движения корешка в позвоночном канале во время махов препятствуют развитию спаек. Разрабатываются различные противоспаечные агенты, накладываемые на твердую мозговую оболочку во время первичного вмешательства [60, 61]. Некоторые средства позволяют снизить риск развития эпидурита на 20—30% [62—67]. Считается, что сохранение желтой связки при микродискэктомии надежно предупреждает развитие эпидурального фиброза [68].
Арахноидит может проявляться формированием интрадуральных спаек с образованием кист, слипанием и деформацией корешков, которые выявляются при высокопольной МРТ [69]. Интрадуральное повреждение корешков вызывает разнообразную радикулярную симптоматику. Поскольку в патологический процесс вовлечены непосредственно невральные структуры, болевой синдром при арахноидите плохо поддается терапии [70]. Лечение начинают консервативно, возможно интрадуральное введение НПВП. Описаны способы хирургического рассечения интрадуральных спаек. При неэффективности любого вида лечения методом купирования болевого синдрома является электростимуляция спинного мозга.
Посткомпрессионная изолированная радикулопатия проявляется корешковой симптоматикой после устранения компримирующего корешок фактора (ГМД, гипертрофированный суставно-связочный комплекс, эпидуральный рубец, некорректно установленный имплант). Несмотря на технически правильно проведенную операцию и полную декомпрессию корешка, у пациента могут сохраняться онемение, слабость и боль в соответствующей области. При послеоперационной МРТ отсутствует сдавливающий корешок субстрат, однако он может быть отечен и/или деформирован [71]. Это обусловлено структурными изменениями, произошедшими в корешке за период компрессии [72, 73]. Наиболее тяжелым проявлением является интенсивная корешковая боль. В доступной литературе нам не удалось найти сведений о частоте встречаемости изолированной посткомпрессионной радикулопатии, сопровождающейся болью, интенсивность которой не уменьшилась после проведения операции. По нашим данным, это состояние наблюдается менее чем у 0,5% пациентов, оперированных по поводу остеохондроза позвоночника. Лечение консервативное, при его неэффективности возможно применение электростимуляции спинного мозга.
Эпидуральная гематома
Это редкое и тяжелое осложнение операции на позвоночнике встречается в 0,1% случаев и проявляется развитием каудального синдрома в ближайшие часы после операции [74]. Его развитие требует экстренной повторной операции с удалением гематомы. Факторами риска являются коагулопатии и обширность вмешательства. Отсроченные гематомы, развивающиеся спустя несколько дней или даже недель после операции, — еще более редкое явление [75—77]. Имеется описание наблюдения пациента, которому была выполнена декомпрессивно-стабилизирующая операция на уровне L3—L5 по поводу стеноза позвоночного канала [78]. Через 14 сут после операции у него остро возникла клиническая картина изолированного поражения S2—S4 корешков с задержкой мочеиспускания. Больной был экстренно госпитализирован, на МРТ выявлена эпидуральная гематома, сдавливающая дуральный мешок в области операции. После экстренного удаления гематомы неврологический дефицит регрессировал. В литературе отсутствуют описания постоперационной хронической спинальной эпидуральной гематомы, однако имеются соответствующие данные об идиопатической или посттравматической хронической спинальной эпидуральной гематоме, проявляющейся корешковой симптоматикой [79].
Поломка, смещение имплантов, резорбция кости в области стояния импланта
В хирургии поясничного остеохондроза обычно имплантируют два типа систем: межостистые фиксаторы и транспедункулярные системы с межтеловыми кейджами. Возможно осложнение в виде резорбции кости в области контакта с имплантом, частота его достигает 8% [80]. Оно определяется индивидуальными особенностями реакции костной ткани, вследствие этого правильно установленный во время операции имплант через несколько месяцев/лет начинает разбалтываться и может сместиться. При использовании межостистых имплантов переломы остистых отростков наблюдаются в 1—20%, миграция импланта — в 0,5—2%, поломка — в 1% [81—86]. Переломы балок, винтов, раскручивание гаек, смещение имплантов в транспедункулярных системах встречаются с частотой 1,7—15% [87]. Факторами риска указанных осложнений являются несоблюдение ортопедического режима, остеопороз. Как правило, во всех этих случаях показано удаление импланта. При транспедункулярной фиксации на фоне остеопороза используют саморасширяющиеся или канюлированные винты с введением цемента. Резорбцию кости определяют при рентгенографии и К.Т. Для снижения риска ее развития в послеоперационном периоде возможно лечение, направленное на укрепление костной ткани [88].
Таким образом, в настоящее время проблема СОП широко изучается. Получены новые данные, благодаря которым возможно прогнозировать и предупреждать развитие некоторых осложнений. Однако многие аспекты СОП остаются до конца не изученными. Это касается и рецидива ГМД. Лечение пациента с СОП — сложная и не всегда полностью выполнимая задача. При наличии послеоперационного болевого синдрома у больного с оперированным позвоночником необходимо провести дифференциальный диагноз, обычно в рамках самого СОП. Консервативное лечение таких больных проводится неврологом, при отсутствии эффекта необходима консультация нейрохирурга.