Метаболическая активность фдг что это такое
Позитронно Эмиссионная Томографии (ПЭТ)
Главное в онкологии – максимально быстро начать лечение и лучшим считается тот метод визуализации, который обеспечивает быстроту, неинвазивность и точность, поскольку время, потраченное на диагностику, может обернуться значительным ростом опухоли или метастазированием, а лечение заболевания становится более сложным.
Применение таких методов диагностики опухолей даёт возможность клиницистам онкологического центра имени Н.Н. Блохина выработать адекватную стратегию для успешного и своевременного лечения в каждом конкретном случае.
ПОЗИТРОННАЯ ЭМИССИОННАЯ ТОМОГРАФИЯ (ПЭТ) – метод ядерной медицины, основанный на использовании радиофармпрепаратов (РФП), меченных короткоживущими позитрон-излучающими радионуклидами, которые могут быть включены в состав многих естественных биологических веществ, участвующих в метаболизме, без изменения их биохимических свойств. Поэтому ПЭТ с различными РФП позволяет оценить происходящие в организме процессы, обеспечивает информацией о вариабельности различных клеточных и биологических процессов в опухолях и окружающих их тканях. 18 F-ФДГ («ПЭТ с глюкозой») – наиболее распространённый РФР в онкологии. Препараты на основе аминокислот 18 F-ФЭТ («ПЭТ с тирозином») является аналогом 11 С-Метионина («ПЭТ с метионином»), но обладают рядом преимуществ – меньше накапливаются в воспалительных изменениях и имеют более длинный период полураспада. 18 F-Холин («ПЭТ с холином») – препарат, получивший широкое распространение в мире в диагностике рецидивов рака простаты после радикального лечения и оценке отдалённого метастатического поражения.
ПЭТ – это диагностическая процедура, которая практические не имеет побочных эффектов или абсолютных противопоказаний и, в общем, не доставляет неприятных ощущений. Данное обследование может быть показано как взрослым, так и детям, и, как любые другие диагностические исследования, назначается врачом-клиницистом после консультации.
Исследования в нашем центре проводятся в условиях максимального комфорта и конфиденциальности.
Полученная при ПЭТ исследовании информация о характере метаболических процессов в опухолях даёт возможность целенаправленно воздействовать на их жизнедеятельность, повышает избирательность и точность предстоящего лечения.
Уточнение объёма активной опухолевой ткани позволяет максимально сократить отрицательное влияние на здоровые клетки организма при выборе лучевых методов лечения.
ПЭТ позволяет на ранних сроках выявлять рецидивы злокачественных опухолей и дифференцировать их с посттерапевтическими изменениями (в частности, постлучевыми некрозами и фиброзами).
Метаболическая активность опухоли отображается в виде количественной оценки уровня накопления различных РФП и измеряется в единицах SUV (Standardized Uptake Values – стандартизированный уровень накопления, чаще используются максимальные значения). Динамика изменения уровня накопления РФП в опухолях и их метастазах до лечения и в процессе терапии позволяет с высокой достоверностью оценивать эффективность лечения.
Вследствие разнородности метаболических изменений внутри самой опухоли различные участки злокачественных новообразований могут отличаться по уровню включения РФП. Исходя из этого, ПЭТ позволяет выявлять наиболее агрессивные участки опухоли для выбора оптимального места для биопсии.
Полученная информация даст возможность вашему лечащему врачу в кратчайшие сроки установить диагноз и правильно спланировать лечение.
В нашем отделении исследования проводятся на современной аппаратуре в режиме ПЭТ/КТ. Полученные в ходе исследования данные значительно сокращают общее время диагностики и позволяют адекватно корректировать проводимую терапию.
Особенно важное значение метод имеет при раке лёгких, опухолях желудочно-кишечного тракта, раке простаты, нейроэндокринных опухолях, опухолях головного мозга, а также при лимфомах. При солидных опухолях (опухоли в паренхиматозных органах: таких как лёгкие, печень, простата, почки, головной мозг, поджелудочная железа, яичники и др.) результаты ПЭТ могут использоваться для планирования лечения на роботизированной стереотаксической радиохирургической установке, представленной на территории РОНЦ имени Н.Н.Блохина кабинетом «КиберНож».
ГИБРИДНАЯ ТЕХНОЛОГИЯ ПЭТ, СОВМЕЩЁННОЙ С КОМПЬЮТЕРНОЙ ТОМОГРАФИЕЙ (ПЭТ/КТ) облегчает интерпретацию результатов радионуклидного метода за счёт «наложения» анатомической картины, получаемой при КТ. ПЭТ/КТ открывает новые возможности в уточняющей диагностике опухолей и за одну процедуру, кроме более чёткой локализации первичной опухоли, позволяет получать развёрнутую информацию о состоянии других органов и систем (для исключения метастазирования).
Использование комбинированных систем предусматривает коррекцию изображений ПЭТ по данным КТ, и, поскольку, длительность исследования составляет 30-40 минут, для того, чтобы избежать артефактов при реконструкции ПЭТ (мисрегистрации изображений вследствие движения пациента) и обеспечения качества полученных изображений, используются различные приспособления в виде специальных подголовников, фиксирующих подушек и матрацев.
При ПЭТ-исследованиях наиболее стандартный уровень сканирования всего тела — от основания черепа до середины бедра. При необходимости, ПЭТ и ПЭТ/КТ проводят с расширенной зоной сканирования с реальным захватом всего тела – от макушки до стоп.
При проведении ПЭТ-исследования пациенту внутривенно водится радиофармпрепарат (РФП), меченный «короткоживущим» радионуклидом, например, 18F-ФДГ (2-фтор-2-дезокси-D-глюкоза), который используется для оценки активности метаболизма глюкозы (рис. а).
Все радиофармпрепараты (РФП) изготавливаются нами индивидуально для каждого пациента в день исследования с соблюдением всех необходимых норм (по стандартам GMP). В случае любых незначительных отклонений от технологии производства проведение ПЭТ-исследования будет отложено, чтобы гарантировать вашу безопасность.
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ (КТ) основана на рентгеновском излучении, она позволяет определять анатомическое строение органов и тканей.
В ряде случаев (уточняйте у вашего врача) КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ (КТ) проводится с внутривенным КОНТРАСТИРОВАНИЕМ, которое выполняется посредством болюсного введения контрастного вещества со скоростью 2,5-4 мл/с при помощи автоматического шприца-инжектора. Как правило, используются йодсодержащие рентгеноконтрастные вещества (например, «Омнипак») в объёме от 50 до 100 мл3 – в зависимости от органа или части тела, которые требуется исследовать, а также различные методики КТ (многофазное контрастирование, ангиография, КТ-перфузия).
КТ С ВНУТРИВЕННЫМ КОНТРАСТИРОВАНИЕМ позволяет уточнить природу новообразования, определить границы опухоли, отношение её к окружающим органам и кровеносным сосудам, что имеет немаловажное значение для планировании лечения.
18 F—ФДГ с химической точки зрения является аналогом природной глюкозы и позволяет оценивать гликолитическую активность тканей. При внутривенном введении 18 F—ФДГ интенсивно накапливается в органах и тканях, в которых активно протекает процесс гликолиза (головной мозг, миокард, желудок и кишка, печень, мышцы).
Принцип применения 18 F- ФДГ в онкологии основывается на разнице дифференциальных скоростей метаболизма глюкозы в доброкачественных и злокачественных тканях. Известно, что интенсивность накопления 18 F- ФДГ может быть связана с размером опухоли и может значительно варьироваться при различных типах злокачественных опухолей. NB: накопление РФП также ускоряется при воспалительных процессах, таких как: гранулёмы, абсцессы, что может приводить к возникновению ложно-положительных результатов.
Многие злокачественные опухоли характеризуются повышенным метаболизмом глюкозы, и, следовательно, применение ПЭТ с 18 F—ФДГ у них имеет высокую диагностическую эффективность. Интенсивность накопления 18 F—ФДГ в различных злокачественных опухолях отображает степень их злокачественности и биологическую агрессивность.
В процессе противоопухолевого лечения, объём жизнеспособных злокачественных клеток значительно сокращается, и, следовательно, количественная оценка изменений накопления 18 F-ФДГ в опухолях позволяет использовать этот РФП в качестве чувствительного маркёра эффективности противоопухолевой терапии, что было реализовано в системе критериев оценки эффективности лечения PERCIST (Positron Emission tomography Response Criteria In Solid Tumors).
ПЭТ/КТ с 18 F-ФДГ используется для диагностики, оценки распространённости и динамического наблюдения опухолей молочной железы, колоректального рака, рака пищевода, рака лёгких, лимфом, опухолей головы и шеи, меланомы и ряда других онкологических заболеваний (уточните при записи на исследование). ПЭТ/КТ с 18 F-ФДГ – надёжный способ диагностировать эти опухоли и определить распространённость заболевания, выявлять рецидивы при наличии биомаркёрного рецидива (у бессимптомных пациентов при отсутствии патологических изменений по данным МРТ, КТ или УЗИ), дифференцировать рецидивы от фиброзов и некрозов, и, соответственно, при необходимости корректировать лечение в ходе наблюдения за пациентом.
ПОДГОТОВКА К ИССЛЕДОВАНИЮ:
Этот препарат применяется прежде всего для оценки распространённости, эффективности лечения и диагностики рецидивов РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ, а так же для диагностики ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА, ОПУХОЛЕЙ ПЕЧЕНИ (прежде всего ГЦР ).
Исследование проводится в два этапа (сразу после введения РФП и через 40 минут), строго натощак (при обследовании по поводу рака предстательной железы без водной нагрузки – с утра полностью исключить потребление жидкости).
За 48 часов до исследования необходимо исключить из рациона питания следующие продукты: яйца, субпродукты, бобы, овсяная крупа, шпинат, арахис, апельсиновый сок, капуста, любые витамины (прежде всего группы В).
Чтобы подготовится к исследованию, необходимо выполнить следующие условия:
В настоящее время наиболее прогрессивным и уже зарекомендовавшим себя методом является ПЭТ/КТ, в частности, с использованием 18 F-Холина. Благодаря особенностям метаболизма Холина в клетке рака предстательной железы возможно не только оценить распространённость процесса, но и отличить воспалительные изменения от опухолевых с применением методики двухэтапного исследования, как это показано на представленных снимках – на первом этапе происходит накопление в двух лимфоузлах, указанных красными стрелками. Проведение 2 этапа исследования через 40-50 минут показало, что накопление 18 F-Холина сохраняется только в одном из лимфоузлов (указан красной стрелкой), в то время как изменения в другом лимфоузле (указан зелёной стрелкой) имеют воспалительную природу.
Тактика лечения злокачественных опухолей печени зависит от их внутри- и внеорганной распространённости (метастазы). Хирургическое лечение не показано при множественных метастазах. Поэтому одной из основных задач диагностики является определение распространённости процесса. ПЭТ/КТ обладает высокой чувствительностью при обнаружении рецидивов опухолей после хирургического вмешательства. Так как частота рецидивов при раке печени высока (рецидив заболевания в первый год после операции составляет 20–64%, через 3 года — 57–81%), необходимо как можно раньше выявить изменения, чтобы своевременно начать лечение. Даже при наличии такого высокоточного метода диагностики, как МРТ, нередко возникает проблема дифференцировки объёмного образования в печени. Зачастую, вследствие его малых размеров (менее 1 см), невозможно однозначно высказаться о природе новообразования (доброкачественное или злокачественное). ПЭТ/КТ с 18 F-Холином и 18 F-ФДГ может дать ответ на поставленный вопрос, основываясь на механизмах включения указанных радиофармпрепаратов в опухолевые клетки.
ЦЕЛИ ИССЛЕДОВАНИЯ ПРИ ОПУХОЛЯХ ГОЛОВНОГО МОЗГА:
18 F-ФЭТ отражает уровень активности транспорта аминокислот в клетке и имеет высокую диагностическую точность в определении объёма опухолевого поражения и достоверной оценке границ образования при планировании как хирургического, так и лучевого лечения.
Показания к ПЭТ/КТ исследованию с 18 F-ФЭТ:
Исследование проводится строго натощак. Пить воду можно по желанию (несладкую, негазированную). Необходимо исключить продукты, богатые тирозином: орехи, бобовые, пряности, включая травы, за неделю до исследования.
Для прохождения ПЭТ/КТ исследования вам необходимо взять с собой все документы по заболеванию (выписки, консультации и т.п.), все диски МРТ.
Известно, что большинство опухолей женской репродуктивной системы и молочных желёз гормонозависимы, то есть имеют в структуре рецепторы стероидных гормонов (эстрогена и прогестерона).
18 F-фторэстрадиол ( 18 F-ФЭС) – радиофармпрепарат (РФП), который является аналогом эстрадиола и применяется при опухолях, экспрессирующих рецепторы эстрогенов (РЭ).
В настоящее время исследование ПЭТ/КТ с 18 F-ФЭС наиболее широко применяется у больных раком молочной железы (РМЖ), поскольку в половине случаев опухоль является гормонозависимой.
По ПЭТ гормонозависимая опухоль молочной железы визуализируется в виде «горячего» очага патологического включения 18 F-ФЭС (на фоне нормального физиологического накопления РФП в железистой ткани). Чем больше РЭ в опухолевой ткани (по результатам иммуногистохимического исследования после биопсии опухоли молочной железы – люминальный лип А и В и РЭ должны быть не менее 5 баллов), тем больше чувствительность ПЭТ/КТ с 18 F-ФЭС и выше прогностическая ценность положительного результата в оценке распространённости опухолевого процесса и мониторинга гормональной терапии.
В норме 18 F-ФЭС накапливается в печени, желчевыводящих путях, тонкой кишке и мочевом пузыре, что обусловлено физиологическим выведением 18 F-ФЭС через гепатобилиарную и мочевыделительную системы.
ПЭТ/КТ с 18 F-ФЭС позволяет определить разные биологические подтипы РМЖ, то есть распознавать гормонозависимые формы, что и отличает эти исследования от широко распространённой ПЭТ/КТ с 18 F-фтордезоксиглюкозой ( 18 F-ФДГ).
В оценке распространённости опухолевого процесса при гормонозависимом РМЖ чувствительность и специфичность ПЭТ/КТ с 18 F-ФЭС превосходит таковые при 18 F-ФДГ (другими словами позволяет выявить бόльшее количество опухолевых очагов), что может влиять на тактику лечения.
Применение ПЭТ/КТ с 18 F-ФЭС при раке молочной железы:
Ограничения при проведении ПЭТ/КТ с 18 F-ФЭС у пациентов с гормонозависимой формой РМЖ при гормональной терапии препаратами из группы ингибиторов РЭ (селективных модификаторов эстрогенных рецепторов, например, тамоксифен и фазлодекс). Необходима отмена препарата не менее чем за 30 дней, согласованная с лечащим врачом-онкологом. Гормонотерапия препаратами других групп (к примеру, ингибиторами ароматазы) не влияет на информативность исследования.
Подготовка к исследованию ПЭТ/КТ с 18 F-ФЭС:
Методика проведения исследования ПЭТ/КТ с 18 F-ФЭС (аналогична ПЭТ/КТ с 18 F-ФДГ). В среднем процедура занимает 1,5 часа.
После введения РФП в катетер, предварительно установленный в кубитальной вене (желательно с противоположной стороны от локализации опухоли), пациент проводит в комнате релаксации час, за это время РФП распределяется по организму. Затем проводится ПЭТ/КТ сканирование в течение примерно 20 минут.
Запись на исследование ПЭТ/КТ с 18 F-ФЭС проводится в регистратуре отделения ПЭТ НМИЦ онкологии им. Н.Н. Блохина по рекомендации лечащего врача.
Рак предстательной железы является одним из наиболее распространённых онкологических заболеваний у мужчин.
Простатспецифический мембранный антиген (ПСМА) – мембранный гликопротеин, содержащийся в нормальных эпителиальных клетках предстательной железы. Его уровень увеличивается при раке предстательной железы, особенно при низкой степени дифференцировки, метастатическом процессе или гормон-рефрактерных формах заболевания.
18 F-простатспецифический мембранный антиген-1007 ( 18 F-ПСМА-1007, 18F-PSMA-1007) – радиофармпрепарат (РФП), который является аналогом ПСМА и используется в диагностике опухолей предстательной железы.
В настоящее время ПЭТ/КТ-исследование с 18 F-ПСМА-1007 является перспективным радиофармпрепаратом в диагностике рецидивов рака предстательной железы, так как обладает наиболее высокой чувствительностью, в том числе при уровне ПСА 18 F-ПСМА-1007 накапливается в слёзных и слюнных железах, печени, селезёнке, тонкой кишке и почках.
В отличие от других ПСМА-таргетных трейсеров, 18 F-ПСМА-1007 характеризуется меньшим выведением по мочевыводящим путям, а потому лучшей визуализацией предстательной железы.
Методика проведения исследования ПЭТ/КТ с 18 F-ПСМА-1007 (аналогична ПЭТ/КТ с 18 F-ФДГ). В среднем процедура занимает 1,5-2 часа. После введения РФП в катетер, предварительно установленный в локтевой вене, пациент проводит в комнате релаксации 60-90 минут. За это время РФП распределяется по организму. Затем проводится ПЭТ/КТ сканирование в течение примерно 20-30 минут.
Запись на исследование ПЭТ/КТ с 18 F-ПСМА-1007 проводится в регистратуре отделения ПЭТ НМИЦ онкологии им. Н.Н. Блохина по рекомендации лечащего врача.
На базе НИИ КиЭР в рамках отделения позитронной эмиссионной томографии, лаборатории радиоизотопной диагностики, отделения лучевой топометрии и клинической дозиметрии сформировано направление ТЕРАНОСТИКИ, основанное на комбинированном применении методов радионуклидной диагностики и терапии.
В настоящий момент планируется внедрение препаратов на основе таких изотопов, как 89 Sr, 223 Ra, 177 Lu, применяемых преимущественно для лечения костных метастазов и диссеминированного рака предстательной железы.
Радионуклидная диагностика в онкологии
ГУ – Медицинский радиологический научный центр РАМН,
Обнинск, ул. Королева 4, 249036 г., Калужская область, Российская Федерация
Адрес для переписки: Герман Анатольевич Давыдов; e-mail:
Ключевые слова: онкология, диагностика, радионуклиды.
Ранняя диагностика злокачественных новообразований остается одной из наиболее актуальных задач современной медицины. Возможности методов ядерной медицины в онкологии основаны в первую очередь на выявлении метаболических нарушений в опухолях и окружающих тканях. Принцип функциональной визуализации опухолей отличает методы ядерной медицины от анатомо-топографических методов лучевой диагностики (ультразвуковой томографии, рентгеновской компьютерной томографии и магнитно-резонансной томографии), которые оценивают динамику новообразований по изменению их размеров и структуры. Особенности радионуклидных методов позволяют использовать их для выявления опухолевых поражений в ситуациях, когда структурные изменения не определяются или неспецифичны, а также для оценки раннего ответа опухоли на специфическую терапию, в целях прогнозирования результатов лечения.
Наряду с однофотонной эмиссионной компьютерной томографией (ОФЭКТ), основанной на использовании гамма-излучающих радионуклидов, все большую диагностическую роль в онкологии играет позитронная эмиссионная томография (ПЭТ). Использование в качестве метки биологически важных ультракороткоживущих позитрон-излучающих радионуклидов ( 11 C, 13 N, 15 O, 18 F), позволило создать радиофармпрепараты, обладающие уникальными свойствами (РФП). ПЭТ обеспечивает лучшие возможности для дифференциальной диагностики злокачественных и доброкачественных новообразований, определения распространенности опухолевого процесса, раннего выявления рецидивов и оценки эффективности проводимого лечения.
Основными задачами радионуклидной диагностики при исследовании онкологических больных являются следующие:
РФП для сцинтиграфической диагностики опухолевого процесса
Применяемые для диагностики опухолей РФП разделяют на следующие группы:
РФП, способные накапливаться в интактных тканях, окружающих опухоль
РФП этой группы отличаются тропностью к той или иной ткани организма, что позволяет выявить наличие опухоли как область пониженного накопления индикатора – «дефект накопления». К ним относятся: 99m Тс-коллоид, который аккумулируется в купферовских клетках печени. 99m Тс-пертехнетат и изотопы йода ( 123 I или 131 I), использующиеся для диагностики опухолей щитовидной железы. Недостатком методик с использованием этих препаратов является невысокая специфичность, так как любое объемное поражение (например, киста) визуализируется аналогичным образом.
РФП, способные накапливаться в тканях, подверженных неспецифическим изменениям со стороны опухоли
Использование РФП данной группы основано на свойстве их повышенного включения в участки ткани, окружающие новообразование. Так, окружающие костную опухоль ткани реагируют на ее рост повышенной остеобластической активностью. Фосфатные комплексы 99m Тс, накапливаясь в остеобластах этих участков, позволяют визуализировать костные метастазы и первичные опухоли костей на самой ранней стадии их развития как очаги гиперфиксации РФП. Метод остеосцинтиграфии обладает высокой чувствительностью, однако специфичность его невысока. Высокое накопление указанных РФП в костной ткани может наблюдаться также при травмах, воспалительных и дистрофических заболеваниях.
С целью паллиативной терапии метастазов в кости применяются меченный самарием-153 этилендиаминтетраэтиленфосфонат и меченный рением-186 этидронат, накапливающиеся в участках с повышенной остеобластической активностью.
РФП, тропные к мембранам опухолевых
клеток по реакции «антиген-антитело»
В основе диагностического применения РФП данной группы в онкологии лежит реакция связывания меченых моноклональных антител с антигенами мембран раковых клеток. В радионуклидной диагностике нашли применение как целые антитела типа IgG, так и их фрагменты (Fab-fragments of antibody). Для диагностики колоректального рака применяется препарат на основе целых антител – 111 In-Онкосцинт, а также фрагментов антител – 99m Tc-КЭА-Скан. Преимуществом фрагментов меченых антител является более высокая онкоспецифичность. Однако ускоренный клиренс фрагментов антител из крови за счет более быстрого, по сравнению с большими молекулами иммуноглобулинов, выведения почками может снижать соотношение «опухоль/фон» в злокачественных новообразованиях с обедненным кровотоком. Кроме того, технология получения Fab является достаточно трудоемкой и дорогостоящей.
РФП, тропные к мембранам опухолевых
клеток по механизму клеточной рецепции
Применение таких РФП для сцинтиграфической диагностики основано на их тропности к некоторым рецепторам мембран опухолевых клеток.
Из индикаторов такого типа наиболее часто используются аналоги соматостатина – окреотид, меченный 111 In, и 99m Тс-депреотид (NeoSpect). Соматостатин представляет собой тетрадекапептид, секретируемый гипоталамусом, который подавляет выделение нейроэндокринных гормонов (гормон роста, глюкагон, инсулин и гастрин). Во многих злокачественных опухолях и при некоторых воспалительных заболеваниях плотность рецепторов соматостатина значительно повышается. Гиперэкспрессия рецепторов соматостатина наблюдается в большинстве нейроэндокринных опухолей, включая мелкоклеточный рак легкого, а также в перитуморальных венах некоторых опухолей человека.
Меченые аналоги соматостатина нашли применение для диагностики ряда нейроэндокринных опухолей (карциноид, феохромацитома, параганглиома, меланома), мелкоклеточного рака легких, новообразований центральной нервной системы и лимфом. Чувствительность и специфичность сцинтиграфического выявления таких злокачественных новообразований с применением 111 In-окреотида превышает 80%. Вместе с тем, диагностика онкологических поражений печени и селезенки с этим РФП существенно затруднена по причине высокого уровня неспецифической аккумуляции данного индикатора в указанных органах. Депреотид, меченный 99m Тс, используется преимущественно для выявления рака легкого. При этом чувствительность диагностики злокачественных солитарных легочных новообразований в комбинации сцинтиграфии с КТ или рентгенографией грудной клетки достигает 97% при специфичности 73% [1].
В последние годы в онкологической практике нашли применение меченные 123 I пептиды, которые также способны связываться с мембранами опухолевых клеток. Среди них следует отметить 123 I-вазоактивные кишечные пептиды для визуализации злокачественных новообразований желудочно-кишечного тракта и поджелудочной железы; 123 I-ά-меланоцитостимулирующий гормон для диагностики меланом; 123 I-инсулин, накапливающийся в гепатомах, и 123 I-нейропептиды для выявления мелкоклеточного рака легкого.
Специфические РФП, проникающие в опухолевые клетки
Радиофармпрепараты указанной группы включаются в специфический метаболизм опухолей. К ним относятся изотопы йода 123 I и 131 I, 123 I-метайод-бензил-гуанидин ( 123 I-МИБГ) и пятивалентный 99m Тс (V)-ДМСА.
Йод-131 уже более 50 лет успешно используется для диагностики метастазов фолликулярного и папиллярного рака щитовидной железы, поскольку дифференцированные опухоли щитовидной железы сохраняют способность захватывать йод и включать его в синтез тиреоидных гормонов. Метастазы раковой опухоли обнаруживаются в виде участков экстратиреоидного эктопического накопления.
В последние годы для выполнения радиодиагностических процедур все чаще вместо 131 I используют 123 I, который имеет ряд преимуществ: оптимальный для регистрации спектр энергетического излучения (159 кэВ) и короткий период полураспада (13,2 часа), способствующий уменьшению лучевой нагрузки на пациента.
К специфическим опухолетропным препаратам относится также 123 I-МИБГ, который через норэпинефриновый механизм поглощения превращается в катехоламины адренергических нервных окончаний и клеток мозгового слоя надпочечников, позволяя тем самым визуализировать надпочечники. Наряду с этим была показана высокая эффективность использования указанного РФП для диагностики и терапии нейроэндокринных опухолей, особенно феохромоцитом, нейробластом, карциноида, медуллярного рака щитовидной железы и параганглиом. Для радиотерапевтических целей используется МИБГ, меченный 131 I.
К РФП этой группы также относят пятивалентный 99m Тс(V)-ДМСА, специфично накапливающимся в клетках медуллярного рака щитовидной железы. Однако механизм аккумуляции 99m Тс(V)-ДМСА в опухоли остается неизученным [1, 7].
Неспецифические РФП, проникающие в опухолевые клетки
Цитрат галлия-67 ( 67 Ga-цитрат) уже много лет успешно используется как туморотропный радиофармпрепарат. 67 Ga после внутривенного введения образует комплекс с трансферрином крови, который связывается с рецепторами некоторых опухолевых клеток. Посредством инвагинации целлюлярной мембраны 67 Gа-трансферрин попадает внутрь клетки и, образовав комплекс с лактоферрином, остается в ней [1, 7].
67 Ga-цитрат хорошо зарекомендовал себя в качестве РФП для радионуклидной диагностики лимфом и мелкоклеточного рака легких. В литературе описаны случаи применения этого РФП и для выявления других злокачественных образований. В то же время, неспецифическая аккумуляция 67 Ga-цитрата в печени и экскреция в желудочно-кишечный тракт ограничивают его использование для диагностики опухолей брюшной полости. Специфичность метода снижает также аккумуляция 67 Ga-цитрат в зонах инфекции и воспаления. Сцинтиграфия с этим РФП особенно эффективна для динамического наблюдения за больными с верифицированными злокачественными новообразованиями в динамике химио- или лучевой терапии.
Изотопы таллия ( 201 Тl и 199 Тl), являясь биологическим аналогом калия, поступают внутрь клетки с помощью натрий-калиевого АТФ-зависимого насоса и локализуются в митохондриях. Эти РФП аккумулируются преимущественно в тканях с интенсивным энергетическим обменом (к числу которых относятся атипичные клетки) и широко используются для диагностики самых разнообразных опухолей, включая новообразования бронхов, лимфомы, рак щитовидной железы, костей и головного мозга. Как и цитрат 67 Ga, изотопы таллия успешно применяют для динамической оценки противоопухолевой терапии.
В последнее время в ядерной онкологии стали активно использоваться комплексы технеция-99m с метокси-изобутил-изонитрилом ( 99m Тс-МИБИ) и тетрофосмином (миовью), благодаря способности этих РФП к усиленной аккумуляции в митохондриях злокачественных клеток. Наиболее активно эти индикаторы используют для выявления рака молочной железы, опухолей легких, лимфом и миеломной болезни [1, 7].
РФП для позитронно-эмиссионной томографии
Позитронно-излучающий РФП 18 F-фтордезоксиглюкоза ( 18 F-ФДГ) позволяет с высокой чувствительностью выявлять самые разнообразные злокачественные новообразования.
Аккумуляция этого индикатора в клетке прямо пропорциональна эффективности функционирования белкового переносчика глюкозы и коррелирует с активностью гексокиназы II – фермента, реализующего обмен гидроксильной группы глюкозы на фосфатный комплекс АТФ. Фосфорилированный метаболит 18 F-фтордезоксиглюкозы теряет способность к транспорту через мембрану клетки и остается интрацеллюлярно. Таким образом, ФДГ в отличие от обычной глюкозы, попадая внутрь клетки, участвует только в начальных этапах гликолиза, поэтому не распадается, за счет чего и происходит ее прогрессивное накопление в клетке (феномен «метаболической ловушки»). Высокое соотношение концентрации РФП «опухоль/фон» достигается, таким образом, за счет заметно более высокой активности гексокиназы II в малигнизированных клетках. Визуализация опухолей осуществляется за счет повышенной гликолитической активности клеток опухолевой ткани и повышенной активности глюкозных транспортеров на мембранах опухолевых клеток, осуществляющих захват глюкозы внутрь клетки. При этом биологическая активность опухоли прямо пропорциональна степени метаболического захвата глюкозы 3.
Применение другого неспецифического позитронно-излучающего РФП 11 С-метионина для диагностики опухолей базируется на высоком уровне аминокислотного обмена в активно пролиферирующих клетках злокачественных опухолей. Этот индикатор используется при выявлении лимфом, злокачественных новообразований шеи и головы.
Для диагностики новообразований методом ПЭТ применяется ряд туморотропных РФП, визуализирующих злокачественные опухоли как очаги нарушения метаболизма. Для изучения нарушений углеводного обмена (клеточная энергетика) применяется 18F-фтордеоксиглюкоза (18F-ФДГ); клеточного транспорта аминокислот – 11С-метионин; процессов клеточного синтеза белков – 11С-тирозин, 11С-лейцин; скорости клеточной пролиферации – 11С-тимидин (как маркер синтеза ДНК) и 11С-холин (участвующий в биосинтезе клеточной мембраны); синтеза липидов – (11С-ацетат); степени гипоксии опухолевой ткани – 18F-фтормизонидазол [4].
Индикаторы гипоксии являются перспективными РФП для сцинтиграфической диагностики злокачественных новообразований. Визуализация малигнизированных тканей в этом случае становится возможной потому, что в центральных областях опухоли имеют место обеднение кровотока и сопутствующая гипоксия. Нитроимидазол путем диффузии проникает внутрь клетки за счет липофильности своей молекулы, образуя в условиях гипоксии ряд недоокисленных продуктов своего превращения. Эти метаболиты связываются с компонентами клетки и, в отличие от нормы, фиксируются интрацеллюлярно [2, 8].
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ПЭТ В ОНКОЛОГИИ
ПЭТ в настоящее время нашла широкое применение во многих областях медицины. Первый опыт использования этого метода был посвящен функциональным исследованиям головного мозга. В дальнейшем ПЭТ стала успешно использоваться для диагностики различных форм деменции, очаговых форм эпилепсии.
В кардиологии ПЭТ-исследования сердца дают уникальную информацию о жизнеспособности миокарда, таким образом определяя целесообразность кардиохирургических вмешательств. Однако самым востребованным метод ПЭТ оказался в онкологии. Этому способствовало появление и начало серийного изготовления установок для ПЭТ «всего тела», а также разработка большого ассортимента позитронно-излучающих туморотропных РФП. Ценнейшая информация, получаемая при исследованиях больных злокачественными новообразованиями, сделала ПЭТ одним из ведущих диагностических методов. Это обстоятельство привело к резкому возрастанию относительной доли онкологических ПЭТ-исследований, которая в настоящее время составляет около 90%.
Самой распространенной и наиболее освоенной методикой является ПЭТ с 18F-фтордеоксиглюкозой (18F-ФДГ). Количество этих исследований приобрело такой размах, что, по мнению ведущих специалистов ядерной медицины, 18F-ФДГ завоевала в 1990-х гг. номинацию «молекулы века» [4, 6].
Применение ПЭТ в диагностике рака легких
ПЭТ c ФДГ высоко эффективна в дифференциальной диагностике первичных опухолей у больных с солитарными легочными узлами: прогностическая ценность положительного результата – 90%, отрицательного результата – до 100%.
Ложноотрицательный результат может наблюдаться при поражениях менее 1 см, опухолях с низкой метаболической активностью (например, карциноидных), бронхоальвеолярном раке. Повышенное включение ФДГ возможно при различных воспалительных заболеваниях. В сомнительных случаях поражения с повышенным захватом ФДГ должны считаться злокачественными, пока не будет доказано обратное.
Оценка региональных лимфоузлов средостения у потенциально операбельных больных немелкоклеточным раком легкого превышает результаты КТ и составляет: чувствительность 89%, специфичность 92% и точность 90%. Лучшие результаты ПЭТ объясняются тем, что размеры лимфоузлов являются относительным критерием метастатического поражения. Лимфоузлы могут быть увеличены вследствие воспаления или инфекции, а мелкие узлы могут содержать метастазы.
При выявлении внутригрудных метастазов ПЭТ несколько точнее КТ. По сравнению со стандартной остеосцинтиграфией с 99m Tc-метилендифосфонатом, ПЭТ имеет большую специфичность (98% против 61%) при аналогичной чувствительности (до 90%) при визуализации метастазов в кости. Интерпретация сцинтиграфии костей с МДФ затруднена из-за ложноположительных результатов при воспалительных и дистрофических изменениях костей и суставов.
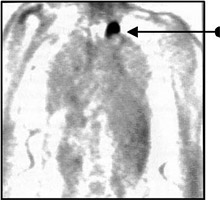
Отмечается высокая эффективность ФДГ-ПЭТ в выявлении рецидивов немелкоклеточного рака легкого. При подозрении КТ на рецидив ПЭТ способна дифференцировать посттерапевтические рубцы и опухоли с чувствительностью 97-100%, специфичностью 62-100% и точностью 78-98% (Рис.1). Чтобы избежать ложноположительных результатов ПЭТ вследствие лучевого пневмонита или гликолиза макрофагов внутри опухолевого некроза, исследование рекомендуется проводить через 4-6 месяцев по окончании лечения.
Показаниями к проведению ПЭТ с ФДГ у больных немелкоклеточным раком легкого являются: дифференциальная диагностика первичной опухоли, определение распространенности опухолевого процесса, выявление рецидивов.
Рис. 1. Результат ПЭТ-исследования. Выявление рецидивной опухоли верхушки левого легкого.
Применение ПЭТ в диагностике рака толстой кишки
Основными задачами ПЭТ с ФДГ при исследовании больных раком толстой кишки являются:
Метод ПЭТ недостаточно эффективен при диагностике регионарных лимфоузлов. Причина низкой чувствительности объясняется расположением большинства лимфоузлов вблизи первичной опухоли или наличием в них микрометастазов. Однако отсутствие вовлечения лимфоузлов не вызывает изменения в лечении, поскольку удаление брыжейки без первичного поражения является частью лечебной процедуры. ПЭТ является наиболее чувствительным (90-95%) методом выявления метастазов в печень колоректального рака, в чем превосходит КТ, при специфичности 88-100%. Исключение отдаленных метастазов до операции и повторных резекциях является важным показанием ФДГ-ПЭТ у больных колоректальным раком.
Показаниями к ПЭТ у больных с выявленным или подозреваемым рецидивом являются: увеличение опухолевых маркеров, аномальное поражение при стандартной визуализации (КТ и МРТ), дифференциальная диагностика местных рецидивов и посттерапевтических (хирургических, лучевых и химиотерапевтических) изменений. ПЭТ позволяет дифференцировать рецидив опухоли от захвата ФДГ вследствие лучевой терапии (спустя 6 месяцев после лечения). По данным ПЭТ выявляется больше поражений, чем при КТ, что приводит к серьезным изменениям в лечении у 48% больных.
Примером успешной дифференциальной диагностики между рецидивом опухоли и послеоперационной рубцовой тканью является выявление, по данным ПЭТ, рецидива рака прямой кишки после брюшно-промежностной экстирпации прямой кишки, когда эндоскопия оказалась невозможной, а УЗИ и КТ не позволяли дифференцировать рецидив и послеоперационные рубцовые изменения (Рис.2).
Рис. 2. ПЭТ с 18F-ФДГ. Визуализация рецидива рака прямой кишки (а) на фоне физиологического накопления
радиофармпрепарата в головном мозге и почках.
Применение ПЭТ в диагностике гемобластозов
При исследовании больных злокачественными лимфомами перед ФДГ-ПЭТ ставятся задачи по определению стадии опухолевого процесса, оценке эффективности лечения, выявлению рецидивов заболевания. Диагностическое обследование больных злокачественными лимфомами является одним из наиболее значимых показаний для проведения ПЭТ с ФДГ.
При стадировании злокачественной лимфомы ФДГ-ПЭТ имеет одинаковую специфичность с РКТ (90%), однако превосходит ее в чувствительности (92% и 65% соответственно). Точность оценки состояния селезенки при первичном стадировании злокачественной лимфомы для ФДГ-ПЭТ составляет около 100% (для КТ –57%), а точность диагностики поражения костного мозга посредством ФДГ-ПЭТ сопоставима с таковой при биопсии костного мозга.
ПЭТ с ФДГ успешно применяется для оценки эффективности проводимого лечения. Контроль ответа на химиотерапию обычно проводится через 3-4 цикла лечения. По данным некоторых исследователей, прогностическая информация может быть получена уже после первого цикла химиотерапии (Рис.3).
Рис. 3. ПЭТ-исследование при злокачественной лимфоме:
а) до лечения (поражение правых шейно-надключичных и медиастинальных лимфоузлов);
б) после эффективного лечения (отсутствие активных очагов специфической ткани).
Применение ПЭТ в диагностике метастазов меланомы
Меланома относится к опухолям с наиболее выраженным гликолизом, высоким захватом ФДГ и соотношением «опухоль-кровь». Основными задачами ПЭТ с ФДГ при обследовании больных меланомой являются: диагностика местной и региональной распространенности опухолевого процесса у больных меланомой высокого риска (толщина первичной опухоли больше 4,0 мм с прорастанием в подкожные ткани), выявление отдаленных метастазов и рецидивов опухоли.
В диагностике первичной опухоли и пораженных регионарных лимфоузлов в стадиях 1-2 метод ПЭТ с ФДГ обладает низкой чувствительностью, большая по величине опухоль выявляется отчетливо. В стадии 3 визуализируются практически все метастазы в регионарные лимфоузлы размерами более 10 мм, 83% метастазов размерами 6-10 мм и 13% метастазов меньших размеров.
В диагностике метастазов во внутренние органы общая чувствительность ПЭТ с ФДГ составляет 80-100%. Наиболее полезна ПЭТ у больных с наличием метастазов в брюшной полости (чувствительность – до 100%). По сравнению со стандартной КТ, ПЭТ более чувствительна и специфична в визуализации метастазов в кости, тонкую кишку и лимфоузлы, в то время как метастазы в легкие выявляются хуже. В диагностике метастазов в печень ПЭТ более чувствительна, чем УЗИ, КТ и МРТ.
Применение ПЭТ в диагностике
распространенности рака пищевода и желудка
Основными задачами исследования ПЭТ с ФДГ у больных раком пищевода и желудка являются: стадирование лимфоузлов и выявление отдаленных метастазов у больных с резектабельной опухолью.
Первичные опухоли пищевода и желудка, ограниченные слизистой оболочкой, с помощью ФДГ-ПЭТ визуализируются плохо. Их выявление становится возможным только при инвазии опухоли в подслизистый слой. Специфичность ПЭТ в стадировании лимфоузлов выше, чем у других методов лучевой диагностики (КТ, эндоскопической сонографии). В оценке отдаленных метастазов (в лимфоузлах, печени, плевре, грудной клетке и костях) ПЭТ с ФДГ имеет большую точность по сравнению со стандартным использованием СКТ и УЗИ. ПЭТ обладает высокой диагностической эффективностью в выявлении рецидивов рака пищевода, однако в диагностике перианастомотических рецидивов часто дает ложноположительные результаты из-за накопления ФДГ в участках воспаления. Отмечается высокая эффективность ПЭТ с ФДГ в оценке ответа на лучевую и химиотерапию опухолей пищевода и желудка.
Применение ПЭТ в диагностике
распространенности опухолей головы и шеи
Эффективность лечения больных раком органов головы и шеи в существенной мере зависит от точности оценки местной и регионарной распространенности опухолевого процесса.
Первичные опухоли, региональные и отдаленные метастазы характеризуются интенсивным захватом ФДГ. Метастазы в лимфоузлы характеризуются высоким захватом ФДГ и хорошо контрастируются. Установлено, что в выявлении метастатического поражения шейных лимфатических узлов у больных раком органов головы и шеи чувствительность и специфичность ПЭТ с ФДГ составили 90 и 94%, в то время как аналогичные показатели для КТ были 82 и 85%, МРТ – 80 и 79%.
ПЭТ с ФДГ также является эффективным и объективным инструментом оценки эффективности химиотерапии и лучевого лечения злокачественных опухолей головы и шеи. Метод позволяет дифференцировать жизнеспособную опухолевую ткань от фиброзно-склеротического процесса после лучевой терапии (Рис.4).
Рис. 4. ФДГ-ПЭТ и МРТ при плоскоклеточном раке слизистой левой щеки: А, B – до лечения; С, Д – после химиорадиотерапии.
При ФДГ-ПЭТ констатирован полный эффект в виде исчезновения гиперметаболического очага (истинно отрицательный результат), хотя на МРТ визуализируется остаточный субстрат (ложноположительный результат).
ФДГ позволяет эффективно выявить пораженные ЛУ средостения, а также отдаленные метастазы в легкие, печень, кости. Отсутствие захвата ФДГ обычно исключает остаточную или рецидивную опухоль.
При обследовании больных дифференцированным раком щитовидной железы наиболее важной задачей ФДГ-ПЭТ является выявление рецидивов у больных с повышенным уровнем опухолевого маркера (тиреоглобулина) на фоне отрицательного скана «всего тела» с 131 I. По мнению большинства исследователей, ФДГ-ПЭТ является эффективным методом выявления йод-негативного метастатического поражения шейно-надключичных, медиастинальных лимфоузлов и легких.
Применение ПЭТ в диагностике
распространенности рака молочной железы
Основной задачей ФДГ-ПЭТ при исследовании больных раком молочной железы является прогностическая оценка биологической активности первичной опухоли, диагностика регионарных и отдаленных метастазов, оценка эффективности проводимого противоопухолевого лечения и выявление местных рецидивов заболевания. Некоторые исследователи при наблюдении за группой больных местно-распространенным раком молочной железы отметили, что при высокой метаболической активности первичной опухоли, определяемой ФДГ-ПЭТ, можно прогнозировать низкую эффективность неоадъювантной химиотерапии. Что касается предоперационного стадирования рака молочной железы, то, по данным ряда зарубежных авторов, чувствительность ФДГ-ПЭТ при диагностике мультифокального поражения оказалась вдвое выше, чем при комбинированном применении маммографии и ультразвукового метода (63 и 32% соответственно). Чувствительность и специфичность ФДГ-ПЭТ при диагностике метастатического поражения аксиллярных лимфатических узлов составили 79 и 92% соответственно.
Влияние результатов ФДГ-ПЭТ на установление стадии заболевания и выбор тактики лечения рака молочной железы проанализировано в ряде зарубежных работ. Авторы указывают, что с учетом находок ФДГ-ПЭТ клиническая стадия была изменена в 36% наблюдений (28% – в сторону увеличения, 8% – в сторону уменьшения), вид лечения был скорректирован у 28%, а объем лечения – у 30% больных. Диагностическая чувствительность и специфичность ФДГ-ПЭТ при обследовании пациентов с подозрением на рецидив рака молочной железы, имеющих асимптоматическое повышение уровня опухолевых маркеров, составляют 96 и 90% соответственно [2, 4, 5].
Позитронные томографы обладают сравнительно невысоким пространственным разрешением, что затрудняет визуальный анализ ПЭТ-изображений. В связи с этим ПЭТ-сканеры производятся в конфигурации со сканерами рентгеновской компьютерной томографии (КТ), совмещенными в одной установке. Совмещение метаболических (ПЭТ) и анатомо-топографических (КТ) данных позволяет повысить точность локализации опухоли и определения распространенности заболевания. Совмещенная ПЭТ/КТ-технология позволяет получать более информативные изображения по сравнению с изображениями, получаемыми КТ- и ПЭТ-методами (Рис.5).
Рис. 5. КТ-изображение (А) и ПЭТ-изображение (В) плоскоклеточного рака левого легкого с метастазами в лимфоузлы средостения. Совмещенное КТ-ПЭТ-изображение (С) позволяет констатировать в рентгенологически выявленном очаге в легком наличие активной опухолевой ткани по периферии образования и очаг некроза в центре опухоли (помечено стрелкой).
Проблемы применения ПЭТ c ФДГ в онкологии
Клиническое применение ПЭТ с ФДГ выявило ряд ограничений, обусловленных, в частности, неспособностью эффективно выявлять опухоли малых размеров (до 10 мм), визуализировать некоторые опухоли мозга и опухоли мочеполовой системы, а также неспособностью дифференцировать злокачественные заболевания от воспалительных изменений. Поэтому задача разработки новых альтернативных ФДГ радиофармпрепаратов с более высокой туморотропностью и специфичностью является актуальной.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.