Метиленхлорид для чего используется
Метиленхлорид
Метиленхлорид
| Дихлорметан | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | дихлорметан |
| Сокращения | ДХМ |
| Традиционные названия | дихлорметан, метилен хлористый |
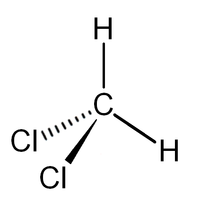
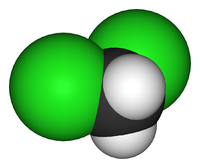
| Химическая формула | CH2Cl2 |
| Эмпирическая формула | CH2Cl2 |
| Молярная масса | 84.9 г/моль |
| Физические свойства | |
| Плотность вещества | 1.3266 г/см³ |
| Примеси | хлорметаны |
| Состояние (ст. усл.) | подвижная прозрачная жидкость |
| Термические свойства | |
| Температура плавления | -96.7 °C |
| Температура кипения | 40 °C |
| Температура вспышки | 14 °C |
| Критическая точка | 245 |
| Энтальпия (ст. усл.) | -87.86 кДж/моль |
| Удельная теплота парообразования | 336,4 Дж/кг |
| Давление пара | 470 |
| Химические свойства | |
| Растворимость в воде | 20 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,4242 |
| Классификация | |
| номер CAS | 75-09-2 |
| RTECS | PA8050000 |
Дихлорметан (хлористый метилен, ДХМ, CH2Cl2) — прозрачная лекгоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Содержание
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °С при соотношении равном 5:1
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцей. После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворитель для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Вытяжная вентиляция необходима. В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлрометаном может вызвать накопление его в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия. На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В тоже время не было отмечено какого либо влияния на развития эмбрионов у женщин имевших контакт с ДХМ.
Общая безопасность и методы устранения аварий [3]
Дихлорметан
| Дихлорметан | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | дихлорметан |
| Сокращения | ДХМ |
| Традиционные названия | дихлорметан, метилен хлористый |
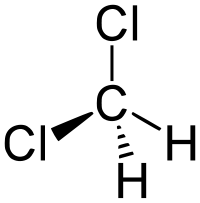
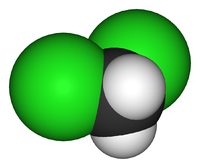
| Химическая формула | CH2Cl2 |
| Эмпирическая формула | CH2Cl2 |
| Физические свойства | |
| Состояние (ст. усл.) | подвижная прозрачная жидкость |
| Примеси | хлорметаны |
| Молярная масса | 84.9 г/моль |
| Плотность | 1.3266 г/см³ |
| Термические свойства | |
| Температура плавления | -96.7 °C |
| Температура кипения | 40 °C |
| Температура вспышки | 14 °C |
| Критическая точка | 245 |
| Энтальпия образования (ст. усл.) | -87.86 кДж/моль |
| Удельная теплота испарения | 336,4 Дж/кг |
| Давление пара | 470 |
| Химические свойства | |
| Растворимость в воде | при 20 °C 1.3 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,4242 |
| Классификация | |
| Рег. номер CAS | 75-09-2 |
| SMILES | C(Cl)Cl |
| RTECS | PA8050000 |
Дихлормета́н (хлористый метилен, ДХМ, CH2Cl2) — прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Содержание
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцией. После чего он имеет чистоту не менее 99,7 % В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Растворимость в воде 2% по массе (13 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину,муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlСl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан. [1]
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Работы следует проводить при работающей вытяжной вентиляции.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессонального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
Контакт дихлорметана с щелочными металлами приводит к взрыву.
ПДК в рабочей зоне 50мг/м³, в воде водоёмов не более 7.5 мг/л. КПВ 12-22 %
Метилен хлористый технический
Синонимы названия:дихлорметан, метиленхлорид, хладон 30, фреон 30
Product name:dichloromethane, methylene chloride
ТУ2412-426-05763441-2004, изм. 1 CAS:75-09-2
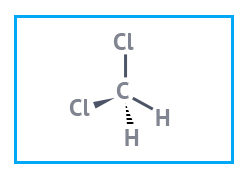
Химическая формула CH2Cl2
Структурная формула
Спецификация:
Применение:
Метилен хлористый технический используется в следующий отраслях и технологиях:
В производстве фото и кинопленок.
Используют как средство для снятия красок. Применяется для снятия старых лакокрасочных покрытий на различных основах (алкидных, пентафталевых, глифталевых, перхлорвиниловых, виниловых, акриловых, эпоксидных, меламиноформальдегидных и других смол как холодного, так и горячего отверждения) с различных поверхностей (металла, бетона, керамики).
Входит в состав смывок СП-6(70,5%), СПС-1(69,3%). Также могут использоваться спирты, ацетон, бензол, метилэтилкетон, щелок (гидроксид натрия).
Используется при производстве низкоплотностного поролона. Также используется как растворитель полиуретановой пены.
Метиленхлорид разрушает озоновый слой. На Западе технология не используется В России постепенно переходят к более передовым технологиям производства поролона без использования метиленхлорида.
Используется при производстве химического волокна как растворитель (смесь этилового спирта и хлористого метилена). По испарении растворителя образуются нити шелка.
Используется в фармацевтической промышленности. Используется для синтеза аскорбиновой кислоты.
Используется как органический растворитель для очистки поверхности, например для обезжиривания металлов. Также могут использоваться трихлорэтилен, перхлорэтилен.
Очищают до химически чистого. Химически чистый потребляется предприятиями медицинской промышленности.
Входит в состав аэрозольных красок для авторемонта.
Используется при склеивании оргстекла как растворитель. Также может использоваться дихлорэтан.
Упаковка: стальные бочки 208 л. Хранение: в неотапливаемых складских помещениях или под навесом. Класс опасности: 4 класс.
Хлористый метилен
Хлористый метилен
| Дихлорметан | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | дихлорметан |
| Сокращения | ДХМ |
| Традиционные названия | дихлорметан, метилен хлористый |
| Химическая формула | CH2Cl2 |
| Эмпирическая формула | CH2Cl2 |
| Молярная масса | 84.9 г/моль |
| Физические свойства | |
| Плотность вещества | 1.3266 г/см³ |
| Примеси | хлорметаны |
| Состояние (ст. усл.) | подвижная прозрачная жидкость |
| Термические свойства | |
| Температура плавления | -96.7 °C |
| Температура кипения | 40 °C |
| Температура вспышки | 14 °C |
| Критическая точка | 245 |
| Энтальпия (ст. усл.) | -87.86 кДж/моль |
| Удельная теплота парообразования | 336,4 Дж/кг |
| Давление пара | 470 |
| Химические свойства | |
| Растворимость в воде | 20 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,4242 |
| Классификация | |
| номер CAS | 75-09-2 |
| RTECS | PA8050000 |
Дихлорметан (хлористый метилен, ДХМ, CH2Cl2) — прозрачная лекгоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Содержание
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °С при соотношении равном 5:1
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцей. После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворитель для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Вытяжная вентиляция необходима. В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлрометаном может вызвать накопление его в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия. На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В тоже время не было отмечено какого либо влияния на развития эмбрионов у женщин имевших контакт с ДХМ.
Общая безопасность и методы устранения аварий [3]
Примечания
Полезное
Смотреть что такое «Хлористый метилен» в других словарях:
Хлористый метилен — (хим.), дихлорметан СН2Cl2, получен впервые Реньо при действии хлора на X. метил: СН3Cl + Cl2 = CH2Cl2 + HCl; впоследствии он получен Бутлеровым при пропускании струи хлора в йодистый метилен: СН2J2 + Cl2 = CH2Cl2 + J2 и Перкиным при действии… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
хлористый метилен — дихлорметан … Cловарь химических синонимов I
дихлорметан — хлористый метилен … Cловарь химических синонимов I
Болотный газ или метан — (также водородистый метил, формен) предельный углеводород состава СН4, первый член ряда СnН2n+n, одно из простейших соединений углерода, вокруг которого группируются все остальные и от которого могут быть произведены через замещение атомов… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химическое строение — Настоящая статья имеет задачей изложение истории возникновения теории X. строения органических соединений и ее связи с предыдущими теориями. В значительной мере это уже выяснено в статьях Замещение, Унитарная система, Химических типов теория и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Галоидопроизводные — Этим именем в органической химии обозначаются вообще продукты, происходящие из различных органических веществ (углеводородов, спиртов, кислот, альдегидов, кетонов, аминов и пр.) через замещение в них атомов водорода углеводородных групп галоидами … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Термохимия — отдел химии, занимающийся превращениями внутренней энергии тел в тепло при химических процессах. Почти каждая химическая реакция связана с тем или иным тепловым эффектом: химическое превращение сопровождается или выделением, или поглощением тепла … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Отравления — I Отравления (острые) Отравления заболевания, развивающиеся вследствие экзогенного воздействия на организм человека или животного химических соединений в количествах, вызывающих нарушения физиологических функций и создающих опасность для жизни. В … Медицинская энциклопедия
Дихлорметан — Дихлорметан … Википедия
Метиленхлорид — популярный промышленный растворитель
Метиленхлорид — органическое соединение, 
Впервые был синтезирован в 1840-м году: в лаборатории соединили газообразный хлор с хлористым метилом и выдерживали смесь на свету. Для массового производства дихлорметан получают химическим синтезом из метана, выделенного из коксовых газов, и газообразного хлора. Другой метод: получение хлорметила из метанола и соляной кислоты, с последующим хлорированием.
Свойства
Подвижная прозрачная жидкость без цвета, летучая, с характерным резким, сладковатым запахом эфира. В воде растворяется слабо, хорошо — в орг. растворителях. При растворении в горячей воде разрушается, разлагаясь на соляную кислоту и формальдегид. Малотоксичен по сравнению с другими растворителями.
Вступает в реакцию с хлором, с получением хлороформа. Реагирует и с другими галогенами: йодом, бромом. Взаимодействует со спиртовым и водным растворами аммиака. В результате реакции с водным аммиаком получается муравьиная и соляная кислоты и метиламин. Вступает в реакции с ароматическими углеводородами, например, с бензолом.
Очень бурно реагирует (вплоть до взрыва) со щелочными металлами.
 |  |
| Вытяжной шкаф ВА-102, комплектация «Стандарт» | Метиленхлорид (дихлорметан) «хч» 1000 мл |
Реактив токсичен, плохо горит, но горение поддерживает; смеси с воздухом взрывоопасны. Обладает канцерогенным действием.
Проглатывание реактива и длительное вдыхание паров или аэрозолей приводит к раздражению слизистых глаз и органов дыхания, отравлению, головокружению и головным болям, обморокам, диарее, заболеваниям печени и поджелудочной железы. Тяжелое отравление может привести к остановке дыхания. Длительное воздействие вещества на кожу может вызвать химический ожог.
При работе с метиленхлоридом следует использовать средства защиты: очки, резиновые перчатки (не нитриловые и не латексные), одежду с длинными рукавами, респиратор. В лабораториях все эксперименты проводят в вытяжном шкафу.
Хранят реактив обычно в стальных контейнерах или бочках. Допускается хранение вне помещения, под навесом. Предпочтительнее в прохладных, вентилируемых, сухих складах.
Перевозить ДХМ можно любыми видами транспорта, контейнеры и транспорт маркируются символом опасности Xn (вредное вещество).
Применение
Реагент гораздо менее токсичен, чем другие органические растворители, легко удаляется, отличается невысокой стоимостью, поэтому широко используется во многих сферах промышленности, включая пищепром и фармацевтику.

