Микроцитоз что это такое
Микроцитоз что это такое
Морфологическое исследование эритроцитов, лейкоцитов, тромбоцитов и подсчет лейкоцитарной формулы производят в окрашенных мазках крови.
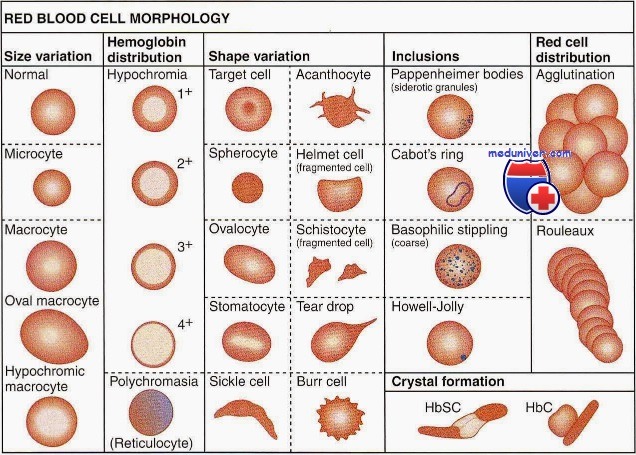
Качественная оценка эритроцитов имеет большое диагностическое и прогностическое значение. Обязательным является определение размеров и формы эритроцитов, их окраски, наличия и степени анизоцитоза и пойкилоцитоза, наличия патологических форм эритроцитов и включений в них.
При отсутствии автоматического анализатора для определения размеров эритроцитов измеряют их средний диаметр с построением эритроци-тометрической кривой Прайс-Джонса (гистограмма распределения эритроцитов по размеру). Диаметр нормальных эритроцитов в мазке равен 7-8 мкм, средний диаметр — 7,55 мкм.
Эритроциты размером более 8 мкм называются макроцитами (большие эритроциты с сохраненным просветлением в центре), более 12 мкм — мегалоциты или гигантоциты (гигантские эритроциты без просветления в центре). Эритроциты диаметром менее 6,5 мкм называются микроцитами, менее 2-3 мкм — шизоцитами. В норме в периферической крови выявляется 15,5% микроцитов и 16,5% макроцитов.
При использовании автоматического анализатора клеток крови проводится определение среднего объема эритроцитов (MCV), в зависимости от которого различают микроциты (MCV менее 75 мкм3), нормоциты (MCV в пределах 75-95 мкм3) и макроциты (MCV более 95 мкм3). На основании среднего объема эритроцитов строится эритроцитометрическая кривая.
Клиническое значение морфологического исследования клеток крови
При микроцитозе 30-50% от общего числа эритроцитов составляют микроциты. Микроцитоз наблюдается при ряде наследственных анемий (талассемии, гемоглобинопатии, микросфероцитоз, серповидноклеточная анемия, атрансферринемия, врожденная форма сидеробластной анемии).
Сдвиг эритроцитометрической кривой влево (увеличение количества эритроцитов малого диаметра) наблюдается при многих приобретенных анемиях (железодефицитные анемии, анемия хронических заболеваний, анемии при отравлении свинцом и др.).
При макроцитозе 50% и более от общего числа эритроцитов составляют макроциты. Макроцитоз чаще всего наблюдается при В12- и фолиеводефицитной анемиях.
Увеличение количества эритроцитов разного размера в мазке крови называется анизоцитозом. Это ранний признак анемии, наблюдающийся при ее легкой степени. Выделяют три степени анизоцитоза, которые обозначаются цифрами 1, 2 и 3.
Степень анизоцитоза эритроцитов (RDW — the Red cell Destribution Width) в современных гематологических анализаторах определяется автоматически. У здоровых людей большая часть эритроцитов (68%) представлена нормоцитами; микроциты составляют около 15%, макроциты — 17%. В норме RDW колеблется от 9,9 до 14,5%. При увеличении количества эритроцитов разного размера RDW нарастает.
В мазке крови большинство эритроцитов имеет округлую форму и только малая часть (до 10%) отличается по своей форме. Увеличение количества эритроцитов разной формы называется пойкилоцитозом. При этом эритроциты могут становиться овальными, грушевидными, звездчатыми, зазубренными и др.
Пойкилоцитоз является результатом продукции патологических клеток костным мозгом либо развивается вследствие повреждения нормальных клеток после выхода их из костного мозга в кровяное русло. Присутствие некоторых специфических форм эритроцитов (микросфероцитоз, эллиптоцитоз, стоматоцитоз) в большем количестве по сравнению с нормой имеет важное диагностическое значение.
Выделяют три степени пойкилоцитоза, которые также обозначаются цифрами 1, 2 и 3. Как и анизоцитоз, пойкилоцитоз является неспецифическим признаком любой анемии и отражает ее степень. Однако, в отличие от анизоцитоза, пойкилоцитоз появляется только при выраженной анемии и имеет более неблагоприятное прогностическое значение.
Эритроциты здоровых людей являются нормохромными, т. е. имеют равномерную окраску и небольшое (не более 1/3 диаметра клетки) просветление в центре. Гипохромия — увеличение центральной неокрашенной части эритроцита больше нормы. В зависимости от размеров просветления выделяют три степени гипохромии (1, 2, 3).
Усиленная окраска эритроцитов называется гиперхромией. Гиперхромия обусловлена увеличением объема эритроцитов и обычно сочетается с макроцитозом и мегалоцитозом. Более интенсивно окрашиваются микросфероциты.
В норме эритроциты окрашиваются кислыми красками, но молодые эритроциты с остатками ядерной субстанции (ретикулоциты) могут окрашиваться основными, приобретая различные оттенки серовато-сиреневого, серовато-фиолетового или серовато-голубого цвета. Эти клетки называются полихроматофилами. Полихроматофилия (полихромазия) — показатель усиленной регенерации костного мозга (наблюдается при гемолитических и постгеморрагических анемиях). В зависимости от числа полихроматофилов в поле зрения различают три степени полихромазии (1, 2, 3).
При различных состояниях в мазке крови могут обнаруживаться патологические формы эритроцитов (ядросодержащие — нормоциты), а также внутриэритроцитарные включения ядерного и цитоплазматического происхождения. Ядросодержащие эритроциты (синонимы: эритрокариоциты, нормоциты) в значительном количестве встречаются при гемолитических анемиях (прежде всего — гемолитическом кризе) и остром эритромиелозе (М6 по FAB-классификации).
Умеренный нормоцитоз наблюдается при постгеморрагических анемиях, сублейкемическом миелозе и метастазах злокачественных опухолей в костном мозге. Единичные нормоциты могут встречаться при В12-дефицитной анемии, миелодиспластических синдромах, хроническом миелолейкозе.
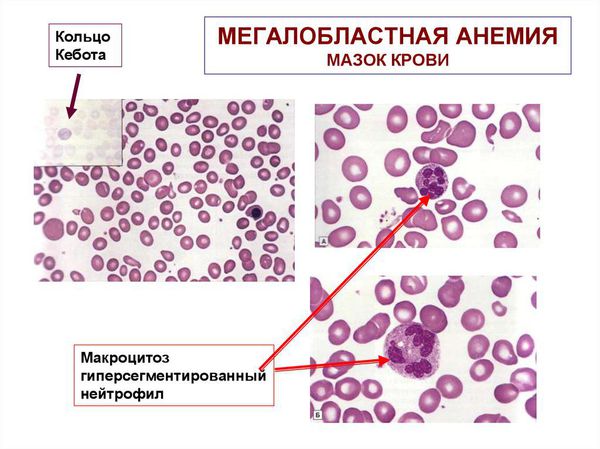
Среди внутриэритроцитарных включений ядерного происхождения различают тельца Жолли (круглые включения сине-фиолетового или вишнево-красного цвета диаметром 1-2 мкм), кольца Кебота (остатки ядерной оболочки в форме тонких нитеобразных колец, «восьмерки» или эллипса, окрашенные в красный цвет) и пылинки Вейденрейха (мелкая азурофильная, иногда голубая зернистость, чаще обнаруживается в мегалоцитах). Ядерные включения свидетельствуют о неэффективном эритропоэзе и встречаются при В12-дефицитных и гемолитических анемиях.
Кроме того, эритроциты с тельцами Жолли появляются после спленэктомии и при функциональной гипосплении и асплении у больных хроническими миелопролиферативными заболеваниями.
К внутриэритроцитарным включениям цитоплазматического происхождения относится базофильная пунктация (зернистость), которая представляет собой патологическую преципитацию вещества рибосом, перерожденных митохондрий и сидеросом и выглядит как точечная зернистость темно-синего цвета различной величины. Эритроциты с базофильной пунктацией встречаются при токсическом повреждении костного мозга (отравления свинцом, цинком, ртутью и др.), ряде анемий (талассемии, мегалобластные анемии), миелодиспластических синдромах и являются неблагоприятным прогностическим признаком.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Микроцитоз что это такое
Фото представлено рекламодателем
Термин «микроцитоз» имеет непосредственное отношение к медицине. Таким словом принято называть избыток эритроцитов в составе крови, при этом последние не отличаются большим размером. К причинам возникновения патологий можно отнести: железодефицитную анемию, наследственный сфероцитоз и талассемию.
Если всё-таки было принято решение провести анализ крови и микроцитоз подтверждён, то в данном случае медлить нельзя. Необходимо срочно обращаться к профильным специалистам, с целью в оптимально короткий срок избавиться от проблемы. Спровоцировать диагноз способны и врождённые проблемы, но часто это связано с отравлением свинцом. В последнем случае эритроциты принимают особенную форму (их центральный участок становится более насыщенного цвета). Их продуцирует костный мозг, они стабильно появляются в пределах организма человека. Недостаточное число эритроцитов также считается отклонением от нормы.
Обычно микроцитоз сопровождается следующей симптоматикой: сильные головокружения; ощущение слабости во всём теле; бледность, проступающая на лице; образование отдышки; частое сердцебиение; раздражительность и нервозность.
Понятно, что признаки носят общий характер, но они должны послужить причиной экстренного обращения к врачу. Он должен провести обследования и взять необходимые анализы. От правильности диагностики будет зависеть очень многое.
О процессе лечения сложно говорить без знания причин, которые повлекли за собой развитие заболевания. Каждый случай может носить индивидуальный характер.
Для борьбы с недугом могут применяться консервативные или медикаментозные методы либо практиковаться оперативное вмешательство. Иногда причина банальна и кроется в нехватке железа, неправильном питании или недостаточном количестве гемоглобина. Такие потери легко восполнить при помощи определённого набора продуктов или исправить ситуацию диетой. В некоторых случаях микроэлементы вводят внутривенно. В любом случае, самодеятельность лучше исключить. Обратитесь за помощью к специалистам.
Что такое в12-дефицитная анемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Слесарчук О. А., гематолога со стажем в 15 лет.
Определение болезни. Причины заболевания
B12-дефицитная анемия (B12ДА) — это заболевание, при котором снижается уровень эритроцитов и гемоглобина из-за недостатка в организме витамина В12.
Синонимы: анемия Аддисона — Бирмера, мегалобластная, пернициозная анемия.
Распространённость
Причины B12-дефицитной анемии
Причинами развития B12ДА являются недостаточное поступление витамина в организм, нарушение его высвобождения из пищи, нарушение всасывания, транспорта, обмена (метаболизма) или повышенное его расходование. Разберём подробнее каждую причину.
2. Нарушение высвобождения В12 из пищи может быть вызвано следующими причинами:
3. Нарушение всасывания витамина в тонком кишечнике. Возможные причины:
6. Повышенное расходование витамина В12. Может быть вызвано [4] :
Симптомы В12-дефицитной анемии
При дефиците внутреннего фактора, дефиците транспортного белка, нарушении внутриклеточного метаболизма и некоторых других врождённых состояниях симптомы B12ДА могут появиться у детей в первые месяцы или годы жизни. При недостаточности поступления с пищей или нарушении всасывания симптомы развиваются постепенно, обычно у детей в возрасте старше 7 лет и у взрослых.
Все проявления B12ДА можно разделить на 3 группы:
Каждая из этих групп симптомов может присутствовать по отдельности, а может встречаться их сочетание.
Анемический синдром
При B12ДА, как и при любой анемии, наблюдается бледность кожи, иногда с желтушным оттенком. Может беспокоить общая слабость, повышенная утомляемость, сонливость, одышка при незначительной физической нагрузке.
Возможно учащённое сердцебиение, шум в ушах, головокружение, потемнение в глазах, мелькание «мушек» перед глазами. Обращает на себя внимание снижение памяти, работоспособности, успеваемости в школе или ВУЗе. У детей на фоне анемического синдрома возможно нарушение роста и развития.
Симптомы поражения желудочно-кишечного тракта
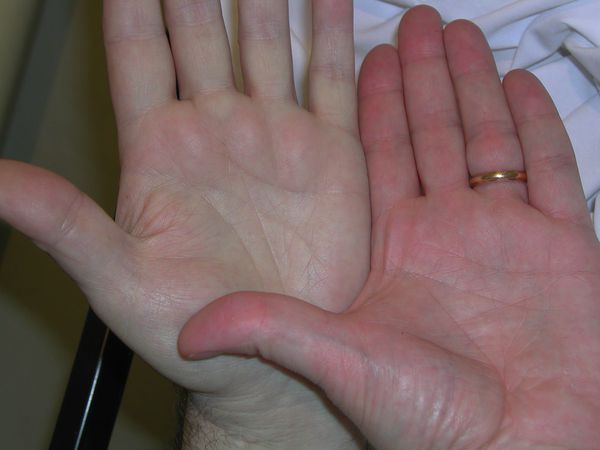
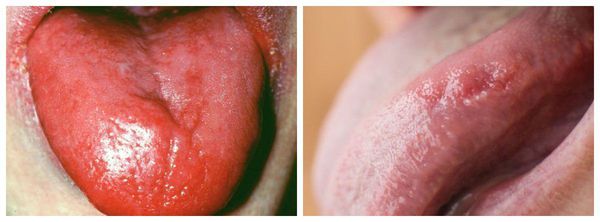
Для больных B12ДА специфичным симптомом является воспаление языка, которое сопровождается неприятными ощущениями и болями. При этом язык ярко-красного цвета, со сглаженными сосочками («лакированный язык», Гунтеровский глоссит), участками воспаления, трещинами и изъязвлениями. Может наблюдаться появление язвочек в углах рта и болей в деснах и губах.
Возможно снижение аппетита и, как следствие, потеря веса, ощущение тяжести в животе, диарея. Иногда незначительно увеличивается печень и селёзенка, что может быть выявлено при пальпации живота врачом либо при УЗИ органов брюшной полости.
Симптомы поражения нервной системы
Поражение нервной системы при B12ДА называется фуникулярным миелозом. Он затрагивает задние и боковые столбы спинного мозга, а также периферические нервы. Чаще встречается у мужчин. Это состояние проявляется онемением, парестезиями (ощущением ползанья мурашек), слабостью в ногах и нарушением походки. Реже наблюдаются подобные жалобы со стороны рук, при этом возникает трудность при выполнении точных движений.
Патогенез В12-дефицитной анемии
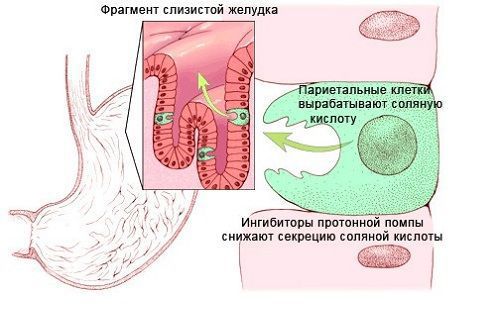
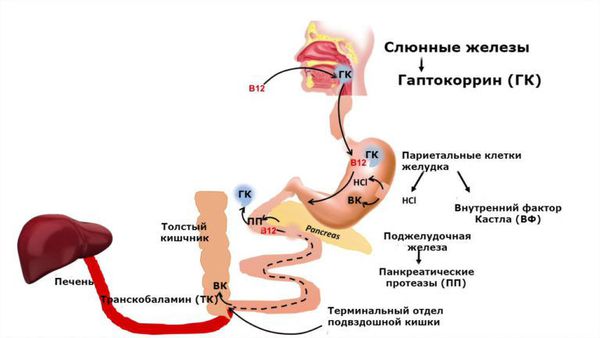
Витамин B12 поступает в организм с продуктами животного происхождения: мясные продукты, яйца, сыр, молоко. Из связи с белками пищи витамин высвобождается сначала под воздействием кулинарной обработки, а затем соляной кислоты и ферментов желудочного сока.
В двенадцатиперстной кишке витамин B12 соединяется с внутренним фактором Кастла, который синтезируется париетальными клетками желудка. Благодаря фактору Кастла витамин B12 поступает в клетки слизистой оболочки подвздошной кишки. После этого он связывается с транспортным белком транскобаламином II и переносится кровью клеткам-потребителям, в основном в печень и костный мозг.
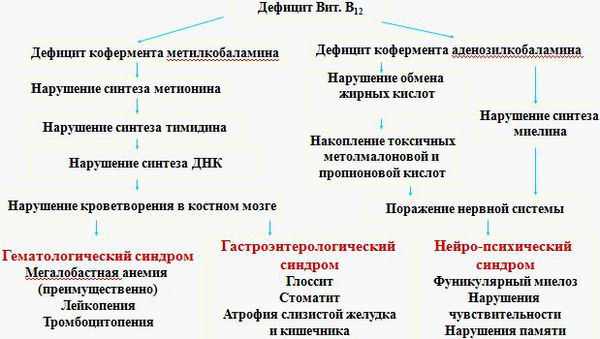
Метилкобаламин является коферментом для фермента метионинсинтазы, который преобразует одну аминокислоту — гомоцистеин в другую — метионин. При сбое этого процесса в организме накапливается гомоцистеин, не образуются пиримидиновые основания, необходимые для формирования ДНК. В результате нарушается синтез ДНК и процессы деления клеток. К этому изменению особенно чувствительны быстроделящиеся клетки — кроветворные клетки костного мозга, из которых образуются клетки крови, а также эпителиальные клетки желудочно-кишечного тракта. Отсюда появление таких изменений в анализе крови, как анемия, лейкопения (снижение количества лейкоцитов), тромбоцитопения (снижение количества тромбоцитов), а также атрофия слизистых оболочек.
Классификация и стадии развития В12-дефицитной анемии
Классификация В12ДА по причинам развития:
Стадии развития B12ДА:
Степени тяжести В12ДА:
Осложнения В12-дефицитной анемии
Задержка роста и развития у детей возможна в результате снижения гемоглобина при B12ДА.
Потеря массы тела может стать результатом снижения аппетита и проявлений со стороны желудочно-кишечного тракта.
Присоединение инфекционных осложнений возможно при развитии глубокой лейкопении (низкого уровня лейкоцитов). Снижение тромбоцитов, как правило, незначительное и не приводит к геморрагическим осложнениям.
Также описано такое тяжёлое осложнение B12ДА, так тромботическая микроангиопатия — заболевание, в основе которого лежит поражение мелких сосудов и формирование в их просвете тромбов, что сопровождается воспалением сосудистой стенки. Как следствие, может развиваться ишемия органов и тканей.
Диагностика В12-дефицитной анемии
Для правильной постановки диагноза B12ДА важен осмотр врача-гематолога. Для уточнения и коррекции проблем, связанных с работой желудочно-кишечного тракта, потребуется консультация гастроэнтеролога. Для оценки неврологических проявлений может быть необходим осмотр врача-невролога.
Осмотр пациента
При осмотре врач может обратить внимание на бледность и лёгкую желтушность кожи, увеличение частоты сердечных сокращений и расширение границ сердца. Необходимо провести осмотр полости рта, особенно языка. Невролог может оценить тонус мышц и наличие патологических рефлексов.
Лабораторная диагностика
Одним из самых важных этапов диагностики является оценка клинического анализа крови. В анализе наблюдается:
Могут встречаться также патологические формы нейтрофилов:
В биохимическом анализе крови:
В общем анализе мочи может наблюдаться стойкая протеинурия — появление белка в моче. В ряде случаев отмечается повышение уровня метилмалоновой кислоты и гомоцистеина.
Дополнительные лабораторные исследования, которые могут помочь выявить причину дефицита витамина B12:
Возможна пренатальная диагностика генетически обусловленной недостаточности транспортного белка транскобаламина II, поскольку он синтезируется амниоцитами (клетками плодной оболочки).
Инструментальная диагностика
При ультразвуковом исследовании органов брюшной полости можно обнаружить незначительную гепатоспленомегалию — увеличение печени и селезёнки.
Дифференциальная диагностика
Дифференциальный диагноз при В12-дефицитной анемии, особенно со снижением лейкоцитов и тромбоцитов, проводится с такими заболеваниями системы крови:
Для уточнения диагноза может потребоваться выполнение пункции костного мозга и его морфологическое исследование. При наличии B12ДА специалист морфолог описывает в костном мозге характерные изменения стволовых клеток-предшественников:
Лечение В12-дефицитной анемии
При анемии, которая связана с недостаточностью поступления витамина с пищей, лечение предполагает коррекцию диеты в комбинации с внутримышечным введением витамина B12. Диета с достаточным содержанием витамина B12 предполагает употребление продуктов животного происхождения. Овощи, фрукты, хлеб не содержат витамин B12.
При других причинах коррекция диеты будет неэффективна. Во всех случаях лечение подразумевает введение препарата витамина В12 по стандартным схемам. Дозы препарата могут отличаться в зависимости от возраста больного и от наличия неврологических симптомов.
Лечение обычно проводится в амбулаторных условиях. Показанием для госпитализации в стационар может послужить тяжёлая анемия (уровень гемоглобина менее 70 г/л) и пожилой возраст.
При подозрении на B12ДА без лабораторного её подтверждения категорически не рекомендуется начинать лечение витамином B12 либо поливитаминными комплексами, поскольку введение B12 приводит к быстрому исчезновению морфологических аномалий клеток, что в свою очередь затруднит постановку правильного диагноза. Ошибочное использование фолиевой кислоты при дефиците B12 может привести к усугублению неврологических симптомов. Поэтому очень важно начинать терапию только после лабораторного подтверждения диагноза.
Первый этап терапии — насыщение. Он длится 4-6 недель и предполагает внутримышечное введение препарата цианокобаламин в лечебной дозе. В некоторых случаях может быть эффективно использование сублингвальных форм витамина B12. Признаки улучшения состояния наблюдаются после первых 3-5 инъекций препарата.
Первым лабораторным признаком эффективности терапии является ретикулярный криз — повышение уровня ретикулоцитов в крови в 2-3 раза по сравнению с исходным на 4-7 день от начала терапии. Нормализация уровня гемоглобина достигается через 1-2 месяца, периферическая нейропатия купируется медленнее.
На фоне терапии цианокобаламином в связи с активным делением клеток-предшественников в костном мозге возможно присоединение дефицита фолиевой кислоты и железа, поэтому спустя 7-10 дней от начала терапии витамином B12 необходимо дополнительно назначить фолиевую кислоту, а при снижении уровня ферритина — препараты железа.
Второй этап — закрепляющая терапия: витамин B12 вводится в той же дозе, но кратность введения уменьшается.
Прогноз. Профилактика
Независимо от возраста больного, при ранней постановке диагноза, своевременном начале лечения и правильном наблюдении после выздоровления прогноз при B12ДА благоприятный. Ухудшению прогноза могут способствовать сопутствующие сердечно-сосудистые заболевания у пожилых больных, а также поражение нервной системы (фуникулярный миелоз).
Еще раз об анемии… Точная дифференциальная диагностика – залог успешного лечения
Куриляк О.А., к.б.н.
Анемией обозначается состояние, которое характеризуется снижением содержания в крови гемоглобина ( 3 4,5-11,0*10 9 /л
Дети до 2 лет: 0,4-1,0 мг/л (7 – 18,0 мкмоль/л)
Итак, на первом этапе в лаборатории следует повести анализ образца на гематологическом анализаторе. При выявлении снижения гемоглобина необходимо прежде всего определить характер анемии: гипо-, нормо- или гиперхромный. Критерием является величина МСН, отражающая, как известно, среднее содержание гемоглобина в эритроците.
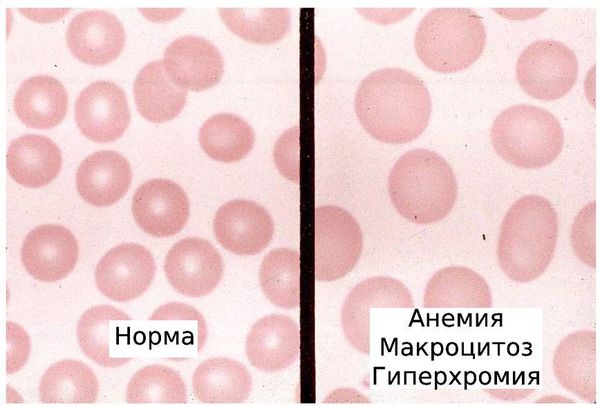
Гипохромные анемии характеризуются низким значением МСН ( 95 фл). Значение MCHC тоже не выходит за пределы нормы, а снижение гемоглобина обычно обусловлено резким снижением количества эритроцитов с преобладанием фракции клеток с большим объемом (макроцитов). К данному типу анемий относят В12-дефицитную, фолиеводефицитную и аутоиммунную гемолитическую анемии.
Нормохромные анемии в большинстве случаев являются и нормоцитарными, т.е. все эритроцитарные индексы находятся в пределах нормы (см. Табл. 1). Причиной снижения гемоглобина в этих случаях является снижение общего количества эритроцитов. В группу нормохромно-нормоцитарных анемий входят анемии при острой кровопотере, а также разнообразные гемолитические анемии и анемии при костномозговой недостаточности.
МСН является аналогом цветового показателя (ЦП),который вычисляют в тех случаях, когда в лаборатории нет гематологического анализатора и подсчет эритроцитов осуществляется в камере Горяева. Нормальные значения ЦП находятся в пределах 0,85 – 1,0. Однако, в случае ошибочного подсчета числа эритроцитов, в частности занижения их количества (что при ручном подсчете случается достаточно часто!), цветовой показатель может оказаться близким к единице. Это может служить источником серьезной ошибки на начальном этапе диагностического поиска, которая повлечет за собой назначение необоснованных исследований, и, как следствие, существенно усложнит дифференциальную диагностику.
Алгоритм диагностического поиска при анемии
Гипохромно-микроцитарные анемии
Как было упомянуто выше, при выявлении у пациента гипохромного характера анемии в первую очередь следует заподозрить ЖДА (все ЖДА являются гипохромными!). Однако факт наличия гипохромной анемии сам по себе не исключает других патогенетических вариантов анемии, поскольку не все гипохромные анемии являются железодефицитными. Например, гипохромная анемия может возникать при нарушении синтеза гемоглобина в результате нарушения включения в его молекулу железа при нормальном или даже повышенном уровне железа в сыворотке крови (см. нарушение синтеза порфиринов). Поэтому для дифференциальной диагностики этих состояний следует в первую очередь провести исследование содержания железа в сыворотке. Причем, этот анализ надо выполнять обязательно до назначения больным лекарственных препаратов железа или проведения трансфузий эритроцитов.
Если уровень железа в сыворотке крови находится в пределах нормы или повышен, следует заподозрить у пациента анемию, связанную с нарушением синтеза порфиринов или талассемию и на следующем этапе диагностики целесообразно определить концентрацию ретикулоцитов. Выявление пониженного уровня железа в сыворотке крови однозначно указывает на необходимость определения других показателей обмена железа (ОЖСС и уровень ферритина).
При ЖДА этот показатель снижается (менее 15%), а при перегрузке железом значительно повышается (более 50%).
Еще одним высоко специфичным диагностическим признаком ЖДА является концентрация ферритина в сыворотке крови. Уровень ферритина отражает величину запасов железа в организме. Поскольку истощение запасов железа является обязательным этапом формирования ЖДА, то снижение содержания ферритина (менее 15 мкг/л) – характерный признак не только ЖДА, но и латентного дефицита железа. Однако этот показатель следует оценивать с осторожностью при сопутствующих острых воспалительных процессах, болезнях печени и некоторых опухолях. Дело в том, что ферритин принадлежит к классу острофазных белков и при перечисленных выше состояниях его синтез увеличивается, что при ЖДА может маскировать гипоферритинемию.
снижение содержания ферритина в сыворотке.
Клинический пример №1: У 34-летней женщины выявлена гипохромная микроцитарная анемия с очень низкими MCV (49,0 фл) и МCH (15.0 пг), а также существенно увеличенным значением RDW ( 21.3%).
Т. о., биохимические исследования подтвердили диагноз ЖДА.
После 10-дневного курса терапии пероральными препаратами железа отмечено увеличение RDW, а также появление на гистограмме распределения эритроцитов по объему второго пика в области нормоцитов (отмечен стрелкой).
Полученная кривая свидетельствует об адекватности назначенного лечения.
Таким образом, по данным гемограммы анемия отсутствует. Однако, в картине крови преобладают микроциты с низким содержанием гемоглобина. Наиболее вероятен диагноз – латентный дефицит железа.
2. Анемии при хронических заболеваниях (АХЗ) = железораспределитель-ные анемии
Среди микроцитарно-гипохромных анемий второе место по частоте после ЖДА занимают анемии при различных воспалительных заболеваниях как инфекционного, так и неинфекционного происхождения.
При всем многообразии патогенетических механизмов анемий в данных ситуациях одним из основных при АХЗ считается перераспределение железа в клетки макрофагальной системы, активирующейся при различных воспалительных или опухолевых процессах. Поступающее в организм и высвобождающееся из разрушающихся эритроцитов железо переходит, главным образом, в депо, где и накапливается в макрофагальных клетках в виде железосодержащего белка ферритина. В то же время, перенос железа из клеточного ферритина к трансферрину нарушен, что влечет за собой снижение уровня сывороточного железа. Развивается перераспределительный, или функциональный, дефицит железа вследствие накопления и блокады освобождения железа в тканевых макрофагах, что приводит к снижению доставки железа к эритрокариоцитам костного мозга, нарушению эритропоэза и развитию анемии. Поскольку истинного дефицита железа при этих АХЗ не наблюдается, более оправданно говорить не о железодефицитных, а о железоперераспределительных анемиях. Выделение железоперераспределительных анемий в отдельный патогенетический вариант имеет важное значение, так как при сходстве данного варианта с ЖДА терапевтические подходы при этих анемиях абсолютно различны.
Критерии железоперераспределительных анемий:
3. Анемии, связанные с нарушением синтеза порфиринов = сидероахрести-ческие анемии
Картина гемограммы при данном типе анемий аналогична таковой при ЖДА, поэтому для уточнения диагноза следует обращать пристальное внимание на биохимические показатели обмена железа (Табл.3).
Критериями сидероахрестических анемий являются:
Пациентку лечили препаратами железа. Эффекта не было. После проведения дополнительных исследований получены следующие результаты:
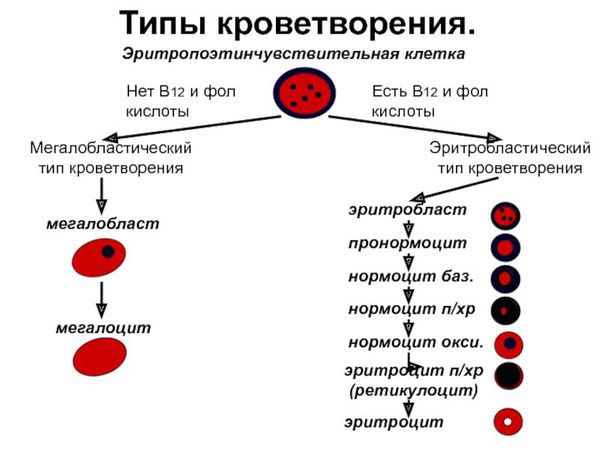
Поскольку при мегалобластном типе кроветворения соотношение лейкопоэз/эритропэз сдвигается в сторону эритропоэза, при анализе гемограммы обычно отмечается лейкопения и тромбоцитопения, которые носят умеренно выраженный характер. Нарушение процессов созревания гранулоцитарного ростка приводит к появлению в крови гигантских гиперсегментированных нейтрофилов.
На этапе синдромной диагностики основным методом является исследование костного мозга, при котором выявляется мегалобластический тип кроветворения с высоким уровнем неэффективного эритропоэза. Данное исследование должно проводиться до назначения витамина В12, т.к. иньекция В12 в течение 1-2 суток изменяет тип кроветворения в костном мозге. Мегалобласты уменьшаются в размерах, меняется структура ядра, клетки становятся макронормобластами. Только по присутствию гиганских форм нейтрофилов можно предположить, что имело место мегалобластическое кроветворение. При невозможности выполнить диагностическое исследование костного мозга допустимо пробное назначение витамина В12 с последующим обязательным исследованием количества ретикулоцитов через 3–5 дней (не позже), приобретающим диагностическое значение. Если анемия связана с дефицитом витамина В12, то под влиянием нескольких инъекций препарата происходит трансформация мегалобластического кроветворения в нормобластическое, что приводит к значительному увеличению в периферической крови количества ретикулоцитов по сравнению с исходным (ретикулоцитарный криз).
Окончательная верификация В12-дефицитного характера анемии может быть осуществлена с помощью исследования концентрации в крови витамина В12 (норма для взрослых: 148-616 пмоль/л, старше 60-ти лет: 81-568 пмоль/л).
Макроцитоз в комбинации с гиперсегментацией нейтрофилов и дефицитом витамина В12 подтверждают диагноз В12-дефицитной анемии.
Фолиево-дефицитные анемии
Фолиево-дефицитные анемии по своим гематологическим признакам (макроцитоз, мегалобластический эритропоэз) аналогичны В12-дефицитным анемиям. Отличительной особенностью является снижение в сыворотке крови уровня фолата (норма 6-20 нг/мл), а также снижение его концентрации в эритроцитах (норма 160-640 нг/мл).
Нормохромно-нормоцитарные анемии
1. Гемолитические анемии ГА
Основным патогенетическим механизмом развития гемолитической анемии (ГА) является укорочение продолжительности жизни эритроцитов (в норме в среднем 120 дней) и их преждевременный распад под воздействием различных причин.
Критерии ГА:
Большинство ГА являются нормохромными, за исключением ГА, связанной с нарушением синтеза глобина (талассемия), которая, как было отмечено выше, является гипохромной. Основным лабораторным признаком, позволяющим заподозрить ГА, является повышение в крови количества ретикулоцитов, в связи с чем данный анализ следует считать обязательным при всех неясных анемиях. Фактически ретикулоцитоз встречается в двух ситуациях, при которых активируется нормальный эритропоэз – при гемолизе и острых кровопотерях. Наряду с ретикулоцитозом при интенсивном гемолизе в крови обнаруживаются ядросодержащие эритроидные клетки (эритрокариоциты), обнаруживаемые в норме только в костном мозге. Наличие или отсутствие гипербилирубинемии определяется, с одной стороны, интенсивностью гемолиза, а с другой – функциональной способностью печени связывать билирубин с глюкуроновой кислотой и экскретировать его в желчь. Поэтому нормальные показатели содержания билирубина в крови не исключают гемолиза. При некоторых ГА, сопровождающихся внутрисосудистым гемолизом (болезнь Маркиафавы, аутоиммунные ГА), в крови увеличивается содержание свободного гемоглобина, выделяющегося с мочой в виде гемосидерина. Последний может быть обнаружен в моче с помощью бензидиновой пробы (аналогичной исследованию скрытой крови в кале) или при окраске осадка мочи на выявление гемосидерина. Эти информативные тесты должны чаще использоваться в лабораторной практике при подозрении на внутрисосудистый гемолиз.
Наследственные ГА связаны с различными генетическими дефектами, в частности с дефектом мембраны эритроцитов (наследственный микросфероцитоз, овалоцитоз), дефицитом некоторых ферментов в эритроцитах (глюкозо-6-фосфат-дегидрогеназа, пируваткиназа и др.), нарушением синтеза цепей глобина (талассемия), наличием нестабильных гемоглобинов.
Среди приобретенных ГА наиболее распространенными являются аутоиммунные ГА (симптоматические и идиопатические). Симптоматические аутоиммунные ГА возникают на фоне лимфопролиферативных заболеваний (хронический лимфолейкоз, лимфогранулематоз и др.), системных васкулитов (системная красная волчанка, ревматоидный артрит), хронического активного гепатита, некоторых инфекций, в частности, вирусных, при приеме ряда медикаментов (альфа-метилдопа). Если причина аутоиммунного гемолиза не выявляется, то говорят об идиопатических ГА. К приобретенным ГА относятся болезнь Маркиафавы (перманентный внутрисосудистый гемолиз), микроангиопатические ГА (гемолиз вследствие ДВС-синдрома на фоне различных заболеваний), механический гемолиз при протезированных сосудах и клапанах сердца, маршевой гемоглобинурии, ГА при воздействии различных токсических веществ (уксусная кислота, мышьяк и др.).
При наличии соответствующих подозрений уточнению причины ГА, т.е. нозологической диагностике, могут способствовать следующие исследования:
2. Анемии при костномозговой недостаточности
В основе данного патогенетического варианта анемий лежит нарушение нормальной продукции эритроидных клеток в костном мозге. При этом часто одновременно с угнетением эритропоэза имеется нарушение продукции клеток гранулоцитарного и тромбоцитарного ростков, что отражается на составе периферической крови (панцитопения) и служит ориентиром в распознавании возможного механизма развития анемии.
Критерии анемии при костномозговой недостаточности:
Ключевой особенностью, позволяющей предположить данный патогенетический вариант анемий, является нарушение со стороны других ростков костного мозга (гранулоцитопения, тромбоцитопения), что может проявляться соответствующей клинической симптоматикой в виде инфекционных осложнений (часто отмечается только лихорадка) или геморрагического синдрома (зависит от выраженности тромбоцитопении). Уместно напомнить, что при В12-дефицитной анемии также может наблюдаться лейко- и тромбоцитопения, однако цитопении при этом выражены умеренно и обычно не сопровождаются описанными симптомами.
Анемия при костномозговой недостаточности может возникать при следующих заболеваниях и патологических процессах: острые и хронические лейкозы; метастазы злокачественных опухолей в костный мозг; замещение костного мозга фиброзной тканью (миелофиброз) вследствие различных причин; замещение костного мозга жировой тканью (апластическая анемия) вследствие различных причин; изолированное угнетение продукции эритроидных клеток костного мозга, чаще иммунной природы (парциальная красноклеточная анемия); миелодиспластический синдром (гетерогенная группа гематологических нарушений, одними из которых являются так называемые рефрактерные анемии).
Фактически с помощью исследования костного мозга (цитологического, гистологического) при данном патогенетическом варианте осуществляется нозологическая диагностика, хотя часто требуется уточнение формы и причины выявленных изменений.
В основе развития анемии может лежать так называемый миелодиспластический синдром (МДС), который является результатом приобретенного дефекта стволовой клетки-предшественницы миелопоэза, что приводит к нарушению нормальной дифференцировки клеток различных ростков костного мозга (эритроидного, гранулоцитарного, тромбоцитарного). В результате этого гемопоэз оказывается неэффективным, что в конечном счете проявляется цитопениями в различных сочетаниях. Неэффективность эритропоэза позволяет трактовать анемию при МДС как следствие костномозговой недостаточности. Основным признаком, позволяющим заподозрить МДС, является бедность клетками периферической крови в сочетании с высокой клеточностью костного мозга и признаками дисплазии всех ростков кроветворения. МДС встречается почти исключительно у больных пожилого и старческого возраста, характеризуется анемией, рефрактерной к лечению препаратами железа, витамином В12, фолиевой кислотой, повышением в костном мозге эритроидных клеток, содержащих железо (рефрактерная анемия с сидеробластами).
3. Анемия при уменьшении массы циркулирующих эритроцитов
Данный патогенетический вариант анемии отличается от остальных и характеризуется уменьшением количества эритроцитов и гемоглобина за счет уменьшения массы циркулирующей крови. Основной причиной развития данного варианта анемий являются острые кровопотери различной локализации.
Основные признаки анемии при уменьшении массы эритроцитов: