Минералокортикоидная активность что это
Минералокортикоиды
Минералокортикоиды, или минералокортикостероиды — общее собирательное название подкласса кортикостероидных гормонов коры надпочечников и их синтетических аналогов, общим свойством которых является более сильное и избирательное действие на водно-солевой, чем на углеводный обмен.
Естественные минералокортикоиды — альдостерон и дезоксикортикостерон практически не обладают глюкокортикоидной активностью. У человека альдостерон является основным, наиболее физиологически важным и наиболее активным минералокортикоидом. Но это верно не для всех видов животных — у некоторых видов роль основного минералокортикоида играет дезоксикортикостерон.
Синтетический аналог минералокортикоидных гормонов — флудрокортизон в отличие от естественных минералокортикоидов обладает сильной глюкокортикоидной активностью, но ещё более сильной минералокортикоидной. Поэтому в дозах, замещающих минералокортикоидную недостаточность, он практически не оказывает глюкокортикоидного действия и обычно не даёт характерных «глюкокортикоидных» побочных эффектов. Поэтому флудрокортизон, по крайней мере в рекомендуемых дозах, правомерно рассматривать именно как минералокортикоид.
Минералокортикоиды вызывают усиление канальцевой реабсорбции катионов натрия, анионов хлора и воды и одновременно усиливают канальцевую экскрецию катионов калия и повышают гидрофильность тканей (способность тканей удерживать воду), способствуют переходу жидкости и натрия из сосудистого русла в ткани.
Конечным результатом действия минералокортикоидов является увеличение объёма циркулирующей крови и повышение системного артериального давления. В патологических случаях гиперальдостеронизма это приводит к развитию отёков, гипернатриемии, гипокалиемии, гиперволемии, артериальной гипертензии и иногда застойной сердечной недостаточности.
Роль минералокортикоидов в лечении больных с хронической надпочечниковой недостаточностью
Хроническая надпочечниковая недостаточность (ХНН) — клинический синдром, обусловленный недостаточным содержанием гормонов коры надпочечников, в результате нарушения функционирования одного или нескольких звеньев гипоталамо-гипофизарно-надпочечниковой сис
Хроническая надпочечниковая недостаточность (ХНН) — клинический синдром, обусловленный недостаточным содержанием гормонов коры надпочечников, в результате нарушения функционирования одного или нескольких звеньев гипоталамо-гипофизарно-надпочечниковой системы.
Классификация надпочечниковой недостаточности
Первичная надпочечниковая недостаточность
Центральная (гипоталамо-гипофизарная) надпочечниковая недостаточность
Вторичная надпочечниковая недостаточность
Третичная надпочечниковая недостаточность (повреждения гипоталамуса различного генеза)
Классическое описание первичной хронической надпочечниковой недостаточности было сделано Томасом Аддисоном в 1855 г., тогда как проведение эффективной заместительной терапии заболевания оказалось возможным только в 30-х гг. ХХ в. Первая попытка лечения больных экстрактом надпочечников, который назначался внутрь, была предпринята R. Stockman в 1867 г. и оказалась неудачной. В 1936 г. E. C. Kendall et al. впервые получили из экстракта коры надпочечников кортикостерон и дегидрокортикостерон в кристаллической форме, а в 1937 г. M. von Steiger и T. Reichstein выделили дезоксикортикостерона ацетат (ДОКСА) и синтезировали его из сигмастерола. С 1939 г. ДОКСА в виде внутримышечных инъекций начали с успехом использовать в лечении первичной хронической надпочечниковой недостаточности. В середине 70-х гг. ДОКСА применялся в виде подкожных подсадок кристаллов по 100 мг, что избавляло пациента от необходимости делать инъекции. Однако это затрудняло подбор дозировки из-за индивидуальной скорости всасывания препарата и невозможности регулирования его действия при нестабильном АД, а сама манипуляция подсадки требовала специальной квалификации персонала. В 1953 г. Freed и Sabo синтезировали пероральный минералокортикоид 9α-фторкортизол (кортинефф), который с тех пор широко используется во всем мире и в конце 70-х гг. пришел на смену препарату ДОКСА, применявшемуся до этого в России [2].
Современная заместительная терапия первичной хронической надпочечниковой недостаточности заключается в обязательном комбинированном назначении препаратов глюко- и минералокортикоидов. Типичной ошибкой является лечение первичной хронической надпочечниковой недостаточности с помощью монотерапии глюкокортикоидами. Часто в этой ситуации, несмотря на увеличение дозы препарата, состояние больных не нормализуется, а дозировки продолжают увеличивать, что в ряде случаев приводит к развитию экзогенного синдрома Кушинга [1, 3].
По данным Нидерландского исследования (P. M. J. Zelissen, 1994), назначение монотерапии глюкокортикоидами можно считать обоснованным не более чем в 6,6% случаев, при этом следует учитывать, что практически все обследованные пациенты получали таблетированный гидрокортизон или кортизон-ацетат, который обладает большей минералокортикоидной активностью, чем синтетические глюкокортикоиды.
При вторичной надпочечниковой недостаточности дефицит минералокортикоидов не наблюдается, и в назначении минералокортикоидов (кортинефф) необходимости, как правило, нет, за исключением тех случаев, когда у пациента имеется выраженная артериальная гипотензия [5].
Заместительная терапия первичной хронической надпочечниковой недостаточности минералокортикоидами подразумевает использование только одного препарата — 9α-фторкортизола (9α-FF, кортинефф). Естественный минералокортикоид альдостерон не назначается для заместительной терапии по той же причине, что и ДОКСА, — из-за полной метаболизации при первом прохождении через печень; кроме того, препарат чистого альдостерона стоит достаточно дорого.
Основные преимущества 9α-FF заключаются в его эффективности при пероральном применении, а также в минералокортикоидной активности. После приема внутрь препарат быстро и полностью всасывается из желудочно-кишечного тракта. Своего пика плазменная концентрация 9α-FF достигает через 1,5 ч после приема. Период полувыведения составляет 18—36 ч, что позволяет имитировать практически не имеющую циркадного ритма секрецию альдостерона, благодаря ежедневному однократному приему 0,05—0,2 мг препарата. Метаболизируется 9α-FF в печени, выделяется с мочой в виде неактивных метаболитов. Интересен тот факт, что, как и сам альдостерон, кортизол и 9α-FF имеют одинаковую аффинность к рецепторам альдостерона в почках. Однако если альдостерон и 9α-FF достигают рецептора, то кортизол, попав в клетку, в результате действия 11-b-гидроксистероиддегидрогеназы превращается в неактивный кортизон. Именно поэтому минералокортикоидная активность 9α-FF в 200—400 раз выше, чем у кортизола, хотя эти соединения отличаются друг от друга всего на один атом фтора, который делает 9α-FF неуязвимым для указанного фермента. Глюкокортикоидными эффектами 9α-FF на практике можно пренебречь, поскольку ощутимо они проявляются, если доза препарата превышает 0,5 мг/сут. Глюкокортикоидный эффект 1мг 9α-FF (10 таблеток кортинеффа) эквивалентен 20 мг гидрокортизона.
Фармакологическое действие кортинеффа заключается в воздействии на дистальную часть почечных канальцев, усилении обратного всасывания ионов натрия и воды, а также увеличении выделения ионов калия и водорода. Кортинефф влияет также на выделение воды и электролитов толстым кишечником, потовыми и слюнными железами. Увеличение объема внеклеточной жидкости и задержка натрия в организме приводят к повышению АД. При длительном применении кортинеффа повышение АД связано с увеличением периферического сопротивления, а не только с его влиянием на водно-электролитный обмен [3].
Кортинефф в дозах, превышающих терапевтические, может угнетать функцию коры надпочечников, у молодых пациентов — функцию вилочковой железы, тормозить секрецию АКТГ гипофизом, а также ускорять процесс отложения гликогена в печени, а при недостаточном количестве белка в пище приводить к отрицательному азотистому балансу. По данным литературы, частым симптомом передозировки 9α-FF являются отеки, которые, как правило, не сопровождаются значительным подъемом АД у пациентов с первичной ХНН. Отечность на фоне терапии носит преходящий характер, развиваясь при первом назначении или увеличении дозы препарата.
Кортинефф назначается один раз в сутки в дозе 0,05—0,1 мг (максимально 0,2 мг), ежедневно утром, после еды, его необходимо запивать большим количеством жидкости. В ряде случаев дозу 9α-FF приходится увеличивать летом, особенно в условиях жаркого климата, что связано с повышением потерь натрия и воды, выводящихся из организма с потом.
Если имел место пропуск приема препарата, следует принять его как можно быстрее. Если же приближается время следующего приема, пропущенную дозу нужно отменить. При необходимости доза препарата уменьшается постепенно. Во время терапии кортинеффом не следует проводить вакцинацию. Препарат может маскировать проявление симптомов инфекционно-воспалительных заболеваний. На фоне применения кортинеффа в высоких дозах обязательно определение концентрации электролитов в плазме крови (Na, K) [4].
На сегодняшний день разработаны следующие критерии адекватности минералокортикоидного компонента заместительной терапии первичной ХНН [1, 3]:
Как показало исследование M. Jadoul et al. (1991), артериальное давление при первичной ХНН коррелирует с АРП (см. рисунок) и, таким образом, с дозой 9α-FF. Следовательно, первым шагом в лечении артериальной гипертензии у больных первичной ХНН является ограничение потребления пищевой соли в сочетании с уменьшением дозы 9α-FF. Назначение диуретиков и спиронолактона вместе с кортинеффом не оправдано, поскольку эти препараты действуют как антагонисты [5].
| Воздействие ренин-ангиотензин-альдостерон системы на артериальное давление |
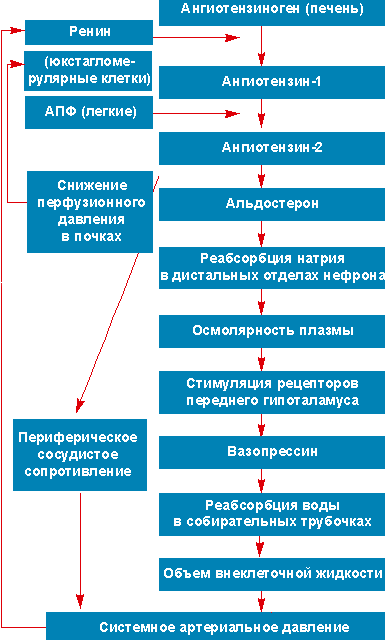 |
Нами был составлен регистр больных с ХНН г. Москвы. Из 300 человек минералокортикоиды были назначены 180 (60%). Большая часть пациентов, принимающих кортинефф, имеют первичную ХНН аутоиммунной природы или развившуюся вследствие оперативного вмешательства. Относительно низкий процент использования минералокортикоидов свидетельствует о недостаточной информированности врачей различных лечебных учреждений г. Москвы о современных подходах к заместительной терапии первичной ХНН. Доза кортинеффа составляла от 0,1 до 0,2 мг и принималась однократно утром. Побочных эффектов (подъемы АД и задержка жидкости) не наблюдалось.
Следует отметить некоторые особенности заместительной терапии кортинеффом во время беременности. При беременности происходит постепенное и значительное увеличение уровня прогестерона, который является антагонистом минералокортикоидов. Поэтому необходимая доза 9α-FF в этот период может значительно возрастать. Подбор дозы должен осуществляться по уровню калия плазмы и артериальному давлению. Уровень АРП неинформативен, поскольку во время беременности он и в норме значительно повышен. Описаны случаи, когда, основываясь на перечисленных критериях, дозу 9α-FF приходилось увеличивать до 0,3 и даже до 0,6 мг в день (S. Diederich et al., 1994).
Дети, рожденные от матерей, получавших 9α-FF, требуют тщательного медицинского наблюдения из-за опасности развития у них недостаточности функции надпочечников. При назначении препарата женщине в период кормления грудью следует решить вопрос о переводе ребенка на искусственное вскармливание [2, 5].
Надпочечниковая недостаточность представляет собой одну из самых серьезных по своим проявлениям и осложнениям эндокринопатий. Больных с хронической надпочечниковой недостаточностью необходимо обследовать два раза в год. Следует подчеркнуть, что для оценки эффективности заместительной терапии решающую роль имеют клинические данные. Не следует добиваться оптимальных лабораторных показателей за счет назначения высоких доз глюко- и минералокортикоидов, что может привести к передозировке и клиническим симптомам гиперкортицизма. В условиях заместительной терапии прогноз заболевания будет зависеть от ее адекватности, что делает обязательным обучение пациентов приемам самоконтроля и наблюдение за ними в специализированном лечебном учреждении.
По вопросам литературы обращайтесь в редакцию
Г. А. Мельниченко, доктор медицинских наук, профессор
Г. Ф. Александрова, кандидат медицинских наук
М. Б. Анциферов, доктор медицинских наук, профессор
Т. С. Елисеева, С. Ф. Машков
ГУ ЭНЦ, Диабетологический центр РАМН, Москва
Минералокортикоидная активность что это
а) Адренокортикальные гормоны связываются с белками плазмы. Приблизительно 90-95% кортизола в плазме связаны с белками, особенно с глобулином, названным кортизол-связывающим глобулином, или транскортином, и в меньшей степени — с альбумином. Высокая белковосвязывающая способность кортизола уменьшает его выведение из плазмы, поэтому он имеет относительно высокое время полувыведения — от 60 до 90 мин. Только 60% циркулирующего в крови альдостерона связывается с белками плазмы, а 40% остаются в свободной форме, в результате период полувыведения альдостерона уменьшается приблизительно до 20 мин. Обе формы гормонов (связанная и свободная) транспортируются во внеклеточное пространство.
Связанные с белками плазмы крови кортикостероиды играют роль резерва, препятствующего быстрым колебаниям концентрации свободных гормонов в крови, что происходит, например, с кортизолом в связи с кратковременным стрессом и эпизодической продукцией АКТГ. Этот функциональный резерв может также обеспечить равномерное распределение гормонов в тканях.
б) Адренокортикальные гормоны метаболизируются в печени. Кортикостероиды разрушаются главным образом в печени, где связываются с глюкуроновой кислотой и в меньшей степени — с сульфатами. В такой форме они не обнаруживают глюко- или минералокортикоидной активности. Почти 25% связанных форм выделяются с желчью и затем выводятся с каловыми массами. Часть конъюги-рованных форм, оставшихся в печени, попадают в кровоток, но не связываются с белками плазмы и, будучи высокорастворимыми веществами, легко фильтруются почками и экскретируются с мочой. Заболевания печени заметно снижают скорость инактивации кортикостероидов, а болезни почек — скорость экскреции неактивных конъюгатов.
В норме концентрация альдостерона в крови составляет около 6 нг на 100 мл, а скорость секреции — приблизительно 150 мкг/сут (0,15 мг/сут).
Концентрация кортизола в крови составляет около 12 мкг/дл, а скорость секреции — от 15 до 20 мг/сут.
в) Функции минералокортикоидов. Альдостерон. Дефицит минералокортикоидов вызывает тяжелые потери хлорида натрия с мочой и гиперкалиемию. Полная утрата адренокортикальной секреции обычно заканчивается гибелью организма в сроки от 3 дней до 2 нед при отсутствии введения избытка соли или минералокортикоидов.
Дефицит минералокортикоидов приводит к заметному повышению концентрации ионов калия в межклеточной жидкости, а ионы натрия и хлориды обычно исчезают из организма, что приводит к резкому уменьшению объемов и крови, и внеклеточной жидкости. Быстро уменьшается сердечный выброс и формируется состояние, напоминающее шок и ведущее к смерти. Предупредить такой исход можно введением альдостерона или других минералокортикоидов, поэтому минералокортикоиды могут быть названы жизненно важной частью адренокортикальных гормонов. В равной мере необходимы и глюкокортикоиды, позволяющие организму противодействовать развитию деструктивных процессов в связи с физическим или умственным «стрессом».
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Минералокортикоидная активность что это
а) Пути синтеза стероидов коры надпочечников. На рисунке ниже представлены основные этапы образования важнейших адреналовых стероидов: альдостерона, кортизола и андрогенов.
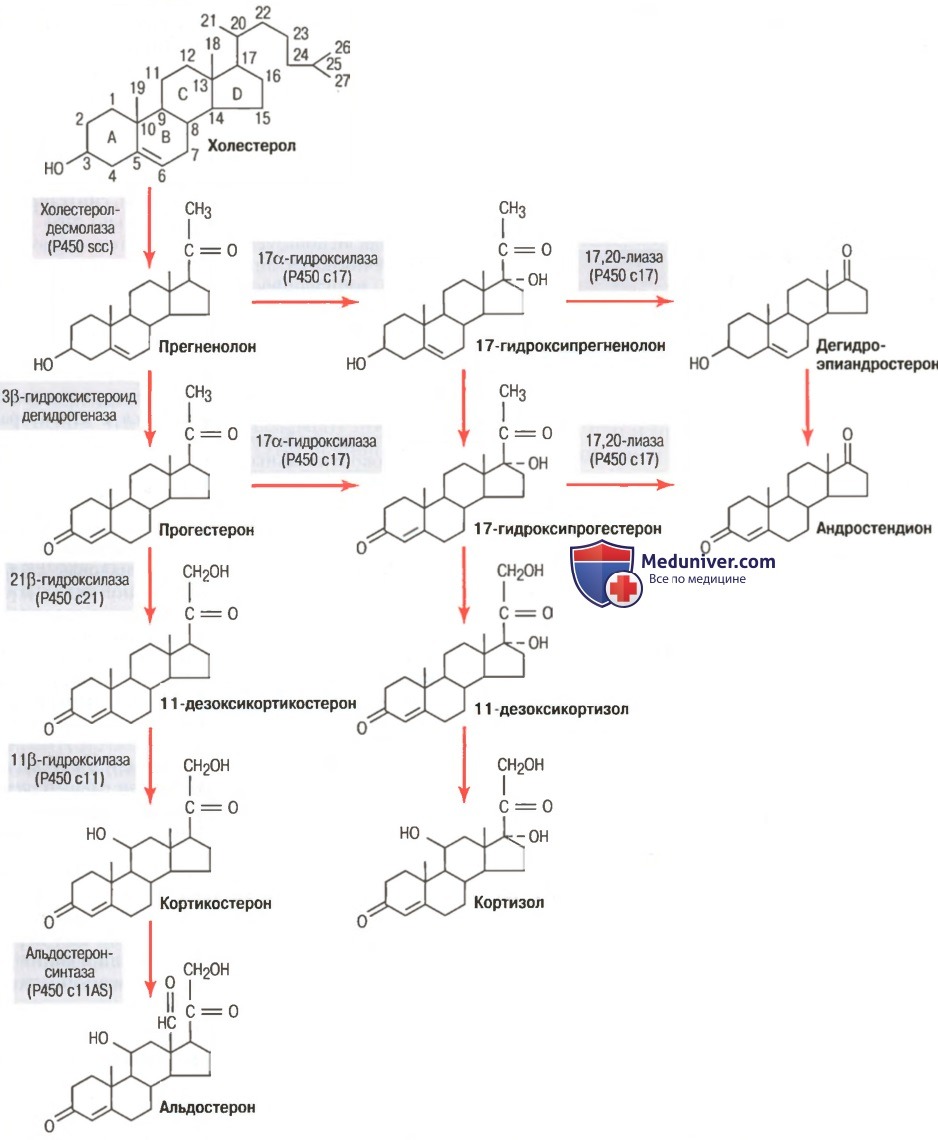
Главными органоидами клетки, где осуществляются процессы стероидогенеза, являются митохондрии и эндоплазматический ретикулум. Изменение в схеме даже одного фермента приводит к громадным вариациям как количества синтезируемого гормона определенного типа, так и относительной представленности разных видов гормонов. Так, изменение активности единственного фермента ведет к продукции огромного количества половых гормонов и маскулинизации организма наряду с появлением стероидов, в норме отсутствующих в крови.
На рисунке выше сопоставлены химические формулы альдостерона и кортизола — двух важнейших минерало- и глюкокортикоидов. Кортизол имеет кетогруппу у углерода в третьем положении, гидроксилированный углерод — в одиннадцатом и двадцать первом. У альдостерона восемнадцатый по счету углерод связан с кислородом.
В норме дополнительно к альдостерону и кортизолу корой надпочечников синтезируются и другие стероиды с минерало- и глюкокортикоидной активностью. Созданы препараты, которые в норме не продуцируются надпочечниками, но обладают активностью стероидных гормонов и используются в терапии различных состояний. Сведения о некоторых наиболее важных кортикостероидах, включая синтетические, систематизированы в таблице ниже.
— Альдостерон (очень активен, обеспечивает почти 90% всей минералокортикоидной активности).
— Преднизон (синтетический, в 4 раза активнее кортизола).
— Метилпреднизон (синтетический, в 5 раз активнее преднизона).
— Дексаметазон (синтетический, в 30 раз активнее кортизона).
Очевидно, что некоторые из вышеприведенных гормонов обладают как глюко-, так и минералокортикоидной активностью. Особенно важно: кортизол, обладающий слабой минералокортикоидной активностью, ввиду громадной его продукции при некоторых синдромах может вызывать минералокортикоидные ответы наряду с более выраженными глюкокортикоидными влияниями.
В заключение нужно сказать о дексаметазоне, синтетическом препарате с его нулевой минерало- и чрезвычайно высокой глюкокортикоидной активностью, который имеет очень важное значение для получения глюкокортикоидных ответов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Минералокортикоидная активность что это
Смоленская государственная медицинская академия
Кафедра клинической фармакологии и антимикробной химиотерапии
ГЛЮКОКОРТИКОИДНЫЕ ПРЕПАРАТЫ
ПРЕДИСЛОВИЕ
Глюкокортикоидные препараты обладают разносторонним действием на организм, многие элементы которого до конца не выяснены. Высокая биологическая активность глюкокортикоидов позволяет использовать их в наиболее тяжелых клинических ситуациях. Нередко они включаются в комплекс экстренных мер помощи при неотложных состояниях. Тем не менее, многие аспекты применения глюкокортикоидов остаются спорными.
За последние годы проведено большое количество контролируемых клинических исследований эффективности и безопасности глюкокортикоидов при различных видах патологии. В настоящем руководстве обобщены результаты целого ряда таких работ, которые во многом способствовали уточнению терапевтической роли глюкокортикоидов при некоторых заболеваниях.
В руководстве с современных позиций рассматриваются общие принципы применения глюкокортикоидных препаратов, а также особенности их назначения при различных заболеваниях: ревматических, инфекционных, бронхиальной астме и других. Особое внимание уделено методам предупреждения нежелательных реакций, в частности, профилактике вторичной надпочечниковой недостаточности.
Специальный раздел посвящен широко распространенному в настоящее время местному применению глюкокортикоидов, который включает их ингаляционное, внутри- и околосуставное введение, использование в дерматологии, офтальмологии. Все включенные препараты зарегистрированы и разрешены для применения в России.
Руководство предназначено для врачей различных специальностей, фармакологов и студентов медицинских вузов.
Во втором издании в более конкретной форме представлена информация о применении глюкокортикоидов при инфекциях, детализирован механизм терапевтического действия дексаметазона при эндокардите, включены новые сведения по внутрисуставному введению глюкокортикоидов.
Л.С. Страчунский, С.Н. Козлов
ВВЕДЕНИЕ
Глюкокортикоиды являются стероидными гормонами, которые вырабатываются в коре надпочечников. Данный термин относится также к полусинтетическим препаратам, таким как преднизолон, дексаметазон и другие, которые представляют собой производные гидрокортизона, наиболее активного природного глюкокортикоида.
Рисунок 1. Регуляция функции гипоталамо-гипофизарно-надпочечниковой системы.
Контроль за продукцией глюкокортикоидов осуществляет гипоталамо-гипофизарно-надпочечниковая система. Ключевым органом в регуляции синтеза глюкокортикоидов является гипоталамус, который реагирует на два стимула: уровень гидрокортизона в плазме крови и стресс (рис. 1). При низком уровне глюкокортикоидов крови или стрессовом воздействии (травма, инфекция, физическое напряжение и другие) гипоталамус вырабатывает кортикотропин-рилизинг-фактор (кортиколиберин), который стимулирует выброс адренокортикотропный гормон (АКТГ) из гипофиза. Под действием АКТГ в надпочечниках синтезируются глюкокортикоиды и минералокортикоиды. При избытке глюкокортикоидов в крови гипоталамус прекращает продуцировать кортикотропин-рилизинг-фактор. Таким образом, гипоталамо-гипофизарно-надпочечниковая система функционирует по механизму отрицательной обратной связи.
У взрослого человека в обычных условиях в сутки вырабатывается 10-30 мг гидрокортизона, но при стрессе продукция его может возрастать до 250 мг. У детей суточная выработка гидрокортизона составляет около 12 мг/м 2 поверхности тела.
Выход глюкокортикоидов из надпочечников в кровь в течение суток происходит не равномерно, а в виде 8-12 импульсов, которые подчиняются циркадному ритму. Особенностью циркадного ритма глюкокортикоидов является то, что максимальная секреция гидрокортизона происходит в ранние утренние часы (6-8 часов) с резким ее снижением в вечерние и ночные часы.
ФАРМАКОДИНАМИКА
Механизм действия
После прохождения через мембрану клетки глюкокортикоиды в цитоплазме связываются со специфическим стероидным рецептором. Активированный комплекс «глюкокортикоид-рецептор» проникает в ядро клетки, соединяется с ДНК и стимулирует образование информационной РНК. В результате трансляции РНК на рибосомах синтезируются различные регуляторные белки. Одним из важнейших является липокортин, который ингибирует фермент фосфолипазу-А2 и, тем самым, подавляет синтез простагландинов и лейкотриенов, играющих ключевую роль в развитии воспалительной реакции.
Таким образом, для проявления полного эффекта глюкокортикоидов необходимо несколько часов. Максимум фармакологической активности глюкокортикоидов приходится на тот период времени, когда их пиковые концентрации в крови уже позади. Следует, однако, учитывать, что до конца механизм действия глюкокортикоидов не раскрыт.
Основные эффекты
Водно-электролитный обмен
Замедление выделения из организма натрия и воды за счет увеличения реабсорбции в дистальном отделе почечных канальцев. Усиление выведения калия. Эти минералокортикоидные эффекты в большей степени присущи природным глюкокортикоидам (кортизону и гидрокортизону), в меньшей полусинтетическим (преднизону, преднизолону, метилпреднизолону). У фторированных препаратов триамцинолона, дексаметазона и бетаметазона минералокортикоидная активность отсутствует.
Углеводный обмен
Стимуляция глюконеогенеза в печени, уменьшение проницаемости мембран для глюкозы, гипергликемия, глюкозурия вплоть до развития стероидного диабета. Таким образом, глюкокортикоиды являются контринсулярными гормонами.
Белковый обмен
Угнетение синтеза белка, усиление процессов катаболизма, особенно в коже, в мышечной и костной тканях. Это проявляется похуданием, мышечной слабостью, атрофией кожи и мышц, стриями, кровоизлияниями, замедлением заживления ран. Как следствие распада белкового матрикса костей и гипокальциемии развивается остеопороз.
Жировой обмен
Перераспределение подкожной жировой клетчатки по кушингоидному типу вследствие того, что в тканях конечностей преобладает липолиз, а в тканях груди, шеи, лица, плечевого пояса липогенез.
Обмен кальция
Глюкокортикоиды угнетают всасывание кальция в кишечнике, способствуют выходу кальция из костной ткани и усиливают его почечную экскрецию. В результате могут развиваться гипокальциемия и гиперкальциурия.
Сердечно-сосудистая система
Глюкокортикоиды повышают чувствительность адренорецепторов к катехоламинам, усиливают прессорное действие ангиотензина-II. Они уменьшают проницаемость капилляров, поддерживают нормальный тонус артериол, сократимость миокарда. Недостаточность коры надпочечников характеризуется низким сердечным выбросом, расширением артериол, слабой реакцией на адреналин. В сочетании с гиповолемией, вызванной дефицитом минералокортикоидов, эти изменения могут вести к сосудистому коллапсу.
Противовоспалительное действие
Глюкокортикоиды угнетают все фазы воспаления, независимо от вызвавшей его причины. В их противовоспалительном действии играют роль многие факторы. Одним из ведущих является ингибирование фосфолипазы-А2 и связанное с этим нарушение образования простагландинов и лейкотриенов. Глюкокортикоиды стабилизируют клеточные мембраны, мембраны лизосом, уменьшают проницаемость капилляров, тормозят миграцию нейтрофилов и макрофагов в очаг воспаления и их фагоцитарную активность, угнетают пролиферацию фибробластов и синтез коллагена.
Иммуномодулирующее и противоаллергическое действие
Глюкокортикоиды угнетают пролиферацию лимфоидной ткани и клеточный иммунитет, что лежит в основе их применения при пересадке органов и тканей. Глюкокортикоиды тормозят образование и нарушают кинетику Т-лимфоцитов (в большей степени Т-хелперов, чем Т-супрессоров), снижают их цитотоксическую активность. В-лимфоциты более устойчивы к действию глюкокортикоидов, но введение высоких доз метилпреднизолона ведет к снижению концентрации иммуноглобулинов, что связано с первоначальным усилением их катаболизма и последующим торможением синтеза. В то же время, у больных с иммунодефицитом Глюкокортикоиды снижают супрессорную активность лимфоцитов, восстанавливая тем самым уровень иммуноглобулинов. Глюкокортикоиды препятствуют взаимодействию иммуноглобулинов с тучными клетками, макрофагами, ингибируя высвобождение из них биологически активных веществ.
В последние годы выявлена способность глюкокортикоидов влиять на систему цитокинов, синтез которых моноцитами и макрофагами имеет важное значение для иммунорегуляции и развития воспаления. Глюкокортикоиды подавляют выработку так называемых «провоспалительных» цитокинов (интерлейкины 1, 6 и 8, фактор некроза опухолей), которые участвуют в механизмах иммунного ответа, влияя, в частности, на Т-клеточное распознавание антигенов. Этим цитокинам отводят большую роль в патогенезе ревматических заболеваний, бактериального менингита.
Кровь
Глюкокортикоиды вызывают лимфоцитопению, моноцитопению и эозинопению. В то же время, они стимулируют образование эритроцитов и тромбоцитов.
Эндокринная система
Отмечается угнетение гипоталамо-гипофизарно-надпочечниковой системы, обусловленное механизмом отрицательной обратной связи. Оно более выражено при длительном применении глюкокортикоидов и/или использовании препаратов, обладающих продолжительным действием.
Кроме того, глюкокортикоиды вызывают снижение выработки половых гормонов, которое является результатом прямого ингибирования их синтеза и уменьшения продукции лютеинизирующего гормона гипофиза. Уменьшение уровня половых гормонов рассматривается как один из факторов развития глюкокортикоидного остеопороза.
ФАРМАКОКИНЕТИКА
Всасывание
При приеме внутрь глюкокортикоиды всасываются быстро и практически полностью в верхних отделах тощей кишки. Максимальная концентрация в крови отмечается через 0,5-1,5 часа. Пища несколько замедляет скорость их всасывания, но не уменьшает его степень.
Инъекционные формы глюкокортикоидов выпускаются в виде различных эфиров. Наиболее распространенными являются сукцинаты, гемисукцинаты, фосфаты, ацетаты. Сукцинаты, гемисукцинаты и фосфаты водорастворимы и при парентеральном введении обладают быстрым и относительно кратковременным действием. В неотложных ситуациях они являются препаратами выбора и вводятся внутривенно. При внутримышечном введении максимальный эффект развивается через 1-2 часа. Среди водорастворимых существуют и такие эфиры, которые представляют собой пролекарства, например, метилпреднизолона сулептанат. После внутривенного введения он быстро гидролизуется с высвобождением активного метилпреднизолона.
Распределение, метаболизм, экскреция
Экскреция метаболитов осуществляется почками. При почечной недостаточности коррекция дозы не производится.
НЕЖЕЛАТЕЛЬНЫЕ РЕАКЦИИ
При системной терапии глюкокортикоидов в фармакологических дозах нежелательные реакции могут включать изменения со стороны многих органов и систем (табл. 1). Риск их появления, как правило, повышается с увеличением доз и длительности применения глюкокортикоидов. В зависимости от частоты, условий возникновения и, следовательно, клинической значимости, нежелательные реакции, обусловленные системным применением глюкокортикоидов, подразделяются на несколько групп (табл. 2).
Современные методы применения глюкокортикоидов (альтернирующая терапия, пульс-терапия), их ингаляционное и внутрисуставное введение позволяют не только уменьшить частоту развития нежелательных реакций, но и повысить эффективность терапии. Однако при любой схеме терапии необходимо проводить контроль за нежелательными реакциями.
Методы контроля нежелательных реакций
Наиболее выраженные изменения отмечаются в первые 6 месяцев, причем назначение препаратов через день (альтернирующая схема) не ослабляет костных поражений. Для профилактики и лечения рекомендуются препараты кальция, витамин Д, тиазидовые диуретики с одновременным ограничением потребления натрия, бифосфонаты, половые гормоны [2].
Инфекционные осложнения терапии глюкокортикоидами
Инфекционным осложнениям (бактериальным, вирусным, грибковым, паразитарным) особенно подвержены больные с исходными нарушениями иммунитета. При их развитии, помимо проведения специфической терапии, необходимо попытаться снизить дозы глюкокортикоидов или перевести больного на альтернирующую терапию.
Бактериальные инфекции возникают наиболее часто. Проявляются, как правило, в форме пневмонии или септицемии. Основными возбудителями являются стафилококки и грам(-) бактерии кишечной группы. Это надо иметь в виду при выборе эмпирической антибактериальной терапии.
Туберкулез. Больные с положительными туберкулиновыми реакциями подвержены риску развития тяжелой формы туберкулеза, поэтому при длительной терапии глюкокортикоидами они должны с профилактической целью получать изониазид.
Вирусные инфекции. Применение глюкокортикоидов повышает риск диссеминации вирусных инфекций, отмечены случаи смерти от ветряной оспы и других герпетических инфекций. Поэтому при контакте с больным ветряной оспой или опоясывающим лишаем пациент, ранее не болевший ими, в течение 48 часов должен получить специфический иммуноглобулин. При развитии этих инфекций следует провести лечение ацикловиром внутривенно в течение 7 дней.
Если курс терапии глюкокортикоидов превышает 2 недели, то у таких больных не рекомендуется применять живые вирусные вакцины.
Таблица 1. Нежелательные реакции при использовании глюкокортикоидов
|
Таблица 2. Время и условия возникновения нежелательных реакций при использовании глюкокортикоидов (По Boumpas D.T. и соавт., 1993) [3]
* ГГНС гипоталамо-гипофизарно-надпочечниковая система
ВТОРИЧНАЯ НАДПОЧЕЧНИКОВАЯ НЕДОСТАТОЧНОСТЬ
К наиболее тяжелым осложнениям терапии глюкокортикоидов, потенциально опасным для жизни, относится вторичная надпочечниковая недостаточность, которая является следствием угнетения гипоталамо-гипофизарно-надпочечниковой системы при длительном применении глюкокортикоидов, особенно при несоблюдении принципов длительного их назначения.
Факторы риска угнетения гипоталамо-гипофизарно-надпочечниковой системы
Доза. При приеме глюкокортикоидов в физиологических дозах (у взрослого 2,5-5 мг/сутки преднизолона или 10-30 мг/сутки гидрокортизона) угнетения гипоталамо-гипофизарно-надпочечниковой системы не происходит. Если используются более высокие дозы, то уже через 1-2 недели отмечается функциональное угнетение коры надпочечников, а в дальнейшем развивается ее атрофия. Причем, полное восстановление функции коры надпочечников при курсе глюкокортикоидов 2-3 недели происходит только через 6-12 месяцев.
Длительность курса. При курсе глюкокортикоидов до 10 дней (в дозе не более 40 мг преднизолона в сутки) нет опасности значительного угнетения гипоталамо-гипофизарно-надпочечниковой системы, при приеме глюкокортикоидов в течение нескольких недель может возникнуть атрофия коры надпочечников.
Время приема. Необходимо учитывать циркадный ритм выработки глюкокортикоидов, поэтому опаснее давать 5 мг преднизолона вечером, чем 20 мг утром.
Вид препарата. В наибольшей степени угнетение гипоталамо-гипофизарно-надпочечниковой системы отмечается при приеме фторированных глюкокортикоидов триамцинолона, дексаметазона, бетаметазона, обладающих наиболее продолжительным действием.
Клиника синдрома «отмены» глюкокортикоидов
Тяжесть синдрома «отмены» зависит от степени сохранности функции коры надпочечников. В легких случаях у больных после отмены глюкокортикоидов появляются слабость, недомогание, быстрая утомляемость, потеря аппетита, мышечные боли, обострение основного заболевания, повышение температуры. В тяжелых случаях, особенно при больших стрессах, может развиться классический аддисонический криз, сопровождающийся рвотой, коллапсом, судорогами. Без введения глюкокортикоидов больные быстро погибают от острой сердечно-сосудистой недостаточности.
Меры профилактики вторичной надпочечниковой недостаточности
МОДИФИКАЦИЯ ДЕЙСТВИЯ ГЛЮКОКОРТИКОИДОВ
Лекарственные факторы
Повышение активности глюкокортикоидов отмечается при сопутствующем назначении эритромицина (замедляет метаболизм глюкокортикоидов в печени), салицилатов (увеличение не связанной с белками фракции глюкокортикоидов), эстрогенов.
Ослабление эффекта глюкокортикоидов наблюдается при параллельном приеме индукторов микросомальных ферментов печени фенобарбитала, дифенина, рифампицина и других. Наряду с модификацией действия глюкокортикоидов под влиянием других лекарственных средств следует помнить, что глюкокортикоиды сами могут изменять активность ряда лекарств:
Нелекарственные факторы
Повышение активности глюкокортикоидов с возрастанием опасности развития нежелательных реакций отмечается при гипоальбуминемии, острых заболеваниях печени, гипотиреозе, повышении уровня эстрогенов.
Снижение активности глюкокортикоидов наблюдается при гипертиреозе.
ОБЩИЕ ПОКАЗАНИЯ К НАЗНАЧЕНИЮ ГЛЮКОКОРТИКОИДОВ
Существует три принципиально различных вида глюкокортикоидной терапии.
Заместительная терапия
Применение глюкокортикоидов при надпочечниковой недостаточности любой этиологии, когда используют физиологические дозы глюкокортикоидов. Для заместительной терапии хронической надпочечниковой недостаточности глюкокортикоиды могут применяться в течение всей жизни. При этом кортизон или гидрокортизон вводятся с учетом циркадного ритма 2/3 дозы утром и 1/3 вечером. Другие глюкокортикоиды принимают один раз в день утром.
Супрессивная терапия
Применение глюкокортикоидов при адреногенитальном синдроме в фармакологических (супрафизиологических) дозах, что ведет к подавлению секреции адренокортикотропного гормона и последующему снижению гиперсекреции андрогенов корой надпочечников. В этом случае только 1/3 суточной дозы кортизона или гидрокортизона дается утром, а 2/3 дозы вечером. Другим вариантом является назначение глюкокортикоидов равными дозами 3 раза в день.
Фармакодинамическая терапия
Представляет собой наиболее частый вариант использования глюкокортикоидов, которые при этом также назначают в фармакологических дозах. Фармакодинамическая терапия подразделяется на системную и местную. При системной терапии следует учитывать два принципиальных положения:
При проведении системной фармакодинамической терапии могут быть использованы различные пути введения и режимы дозирования глюкокортикоидов в зависимости от тяжести состояния больного (табл. 3).
Таблица 3. Режимы дозирования глюкокортикоидов при системной фармакодинамической терапии (Applied Therapeutics, 1995) [8]
|
ПРОТИВОПОКАЗАНИЯ
Противопоказания для назначения глюкокортикоидов (табл. 4) являются только относительными и должны приниматься во внимание при планировании длительной терапии. В неотложных ситуациях глюкокортикоиды вводят без учета противопоказаний.
Таблица 4. Относительные противопоказания к назначению глкокортикоидов.

