Миодистрофия дюшенна что это такое лечение
Миодистрофия Дюшенна: что это такое?
Время чтения: 10 мин.
Доктор медицинских наук, президент благотворительного фонда «Гордей» и бабушка Гордея, мальчика с диагнозом миодистрофия Дюшенна, Татьяна Андреевна Гремякова рассказывает о том, что это за болезнь, почему ее часто принимают за гепатит, и что необходимо делать, чтобы дети с этим диагнозом как можно дольше сохраняли активность и жили полной жизнью.
Мышечная дистрофия Дюшенна (МДД) — одно из наиболее распространенных среди редких (орфанных) генетических фатальных нейромышечных заболеваний. В большинстве случаев оно встречается только у мальчиков.
Заболевание развивается вследствие мутации гена, который отвечает за синтез белка дистрофина. У детей прогрессирует повреждение и дегенерация мышц. Со временем мышцы слабеют до такой степени, что дети/подростки не могут самостоятельно передвигаться — в возрасте 10-15 лет мальчики садятся в инвалидную коляску. Параллельно у них развиваются кардиореспираторные нарушения — проблемы с сердцем и дыханием. В возрасте 15-20 лет им уже требуется респираторная поддержка: вначале только ночью, а в дальнейшем – круглосуточно.
Сегодня, благодаря профилактике формирования контрактур, сколиоза и кардиомиопатии, применению стероидов, внедрению респираторной поддержки и другим превентивным мерам, удалось существенно продлить функциональную активность пациентов,
качество и продолжительность их жизни.
Ожидаемая продолжительность жизни мальчиков с МДД, рожденных в последние годы в развитых странах (при условии, что им доступна современная реабилитация, терапия и респираторная поддержка), — 30-40 лет.
Болезнь в большинстве случаев передается от матерей, но сами женщины от нее практически не страдают: они бессимптомные или малосимптомные носители дефектного гена. Ген может передаваться по женской линии многие поколения и никак не проявляться, поэтому рождение ребенка с дистрофией Дюшенна для семьи часто становится неожиданностью. В трети случаев болезнь – результат спонтанной мутации плода без семейной истории.
В начале болезнь распознать трудно: симптомы проявляются не сразу и нарастают постепенно. Чаще всего до четырех-пяти лет врачи и родители считают, что малыш здоров. У ребенка могут быть некоторые задержки двигательного и речевого развития, он может быть неуклюжим, часто падать и быстро уставать. Мальчик с МДД не бегает так быстро, как сверстники, не прыгает. Родителям зачастую видны некоторые особенные нюансы взросления, но никаких «красных флагов», которые позволили бы серьезно обеспокоиться, нет довольно долго.
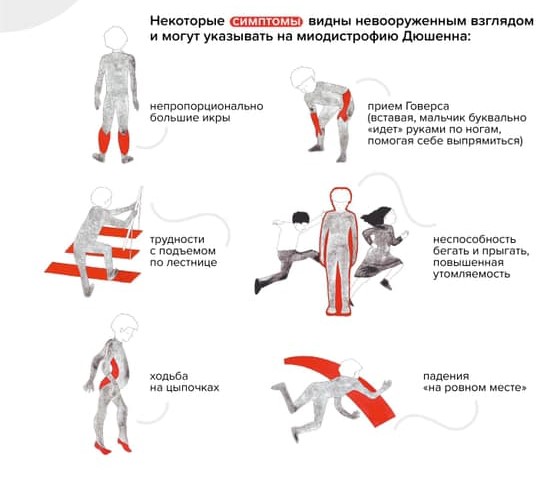
Ребенок растет, со временем меняется его походка и осанка. Можно заметить, что он ходит на носочках. Ему трудно вставать с пола — поднимается, опираясь на руки (прием Говерса).
«Прием Говерса» и другие вероятные признаки наличия у ребенка миодистрофии Дюшенна / Фонд «Гордей»
Обращает на себя внимание увеличение икроножных мышц. Позднее трудности при ходьбе нарастают: ребенок с трудом поднимается по лестнице, у него совсем нет сил. В какой-то момент он вовсе перестает ходить и садится в инвалидную коляску.
Если есть сомнения относительно здоровья мальчика, то первое, что нужно сделать, — анализ крови на активность креатинфосфокиназы (КФК). Это фермент, содержащийся в скелетных мышцах, маркер их распада. Обычно при МДД он бывает выше нормы во много раз — например, несколько десятков тысяч единиц при норме в сотню.
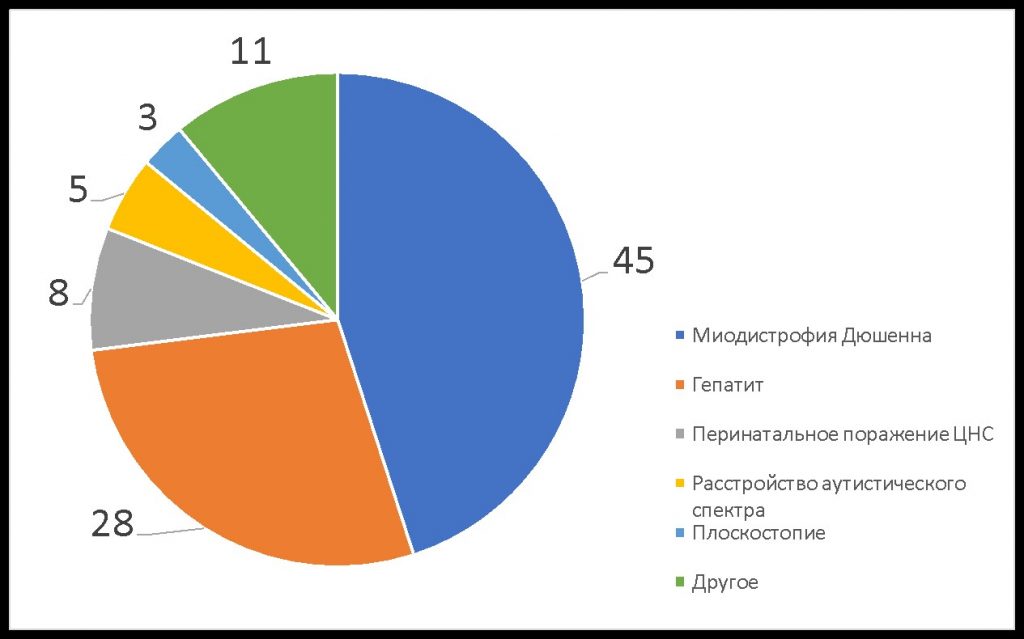
МДД — редкое заболевание. Врачи могут ни разу за свою практику не столкнуться с ним и не знать, что делать. Часто ребенку ошибочно ставят диагноз гепатит, перинатальное поражение ЦНС и/или аутизм и назначают лечение, подчас ускоряющее прогрессирование Дюшенна (Рис. 1).
Рис. 1. Результаты опроса
200 родителей (%): «Какой первый диагноз был поставлен мальчику с миодистрофией Дюшенна в первичном поликлиническом звене?»
Почему гепатит — самый частый из неверных диагнозов? При МДД в крови повышаются уровни трансаминаз, что ошибочно принимается за симптоматику гепатитов. Но эти ферменты в случае МДД мышечного, а не печеночного происхождения.
Если выявлено увеличение уровня КФК выше критического (более 2000 ед), необходимо делать генетический анализ и искать мутацию в гене дистрофина.
Информация для медицинских специалистов
Ген дистрофина — один из самых больших в человеческом организме. Он состоит примерно из 2,5 млн пар нуклеотидов, содержит 79 экзонов, размер гена 2,2 Мб. Уровень мутаций гена относительно высок: в одном из трех случаев МДД вызывается мутацией de novo (впервые возникшее изменение, в отличие от унаследованного – прим.ред). Таким образом, новые случаи возникают даже при наличии хороших инструментов пренатальной диагностики и семейного консультирования для известных случаев.
Высокая частота мутаций также лежит в основе большого разнообразия мутаций, выявленных у пациентов с МДД. Наиболее часто встречаются делеции (
68%), затем по частоте идут дупликации (
11%) одного или нескольких экзонов, реже обнаруживаются небольшие мутации (∼20% пациентов). Мутации могут происходить на любом участке гена, но делеции чаще сконцентрированы между экзонами 45–55, а дупликации — между экзонами 2–10. Тип и расположение мутации определяют ход течения заболевания и то, какое лечение требуется больному.
Сейчас в России применяется специфическая молекулярно-генетическая диагностика повреждения гена дистрофина, определение мутации в каждом конкретном случае.
Генетическое тестирование позволяет точно поставить диагноз. Ранняя и прецизионная диагностика больных МДД необходима для правильного сфокусированного назначения этиопатогенетической терапии. Фактически каждому такому ребенку требуется персонализированная терапия в зависимости от типа и локализации мутации гена.
Бесплатная генетическая диагностика проводится больным с диагнозом МДД, а также бессимптомным пациентам с высокими значениями КФК (более 2000 ЕД\л) с 2019 года. Ограничений по возрасту исследуемых больных нет.
Как попасть на генетическую диагностику?
Диагностику проводят в ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова». Направить на диагностику может только врач. Для этого он должен позвонить на Горячую линию по номеру 8-800-100-17-60 (линия предназначена исключительно для врачей) и зарегистрировать пациента в программе бесплатного генотипирования. В этом случае транспортные услуги по перевозке биоматериалов также будут бесплатны.
Только в 30% случаев больной ребенок рождается в результате спонтанной мутации. В 70% случаев носителем мутации является мама ребенка, которая, как правило, не знает об этом.
При планировании беременности женщинам желательно сделать генетический тест на носительство МДД. В некоторых странах такой тест обязателен.
Оценка функциональной активности ребенка позволяет понять его состояние и спрогнозировать дальнейшее течение заболевания. Для этого заболевания нет биохимических маркеров течения болезни. Изменение функциональной и физической активности у детей с МДД выражается в числовых значениях. Это позволяет понять степень выраженности болезни и динамику ее клинической симптоматики.
Если ребенок ходит, его состояние оценивают по методу The North Star (NSAA). Дополнительно оценивается расстояние, пройденное за 6 минут, и время подъема и спуска с четырех ступеней.
Для тех, кто потерял способность ходить, есть метод оценки работы рук — Performance of Upper Limb (PUL) test.
Физическая терапия и реабилитация — основа ухода за больными с МДД на протяжении всей жизни. Она нужна, чтобы поддерживать физическую активность и функциональность.
Современная реабилитация ориентирована:
На более поздних этапах болезни это:
Тутора для ребенка с миодистрофией Дюшенна / Фонд «Гордей»
Для сохранения способности ходить важно следить за постановкой ног ребенка на полную стопу, а также уделять внимание растяжке, особенно мышц голеностопа. Иначе через некоторое время мальчик сможет ходить только на цыпочках, и тогда ему понадобится коляска.
Занятия в бассейне / Фонд «Гордей»
Если не заниматься физической терапией, ребенок может потерять способность ходить рано и сесть в коляску в 7-8 лет.
В результате начнутся серьезные изменения, в первую очередь, позвоночника: сильный сколиоз, требующий операции на позвоночнике, пострадают сердце и дыхание.
Реабилитация и физическая терапия способны надолго продлить двигательную активность больного.
Позиционирование на стадии коляски фокусируется на том, чтобы сохранить правильное положение тела и ног, не допустить развития сколиоза и контрактур в суставах, сохранить максимальный объем движений рук.
В наиболее тяжелой стадии заболевания важна респираторная реабилитация.
Медицинская помощь
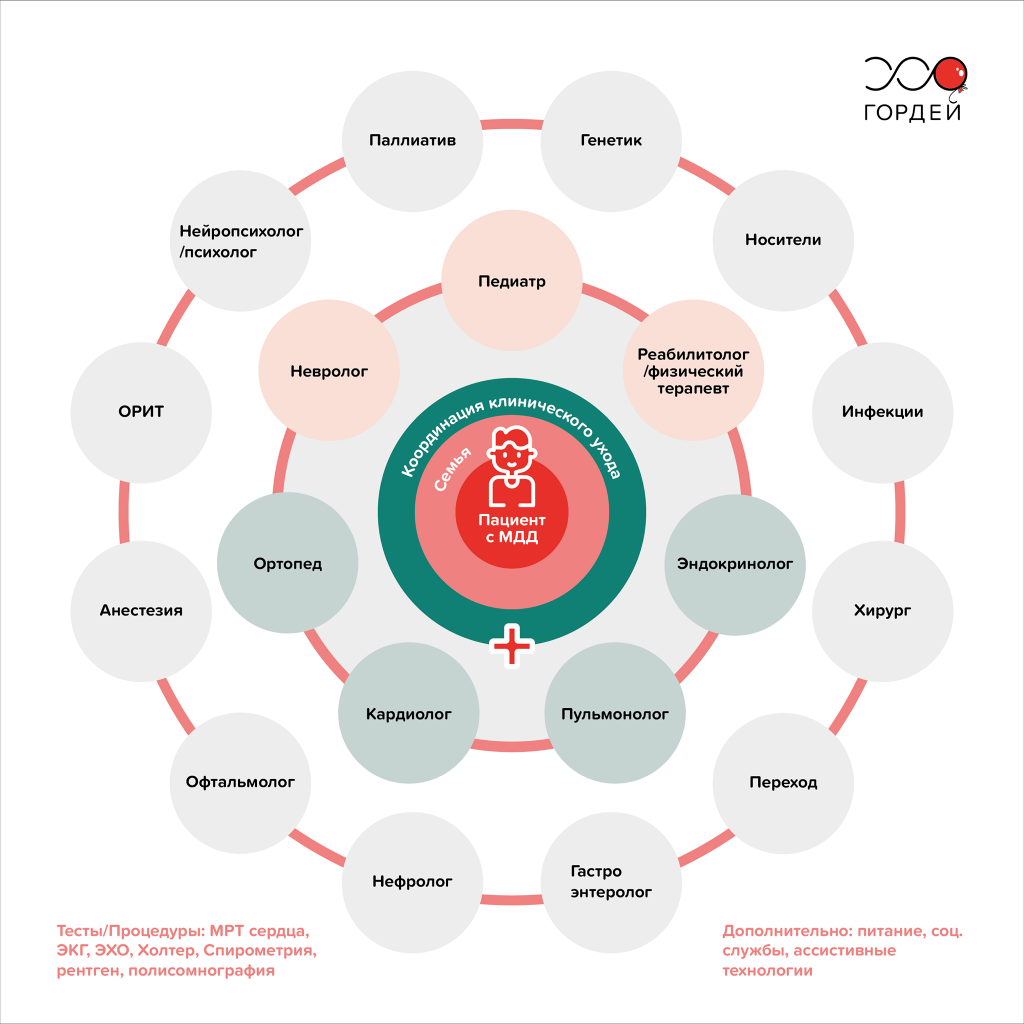
Миодистрофия Дюшенна — прогрессирующее заболевание, которое со временем поражает многие системы и органы человека. А значит, вести пациента с МДД должна мультидисциплинарная команда врачей под руководством специалиста по нервно-мышечным заболеваниям (например, педиатр или детский невролог).
По мере взросления ребенка эта функция переходит к неврологу, работающему со взрослыми пациентами. Следует заранее определить необходимых специалистов, чья помощь понадобится уже взрослому пациенту.
В современной медицинской и паллиативной концепции ведения пациентов с МДД считается важным ориентироваться на его семью: общаться, координировать уход, информировать об ожидаемых изменениях, связанных с болезнью.
Какие врачи ведут пациента с МДД
| Специалист | Сфера ответственности |
|---|---|
| Невролог | Комплексное ведение болезни на протяжении всей жизни. |
| Реабилитолог | Упреждение развития контрактур и деформации, минимизация боли, продление функциональности и способности к передвижению. |
| Ортопед/Хирург | Поддержка двигательных функций как можно дольше, минимизация контрактур суставов, поддержка позвоночника в прямом положении. |
| Эндокринолог (поддержание костного здоровья) | Уменьшение прогрессирования остеопороза, восстановление при ранних признаках остеопороза. |
| Эндокринолог (рост и половое созревание) | Минимизация нарушений роста, коррекция пубертатного развития, развитие и предотвращение опасного для жизни криза надпочечников. |
| Пульмонолог | Уменьшение респираторных осложнений и сохранение функции дыхательных мышц. |
| Кардиолог | Максимальное продление работы сердца, упреждение формирования сердечной недостаточности и других отклонений. |
| Гастроэнтеролог и диетолог | Профилактика недостаточного или плохого питания, избыточного веса и ожирения. |
| Психолог | Психосоциальная поддержка на протяжении всей жизни, помощь в планировании будущего и формировании представлений о том, как пациенты будут активно участвовать в уходе за собой и ежедневной деятельности. |
| Паллиативная помощь | Симптоматическая терапия, предоставление технических средств реабилитации и медицинских изделий, социальная поддержка. |
Рис. 2. Схема организации мультидисциплинарного ухода за пациентами с миодистрофией Дюшенна на протяжении всей жизни / Фонд «Гордей»
Транзит во взрослую медицину и жизнь
Человек с заболеванием, которое начинается в детском возрасте и ведется детскими врачами, взрослея, переходит во взрослую медицинскую и паллиативную службу. Переход обычно происходит в возрасте от 17 лет до 21 года, в зависимости от системы здравоохранения. Однако, чем старше становится больной с МДД, тем больше он нуждается в медицинской помощи и уходе — ведь болезнь прогрессирует. А значит, без поддержки семьи и медиков не обойтись.
К сожалению, не все больные МДД смогут перейти к самостоятельной и долгой взрослой жизни. Первая причина: около трети молодых взрослых с МДД испытывают психосоциальные трудности или страдают когнитивными нарушениями, которые ограничивают самостоятельность и независимость. Вторая причина: различное течение заболевания.
Обе причины зависят от множественности мутаций гена дистрофина: от чрезвычайно злокачественной, когда дети вовсе не научаются ходить, до доброкачественной, похожей по течению и сроку жизни на миодистрофию Беккера (Birnkrant DJ, Bushby KM, Bann CM, и др., Диагностика и ведение пациентов с мышечной дистрофией Дюшенна, часть 3: первичная помощь, неотложная помощь, психосоциальная помощь и преемственность в оказании помощи на протяжении жизни пациента., The Lancet Neurology, 2018; том 17: 445-55′).
И все же для большинства молодых взрослых с МДД следует прогнозировать полноценное участие в планировании будущего и принятии решений.
Есть ли лекарство?
Сделать лекарство для МДД сложно: один препарат не вылечит всех, как при СМА. Больные МДД, как снежинки: нет одинаковых — уже описано около десяти тысяч мутаций гена. Поэтому болезнь по-разному проявляется — даже в одной семье у двух братьев.
Уже есть одобренные патогенетические лекарства, а препарат для коррекции нонсенс-мутаций в ноябре 2020 года зарегистрирован в России. Несколько препаратов находятся в третьей стадии клинических исследований. Одна из самых обнадеживающих перспектив — доставка в мышечную клетку исправленной укороченной копии гена дистрофина с помощью AAV вирусов: именно они могут перенести нужный фрагмент ДНК.
Какие перспективы?
Дети, которым диагноз «миодистрофия Дюшенна» ставится сегодня, будут жить по-другому — лучше и дольше, чем больные, рожденные 10-20 лет назад. Разработаны международные стандарты ухода, накоплен большой опыт, позволяющий предупредить развитие тяжелых осложнений болезни, продлить стадию функциональной активности ребенка, на горизонте — генетическая терапия, которая подойдет многим. Уже сейчас доступны четыре патогенетических препарата для определенных мутаций. В 2020 году в России зарегистрирован первый препарат для лечения миодистрофии Дюшенна — Аталурен.
Кто поможет?
Фонд «Гордей» создала семья, в которой растет Гордей — семилетний мальчик с миодистрофией Дюшенна. Цель фонда – улучшить на системном уровне качество диагностики, ведения, ухода, реабилитации и лекарственного обеспечения больных МДД.
Гордей с мамой, Ольгой Гремяковой. Фото из личного архива / Facebook
Одна из основных задач фонда – информирование и повышение осведомленности о миодистрофии Дюшенна врачебного и родительского сообщества. Чтобы практикующие и будущие педиатры, детские неврологи, медработники детских садов и школ знали о симптомах заболевания, а профильные специалисты имели возможности для обучения, стажировок, обмена опытом и в своей работе опирались на международные стандарты ухода и лучшие мировые практики.
Президент фонда «Гордей», доктор медицинских наук и бабушка Гордея, Татьяна Андреевна Гремякова ежемесячно проводит Школу для родителей вновь диагностированных детей с Дюшенном: отвечает на вопросы, помогает родителям понять, что именно они могут сделать для своего ребенка уже сегодня и что происходит в науке и медицине по данной нозологии.
Учредитель фонда «Гордей», психолог и мама Гордея, Ольга Гремякова два раза в месяц проводит «Передышку» — группу поддержки для мам и пап и вебинары, помогающие родителям развивать жизнестойкость, справляться со стрессом, возвращать себе контроль над своей жизнью. Для родителей вновь диагностированных мальчиков есть индивидуальные консультации с психологом.
Чтобы записаться на ближайшую Школу, «Передышку» или на индивидуальную психологическую консультацию, нужно написать по адресу: go@dmd-russia.ru
Сообщество фонда «Гордей» в Фейсбуке.
Сообщества по таргетной (подходящей для определенных мутаций) терапии:
Для родителей детей с «нонсенс-мутацией».
Для родителей детей с одной из делеций, корректируемых пропуском экзона 45.
Для родителей детей с одной из делеций, корректируемых пропуском экзона 51.
Для родителей детей с одной из делеций, корректируемых пропуском экзона 53.
С МДД также работают следующие организации:
Федеральные центры, работающие с МДД:
Материал подготовлен с использованием гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Прогрессирующая мышечная дистрофия Дюшенна
Прогрессирующая мышечная дистрофия Дюшенна — наследуемая сцеплено с Х-хромосомой патология мышечной системы, проявляющаяся в первые 3-5 лет жизни и характеризующаяся быстро распространяющейся и усугубляющейся мышечной слабостью. Первоначально поражаются мышцы тазового пояса и бедер, затем — плеч и спины, постепенно наступает обездвиженность. Миодистрофия сопровождается скелетными деформациями и поражением сердца. Диагностика дистрофии Дюшенна включает неврологическое и кардиологическое обследование, определение уровня КФК, электромиографию, консультацию генетика, ДНК-анализ, биопсию мышц. Лечение симптоматическое. В связи со слабостью дыхательной мускулатуры на заключительном этапе заболевания требуется ИВЛ.
Общие сведения
Причины
Развитие мышечной дистрофии Дюшенна связано с наличием мутации в 21-ом локусе короткого плеча Х-хромосомы в гене, кодирующем белок дистрофин. Около 70% случаев болезни вызваны дефектным геном дистрофина, полученным от матери — носительницы патологической мутации. Остальные 30% связаны с появлением свежих мутаций в яйцеклетках матери. В отличие от миодистрофии Беккера, при дистрофии Дюшенна генетические аберрации приводят к сдвигу рамки считывания ДНК и полному прекращению синтеза дистрофина, что и обуславливает более тяжелое течение патологии.
В норме входящий в сарколемму миоцитов дистрофин обеспечивает ее целостность и устойчивость к растяжению, возникающему при сократительной активности мышечных волокон. Отсутствие дистрофина влечет за собой нарушение целостности сарколеммы, разрушение миоцитов и их замещение жировой и соединительной тканью. Клинически этот процесс выражается прогрессирующим снижением способности мышц к сокращению, утратой мышечной силы и тонуса, атрофией мышц.
Симптомы
Дебют миодистрофии Дюшенна приходится на период от 1 до 5 лет. Как правило, уже на 1-ом году жизни заметно некоторое отставание моторного развития ребенка. Отмечается задержка сроков начала сидения, самостоятельного вставания и ходьбы. Когда ребенок начинает ходить, он отличается неуклюжестью и большей, по сравнению со сверстниками, неустойчивостью; часто спотыкается.
Мышечная слабость возникает на 3-4-ом годах жизни. Первоначально она выражается в патологически повышенной утомляемости при ходьбе по лестнице или на длинные расстояния. Со временем становится заметной типичная для миодистрофий утиная походка. Обращают на себя внимание особенности поведения ребенка — каждый раз, поднимаясь из положения сидя на корточках, он активно опирается руками о собственное тело, как бы взбираясь по нему как по лесенке (симптом Говерса).
Мышечные атрофии начинаются с мышц бедер и тазового пояса. Для дистрофии Дюшенна характерно их быстрое восходящее распространение на плечевой пояс, мускулатуру спины и проксимальных отделов рук. Вследствие мышечных атрофий формируется «осиная» талия и отстоящие от спины «крыловидные» лопатки. Типичным симптомом выступает псевдогипертрофия икроножных мышц. Наблюдается выпадение сухожильных рефлексов: вначале — коленных, затем — рефлексов с трицепса и бицепса плеча. Ахилловы и карпорадиальные рефлексы могут длительное время быть сохранны. Со временем развиваются ретракции сухожилий и мышечные контрактуры.
Прогрессирующая мышечная дистрофия Дюшенна сопровождается нарушениями в костно-суставной системе. Характерны искривление позвоночника (кифоз, усиленный лордоз, сколиоз), деформации грудной клетки (килевидная или седловидная), деформации стоп. Сердечно-сосудистые расстройства обусловлены развитием кардиомиопатии и включают аритмию, лабильность артериального давления, глухость тонов сердца. У 50% больных фиксируются нейроэндокринные расстройства — адипозогенитальная дистрофия, синдром Иценко-Кушинга и др. Около 30% больных страдает олигофренией, как правило, ограничивающейся степенью дебильности. Могут отмечаться СДВГ, расстройства по типу аутизма, дислексия, нарушения краткосрочной памяти.
Осложнения
Уже к 7-10-летнему возрасту дистрофия Дюшенна приводит к выраженным двигательным ограничениям. К 12 годам больные, как правило, утрачивают способность ходить, а к возрасту 15 лет большинство пациентов полностью теряют возможность самостоятельных движений. Распространение дистрофического процесса на дыхательную мускулатуру приводит к прогрессирующему падению жизненной емкости легких (ЖЕЛ) и, в конечном итоге, невозможности совершать дыхательные движения.
Диагностика
Установить диагноз миодистрофии Дюшенна помогает анамнез, неврологическое обследование, результаты электрофизиологического тестирования, определение креатинфосфокиназы (КФК) в биохимическом анализе крови, морфологическое и иммунохимическое исследование образцов мышечной ткани, генетическое консультирование и анализ ДНК:
При этом дифференциальную диагностику следует проводить с другими миопатиями — метаболической, воспалительной, миодистрофией Беккера, мышечной дистрофией Дрейфуса, дистрофией Эрба-Рота, а также с полиневропатиями, полимиозитом, БАС.
Лечение мышечной дистрофии Дюшенна
Стандартная терапия
Терапия, применяемая в клинической практике, включает симптоматическое и патогенетическое направление. В рамках данных направлений применяется медикаментозная терапия, физическая реабилитация, респираторная поддержка:
Экспериментальная терапия
Прогноз и профилактика
Профилактические мероприятия направлены на выявление женщин-носительниц аномального гена дистрофина и предупреждение рождения у них больного ребенка. В рамках профилактических мер проводятся консультации генетика для планирующих беременность супружеских пар, консультации беременных и пренатальная ДНК-диагностика.
«Ты особенный малыш»: что делать, если у ребенка миодистрофия Дюшенна
Мышечная дистрофия Дюшенна (МДД) – редкое генетическое заболевание, которое обычно поражает мальчиков (примерно одного из 3500–5000). Болезнь развивается из-за мутаций в гене дистрофина и разрушает мышцы: сначала ребенок перестает ходить, а со временем и дышать. Пока заболевание остается неизлечимым.
Эту болезнь врачи в России часто диагностируют поздно. Ольга Гремякова, мама семилетнего Гордея, сама догадалась, что у ее сына миодистрофия Дюшенна: заметила симптомы, нашла информацию и отвезла сына к врачам, которые подтвердили ее опасения.
Ольга и ее семья создали благотворительный фонд «Гордей», чтобы улучшать качество медицинской, социальной и психологической помощи пациентам с МДД и их семьям. В декабре фонд провел первую в России конференцию для родителей и врачей, посвященную миодистрофии Дюшенна.
Поговорили с Ольгой о том, как распознать болезнь и с чем сталкиваются пациенты с МДД и их семьи после постановки диагноза.
От первых симптомов до диагноза
Прислушиваться к себе
Я видела, что Гордей отличается от других ребят, но не понимала, почему. До трех лет он не разговаривал. Был немного неуклюжий, не умел прыгать и бегать. Мне говорили, что причина в тяжелых родах, поэтому нужно немного подождать, и он перерастет эту неуклюжесть. Либо мягко намекали на то, что я просто тревожная мама, которая беспокоится за своего первого малыша. Когда мы проходили обследования перед детским садом, все специалисты в очередной раз сказали, что сын здоров. Не насторожился никто – ни врачи, ни моя мама, доктор медицинских наук.
Кроме того, Гордей был и остается очень требовательным и чувствительным ребенком, с ним сложно взаимодействовать. Родные говорили, что это я воспитала его таким: он капризный и просится на ручки не из-за усталости, а потому что манипулирует. Ну что скажешь в этот момент? Я действительно думала, что сама виновата. Тогда я не знала, что эти особенности тоже связаны с его болезнью.
Заметить симптомы
Я услышала о миодистрофии Дюшенна за пару лет до того, как ее диагностировали у Гордея. Это была история Ольги и Петра Свешниковых – учредителей фонда «Мой Мио», которые усыновили ребенка с МДД. Этот поступок вызвал у меня бесконечные уважение и восхищение. Но тогда я просто прочла об этом и продолжила жить дальше. Спустя какое-то время я увидела в фейсбуке историю папы и сына с МДД. После фразы «я смотрел на его икры, они были такие мускулистые, а сил-то в них не было» картинка в голове полностью сложилась. Я погуглила симптомы и поняла, что с моим ребенком.
Главный признак мышечной дистрофии – прогрессирующая мышечная слабость. Специфические симптомы появляются в разном возрасте и в разных группах мышц, в зависимости от типа мышечной дистрофии. Обычно первые признаки МДД проявляются к двум-трем годам. Ребенок может часто падать, медленно бегать, ходить на цыпочках или вразвалочку. Ему может быть сложно вставать с пола и подниматься по лестнице. Часто у ребенка с МДД непропорционально большие икры. Сначала слабость более выражена в мышцах бедер, но со временем она распространяется и на другие, включая мышцы, участвующие в дыхании. У ребенка может быть задержка двигательного и речевого развития, трудности в обучении. МДД также влияет на память, манеру общения и эмоциональное состояние.
Уже через пару часов Гордей сдал кровь. Как мы дожили до конца дня, я не помню. Ночью проснулась, проверила почту и нашла письмо от лаборатории: уровень креатинкиназы – 23076 при норме у мальчиков до 200!
На следующий вечер я укладывала сына спать и сказала ему: «Гордей, я теперь все про тебя знаю. Знаю, что ты устаешь, что у тебя не очень сильные мышцы, что ты такой вот особенный малыш». Гордюше тогда было четыре с половиной года. Он ничего не сказал, а просто тихонечко заплакал. Наверное, для него было важно, что его наконец понимают.
При подозрении на МДД берут анализ крови на креатинкиназу (КК) – фермент, который мышцы выделяют при повреждении. Высокий уровень КК – характерный признак миодистрофии Дюшенна. Для подтверждения диагноза используют генетические тесты – они находят крупные мутации в гене дистрофина. Если крупных мутаций не нашли, врачи сделают секвенирование (расшифровку последовательности) гена, чтобы найти мелкие точечные мутации.
Если обращать внимание на характерные симптомы, то диагностировать МДД можно рано – например, с года до двух. Но для этого врачи должны заметить признаки миодистрофии Дюшенна в потоке пациентов. По мнению Ольги, идеальным диагностическим решением было бы добавить к неонатальному скринингу тест на креатинкиназу – он простой и стоит около 400 рублей.
К сожалению, примерно половина мальчиков с МДД исходно получает неверный диагноз. Чаще всего гепатит, потому что из-за распада мышц растет уровень ферментов трансаминаз, что обычно соотносят с болезнью печени. Также мальчикам ставят перинатальное поражение ЦНС, аутизм, задержки двигательного и речевого развития и даже ДЦП. Иногда МДД диагностируют очень поздно – в возрасте от 8 до 12 лет, когда симптоматика становится заметной и папы начинают носить мальчиков на руках.
 |
Ольга с детьми. Фото из личного архива
Делать все возможное
Первое изменение в жизни моей семьи – это зашкаливающий уровень боли. Боли от диагноза нашего любимого малыша, которого еще пару дней назад мы считали здоровым. Вскоре у меня развилось состояние предвосхищающего горя: ты знаешь, что ребенок жив, но думая о его диагнозе, понимаешь – все предопределено. Рухнуло все: представление о счастливом материнстве, где я – мама двух прекрасных здоровых малышей, о будущем, где сын будет катать меня на машине и мы вместе будем делать всякие штуки. Рухнула моя идентичность – как мамы и как женщины.
Я плохо помню первые два года жизни после постановки диагноза. Через полгода у меня началась депрессия: не было сил даже на самые обычные дела, я чувствовала себя разбитой, ничто меня не радовало… Мое состояние заметила мама и настояла на обращении к врачу – сама я, несмотря на психологическое образование, депрессии у себя не заметила. Врачи помогли. Все же я не могла пару месяцев лежать лицом к стене – нужно было заниматься детьми.
Мы решили, что будем пользоваться каждым днем и делать для Гордея все возможное, чтобы он чувствовал себя лучше. Да, волшебной таблетки у нас нет, но мы в силах снизить риск контрактур (ограничение подвижности сустава – прим. авт.) голеностопа и других осложнений, которые усаживают мальчиков в коляску раньше.
Физические упражнения, растяжка и низкоинтенсивные аэробные нагрузки (ходьба и плавание) помогают пациентам с МДД сохранить мышечную силу и диапазон движений в суставах. Специальные изделия – туторы – могут поддерживать голеностопный сустав и стопы в правильном положении, замедлять прогрессирование контрактур. Чем дольше ребенок ходит и чем позднее понадобится коляска, тем лучше для сердца и дыхательной системы и тем ниже риск развития сколиоза, требующего оперативного вмешательства.
Чтобы вернуть себе ресурс и сражаться за ребенка, с первого дня учитесь делать ему растяжки ахиллового сухожилия, голеней и бедер – по 20–30 минут ежедневно. Благодаря таким занятиям мальчик сможет ходить дольше. Когда родитель «своими руками» продлевает ребенку активные годы, это очень важно для обоих.
От непонимания до взаимной поддержки
Совершенствовать систему
Со временем мы узнали, как устроена помощь пациентам с миодистрофией Дюшенна. Помимо небольших выплат государство предлагает мальчикам санаторно-курортное лечение. Но пока система плохо понимает, что именно нужно детям с МДД. На опыте Гордея могу сказать, что предлагают обычно не то и не там – хоть и очень стараются. Два раза в год мальчикам и юношам с миодистрофией положена реабилитация – и это не массажи и грязи. Она конечно есть, но далеко не везде соответствует международным стандартам. Более того, не везде она человечная. Иногда мамы с сыновьями сбегают с реабилитации, потому что еда плохая, обращение еще хуже, занятий нет.
Также существует ИПРА – индивидуальный план реабилитации (абилитации). В него вписывают технические устройства, предлагаемые государством, например коляски и туторы. Но часто эти устройства не подходят ребенку, и родители вынуждены покупать другие за свой счет – при этом стоимость компенсируют не всегда. Это очень чувствительный вопрос для семьи, и самые большие трудности возникают именно со средствами передвижения для неходячих мальчиков.
Получается, что государство помогает, но сами механизмы негибкие и нуждаются в пересмотре. По международным стандартам реабилитации ребятам с МДД нужны теплый бассейн, правильные растяжки, полный медицинский чекап и сильная мультидисциплинарная команда. Еще год назад в России не было центров, где могут все это предложить. Сейчас самый современный вариант – реабилитация в Центральной клинической больнице, программу которой разработали эксперты ЦКБ в сотрудничестве с нашим фондом. Она соответствует лучшим международным практикам и в этом смысле уникальна для России.
Но такой центр один, а мальчики с МДД рождаются по всей стране. Их примерно четыре тысячи, при этом для системы здравоохранения видны не более полутора тысяч. В любом случае, наших мальчиков слишком много для того, чтобы всех отправлять в Москву. Ребятам нужна реабилитация в региональных центрах, ведь многим из них сложно передвигаться. Поэтому наша задача – создавать такие центры и обучать специалистов на местах. Для этого нам нужно сильное пациентское сообщество и некоммерческие организации, которые будут влиять на неповоротливую государственную систему и улучшать ее работу.
Отстаивать интересы
Мы стремимся к тому, чтобы в России приняли клинические рекомендации по ведению пациентов с МДД. Хотим, чтобы мальчики и их семьи получали все виды помощи – медицинскую, социальную и психологическую, и чтобы эта помощь соответствовала международным стандартам.
Есть и другие организации, занимающиеся миодистрофией Дюшенна – фонд «Мой Мио» (6 лет) и Родительский проект (3 года). У каждой из них более 500 подопечных. Они реализуют медицинские и образовательные программы для пациентов с МДД, оказывают информационную, консультативную и адресную помощь семьям.
После постановки диагноза семьи сталкиваются с дефицитом информации в отношении препаратов, физической терапии, пищевых добавок и приема стероидов. Именно потребность узнать больше помогает родителям разобраться в разных аспектах заболевания, а значит – принимать лучшие решения в интересах своего ребенка и сохранять чувство контроля.
Еще один способ вернуть контроль – присоединиться к родительскому сообществу. Помимо информации в нем можно найти опору, общаясь с другими родителями. У фонда есть сообщество «ProДюшенн», в котором более четырехсот участников, среди которых родители и врачи. Все наши семьи разные: у одних маленькие мальчики с МДД, у других юноши, а есть семьи, где сыновья уже ушли. Но цель у всех одна – поддерживать друг друга и отстаивать интересы пациентов с Дюшенном при взаимодействии с государством.
Также для нас важно, чтобы мамы мальчиков с МДД и их дочери могли выбирать свое репродуктивное будущее и знали об этом. Болезнь развивается из-за мутаций, которые в 70% случаев возникают в Х-хромосоме матери и передаются сыновьям. Если в семье уже есть мальчик с МДД, другие дети также могут унаследовать мутацию. Но предимплантационная диагностика и ЭКО позволяют планировать рождение здоровых детей после появления малыша с МДД. И если я решусь на третьего ребенка, то, скорее всего, обращусь к этим методам. Девочкам, чьи мамы – носительницы мутаций в гене дистрофина, можно сделать анализ ДНК и проверить, передалась ли мутация.
 |
Команда фонда «Гордей». Фото из личного архива
Справиться с кризисом
При МДД родители сталкиваются со множеством кризисных ситуаций. Часто травматичной становится сама постановка диагноза, когда результат генетического теста присылают по почте, а врачи отвечают на звонки без особого желания. Мальчик может столкнуться с переломом и потом долго восстанавливаться, либо теряет способность ходить. Он может оказаться в кресле и без перелома, когда происходит срыв компенсации – снижение мышечной силы. Молодому человеку может потребоваться респираторная поддержка, и это тоже может быть кризисным моментом – как и любое изменение в жизни, указывающее на переход болезни в более тяжелую стадию. И конечно, в таких ситуациях лучше работать с психологом индивидуально.
Еще есть переходный возраст. Это сложное время для любой семьи, но особенно для родителей мальчиков с МДД. Если ребенок принимает кортикостероиды, он не очень сильно растет – а расти ему важно. Для этого придется снизить дозу гормонов, но тогда он начнет слабеть. И этот момент пересмотра лечения, отношений с ребенком и его личных границ тоже бывает очень непростым.
У ребенка с МДД могут быть трудности с учебой, агрессивное поведение, тревожное расстройство или депрессия. Если знать об этом и вовремя обратить внимание, многие вещи можно скорректировать и улучшить качество жизни ребенка и родителей.
Недавно фонд запустил проект психологической поддержки родителей «Передышка». Мы провели уже три встречи, в начале следующего года надеемся параллельно запустить «Передышку» для пап, где будет психолог-мужчина, а также индивидуальную психологическую поддержку.
Искать лечение
Создать универсальное лекарство для МДД сложно. Во-первых, ген дистрофина огромный, и в нем может быть очень много разных мутаций – известно уже около 10 тысяч. Во-вторых, лекарства доставляют в клетки с помощью вирусных векторов (генетических конструкций – прим.авт.), у которых есть определенная емкость. Можно поместить в вирус только фрагмент гена дистрофина. Кроме того, у части пациентов имеется предсуществующий иммунитет к самим вирусам. В-третьих, чтобы лекарство проникло в мышцы, оно должно попасть в общий кровоток – а значит, пройти через печень, которая постарается удалить его из организма. Возникает конфликт: врачи пытаются доставить лекарство в мышцы, а тело сопротивляется и пытается его вывести.
Но таргетные препараты уже появились – и это большая подвижка. Со временем должно появится лекарство, которое подойдет многим пациентам с МДД. Значит нам нужно выявлять болезнь как можно раньше, чтобы быстрее начинать лечение.
24 ноября 2020 года в России зарегистрировали первый таргетный препарат для лечения МДД – аталурен. Он подходит 13% пациентов с МДД, имеющим нонсенс-мутации – точечные замены в гене дистрофина. По словам производителя, лекарство помогает восстанавливать уровень дистрофина и замедлять прогрессирование болезни. Существуют и другие препараты – вайондис, вилтепсо и экзондис, но они также предназначены для пациентов с определенными мутациями.
Традиционное лечение МДД направлено на устранение симптомов. Для повышения мышечной силы и продления двигательной активности врачи назначают пациенту кортикостероиды, но они увеличивают риск переломов и со временем могут привести к набору веса и повышению давления. Для сохранения функций сердечной мышцы применяют ингибиторы ангиотензинпревращающего фермента (АПФ) или бета-блокаторы.
Найти общий язык
Сейчас Гордей учится в нулевом классе. Он чувствует, что справляется, и совершенно счастлив. У него есть друзья, его хвалят учителя. Гордей учится играть в шахматы, с удовольствием изучает испанский и осваивает скетчинг. Для него и других ребят с МДД очень важны вопросы образования, социальной среды и общения.
Так же важна реакция врача на ребенка с миодистрофией. Если врач общается с ним тепло, уважительно и без страха – это одна история. Но когда врачи боятся диагноза, избегают общения с ребенком и ведут себя скованно – и родители, и сами дети это чувствуют. И то, как реагируют на ребенка врачи, учителя, чиновники на комиссиях по инвалидности – это вовсе не «сходил и забыл». Чувствуется негласная стигма «идите умирайте дома, лекарства нет» – и мы должны с ней бороться. Во-первых, лекарства появляются, их будет больше, они будут лучше. Во-вторых, в современном обществе никто не должен быть оставлен без помощи. Для этого нужно учиться делать все вместе – жить, работать, решать гражданские дела. И в этом смысле не может быть и речи о том, чтобы закрыться и угасать дома.
Сохранить веру
Нам всем нужна вера, и ее очень сложно сохранить. Особенно уязвимы родители взрослых сыновей. Ведь Дюшенн – одно из самых травмирующих заболеваний, причем травмируется вся семья, но особенно – мама, которая, как правило, осуществляет основной уход за сыном. Мамы сильно изранены, многим нужна психологическая поддержка и помощь в уходе за ребенком.
Бывает, что родители молодых людей говорят родителям мальчиков помладше: посмотрим, что вы скажете через 10 лет. Да, они испытали то, через что пока не прошла я. И тогда я думаю – действительно, а что я скажу через 10 лет? Я не знаю, я ли это буду или уже не я. Смогу ли сохранить себя, свою любовь, своего ребенка? Я делаю все, что могу, как и моя семья. Боюсь ли я будущего? Я надеюсь, что справлюсь. Ну а там – посмотрим, что я скажу через 10 лет.