Миоклонус эпилепсия что это
Что такое юношеская миоклоническая эпилепсия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Агранович А. О., эпилептолога со стажем в 11 лет.
Определение болезни. Причины заболевания
Юношеской миоклонической эпилепсией (синдромом Янца) называют эпилептический синдром, который проявляется внезапными подёргиваниями в мышцах — миоклоническими приступами (от греч. «myos» — мышца, «klonos» — беспорядочное движение). Заболевание обычно развивается в подростковом возрасте.
Подёргивания в первую очередь возникают в мышцах верхнего плечевого пояса и рук. Сначала пациенты не обращают на них внимания, но со временем эпизоды возникают всё чаще и ухудшают качество жизни. Например, во время приступов из рук могут выпадать предметы. В дальнейшем появляются подёргивания ног, из-за которых человек может упасть.
Нередко к этим эпизодам присоединяются генерализованные судорожные приступы — судороги возникают по всему телу и пациент теряет сознание. Также возникают абсансы — бессудорожные приступы с отключением сознания и амнезией на этот период. Как правило, частота генерализованных приступов невысокая: от одного за всю жизнь до раза в месяц. Подёргивания обычно случаются утром после пробуждения. Ярким провоцирующим фактором может стать недосыпание или вынужденное пробуждение. Также в трети случаев отмечается фотосенситивность — чувствительность к ритмическим вспышкам света.
Распространённость
Причины заболевания
Симптомы юношеской миоклонической эпилепсии
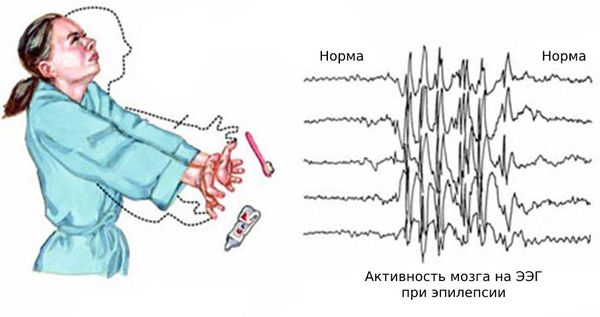
Чаще всего подёргивания возникают в верхнем плечевом поясе: мышцах рук и плеч с обоих сторон. Из-за этого пациенты нередко выпускают предметы из рук, например разбивают кружки и роняют зубные щётки. Однако возможны различные вариации миоклоний.
Приступы учащаются в утренние часы, особенно при недосыпе или вынужденном пробуждении.
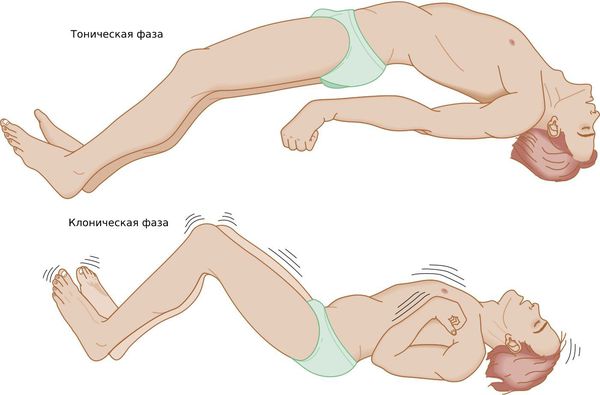
Генерализованный тонико-клонический приступ — состояние, при котором полностью отключается сознание. Приступ начинается с тонической фазы: напряжения в мышцах и специфического вскрикивания или хрипения. Руки полусогнуты и приподняты вверх или прижаты к телу. В этот момент из-за спазма дыхательной мускулатуры меняется цвет лица: оно синеет или сереет.
Далее развивается клоническая фаза, которая проявляется ритмичными подёргиваниями в конечностях. Она завершается полным мышечным расслаблением.
Патогенез юношеской миоклонической эпилепсии
Мозг человека состоит из двух основных типов клеток: нейронов и глии. Нейроны — это электрически возбудимые клетки, которые обрабатывают, хранят и передают информацию с помощью электрических и химических сигналов. Глиальные клетки играют в этом процессе вспомогательную роль.
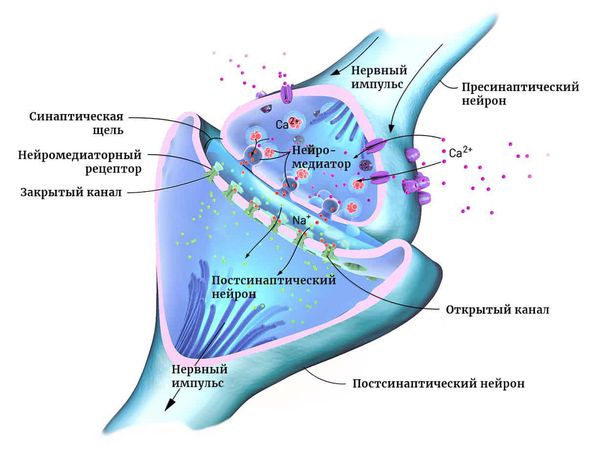
Нейроны могут соединяться друг с другом и образовывать нервные сети. В пределах одного нейрона и его отростков информация передаётся в виде электрического возбуждения. В синапсе (месте контакта между нервными клетками) оно приводит к выделению различных химических веществ — нейромедиаторов.
Нейромедиатор взаимодействует с рецепторами на мембране следующего нейрона. В результате в нём возникает электрическое возбуждение. Или не возникает — это зависит от конкретного нейромедиатора, активного в данный момент.
В нервных сетях между возбуждением и торможением работы нейронов поддерживается постоянный баланс. При сдвиге равновесия в сторону возбуждения происходит эпилептический приступ.
Классификация и стадии развития юношеской миоклонической эпилепсии
В 2017 году Международная лига борьбы с эпилепсией (ILAE) обновила классификацию заболевания, выделив четыре уровня диагностики:
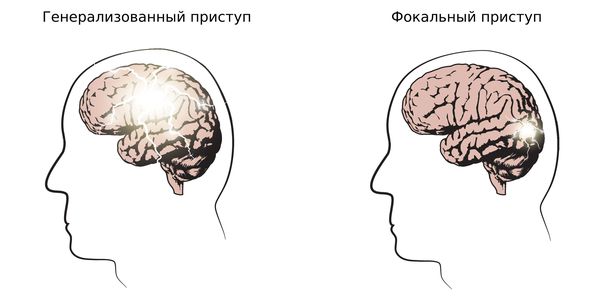
1. Определить тип приступа: фокальный (возникающий из одного очага), генерализованный и с неизвестным началом. Миоклонические, тонико-клонические приступы и абсансы относятся к генерализованным приступам.
2. Установить тип эпилепсии: фокальная, генерализованная, сочетанная (фокальная + генерализованная) и неизвестная. Юношеская миоклоническая эпилепсия относится к генерализованной эпилепсии.
4. Выявить причины заболевания: генетические, структурные, метаболические, иммунные, инфекционные и с неизвестной этиологией. Юношеская миоклоническая эпилепсия в большинстве случаев вызвана генетическими факторами.
Классификация юношеской миоклонической эпилепсии проводится в зависимости от течения заболевания. Главный критерий — это наличие миоклонических приступов. Также выделяют варианты течения с добавлением генерализованных судорожных приступов и/или абсансов.
Осложнения юношеской миоклонической эпилепсии
Пациенты часто не обращают внимания на патологические сокращения мышц, поэтому к неврологу и эпилептологу больной зачастую обращается после появления генерализованных тонико-клонических приступов. В результате противоэпилептические препараты назначают с опозданием. На фоне этого приступы могут учащаться и угрожать здоровью и жизни пациента травмами и утоплениями.
Диагностика юношеской миоклонической эпилепсии
Основной диагностический критерий заболевания — это наличие миоклонических приступов.
Сбор анамнеза
На приёме врач спрашивает о необычных внезапных состояниях:
Пациенты могут не обращать внимания на такие симптомы и считать их своей особенностью. Абсансы и генерализованные тонико-клонические приступы с потерей сознания, особенно во сне, они могут и вовсе забывать. Поэтому при сборе анамнеза важно выяснить обстоятельства приступа не только у самих пациентов, но и у родственников и очевидцев.
Электроэнцефалограмма (ЭЭГ)
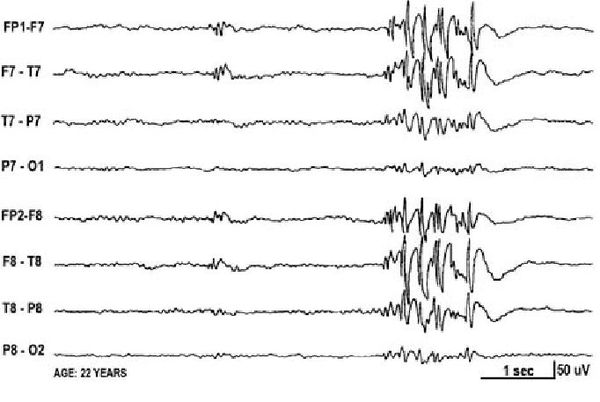
Основным способом диагностики эпилепсии является электроэнцефалограмма — метод исследования, при котором регистрируется суммарная электрическая активность клеток коры головного мозга.
Сейчас диагноз «эпилепсия» устанавливают с помощью длительного видео-ЭЭГ мониторинга — электроэнцефалограмма записывается параллельно с одной или несколькими видеокамерами, датчиком ЭКГ и при необходимости дополнительным контролем мышечной активности, частоты и глубины дыхания.
Основной фон биоэлектрической активности при юношеской миоклонической эпилепсии, как правило, соответствует возрастной норме. Патологическая активность проявляется короткими и генерализованными разрядами полиспайков (островолновых комплексов), которые регистрируются при миоклонических вздрагиваниях и полипик-волновыми комплексами между приступами.
Эпилептическая фотосенситивность — это предрасположенность к приступам под влиянием света. Может протекать бессимптомно или проявляться эпилептическими приступами под воздействием провоцирующих факторов: видеоигр, работы за компьютером, просмотра телевизора, мигающего освещения в ночных клубах и света природного происхождения.
Интеллект и неврологический статус при заболевании находятся в норме. Выражена эмоциональная неустойчивость и признаки невротического развития личности: резкая смена настроения, вспыльчивость и повышенная тревожность
Лечение юношеской миоклонической эпилепсии
Образ жизни
Антиэпилептические препараты
Ранее лидерами в лечении юношеской миоклонической эпилепсии являлись препараты вальпроевой кислоты. Они эффективны для прекращения приступов, но вызывают много побочных эффектов:
Помимо перечисленных препаратов, могут применяться «Топирамат», «Зонисамид», «Перампанел» и «Фенобарбитал».
Прогноз. Профилактика
Эффективность АЭП в предотвращении приступов достигает 90 %. При отмене терапии часто возникают рецидивы, поэтому потребуется длительный приём препаратов, иногда пожизненный.
Качество жизни значительно ухудшается при частых миоклонических и генерализованных тонико-клонических приступах, при которых пациенты рискуют получить травмы.
Профилактика
Особое внимание стоит уделить образу и режиму жизни пациента. Самыми мощными провоцирующими факторами являются недосыпание и злоупотребление алкоголем. А учитывая, что дебют заболевания приходится на подростковый возраст, молодые люди часто нарушают эти рекомендации, особенно в студенческие годы.
Пациент, у которого выявили фотосенситивность, предрасположен к приступам под воздействием мерцающего света. Поэтому им необходимо ограничить просмотр телевизора и работу за компьютером, исключить видеоигры и избегать посещения ночных клубов.
У всех пациентов с эпилепсией имеются определённые социальные ограничения: они не могут работать в некоторых сферах, водить автомобиль и нести военную службу. Все они определяются индивидуально соответствующими комиссиями.
Миоклонус эпилепсия что это
Юношеская миоклоническая эпилепсия — это форма генерализованной эпилепсии, основу клинической картины которой составляют миоклонические приступы — асинхронные мышечные сокращения, кратковременно возникающие в симметричных участках тела, преимущественно в руках и плечевом поясе. Наряду с миоклоническими эпизодами в клинике могут наблюдаться абсансы и клонико-тонические генерализованные эпиприступы. Юношеская миоклоническая эпилепсия диагностируется на основании клиники заболевания и результатов электроэнцефалографии, при исключении органической церебральной патологии по данным неврологического осмотра и МРТ. Лечение проводится преимущественно препаратами вальпроевой кислоты. Как правило, необходимо пожизненное наблюдение эпилептолога.
МКБ-10
Общие сведения
Юношеская миоклоническая эпилепсия (ЮМЭ) составляет до 12% от всех форм этого заболевания и около 23% случаев идиопатической генерализованной эпилепсии. ЮМЭ является одной из разновидностей миоклонической эпилепсии — генерализованной эпилепсии, протекающей с миоклоническими приступами. В эту группу заболеваний также входят: детская доброкачественная миоклония, синдром Веста (миоклоническая энцефалопатия детского возраста с церебральной гипсаритмией), болезнь Лафоры и др.
Первое описание ЮМЭ датировано 1867 г. Однако в качестве отдельной нозологической единицы юношеская миоклоническая эпилепсия была выделена лишь в 1955 г. по предложению группы германских врачей во главе с Янцем, после чего она стала упоминаться как синдром Янца. В научной литературе по неврологии и эпилептологии можно встретить также термин «импульсивный petit mal».

Причины
Симптомы
Юношеская миоклоническая эпилепсия манифестирует в возрасте от 8 до 24 лет. Наиболее часто дебют заболевания приходится на возрастной отрезок 12-18 лет. Патогномоничным симптомом ЮМЭ выступают миоклонические приступы — короткие, внезапно возникающие, непроизвольные мышечные сокращения, имеющие асинхронный характер.
Как правило, в начале заболевания пароксизмы отмечаются в утренние часы при пробуждении больного. Сокращения мышц происходят симметрично в обеих половинах тела, чаще охватывают только плечевой пояс и руки, реже — распространяются на нижние конечности или на все тело. Во время пароксизма пациенты могут автоматически отбрасывать или ронять удерживаемые в руках предметы, при вовлечении нижних конечностей происходит падение.
Пароксизмы ЮМЭ могут иметь одиночный характер или возникать кластерами. В редких случаях наблюдается т. н. миоклонический эпилептический статус. Отличительной чертой является полная сохранность сознания пациента во время миоклонического пароксизма, даже в тех случаях, когда речь идет о миоклоническом статусе.
В 3-5% случаев юношеская миоклоническая эпилепсия протекает с наличием только миоклонических пароксизмов. В подавляющем большинстве наблюдений (около 90%) через некоторое время после дебюта заболевания (в среднем через 3 года) у пациента возникают генерализованные тонико-клонические эпиприступы. Они могут начинаться с серии нарастающих миоклонических подергиваний, затем переходящих в клонико-тонические судороги. Примерно у 40% пациентов отмечаются абсансы — кратковременные эпизоды «выключения» сознания.
Диагностика
Установить диагноз ЮМЭ в ее начальном периоде весьма затруднительно. Зачастую возникающие на фоне пробуждения миоклонические эпизоды расцениваются как нервозность ребенка, а сами дети обычно не обращают внимания на подобные мелкие симптомы. Как правило, родители обращаются к неврологу, когда у ребенка появляются тонико-клонические приступы. Исследование неврологического статуса не определяет каких-либо нарушений. Инструментальные методы включают:
Дифференциальная диагностика
Массивность и билатеральная синхронность отличает пароксизмы ЮМЭ от неэпилептического миоклонуса, эпизоды которого носят спорадический и фокальный характер. Юношеская миоклоническая эпилепсия также требует дифференцировки от других форм эпилепсии, протекающих с миоклоническими эпизодами. Так, в отличии от ЮМЭ, при эпилепсии с генерализованными судорожными пароксизмами пробуждения или при юношеской абсанс эпилепсии миоклонические пароксизмы не являются доминирующими в клинической картине заболевания.
Эпилепсия с миоклонически-астатическими пароксизмами, синдром Леннокса-Гасто и эпилепсия с миоклоническими абсансами дебютируют в более раннем детском возрасте и сопровождаются задержкой психического развития. Последняя характеризуется приступами, в которых миоклонические судороги сочетаются с абсансами, в то время как пароксизмы ЮМЭ протекают без нарушения сознания.
Лечение юношеской миоклонической эпилепсии
Режимные мероприятия
Важное значение имеет не только фармакотерапия эпилепсии, но и соблюдение пациентом некоторых жизненных норм, позволяющих избегать провоцирования приступов. Как и при других видах эпилепсии, при ЮМЭ приступы могут быть вызваны нарушением режима, психической и физической перегрузкой, стрессом, недосыпанием, приемом содержащих алкоголь напитков. Поэтому пациенту следует избегать подобных провоцирующих факторов. Положительно влияет на течение заболевания спокойный, простой и неторопливый уклад жизни, пребывание на природе, вдали от городской суеты. В связи с этим некоторые семьи, где у ребенка диагностирована ЮМЭ, переезжают и живут в сельской местности.
Фармакотерапия
Медикаментозная терапия ЮМЭ проводится вальпроатами. Монотерапия данными препаратами оказалась эффективной в отношении всех видов приступов, сопровождающих клинику ЮМЭ, — миоклонических, тонико-клонических и абсансов. При недостаточности монотерапии возможно комбинированное лечение. Купирование резистентных абсансов достигается сочетанием вальпроатов с этосуксимидом, резистентных клонико-тонических приступов — сочетанием вальпроатов с примидоном или фенобарбиталом.
Для контроля миоклонических пароксизмов эффективен клоназепам, однако его действие не распространяется на тонико-клонические генерализованные приступы. При этом полное купирование миоклонических приступов лишает пациента возможности заранее знать о приближающемся тонико-клоническом приступе по возникающим перед ним миоклоническим проявлениям. Поэтому назначение клоназепама оправдано лишь при стойких миоклонических пароксизмах и должно сочетаться с препаратом вальпроевой кислоты.
Результаты лечения ЮМЭ противоэпилептическими препаратами нового поколения (леветирацетамом, ламотриджином, топираматом) пока проходят проверку в клинических условиях. Отмечена высокая перспективность леветирацетама.
Прогноз
Юношеская миоклоническая эпилепсия считается хроническим заболеванием, которое продолжается в течение всей жизни пациента. Случаи спонтанной ремиссии редки. У 90% больных, по различным причинам прервавших лечение антиэпилептическим препаратом, отмечалось возобновление эпиприступов. Однако имеются указания на то, что в отдельных случаях у пациентов после отмены препарата наблюдалась длительная ремиссия.
В целом, при правильно подобранной терапии приступы контролируются у большинства больных, хотя у половины из них на фоне лечения могут наблюдаться отдельные пароксизмы. Относительно резистентное к терапии течение наблюдается редко, в основном в случаях, когда у пациента отмечаются все 3 разновидности пароксизмов ЮМЭ.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении юношеской миоклонической эпилепсии.
Миоклонус эпилепсия что это
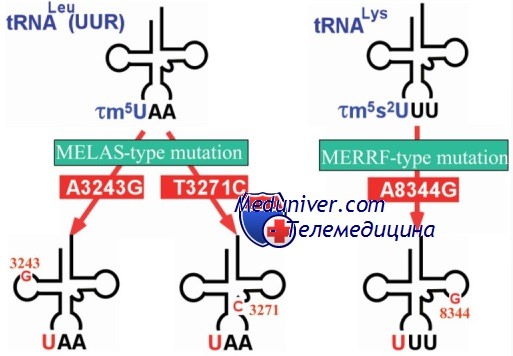
Этиология и встречаемость миоклонус-эпилепсии MERRF. Миоклонус-эпилепсия MERRF (MIM №545000) — редкое панэтническое заболевание, вызываемое мутациями в мтДНК в гене tRNAlys. Более 90% пациентов имеют одну из трех мутаций в этом гене: 8344G>A у 80%, 8356Т>С и 8363G>A вместе дают еще 10%.
Болезнь передается по материнской линии, поскольку митохондрии наследуются почти исключительно от матери. Пациенты с миоклонус-эпилепсией MERRF почти всегда гетероплазматические по мутантной митохондрии.
Патогенез миоклонус-эпилепсии MERRF
Митохондрия генерирует энергию для клеточных процессов, производя АТФ в процессе окислительного фосфорилирования. Магистраль окислительного фосфорилирования формируют пять комплексов ферментов, с I по V.
За исключением комплекса II, определенные компоненты каждого комплекса кодируются мтДНК, а другие ядерным геномом. мтДНК кодирует 13 полипептидов комплексов окислительного фосфорилирования, а также 2 рРНК и 22 тРНК.
При миоклонус-эпилепсии MERRF обычно наиболее сильно снижается активность комплексов I и IV. Мутации тРНК лизина (tRNAlys), связанные с миоклонус-эпилепсией MERRF, уменьшают количество молекул tRNAlys в митохондриях на 50-60%, тем самым уменьшая эффективность трансляции, так как каждый кодон лизина приводит к ее завершению в 26% случаев. Поскольку комплексы I и IV состоят в основном из компонентов, синтезируемых преимущественно в митохондриях, они поражаются наиболее сильно.
Каждая митохондрия содержит множество молекул мтДНК, а каждая клетка содержит многочисленные митохондрии, таким образом, в клетке могут содержаться как нормальные молекулы мтДНК, так и аномальные в различных соотношениях; следовательно, экспрессия фенотипа миоклонус-эпилепсии MERRF в любой клетке, органе и, в конечном счете, у больного, зависит от общего снижения возможностей окислительного фосфорилирования.
Порог для экспрессии опасного фенотипа зависит от баланса между спросом и предложением. Этот порог изменяется с возрастом и различается у разных пациентов, систем органов и тканей.
Порог экспрессии фенотипа миоклонус-эпилепсии MERRF в конкретной ткани, гетероплазматической по tRNAlys, может превышаться за счет накопления мутаций в нормальных молекулах мтДНК или за счет увеличения доли мутантных молекул. По сравнению с ядерной, мтДНК имеет в 10 раз более высокий показатель мутирования; это может быть связано с воздействием высокой концентрации свободных кислородных радикалов при окислительном фосфорилировании, недостатком защитных гистонов или неэффективной репарацией ДНК.
Поскольку мтДНК не имеет интронов, все мутации обычно влияют на кодирующие последовательности. В соответствии с этой повышенной частотой мутаций спад эффективности работы митохондрий нарастает с возрастом, и, по мере истощения резервов активности окислительного фосфорилирования, проявление дефектов в цепи окислительного фосфорилирования становится весьма вероятным.
Увеличение пропорции мутантных молекул мтДНК может быть вызвано и комбинацией наследования, преимущественной репликации мутантной мтДНК и отбора. Во-первых, дети гетероплазматических матерей имеют различные пропорции генотипов мтДНК из-за репликативной сегрегации, т.е. произвольного расхождения митохондрий в ходе увеличения числа овогониев, особенно из-за митохондриального «бутылочного горлышка», возникающего в ходе овогенеза.
Во-вторых, так как гетероплазматические клетки в организме подвергаются митозу, соотношение генотипов мтДНК в дочерних клетках также изменяется по сравнению с родительскими клетками снова благодаря репликативной сегрегации. В-третьих, поскольку изменения соотношения генотипов мтДНК влияют на клеточный фенотип, мтДНК подвергается сильному давлению отбора; это давление различается в разных тканях и приводит к разным популяциям мтДНК в различных тканях у одного человека. Таким образом, передача мтДНК как между клетками, так и между поколениями, соответствует принципам популяционной генетики.
Фенотип и развитие миоклонус-эпилепсии MERRF
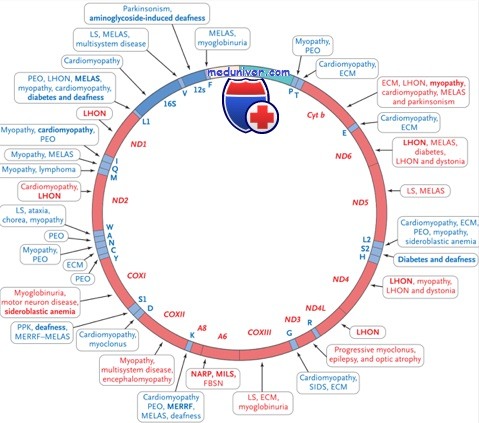
Классический фенотип миоклонус-эпилепсии MERRF включает миоклонус-эпилепсию и митохондриальную миопатию с «рваными» красными волокнами. Другие признаки — аномальные вызванные реакции ствола мозга, нейросенсорная тугоухость, атаксия, дисфункция почек, сахарный диабет, кардиомиопатия и деменция. Начало симптомов может быть в детстве или взрослой жизни, а течение болезни может быть медленно или быстро прогрессирующим.
Поскольку генетика мтДНК соответствует количественным и вероятностным принципам, клинические симптомы у пораженных родственников изменяются по своим проявлениям и тяжести и не имеют легко определяемого клинического течения. Отсутствие «рваных» красных волокон в образце биоптата мышц не исключает миоклонус-эпилепсию MERRF.
В пределах одной родословной фенотипы обычно хорошо согласуются со степенью дефицита окислительного фосфорилирования, но корреляция с процентом мутантных молекул мтДНК в скелетных мышцах требует уточнения с изменением возраста.
В одной родословной юноша с 5% нормальных молекул мтДНК в скелетных мышцах имел выраженный клинический и биохимический фенотип; другой юноша с 15% нормальных молекул имел нормальный фенотип, а пожилой мужчина с 16% нормальных молекул имел тяжелый фенотип.
Этот случай подтверждает, что симптомы прогрессивно накапливаются по мере преодоления порога возможностей окислительного фосфорилирования в конкретном органе и что связанное с возрастом снижение уровня окислительного фосфорилирования играет критическую роль в проявлении и развитии симптомов.
Особенности фенотипических проявлений миоклонус-эпилепсии MERRF:
• Возраст начала: от детства до взрослого возраста
• Миопатия
• Деменция
• Миоклональные приступы
• Атаксия
• Глухота
Лечение миоклонус-эпилепсии MERRF
Лечение миоклонус-эпилепсии MERRF — симптоматическое и паллиативное. В настоящее время специфическая терапия отсутствует. Большинство пациентов получает коэнзим Q и L-карнитин с целью оптимизировать активность комплексов окислительного фосфорилирования.
Риски наследования миоклонус-эпилепсии MERRF
Риск для детей больных мужчин равен нулю, поскольку, с одним известным исключением, дети не наследуют отцовскую мтДНК. Риск для детей больных или здоровых женщин с мутацией MERRF невозможно точно оценить методами пренатальной диагностики, поскольку критические параметры, определяющие развитие болезни у ребенка (репликативная сегрегация, пораженная ткань и соматические мутации мтДНК), заранее предсказать невозможно.
Аналогично молекулярное тестирование образцов крови у членов семьи, находящихся в группе риска, осложняется двумя общими проблемами. Во-первых, из-за репликативной сегрегации и тканевого отбора мутация может быть не обнаружена в крови; следовательно, отрицательный результат не исключает члена семьи как носителя мутации мтДНК. Во-вторых, из-за репликативной сегрегации положительный результат не дает возможности предсказать ни количество мутантных молекул мтДНК в разных тканях, ни ожидаемую тяжесть болезни.
Пример миоклонус-эпилепсии MERRF. Р.С., 15-летний мальчик, направлен в клинику нейрогенетики в связи с подозрением на миоклонус-эпилепсию; его электроэнцефалограмма характеризовалась вспышками медленных волн и комплексами пиков. До появления приступов он был здоров и развивался нормально.
В семейном анамнезе отмечен дядя по матери, умерший от недиагностированного мышечного заболевания в 53 года, тетя по матери с прогрессирующей деменцией, с развитием атаксии в 37 лет и 80-летняя бабушка по матери с глухотой, сахарным диабетом и дисфункцией почек. При осмотре выявлены общая мышечная слабость, миоклонусы и атаксия.
Начальное обследование выявило нейросенсорную тугоухость, сниженную скорость проведения по нервам и слегка повышенные уровни лактата в крови и спинномозговой жидкости. В результате последующей биопсии мышц обнаружены аномальные митохондрии, недостаточное окрашивание на цитохромоксидазу и «рваные» красные мышечные волокна с субсарколеммальными митохондриями, окрашиваемыми в красный цвет красителем Гомори.
Молекулярное тестирование образца биопсии скелетных мышц на мутации в митохондриальном геноме (mtDNA) в 80% мтДНК мышц выявило гетероплазматическую мутацию (8344G>A, ген tRNAlys), ранее описанную в связи с MERRF. Последующее тестирование образцов крови матери, тети и бабушки по матери подтвердило, что они также были гетероплазматическими по этой мутации. Повторный анализ материалов вскрытия умершего дяди позволил выявить «рваные» красные волокна в некоторых группах мышц. Врач сказал членам семьи (сибсам пациента и его матери), что они могут быть явными или скрытыми носителями опасной мутации мтДНК, нарушающей процессы окислительного фосфорилирования. Однако другие члены семьи не решились пройти обследование на мутацию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021