Митохондрии называются энергетическими станциями клетки потому что в них
Митохондрии называются энергетическими станциями клетки потому что в них
К вопросу об « энергетических станциях » клеток
А.А. Байузакова, магистр права, ведущий эксперт ЛХБИ ИСЭ г.Алматы, РК
Митохондриальная ДНК (мтДНК) находится внутри митохондрий, небольших образований, располагающихся в цитоплазме клетки, в отличие от ядерной ДНК, упакованной в хромосомы внутри ядра. Митохондрии имеются у большинства эукариот и имеют единое происхождение, как считается, от одной древней бактерии, когда-то на заре эволюции поглощенной клеткой и превратившейся в ее составную часть, которой были «поручены» очень важные функции.
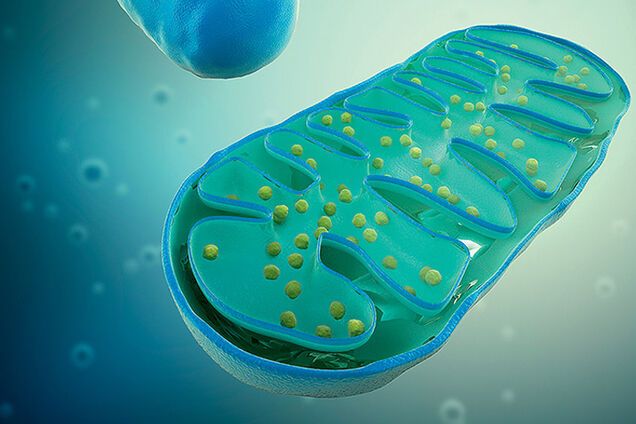
Митохондрии часто называют «энергетическими станциями» клеток по той причине, что внутри них вырабатывается аденозинтрифосфорная кислота (АТФ), химическую энергию которой клетка может расходовать практически везде, подобно тому как человек использует в своих целях энергию топлива или электричества. И точно так же, производство топлива и электричества требует немалых затрат человеческого труда и слаженной работы большого количества специалистов, получение АТФ внутри митохондрии (или «клеточное дыхание», как его называют) использует огромную массу клеточных ресурсов, включая «топливо» в виде кислорода и некоторых органических веществ, и конечно предполагает участие в этом процессе сотен белков, каждый из которых выполняет свои специфические функции.
Ввиду этого существенно упростилась сама структура митохондриальной ДНК, так как многие составные части процесса транскрипции (чтения) ДНК были утеряны, вследствие чего исчезла необходимость в особом структурировании митохондриального кода. Белки-полимеразы, осуществляющие транскрипцию (чтение) и репликацию (удвоение) митохондриальной ДНК, кодируются не в ней самой, а в ядре.
Таким образом, последней особенностью митохондриальной ДНК является ее неспособность к рекомбинации. Иными словами, между различными эволюционными вариантами митохондриальной ДНК одного вида невозможен обмен гомологичными (т.е. сходными) участками, и поэтому вся молекула изменяется только путем медленного мутирования в течение тысячелетий. У людей митохондрии наследуются только от матери, поэтому эволюционное древо митохондриальной ДНК соответствует генеалогии по прямой женской линии. Однако данная особенность не является уникальной, так как ядерные хромосомы также не подвержены рекомбинации (не имея пар) и наследуются только от одного из родителей. Так, например, Y-хромосома может быть передана только от отца к сыну.
Митохондрии: строение и функции
Митохондрии – двомембранний органоид эукариотической клетки. Они являются важными частями наших клеток, поскольку принимают пищу и производят энергию, которую могут использовать клетки.
Животные и растения состоят из многих сложных клеток, которые называются эукариотические клетки. Внутри этих клеток расположены структуры, выполняющие особые функции для клетки, – органеллы. Органеллы, отвечающие за выработку энергии для клетки, – это и эсть митохондрии.
Различные типы клеток имеют разное количество митохондрий. Некоторые простые клетки содержат только один-два митохондрии. Однако сложные животные клетки, которым нужно много энергии, например, мышечные, могут иметь тысячи митохондрий.
Основная функция митохондрий – производить энергию для клетки. Клетки используют специальную молекулу для получения энергии под названием АТФ (аденозинтрифосфат). АТФ для клетки производится внутри митохондрий.
То есть энергетическая функция митохондрий интегрируется с окисления органических соединений, что происходит в матриксе, благодаря чему митохондрии называют дыхательным центром клеток; синтеза АТФ, что осуществляется на кристах, благодаря чему митохондрии называют энергетическими станциями клеток.
Митохондрии вырабатывают энергию в процессе клеточного дыхания. Митохондрии принимают молекулы пищи в виде углеводов и сочетают их с кислородом для получения АТФ. Они используют ферменты для получения правильной химической реакции.
Кроме выработки энергии, митохондрии выполняют и другие функции для клетки, включая клеточный метаболизм, выработки тепла, контроль концентрации кальция и выработки некоторых стероидных гормонов. А о других гормонах можно узнать благодаря онлайн уроку за 8 класс по биологии на тему «Принципы регуляции. Эндокринная система».
Митохондрии имеют четкую структуру, которая помогает им производить энергию.
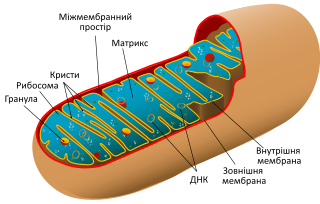
Внешняя мембрана. Защищенная гладкой внешней мембраной, которая имеет форму от круглой палочки до длинного стержня.
Внутренняя мембрана. В отличие от других органелл в клетке, митохондрии также имеют внутреннюю мембрану. Она имеет множество складок и выполняет ряд функций, чтобы помочь сделать энергию.
Кристи. Это складки на внутренней мембране. Наличие всех этих складок способствует увеличению площади поверхности внутренней мембраны.
Матрикс. Это пространство внутри внутренней мембраны. Большинство белков митохондрий находятся в матриксе. Матрикс также содержит рибосомы и ДНК, которые являются уникальными для митохондрий.
Белок синтезирующей системы. В митохондрий есть своя белоксинтезирующая система – ДНК, РНК и рибосомы. Генетический аппарат имеет вид кольцевой молекулы – нуклеотида, точно как у бактерий. Часть необходимых белков митохондрии синтезируют сами, а часть получают из цитоплазмы, поскольку эти белки кодируются ядерными генами.
Интересные факты о митохондриях:
Они могут быстро менять форму и перемещаться по клетке, когда это нужно.
Когда клетке требуется больше энергии, митохондрии могут размножаться, увеличиваясь, а затем делясь. Если клетке нужно меньше энергии, некоторые митохондрии погибнут или станут неактивными.
Митохондрии очень похожи на некоторые бактерии. По этой причине некоторые ученые считают, что сначала они были бактериями, которые поглощались более сложными клетками.
Различные митохондрии вырабатывают различные белки. Некоторые митохондрии могут производить сотни различных белков, которые используются для различных функций.
Кроме энергии в виде АТФ, они также производят небольшие количества углекислого газа.
Нужно выполнить домашнее задание по биологии в учебнике или рабочей тетради? Ищите все готовое в разделе «ГДЗ и решебниики по биологии за 8 класс».
Митохондрии
Человеческие клетки содержат в среднем 1500 митохондрий.Их особенно много в клетках с интенсивным метаболизмом (например, в мускулах или печени).
Митохондрии подвижны и перемещаются в цитоплазме в зависимости от потребностей клетки. Благодаря наличию собственной ДНК они размножаются и самоуничтожаются независимо от деления клетки.
Клетки не могут функционировать без митохондрий, без них жизнь не возможна.
Различный типы клеток отличаются друг от друга как по количеству и форме митохондрий, так и по количеству крист. Особенно много крист имеют митохондрии в тканях с активными окислительными процессами, например в сердечной мышце. Вариации митохондрий по форме, что зависит от их функционального состояния, могут наблюдаться и в тканях одного типа. Митохондрии — изменчивые и пластичные органеллы.
Также упомянем, что существенно упростилась сама структура митохондриальной ДНК, так как многие составные части процесса транскрипции (чтения) ДНК были утеряны, вследствие чего исчезла необходимость в особом структурировании митохондриального кода. Белки-полимеразы, осуществляющие транскрипцию (чтение) и репликацию (удвоение) митохондриальной ДНК, кодируются не в ней самой, а в ядре.
В день преобразовывается 40 кг. АТФ.Энергия в клетке может принимать различные формы. Принцип действия клеточного механизма – преобразование потенциальной энергии в энергию, которую может напрямую использовать клетка.Потенциальные виды энергии попадают в клетку через питание в виде углеводов, жиров и белковКлеточная энергия состоит из молекулы называемой АТФ: Аденозинтрифосфат. Она синтезируется в результате преобразования углеводов, жиров и белков внутри митохондрии.За день в организме взрослого человека синтезируется и распадается эквивалент 40 кг АТФ.В митохондриях локализованы следующие метаболические процессы: превращение пирувата в ацетил-КоА, катализируемое пируватдегидрогеназным комплексом: цитратный цикл; дыхательная цепь, сопряженная с синтезом АТФ (сочетание этих процессов носит название «окислительное фосфорилирование»); расщепление жирных кислот путем ;-окисления и частично цикл мочевины. Митохондрии также поставляют клетке продукты промежуточного метаболизма и действуют наряду с ЭР как депо ионов кальция, которое с помощью ионных насосов поддерживает концентрацию Са2+ в цитоплазме на постоянном низком уровне (ниже 1 мкмоль/л).
Поврежденная митохондриальная ДНК за несколько месяцев порождает более 30 подобных себе митохондрий, т.е. с теми же повреждениями.
Восстановление функций метахондрия и ограничение процессов приводящих к старению возможно при применении коэнзима Q10. В результате проведенных экспериментов было установлено замедление процессов старения и увеличение продолжительности жизни у некоторых многоклеточных организмов в результате введения добавок CoQ10.
Q10 (CoQ10) — это «свеча зажигания» человеческого организма: так же, как автомобиль не может работать без пусковой искры, организм человека не может обойтись без CoQ10. Это самый важный компонент митохондрий, вырабатывающий энергию, которая нужна клеткам для деления, перемещения, сокращения и выполнения всех прочих функций. CoQ10 также играет важную роль в выработке аденозинтрифосфата (АТФ) — энергии, которая приводит в движение все процессы в организме. Более того, CoQ10 — это очень важный антиоксидант, который защищает клетки от повреждений.
Хотя наш организм может вырабатывать CoQ10, он не всегда производит его в достаточном количестве. Поскольку мозг и сердце входят в число самых активных тканей организма, дефицит CoQ10 негативно влияет на них в наибольшей степени и может привести к серьезным проблемам с этими органами. Дефицит CoQ10 могут вызвать различные причины, в том числе плохое питание, генетические или приобретенные дефекты и, к примеру, повышенная тканевая потребность. Сердечно-сосудистые заболевания, включая высокие уровни холестерина и повышенное артериальное давление, также требуют увеличения уровня CoQ10 в тканях. Кроме того, поскольку уровни CoQ10 снижаются с возрастом, людям старше 50 лет может потребоваться больше этого вещества. Многие исследования показали, что ряд лекарственных препаратов (прежде всего гиполипидемические лекарственные средства, такие как статины) снижают уровень CoQ10.
Учитывая ключевую роль CoQ10 в митохондриальной функции и защите клеток, этот кофермент может быть полезен при наличии целого ряда проблем со здоровьем. CoQ10 может принести пользу при наличии такого широкого перечня болезней, что нет никаких сомнений в его важности как питательного вещества. CoQ10 является не только антиоксидантом общего действия, но и может помочь при наличии следующих заболеваний:
Сердечно-сосудистые заболевания: высокое кровяное давление, застойная сердечная недостаточность, кардиомиопатия, защита во время хирургических операций на сердце, высокий уровень холестерина, который лечат с помощью медикаментов, особенно статинов
Рак (для повышения иммунной функции и/или компенсации побочных эффектов химиотерапии)
Сахарный диабет
Мужское бесплодие
Болезнь Альцгеймера (профилактика)
Болезнь Паркинсона (профилактика и лечение)
Парадонтоз
Дегенерация желтого пятна
Исследования на животных и людях подтвердили полезность CoQ10 при всех вышеуказанных заболеваниях, особенно сердечно-сосудистых. В самом деле, исследования показали, что 50–75 процентов людей с различными заболеваниями сердечно-сосудистой системы страдают от дефицита CoQ10 в сердечных тканях. Устранение этого недостатка часто может приводить к драматическим результатам у пациентов с какой-либо болезнью сердца. Например, было доказано, что дефицит CoQ10 имеет место у 39 процентов пациентов с высоким артериальным давлением. Только этот вывод обуславливает необходимость приема добавок с CoQ10. Однако, как представляется, преимущества CoQ10 не ограничиваются устранением сердечно-сосудистой недостаточности.
Проведенное в 2009 году исследование, результаты которого были опубликованы в журнале Pharmacology & Therapeutics, дает основания предположить, что воздействие CoQ10 на артериальное давление становится заметным только через 4–12 недель после лечения и типичное снижение систолического и диастолического артериального давления у больных с высоким давлением является довольно скромным — в пределах 10 процентов.
Статиновые препараты, такие как Crestor, Lipitor, и Zocor, действуют путем ингибирования фермента, который необходим печени для выработки холестерина. К сожалению, они также блокируют выработку других веществ, необходимых для функционирования организма, в том числе CoQ10. Это может объяснить наиболее часто встречающиеся побочные эффекты данных препаратов, особенно усталость и мышечные боли. В одном крупном исследовании ENDOTACT, итоги которого были опубликованы в International Journal of Cardiology в 2005 году, было продемонстрировано, что статиновая терапия значительно снижает уровень CoQ10 в плазме крови, но это снижение можно предотвратить с помощью приема добавки со 150 мг CoQ10. Кроме того, добавки с CoQ10 значительно улучшают функцию выстилки кровеносных сосудов, что является одной из ключевых целей при лечении и профилактике атеросклероза.
В двойных слепых исследованиях было продемонстрировано, что прием добавок с CoQ10 был весьма полезным для некоторых пациентов с болезнью Паркинсона. У всех пациентов в этих исследованиях были три основных симптома болезни Паркинсона — тремор, ригидность и замедление движения, и диагноз заболевания был поставлен им в течение последних пяти лет.
В 2005 году исследование, опубликованное в Archives of Neurology, также показало замедление снижения функциональности у пациентов с болезнью Паркинсона, которые принимали CoQ10. После первоначальной проверки и исходных анализов крови пациенты были разделены случайным образом на четыре группы. Три группы получали CoQ10 в разных дозах (300 мг, 600 мг и 1200 мг в день) в течение 16 месяцев, в то время как четвертая группа получала плацебо. Группа, которая принимала дозу 1200 мг, показала меньшее ухудшение психических и двигательные функций и способности осуществлять повседневные действия, такие как кормление или одевание себя. Наибольший эффект был отмечен в повседневной жизни. У групп, которые получали 300 мг и 600 мг в день, инвалидность развилась в меньшей степени, чем в группе плацебо, но и результаты у членов данных групп были менее кардинальными, чем у тех, кто получал самую высокую дозировку препарата. Эти результаты показывают, что благотворного влияния CoQ10 при болезни Паркинсона можно достичь при наиболее высоких дозах приема препарата. Ни у кого из пациентов не были отмечены какие-либо существенные побочные эффекты.
Кофермент Q10 является очень безопасным. Никогда не сообщалось о серьезных побочных эффектах даже при его длительном применении. Поскольку безопасность во время беременности и лактации не была подтверждена, CoQ10 не следует использоваться в эти периоды, если только врач не установит, что клинические результаты перевешивают риски. Я обычно рекомендую принимать от 100 до 200 мг CoQ10 в день. Для наилучшего усваивания мягких желатиновых капсул их следует принимать с едой. При более высоких уровнях дозировки лучше принимать препарат разделенными дозами, а не одной дозой (лучше по 200 мг три раза в день, чем сразу все 600 мг).
Митохондрии: энергостанции нашего организма
На молекулярном уровне наш организм можно рассматривать как своеобразный биологический механизм. Очень сложную, многогранную, но, тем не менее, машину, принципы работы которой мы сегодня начинаем понимать все лучше и лучше. И один из этих принципов является по-настоящему фундаментальным: никакая машина не сможет работать без притока энергии.
Для более простых механизмов этот принцип нам понятен, что называется, на интуитивном уровне. Двигатель автомобиля получает энергию, сжигая топливо в баке, телевизор использует энергию тока в розетке и так далее. Но вот с нашей собственной биологической машиной – нашим телом – все не так очевидно. То есть, наверняка наш читатель знает, что мы берем энергию из пищи (и об этом мы уже рассказывали более подробно). Но вот как именно это происходит? Где и как в нашем теле условные углеводы или жиры превращаются в ту движущую силу, которая необходима для всех без исключения процессов, протекающих в организме?
Клеточные «электростанции»
Основные объемы энергии в человеческом теле вырабатываются внутри отдельных клеток. Можно сказать, что каждая из них самостоятельно отвечает за собственное энергоснабжение. А это значит, что в каждой клетке (как минимум в тех клетках, которые имеют ядра, эритроциты не в счет), должна быть своя «электростанция». И это действительно так! Более того, нередко таких «электростанций» имеется несколько десятков или даже сотен. Зависит их число от того, насколько интенсивно работает клетка, а значит, и от того, насколько много ей требуется энергии в единицу времени. Научное название таких «электростанций» – митохондрии, а их совокупность именуют митохондриальным пулом клетки.
Как появились митохондрии?
Один из важных вопросов, который давно беспокоил научную общественность: а откуда вообще взялись митохондрии в наших клетках? Самая современная и достоверная теория предлагает крайне необычный ответ: митохондрии – это потомки бактерий.
Давным-давно одноклеточные организмы, которым предстояло стать нашими предками, научились поглощать крохотные бактерии, присутствующие в окружающей среде. Если попросту – они ими питались. Но в один прекрасный день такая протобактерия не разрушилась, попав во внутриклеточную среду. И более того, она сохранила не только целостность, но и кое-какие свои функции. В частности, способность вырабатывать энергию с помощью кислорода. Каков до этого был механизм получения энергии у тех одноклеточных, которые впоследствии станут нами, известно плохо. Но с уверенностью можно сказать, что аэробный путь, предложенный им проглоченной бактерией, был однозначно более выгодным и эффективным.
Результатом этого удивительного события стал внутриклеточный симбиоз. Бактерия вырабатывала много энергии, а одноклеточный организм-хозяин снабжал ее достаточным количеством кислорода и других необходимых соединений. Со временем протобактерия упростилась, видоизменилась и стала необходимой клеточной органеллой. Этот союз оказался настолько успешным, что сейчас на нем построено энергоснабжение практически всех эукариотических клеток растений, грибов и животных. В том числе и нас с вами [1].
Как устроены митохондрии?
Многое в строении митохондрий до сих пор напоминает о том, что когда-то они были самостоятельными бактериями. Так, например, они окружены внешней липидной мембраной – такую мембрану имеют и все остальные клетки нашего организма. Основная функция внешней мембраны – защита митохондрии, отграничение ее от окружающей внутриклеточной среды, а также транспортировка необходимых веществ внутрь и выведение результатов ее работы наружу [2].
Внутреннее пространство митохондрии занимает матрикс. Это жидкая среда, состоящая из смеси жирных кислот, белков, рибосом и других соединений. В матриксе проходит первая стадия кислородного дыхания, то есть, выработки энергии. Кроме того, здесь находится и еще одно свидетельство прошлой самостоятельности митохондрий – митохондриальная ДНК. Да, оказывается, не весь наш генетический материал помещен в клеточное ядро! Эти небольшие кольцевые митохондриальные ДНК (мтДНК) кодируют 13 белков, которые нужны для работы самой митохондрии. В основном это ферменты, участвующие в дыхательной цепи окисления водорода [3].
Что еще интересно: люди наследуют мтДНК исключительно по материнской линии, а мтДНК, полученная от сперматозоида, разрушается сразу после оплодотворения [4]. Эта «женская» мтДНК мутирует по очень четким законам и поэтому можно отследить то, как именно она изменялась с течением времени. Ряд исследований последних лет убедительно доказал, что примерно 200 000 лет назад в Африке жила женщина, от которой свою мтДНК получило все современное человечество. Ученые поэтически назвали эту женщину «митохондриальной Евой» [5].
Наконец, между внешней мембраной и матриксом имеется и вторая, внутренняя мембрана. Она очень неровная и образует кристы – длинные складки, направленные к центру митохондрии. Именно их – как темные полосы – видели первые исследователи XIX века. На внутренней мембране как раз и происходит запасание энергии в виде молекул аденозинтрифосфата (АТФ). В процессе этого потребляется более 80% того кислорода, который попадает в нашу кровь при дыхании [6].
Чем еще заняты наши митохондрии?
Основная функция этих органелл – обеспечение энергией всех протекающих в клетке процессов. Однако, помимо этого митохондрии выполняют и еще целый ряд витальных (жизненно важных) функций. В их числе:
Опираясь на данные современных исследований, можно смело утверждать, что митохондрии, во-первых, активно участвуют во внутриклеточных процессах, а во-вторых, влияют и на физиологию всего организма. Такая «широкая специализация» стала причиной того, что нарушения работы митохондрий сегодня рассматривают как одну из важных причин появления множества заболеваний [12].
Что будет при нарушении работы митохондрий?
Очевидно, что самым первым и самым ярким проявлением дисфункции митохондрий будет уменьшение выработки энергии в клетке. На клиническом уровне такое обстоятельство может проявляться по-разному. И больше всего пострадают те ткани, которые работают максимально активно, а значит, требуют наибольшего притока энергии [13]:
Кроме того, учитывая другие функции митохондрий, о которых мы рассказывали выше, их неправильная работа может становиться фактором риска развития многих нарушений [14]:
Как улучшить работу митохондрий?
На настоящий момент предложены две стратегии того, как улучшить функции митохондриального пула. Первая связана с тем, что митохондрии, как органеллы, не статичны. Они могут сливаться, делиться, увеличиваться и уменьшаться в размерах, а также обмениваться своим генетическим материалом [15]. Это тоже своеобразное «наследие» их бактериального прошлого. В ходе таких слияний и делений поврежденные участки митохондрий и мтДНК отсеиваются и распадаются. Итогом становится образование новых, полноценных митохондрий, которые намного лучше выполняют все свои функции. То есть, благодаря этим процессам происходит обновление всего митохондриального пула клетки [16].
Мы имеем возможность ускорить это обновление. В частности, таким действием обладает функциональный продукт здорового питания под названием T8 ERA MIT UP, который недавно выпустила на рынок компания VILAVI INT LTD. В этом продукте содержится концентрат гранатового сока, который богат веществами под названием эллаготаннины [17]. Попадая в наш желудок, они быстро распадаются с образованием эллаговой кислоты, а ее, в свою очередь, перерабатывают кишечные бактерии, производя уролитин А [18]. Это соединение как раз и стимулирует митохондрии активнее обновляться путем слияния и деления. Уже есть исследования, которые показывают, что дефицит уролитина А – важный фактор преждевременного старения [19]. Помимо этого, доказано, что приток этого вещества увеличивает сопротивляемость физическим и умственным нагрузкам как раз за счет улучшения выработки энергии в митохондриях [20].
Вторая стратегия основана на защите митохондрий от разрушающего воздействия оксидативного стресса. Как мы уже говорили, в ходе выработки энергии они также синтезируют активные формы кислорода. Это молекулы-суперокислители (они же – свободные радикалы), которые играют сигнальную роль. Но, помимо этого, они обладают и немалой химической агрессивностью, являясь основной причиной оксидативного клеточного стресса [21]. А еще один действующий компонент активной формулы T8 ERA MIT UP – комплекс SibXP, содержащий полипренолы, клеточный сок пихты и хвойную пасту CGNC. При этом полипренолы – это многоатомные спирты растительного происхождения, которые обладают выраженной антиоксидантной активностью. Именно это их свойство и важно для улучшения функции митохондрий. Полипренолы химически связывают свободные радикалы, не давая им повреждать митохондриальные мембраны и ферменты. Благодаря этому выработка энергии в клетке и поддерживается на необходимом уровне [22].
Источники
1. Evans A., Neuman N. The Mighty Mitochondria. Molecular Cell. 2016, March, 3, 61 (5): 641.
2. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
3. Gaston D., Tsaousis A.D., Roger A.J. Predicting proteomes of mitochondria and related organelles from genomic and expressed sequence tag data. Methods in Enzymology. 2009, 457: 21-47.
4. Al Rawi S., Louvet-Vallée S., Djeddi A., Sachse M., Culetto E., Hajjar C., Boyd L., Legouis R., Galy V. Postfertilization autophagy of sperm organelles prevents paternal mitochondrial DNA transmission. Science. 2011, 334: 1144-1147.
5. Fu Q., Mittnik A., Johnson P.L., Bos K., Lari M., Bollongino R., Sun C., Giemsch L., Schmitz R., et al. A revised timescale for human evolution based on ancient mitochondrial genomes. Current Biology. 21 March 2013, 23 (7): 553–59.
6. André J. Mitochondria. Biology of the Cell. 1994, 80 (2-3): 103-6.
7. Bock F.J., Tait S.W.G. Mitochondria as multifaceted regulators of cell death. Nature Reviews Molecular Cell Biology. 2020, February, 21 (2): 85-100.
8. Kornmann B. The endoplasmic reticulum-mitochondria encounter structure: coordinating lipid metabolism across membranes. Journal of Biological Chemistry. 2020, May, 26, 401 (6-7): 811-820.
9. Liu X., Hajnóczky G. Ca2+-dependent regulation of mitochondrial dynamics by the Miro-Milton complex. International Journal of Biochemistry and Cell Biology. 2009, 41: 1972-1976.
10. Murphy M.P. How mitochondria produce reactive oxygen species. Biochemistry Journal. 2009, 417: 1-13.
11. Clark A., Mach N. The crosstalk between the gut microbiota and mitochondria during exercise. Frontiers of Physiology. 2017, May 19, 8: 319.
12. Annesley S.J., Fisher P.R. Mitochondria in Health and Disease. Cells. 2019. July, 5, 8 (7): 680.
13. van der Giezen M., Tovar J. Degenerate mitochondria. Reports of European Molecular Biology Organization. 2005, June, 6, (6): 525-30.
14. Duchen M.R. Mitochondria in health and disease: perspectives on a new mitochondrial biology. Molecular Aspects of Medicine. 2004, August, 25 (4): 365-451.
15. Youle R.J., van der Bliek A.M. Mitochondrial fission, fusion, and stress. Science (New York, N.Y.), 2012, 337(6098), 1062–1065.
16. Ashrafi G., Schwarz T.L. The pathways of mitophagy for quality control and clearance of mitochondria. Cell Death & Differentiation. 2013, January, 20 (1): 31-42.
17. Johanningsmeier S.D., Harris G.K. Pomegranate as a functional food and nutraceutical source. Annual Review of Food Science and Technology. 2011-02-28, 2 (1): 181–201.
18. Selma M.V., Beltrán D., Luna M.C., Romo-Vaquero M., García-Villalba R., Mira A., et al. Isolation of Human Intestinal Bacteria Capable of Producing the Bioactive Metabolite Isourolithin A from Ellagic Acid. Frontiers in Microbiology. 2017, 8: 1521.
19. D’Amico D., Andreux P.A., Valdés P., Singh A., Rinsch C., Auwerx J. Impact of the Natural Compound Urolithin A on Health, Disease, and Aging. Trends in Molecular Medicine, May 2021, S1471491421001180.
20. Ryu D., Mouchiroud L., Andreux P.A., Katsyuba E., Moullan N., Nicolet-Dit-Félix A.A., et al. «Urolithin A induces mitophagy and prolongs lifespan in C. elegans and increases muscle function in rodents». Nature Medicine. August 2016, 22 (8): 879–88.
21. Lin M.T., Beal M.F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases. Nature. 2006, October, 19, 443 (7113): 787-95.
22. Михайлова Е.А., Локошко Д.В., Большакова Е.М. Полипренолы и долихолы, как важный компонент антиоксидантной защиты фосфолипидных мембран. Обзор данных современной научной литературы. Современная Российская наука: актуальные вопросы, достижения и инновации: сборник статей II Всероссийской научно-практической конференции, Пенза, 07 мая 2021 года. С. 97-101.