Моча кислая что это значит и как исправить
Что происходит с организмом при избытке мочевой ксилоты
Наверное, вы много раз слышали о гиперурикемии — избыток мочевой кислоты в крови. Но знаете ли вы, о чем конкретно идет речь? Почему возникает такое состояние? И как это угрожает здоровью?
Повышенный уровень мочевой кислоты: причины, симптомы и лечение
Мочевая кислота — это вещество, которое наше тело производит в результате собственного метаболизма. Хотя ее небольшая часть образуется в процессе разложения пурина, типа белка, присутствующего в пище, которую мы потребляем. Чем больше белков мы получаем, тем больше мочевой кислоты вырабатывает организм. Обычно мочевая кислота не вызывает никаких проблем со здоровьем, если она функционально выводится почками. Проблема возникает, когда ее уровень повышается. То есть, когда организм вырабатывает слишком много МК или не выводит ее должным образом.
В таком случае, образуются твердые кристаллы, которые оседают на суставах, вызывая сильную боль.
Основные причины повышенного содержания МК:
Кроме этого, существует несколько факторов риска, которые повышают вероятность заболевания:
Высокое содержание МК может и не вызвать симптомов. Хотя одним из основных последствий этой проблемы является появление подагры, из-за накопления кристаллов кислоты они откладываются в суставах.
Другие симптомы:
Лечение направлено на доведение мочевой кислоты до нормального уровня. Оно основано на диете: минимизации или исключении продуктов с высоким содержанием пурина и потреблении большого количества воды с низким содержанием минералов. Чтобы облегчить боль, вызванную воспалением суставов, можно принимать ибупрофен или противовоспалительные средства, не содержащие стероидов. Врачи часто назначают препараты, которые блокируют всасывание уратов.
Что касается профилактики подагры, то тут применяются ингибиторы ксантиноксидазы. Хотя их не рекомендуется использовать только при возникновении боли в суставах, поскольку состояние может ухудшиться. Очень важно соблюдать диету, чтобы снизить уровень МК.
Вот некоторые из продуктов, на которые нужно обратить внимание:
• Артишок • Лук • Сельдерей • Тыква • Морковь • Хлопья • Яблоки • Клубника • Цитрусовые • Черника • Курица • Яйца • Вода с низкой минерализацией
А это продукты, которые под запретом:
Чтобы избежать повышения уровня МК, нужно следовать некоторым советам:
Эта статья несет информационный характер. Не занимайтесь самолечением и любые советы обсуждайте с врачом.
PH мочи. Нормы, показания, интерпретация результатов. Как снизить pH мочи?
» data-image-caption=»» data-medium-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/12/PH-мочи.-Нормы-показания-интерпретация-результатов..jpeg?fit=450%2C300&ssl=1″ data-large-file=»https://i2.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2021/12/PH-мочи.-Нормы-показания-интерпретация-результатов..jpeg?fit=825%2C550&ssl=1″ />
Анализ мочи — один из наиболее часто запрашиваемых врачами лабораторных анализов. Проводить анализ просто, дешево и быстро. Можно получить результаты общего анализа мочи через несколько часов, чтобы в тот же день узнать, все ли в порядке. В противном случае нужно как можно скорее обратиться к врачу.
Если, например, подозревается инфекция мочевыделительной системы, общий анализ мочи может четко ответить на вопрос, действительно ли произошло инфицирование. Общий анализ мочи позволяет быстро и эффективно диагностировать и начать лечение (обычно после более длительного периода инокуляции).
Анализ мочи измеряет несколько основных параметров, указывающих на здоровье организма. Параметры включают цвет исследуемой мочи, ее удельный вес, pH мочи, наличие глюкозы, а также белок, билирубин и кетоновые тела. Кроме того, общий осмотр — это также оценка осадка и наличия в нем бактерий, плоского эпителия, эритроцитов и лейкоцитов.
О самом анализе мочи и интерпретации каждого из отдельных параметров можно написать несколько страниц. Однако в этой небольшой статье будут рассмотрены только один критерий, а именно pH мочи. Каким должен быть индикатор pH мочи, когда он может измениться, в какой момент следует беспокоиться и что вообще показывает этот индикатор.
Нормы pH мочи
Как и в случае с любым другим тестом, у анализа мочи есть свои стандарты. Описанный в этой статье тест определяет pH мочи.
pH мочи колеблется от 0 до 7; нейтральный — значение принимает pH мочи 7 или щелочной. Тогда значения начинаются с pH мочи 7 и заканчиваются на pH мочи 14.
В случае pH мочи он также бывает кислым, нейтральным. В этом исследовании значения, которые не должны беспокоить, несколько ограничены. Они не имеют того же диапазона, что и весь диапазон pH, и колеблются только в пределах диапазона pH мочи 4,5 — pH 8 мочи. Диапазоны реакции основаны на шкале кислотности-щелочности (pH).
Но зачем вообще проверять pH мочи и что на основании этого можно сделать?
Анализы мочи и, в частности, pH мочи могут предоставить много информации, в том числе:
Нормальный pH мочи
Какой правильный pH мочи? Казалось бы, поскольку pH мочи 7 указывает на нейтральный pH мочи, именно pH мочи 7 является наиболее желательным и считается идеальным результатом теста. Фактически, pH 6,5 считается наиболее оптимальным pH мочи. У здоровых людей без выявленных нарушений обмена веществ, соблюдающих сбалансированное питание, моча должна быть слабокислой. Значение ниже нейтрального уровня связано с безопасностью. Кислая среда способствует росту низкому проценту микроорганизмов. И бактерии, и грибки плохо себя чувствуют в такой среде, поэтому, если моча слегка кислая, человек может чувствовать безопасность.
Слегка низкий или слегка повышенный pH мочи
Однако иногда при проверке pH мочи при общем осмотре выясняется, что pH повышен. Как правило, небольшие изменения, такие как pH мочи 7 или pH 6, являются стандартными и в большинстве случаев не указывают на какую-либо угрозу здоровью. Такие небольшие изменения могут быть результатом недостаточного или чрезмерного увлажнения тела. Еще одно объяснение — ежедневный рацион.
Люди, которые едят больше продуктов животного происхождения, обычно имеют кислый pH мочи. Вегетарианцы будут иметь щелочной pH мочи. Ни в том, ни в другом случае это не особо опасный показатель. Но следует помнить, что лучше всего, если диета будет разнообразной и не вызывает отклонений ни в одном из параметров нашего тела.
Низкий pH мочи
Что делать, если низкий pH мочи? Что ж, проблема может начаться, если нормы pH мочи значительно отклонятся от установленных норм.
С более кислой мочой, pH которой колеблется в районе 4,5-5, можно сделать вывод, что эти значения неверны и требуют консультации врача.
Очень низкий pH мочи может указывать на заболевание почек, включая почечную недостаточность. Кроме того, легко распознать неправильно регулируемый диабет, потому что он вызывает кислотность мочи.
Заболевания легких также могут быть еще одной причиной повышенной кислотности мочи. Эмфизема также характеризуется низким уровнем pH мочи человека.
Щелочная моча
Проблема также может возникнуть, если моча имеет pH выше 7. Результат мочи 8, конечно, все еще является значением в пределах нормального диапазона, и, как уже упоминалось ранее, это значение также не должно означать ничего серьезного. Влияние вегетарианской диеты также может привести к этому значению в общем исследовании. Однако обычно значительная щелочность мочи, то есть pH между pH 7 и 8, позволяет предположить или просто подтвердить (с дополнительными параметрами, например, анализом осадка мочи) об инфекции мочевыделительной системы.
Щелочной pH, помимо инфекций мочевыводящих путей, заболеваний почек или диеты, богатой калием (гиперкалиемия), также является показанием для тестов на работу паращитовидных желез и, опять же, дыхательной системы. Хотя повышенная кислотность мочи может быть вызвана эмфиземой, чрезмерное повышение pH, то есть повышение щелочности мочи, иногда является симптомом астмы.
Один параметр и множество различных интерпретаций помогают в диагностике и лечении заболеваний, связанных не только с выделительной системой. Анализ мочи — это не только анализ, проводимый при подозрении на заболевания или инфекции мочевыделительной системы. Он дает общее представление о состоянии здоровья, и простое изменение pH может помочь определить, в чем проблема.
Добавить комментарий Отменить ответ
Вы должны быть авторизованы, чтобы оставить комментарий.
Влияние рН мочи на процессы камнеобразования при уролитиазе
Просянников М.Ю., Анохин Н.В., Голованов С.А., Сивков А.В., Аполихин О.И.
Сведения об авторах:
ВВЕДЕНИЕ
Кислотность (pH) мочи является одним из ключевых показателей, позволяющих оценить активность процессов литогенеза при мочекаменной болезни (МКБ).
Нормальные показатели pH мочи могут варьировать в достаточно широких пределах. Это связано с тем, что pH мочи не является жесткой физиологической константой организма, как, например, pH крови. Показатель pH мочи можно отнести к так называемым мягким или пластичным физиологическим константам, которые могут отклоняться от стабильного уровня в относительно широких пределах без существенных изменений для функционирования организма.
Согласно современным представлениям о патогенезе МКБ, изменения pH мочи играют одну из ключевых ролей в процессах камнеобразования [1]. Исследованы и описаны показатели pH мочи, специфичные для образования того или иного типа мочевых камней [2]. Определены значения pH мочи, которые являются фактором риска литогенеза и, напротив, при которых процессы камнеобразования не протекают или протекают не столь интенсивно.
Хорошо известно, что кристаллизация кальция фосфата, мочевой кислоты, струвита, цистина напрямую зависит от показателей pH мочи [3]. Известно, что риск образования мочекислых конкрементов возрастает при pH мочи 6,5. Струвитные камни образуются pH мочи >7,0 [2].
При этом изменения pH мочи могут быть связаны не только с МКБ, но и с другими патологическими процессами, в том числе протекающими в мочевыделительных путях (уротелиальный рак, метаболические нарушения) [4,5].
Известны хронические неинфекционные заболевания, для которых характерны изменения pH мочи. Одним из наиболее распространенных хронических заболеваний, при котором наблюдается снижение pH мочи, является ожирение и метаболический синдром. Доказано, что значения показателя pН мочи обратно пропорциональны индексу массы тела (ИМТ) у пациентов с МКБ. Высокий ИМТ увеличивает риск развития МКБ [6]. Известно, что у пациентов, страдающих ожирением и имеющих ИМТ >33,1 кг/м2, выше риск развития мочекислых и струвитных конкрементов [7].
Некоторые авторы полагают, что у пациентов, страдающих метаболическим синдромом и ожирением, инсулинорезистентность может выступать в качестве патогенетической основы нарушенного кислотно-основного равновесия, приводящего в конечном счете к ацидификации мочи 8. Проведенные исследования продемонстрировали, что инсулинорезистентность способна приводить к нарушению экскреции иона аммония (NH4+) что, в свою очередь, служит причиной снижении pH мочи у данной группы пациентов 10.
Известно, что к изменениям pH мочи также могут приводить такие состояния как почечный канальциевый ацидоз (ПКА), хроническая уреазопродуцирующая инфекция мочевых путей [11, 12].
Помимо патологических процессов, протекающих в мочевых путях, метаболического синдрома, ПКА к изменению показателей pH мочи могут приводить особенности питания человека. Обычно, частое употребление богатой животным белком пищи, злоупотребление алкоголем приводит к подкислению мочи [13]. Высокие показатели pH мочи наблюдаются при соблюдении вегетарианской диеты, использовании щелочных добавок [13].
Таким образом, pH мочи, с одной стороны, является одним из значимых маркеров, сигнализирующих о наличии патологических изменений как в организме в целом, так и в мочевыделительной системе в частности. С другой стороны, pH мочи остается одним из ключевых параметров, регулирующих состояние мочевыделительной системы, определяющих тип метаболических литогенных нарушений при МКБ.
Учитывая все вышесказанное, целью данной работы стало изучение влияния pH мочи на образование мочевых камней различного химического состава и на уровень экскреции с мочой основных камнеобразующих веществ.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на базе НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
В исследовании были изучены данные 708 пациентов (303 мужчины и 405 женщины) с диагнозом МКБ, проходивших как амбулаторное, так и стационарное лечение на базе института. Исследование проводилось ретроспективно.
Всем пациентам выполнялся биохимический анализ крови (кальций, натрий, магний, фосфор, хлор, мочевая кислота, мочевина, креатинин), биохимический анализ суточной мочи (определение pH утренней мочи, кальций, натрий, магний, фосфор, хлор, мочевая кислота, мочевина, креатинин), определение химического состава мочевого камня.
Биохимическое исследование крови и мочи выполнялось на анализаторе ADVIA 1200 (Bayer-Siemens) по стандартным методикам с помощью диагностических наборов реагентов фирмы Siemens (Германия).
Определение химического состава мочевого камня выполнялось методом инфракрасной спектроскопии с использованием спектрометра Nicolet iS10 (Thermo Scientific, США). В процессе работы применялась стандартная библиотека спектров мочевых камней, предоставленная производителем. Распределение смешанных мочевых камней по группам происходило следующим образом: при наличии в составе исследуемого конкремента более 50% минерального компонента идентичного заявленного в группе данные о пациенте заносились в соответствующую группу. Такой подход к классификации типов мочевых конкрементов является наиболее распространенным 15.
Поиск статистической зависимости между частотой встречаемости типов мочевых камней и величиной pH мочи выполнялся с помощью критерий χ2-квадрат Пирсона с введенной формулой в Microsoft Excel.
РЕЗУЛЬТАТЫ
В зависимости от показателей pH мочи все больные были разделены на несколько групп (табл. 1):
Таблица 1. Распределение типов мочевых камней пациентов по группам в зависимости от показателей pH мочи (в % от общего числа камней в группе)
Table 1. Urinary stones types distribution by groups depending on the urine pH (% of the total number of stones in the group)
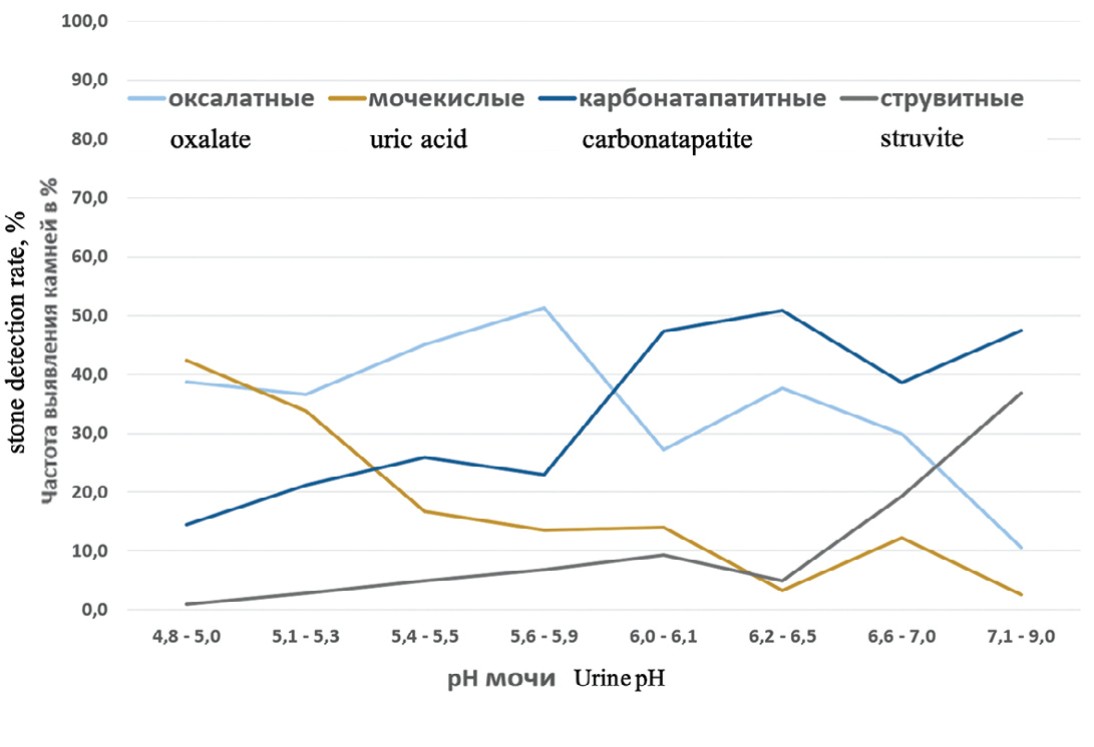
Рис. 1. Частота встречаемости основных типов мочевых камней (в % от общего количества) в зависимости от рН мочи
Fig. 1. Frequency of occurrence of the main types of urinary stones (in % of the total amount) depending on urine pH
Анализ полученных данных показал, что частота встречаемости мочевых камней, состоящих из мочевой кислоты, снижается по мере роста показателей pH мочи с 42,3% (pH1) до 2,6% (pH8) (р=0,0000004) (рис.1, табл. 1).
Результаты проведенного исследования во многом совпадают с данными, представленными в других похожих работах [16,17]. Считается, что низкие показатели pH мочи являются одним из основных факторов риска развития мочекислого уролитиаза. Известно, что при смещении показателей pH мочи в кислую сторону снижается и растворимость мочевой кислоты в моче [18]. Так, при pH мочи равном 5,35 для получения перенасыщенного раствора необходимо добиться концентрации мочевой кислоты в моче 200 мг/л. При pH мочи равном 6,5 для получения перенасыщенной мочи необходимо уже 1200 мг/л мочевой кислоты [18]. Таким образом, pH мочи является одним из основных факторов, стимулирующих мочекислый литогенез.
Помимо низких показателей pH мочи ( 5,9 является одним из основных методов профилактики рецидива мочекислого уролитиаза.
Частота встречаемости кальций-оксалатных конкрементов возрастала в интервалах pH 5,1 (pH2) – 5,9 (pH4) и 6,1 (pH5) – 6,5 (pH6) (табл.1, рис.1). При этом в интервалах pH 5,6 (pH4) – 6,1 (pH5) и 6,5 (pH6) – 9,0 (pH8) было зафиксировано резкое снижение частоты встречаемости кальций-оксалатных мочевых камней (табл. 1, рис. 1).
Существует мнение, что как местный, так и системный ацидоз способен стимулировать кальций-оксалатный литогенез. Ацидоз подавляет экспрессию и активность кальциевого канала TRPV5, который локализован в конце дистальной извитой канальца [20]. В то же время, ацидоз увеличивает экспрессию кальцийсвязывающего белка кальбиндина 28к [21]. Таким образом, местный и системный ацидоз способен стимулировать экскрецию с мочой кальция и фосфора и тем самым увеличивать риск образования кальцийоксалатных мочевых камней.
Полученные в настоящем исследовании данные частично подтверждают результаты предыдущих работ: анализ показал, что наибольшие показатели кальциурии наблюдались при pH мочи 5,4 (pH3) – 6,1 (pH5) (табл. 2, рис. 2). Максимальный уровень экскреции кальция с мочой был зафиксирован при pH мочи 5,6-5,9 (pH4).
Таким образом, ацидоз стимулирует увеличение уровня экскреции кальция с мочой. Однако в то же время, необходимо подчеркнуть, что самый высокий уровень кальциурии (6,184 ммоль/сут) был зафиксирован при умеренном смещении pH мочи в кислую сторону (5,4-6,1), в то время как при резко кислой моче (pH мочи 5,9, фосфатного (карбонатапатитного) уролитиаза 5,9, при струвитных камнях
Метаболические факторы риска и формирование мочевых камней. Исследование III: Влияние pH мочи
С.А. Голованов, А.В. Сивков, А.М. Поликарпова, В.В. Дрожжева, М.И. Андрюхин, М.Ю. Просянников
Важным фактором, способным оказывать модулирующее влияние на образование камней в почках является рН мочи. Этот показатель используется как для оценки риска камнеобразования, так и для контроля результата противорецидивного лечения у пациентов с мочекаменной болезнью (МКБ) [1,2]. В норме моча слегка кислая с рН в среднем около 6,0, хотя кислотность ее у здорового человека может варьировать от 4,5 до 8,0 [3,4]. Кислотность мочи может изменяться при таких заболеваниях, как опухоли уротелия, нарушения обмена веществ и мочекаменная болезнь [5,7]. При МКБ, как установлено, кислотность мочи способна влиять на различные стадии камнеобразования, включая кристаллизацию, рост, агрегацию и ретенцию камня в мочевых путях 9. Кроме того, рН мочи является важным фактором, который может способствовать формированию твердой (кристаллической) фазы и оказывать литолитический эффект в отношении мочевых камней [11,12]. Формирование некоторых типов мочевых камней, (оксалатных, фосфатных, уратных, цистиновых) в значительной степени зависит от рН мочи [1,8,12]. Щелочная реакция мочи рН мочи способствует формированию фосфат-содержащих камней, тогда как кислая рН мочи связана с образованием уратных и цистиновых камней [13,14].
Однако кислотность мочи является не единственным фактором, определяющим способность мочи к камнеобразованию, то есть, ее литогенные свойства. Повышение литогенности мочи происходит при нарушении экскреции различных ионов и веществ, способных влиять на камнеобразование [15]. Известен целый ряд различных ионов и веществ, нарушение экскреции которых с мочой, может повышать литогенный потенциалмочи, который, по-видимому, является результатом взаимного влияния друг на друга как метаболических, так и физико-химических факторов, включая рН мочи [15].
В опубликованных ранее работах исследовали зависимость формирования камней определенной химической природы от интенсивности воздействия таких метаболических факторов риска МКБ, как кальцийурии, уратурии, фосфатурии и магнийурии [16,17].
Цель работы: учитывая важное модифицирующее влияние рН мочи на литогенез, исследовать влияние этого физико-химического фактора на выраженность изучаемых метаболических факторов риска камнеобразования, а также на частоту и риск формирования мочевых камней различных метаболических типов.
МАТЕРИАЛЫ И МЕТОДЫ
Обследовано 636 больных МКБ (274 мужчин и 362 женщин в возрасте от 16 до 77 лет). Минеральный состав мочевых конкрементов и метаболические показатели определяли методами описанными ранее [16], рН утренней мочи определяли на анализаторе AutionMaxAX-4280 (фирмы Arcray, Япония). Значения показателей рН мочи были разделены на семь диапазонов, которые использовали в качестве факторов в дисперсионном анализе (модуль ANOVA программы Statistica v.10), а величины суточной экскреции кальция, мочевой кислоты, фосфатов, магния и процент содержания некоторых минералов в мочевых камнях в качестве зависимых переменных. Классификацию мочевых камней проводили по преобладающему минеральному компоненту (более 50% всей минеральной основы) 19.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
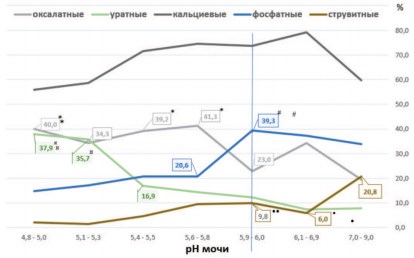
Результаты анализа показывают, что величина рН мочи оказывает заметное влияние на частоту образования камней различных метаболических типов у пациентов с МКБ (рис. 1).
Рис.1. Частота выявления основных типов камней (в %) при различных величинах рН мочи. *p 60% состава), формируется при кислых значениях рН мочи.
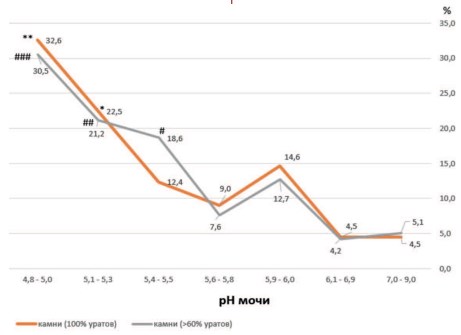
Рис. 5. Преимущественное формирование уратных камней (частота выявления в %) при кислых значениях рН мочи (ниже рН 5,6-5,8). Обозначения: *p 6,0
Камни
Камни
ЛИТЕРАТУРА
1.Grases F, Costa-Bauza A, Prieto RM. Renal lithiasis and nutrition. Nutr J 2006;5:23. doi:10.1186/1475-2891-5-23.
2. Barbas C, Garcia A, Saavedra L, Muros M. Urinary analysis of nephrolithiasis markers. J Chromatogr B Analyt Technol Biomed Life Sci, 2002;781(1-2):433-55. doi:10.1016/S1570-0232(02)00557-3.
3. Welch AA, Mulligan A, Bingham SA, Khaw KT. Urine pH is an indicator of dietary acid-base load, fruit and vegetables and meat intakes: results from the European Prospective Investigation into Cancer and Nutrition (EPIC)-Norfolk population study. Br J Nutr 2008;99(6):1335-43. doi:10.1017/S0007114507862350.
4.Thongboonkerd V, Mungdee S,Chiangjong W. Should urine pH be adjusted prior to gel-based proteome analysis? J Proteome Res 2009; 8(6):3206-11. doi:10.1021/pr900127x.
5. Ide H, Kikuchi E, Hagiwara M, Hayakawa N, Hongo H, Miyajima A, et al. Urinary pH levels are strongly associated with bladder recurrence after nephroureterectomy in upper tract urothelial carcinoma patients with a smoking history. Ann Surg Oncol 2016;23(Suppl 5):1029-1038.
6. Cho YH, Lee SY, Jeong DW, Choi EJ, Nam KJ, Kim YJ, et al. The association between a low urine pH and the components of metabolic syndrome in the Korean population: Findings based on the 2010 Korea National health and nutrition examination survey. J Res Med Sci 2014;19(7):599-604.
7. Bihl G, Meyers A. Recurrent renal stone disease-advances in pathogenesis and clinical management. Lancet 2001;358(9282):651-6. doi:10.1016/S0140-6736(01)05782-8.
8. Tiselius HG. A hypothesis of calcium stone formation: an interpretation of stone research during the past decades. Urol Res 2011;39(4):231-43. doi:10.1007/s00240-010-0349-3.
9. Han H, Segal AM, Seifter JL, Dwyer JT. Nutritional Management of Kidney Stones (Nephrolithiasis). Clin Nutr Res 2015;4(3):137-52. doi:10.7762/cnr.2015.4.3.137.
10. Ratkalkar VN, Kleinman JG. Mechanisms of Stone Formation. Clin Rev Bone Miner Metab 2011;9(3-4):187-197. doi:10.1007/s12018-011-9104-8.
11. Worcester EM, Coe FL. Nephrolithiasis. Prim Care 2008;35(2):369-91. doi:10.1016/j.pop.2008.01.005, vii.
12. McKay CP. Renal stone disease. Pediatr Rev 2010;31(5):179-88. doi:10.1542/pir.31-5-179.
13. Grases F, Costa-Bauzá A, Gomila I, Ramis M, García-Raja A, Prieto RM. Urinary pH and renal lithiasis. Urol Res 2012;40(1):41-6. doi:10.1007/s00240-011-0389-3.
14. Wagner CA. Mohebbi N. Urinary pH and stone formation. J Nephrol 2010;23(Suppl 16):S165-9.
16. Голованов СА, Сивков АВ, Дрожжева ВВ, Анохин НВ. Метаболические факторы риска и формирование мочевых камней. Исследование I: влияние кальцийурии и урикурии. Экспериментальная и клиническая урология 2017;(1):52 – 57.
17. Голованов СА, Сивков АВ, Дрожжева ВВ, Анохин НВ. Метаболические факторы риска и формирование мочевых камней. Исследование II: влияние фосфатурии и магнийурии. Экспериментальная и клиническая урология 2017;(2):42 – 48.
18. Rendina D, De Filippo G, De Pascale F, Zampa G, Muscariello R, De Palma D et al. The changing profile of patients with calcium nephrolithiasis and the ascendancy of overweight and obesity: a comparison of two patient series observed 25 years apart. Nephrol Dial Transplant 2013;28 (Suppl 4):iv146-51. doi: 10.1093/ndt/gft076.
19. Cho ST, Jung SI, Myung SC, Kim TH. Correlation of metabolic syndrome with urinary stone composition. Int J Urol 2013;20(2):208-13. doi: 10.1111/j.1442-2042.2012.03131.x.
20. Daudon M, Lacour B, Jungers P. Influence of body size on urinary stone composition in men and women. Urol Res 2006;34(3):193-9. doi: 10.1007/s00240-006-0042-8.
21. Manissorn J, Fong-Ngern K, Peerapen P, Thongboonkerd V. Systematic evaluation for effects of urine pH on calcium oxalate crystallization, crystal-cell adhesion and internalization into renal tubular cells. Sci Rep 2017;7(1):1798. doi: 10.1038/s41598-017-01953-4.
22. Parks JH, Worcester EM, Coe FL, Evan AP, Lingeman JE. Clinical implications of abundant calcium phosphate in routinely analyzed kidney stones. Kidney Int 2004;66(2):777-85.
23. Coe FL, Evan AP, Worcester EM, Lingeman JE. Three pathways for human kidney stone formation. Urol Res 2010;38(3):147-60. doi: 10.1007/s00240-010-0271-8.
24. Hesse A, Schneider HJ, Berg W, Hienzsch E. Uric acid dihydrate as urinary calculus component. Invest Urol 1975;12(5):405-9.
25. Atsmon A, deVries A, Frank M. Uric Acid Lithiasis. Amsterdam: Elsevier; 1963. pp 423-427
26. Sakhaee K. Epidemiology and clinical pathophysiology of uric acid kidney stones. J Nephrol 2014;27(3):241-5. doi: 10.1007/s40620-013-0034-z.
27. Abou-Elela A. Epidemiology, pathophysiology and management of uric acid urolithiasis: a narrative review. J Adv Res 2017;8(5):513-527. doi: 10.1016/j.jare.2017.04.005.
28. Daudon M, Frochot V. Crystalluria. ClinChem Lab Med 2015;53 (Suppl 2):s1479-87. doi: 10.1515/cclm-2015-0860.
29. Finlayson B, Smith A. Stability of first dissociable proton of uric acid. J Chem Eng Data 1974;19:94-97.
30. Grases F, VillacampaAI,Costa-BauzaA, Sohnel O. Uric acid calculi: types, etiology and mechanisms of formation. Clin Chim Acta 2000;302(1-2):89-104.
31. Grases F, Sanchis P, Isern B, Perello J, Costa-Bauza A. Uric acid as inducer of calcium oxalate crystal development. Scand J Urol Nephrol 2007;41(1):26-31. doi: 10.1080/00365590600831571/
32. Grases F, Costa-Bauza A, Ramis M, Montesinos V, Conte A. Simple classification of renal calculi closely related to their micromorphology and etiology. Clin Chim Acta 2002\322(1-2):29-36.
33. Grases F, Sanchis P, Perello J, Costa-Bauza A. Role of uric acid in different types of calcium oxalate renal calculi. Int J Urol 2006;13(3):252-6.
34. Elliot JS, Sharp RF, Lewis L. The solubility of struvite in urine. J Urol 1959;81(3):366-8.
35. Hesse A, Heimbach D. Causes of phosphate stone formation and the importance of metaphylaxis by urinary acidification: a review. World J Urol 1999;17:308-315.
36. Siener R, Struwe F, Hesse A. Effect of L-Methionine on the Risk of Phosphate Stone Formation. Urology. 2016;98:39-43. doi: 10.1016/ j.urology.2016.08.007
37. Jacobs D, Heimbach D, Hesse A. Chemolysis of struvite stones by acidification of artificial urine. Scand J Urol Nephrol 2001;35:345-349.
38. Hesse A, Tiselius HG, Siener R, Hoppe B. Urinary Stones: Diagnosis, Treatment, and Prevention of Recurrence. 3rd ed. Basel: Karger; 2009. 39. Jarrar K, Boedeker RH, Weidner W. Struvite stones: long term follow up under metaphylaxis. Ann Urol (Paris). 1996;30(3):112-7.
Статья опубликована в журнале «Экспериментальная и клиническая урология». Номер №1/2018 стр. 84-91