Модель атома томсона противоречила опыту резерфорда потому что
Строение планетарной модели атома Томсона: плюсы и минусы
Модель атома Томпсона — что из себя представляет
Модель атома Томпсона является одной из ранних моделей, описывающей строение атома, которая в дальнейшем была признана несостоятельной.
Рассматриваемая модель атома была представлена в 1904 году Д.Д. Томпсоном. Открытию предшествовало обнаружение электронов, а после формулировки гипотезы было обнаружено атомное ядро.
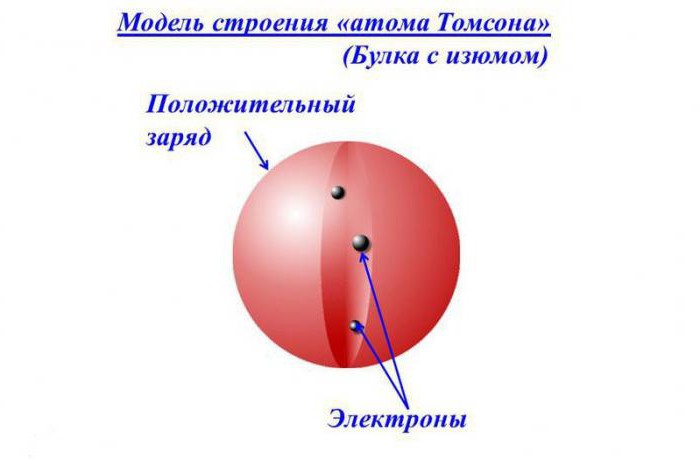
Томпсон выдвинул предположение о том, что атом является равномерно распределенным по всему объему зарядом со знаком плюс. Положительно заряженное «облако» содержит внутри небольшие электроны с отрицательным зарядом, расположение которых определено случайно.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Подобная модель напоминает пудинг с изюмом. Общий заряд атома нейтрален, что обусловлено равенством по модулю суммарного заряда электронов и заряда «облака». Данную модель нередко называют «пудинговой моделью атома».
Предыстория открытия, чем отличалась от модели Резерфорда
В физике 1897 год отмечен знаменательным событием. В это время Джозефом Джоном Томпсоном были открыты электроны. Таким образом, ученому удалось экспериментальным путем подтвердить гипотезу о том, что атом – не «монолитная» частица. Вместе с тем отсутствовало точное представление о характере элементарных частиц.
В результате серии опытов был определен отрицательный заряд электронов. При этом имелась информация о нейтральном заряде атомов. Томпсон выдвинул предположение о наличии некого источника положительного заряда в атоме, что позволяет компенсировать отрицательный заряд электронов. Английским физиком было выдвинуто несколько вероятных механизмов взаимодействия частиц, находящихся внутри атома:
Ученый остановился на третьем варианте, который казался ему наиболее вероятным, отражающим структуру атомов. Публикация модели атома Томпсона состоялась в 1904 году в мартовском выпуске издания Philosophical Magazine. Журнал пользовался авторитетом в Британии.
Мнение автора заключалось в том, что атомы элементов включают в себя определенное количество отрицательно наэлектризованных корпускул или электронов, которые заключены в сферу равномерной положительной электризации. Тем самым, ученый отказался от предшествующей своей теории о «туманном атоме», согласно которой частицы состояли из нематериальных вихрей.
Научное сообщество проявило большой интерес к публикации Томпсона. Однако гипотеза столкнулась с критикой со стороны многих авторитетных физиков по причине отсутствия прочных доказательств. С другой стороны, рассматриваемая модель атома полностью отвечала представлениям и результатам экспериментов, которые были известны в то время.
Только в 1911 году была представлена более точная модель атома Резерфорда. Отличие от модели Томпсона заключается в том, что, согласно представлениям Резерфорда, положительный заряд расположен в малой области атома, а компенсирующие электроны окружают его. К такому утверждению ученый пришел в результате экспериментов по бомбардировке атомов. В дальнейшем данная модель рассматривалась в качестве планетарной модели атома по Резерфорду.
Как описывал атом Томпсон, почему модель назвали «Пудинг с изюмом»
Томпсон был известен, как проницательный и практичный ученый. Основываясь на известных экспериментальных данных, он выдвинул гипотезу об атомной модели. Предположение о том, что объем заряда положительный, является отражением научного подхода Томпсона к открытию, которое стало руководством к действию для дальнейших экспериментов.
Исходя из теории, стабилизация орбит электронов внутри атомной модели Томпсона объясняется воздействием возрастающей силы притяжения на электрон, удаляющийся от центра положительно заряженной сферы или облака. Данное воздействие способствует возвращению электрона, что обусловлено законом Гаусса, подтверждающим более высокую концентрацию положительного заряда во внутренней области сферы.
Рассматриваемая модель предполагает свободное вращение электронов по кольцам, дополнительно стабилизированным, благодаря взаимодействию электронов между собой. С помощью спектроскопических значений объяснялись энергетические различия между отдельными кольцевыми орбитами.
По представлениям тех времен, расположение электронов в сфере с положительным зарядом напоминало изюм в пироге или фруктовые кусочки в сливовом пудинге. В связи с этим концепция приобрела название «пудинговой» модели атома.
Плюсы и минусы теории
Модель Томпсона является объяснением излучения атомов. Однако весь комплекс эмпирических данных по спектрам атома не был подтвержден в этой модели. Формулы определенных химических элементов описали их спектры, но противоречили рассматриваемой модели. Таким образом, с помощью модели Томпсона не получилось объяснить дискретный характер, которым обладают спектры атомов.
Проблема также заключалась в описании устойчивости атома. Представленная модель не могла охарактеризовать рентгеновское и гамма-излучения, которые испускают атомы. Кроме того, отсутствовали пояснения относительно определения размеров атома. Модель противоречила опытам, направленных на изучение того, как распределяется положительный заряд в атоме. Спустя некоторое время после создания модель Томсона признали ошибочной.
В настоящее время рассматриваемая модель имеет историческое значение и, несмотря на несостоятельность, является важным элементом в цепочке развития научных знаний о строении вещества. В качестве еще одного достоинства модели атома Томпсона можно отметить ее простоту. Благодаря этому преимуществу, гипотезу удалось опровергнуть и продвигать науку дальше.
Дилемма несоответствия, дальнейшее развитие
С увеличением объема экспериментальных данных научное сообщество убеждалось в том, что сущность модели атома Томпсона не соответствовала действительности. Попытки ученого усовершенствовать выдвинутую гипотезу не увенчались успехом. Томпсону не удалось объяснить некоторые из ключевых спектральных линий, которые были выявлены опытным путем при исследовании состава нескольких элементов.
В 1909 году Ганс Гейгер и Эрнест Марсден под кураторством профессора Эрнеста Резерфорда поставили опыты над тонким золотым листом. Схема эксперимента заключалась в рассеивании альфа-частиц на фольге из золота. Полученные данные не оправдали ожидания. В 1911 году Резерфорд по итогу длительных размышлений представил миру собственную концепцию, которая затем получила название «модель атома Резерфорда».
Ученый предположил, что в центральной области атомов золота находится очень маленькое ядро, обладающее мощным положительным зарядом, что позволяет удержать порядка ста электронов.
Сразу после публикации гипотезы Резерфорда было выдвинуто предположение ученым Антониусом Ван ден Бруком о равенстве атомного номера элемента общему количеству единиц заряда, которые присутствуют в его ядре. В 1913 году Генри Мозли предоставил нужную информацию, доказывающую теорию Ван ден Брука. Было установлено соответствие эффективного ядерного заряда атомному номеру.
Исследование легло в основу характеристики полуклассической модели атомов, созданной Нильсом Бором в 1913 году. Данная модель напоминает то, как взаимодействуют Солнце и планеты в Солнечной системе, но при наличии квантовых ограничений.
Хаас опубликовал работу на три года раньше, чем были представлены выводы Нильса Бора. Важно заметить, что боровская модель обеспечивает достаточно точные прогнозы для атомных и ионных систем, имеющих один эффективный электрон. С помощью теории «пудинга» можно рассчитать оптимальное распределение идентичных точечных зарядов на единичной сфере, которую называют проблемой Томпсона.
Электростатическое взаимодействие электронов, которые ограничены с помощью сферических квантовых точек, идентично их обработке в атомной модели Томпсона. Классическая задача подразумевает моделирование квантовой точки как простой диэлектрической сферы со свободными или избыточными электронами, а не однородной сферы с положительным зарядом, которая описана в модели «пучкового пудинга».
Строение атома
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: планетарная модель атома.
Атомы каждого химического элемента имеют строго индивидуальный линейчатый спектр, присущий только данному элементу и не меняющийся от опыта к опыту. Как это можно объяснить? Как вывести формулу, дающую весь набор частот атомного спектра? Чтобы сделать это, нужно узнать, как устроен атом.
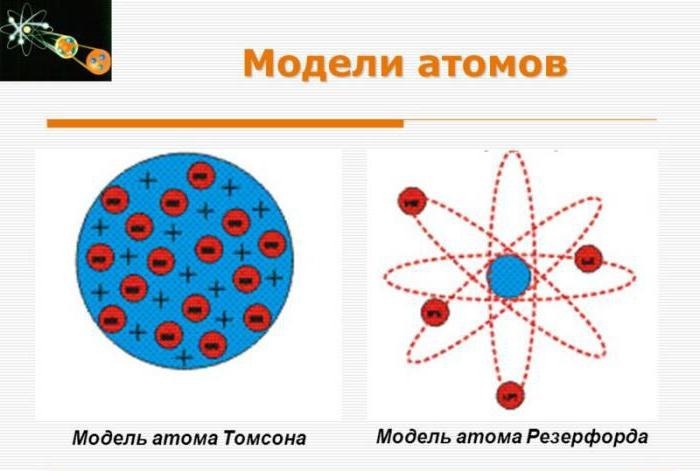
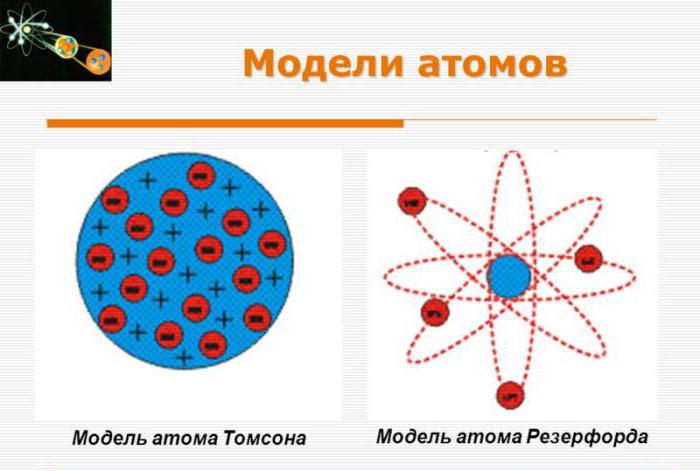
Модель Томсона
Первую модель строения атома придумал английский физик Джозеф Джон Томсон (удостоенный Нобелевской премии за открытие электрона). В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. Физики называли модель Томсона «пудинг с изюмом».
Согласно Томсону атом представляет собой шар размером порядка см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны (рис. 1 ).
Рис. 1. Модель атома Томсона
Суммарный заряд электронов в точности равен положительному заряду шара, поэтому атом в целом электрически нейтрален.
Излучение атомов объясняется колебаниями электронов около положений равновесия (как вы помните, любой ускоренно движущийся заряд излучает электромагнитные волны). Однако вся совокупность экспериментальных данных по атомным спектрам не укладывалась в модель Томсона. Например, для некоторых химических элементов были подобраны формулы, хорошо описывающие их спектры, но эти формулы из модели Томсона никак не следовали.
Опыты Резерфорда
Но в те времена об атомных ядрах ещё ничего не знали — о них Резерфорду лишь предстояло догадаться, глядя на результаты своих знаменитых опытов!
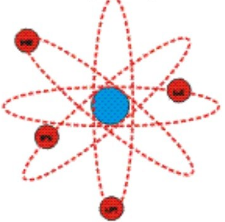
Планетарная модель атома
Эта величина на пять порядков (в сто тысяч раз!) меньше размера атома. Так на смену модели Томсона пришла планетарная модель атома (рис. 3 ).
Рис. 3. Планетарная модель атома
В центре атома находится крошечное положительно заряженное ядро, вокруг которого, словно планеты вокруг Солнца, движутся электроны. Между ядром и электронами действуют силы кулоновского притяжения, но упасть на ядро электроны не могут за счёт своего движения — точно так же, как и планеты не падают на Солнце, хоть и притягиваются к нему.
Заряд ядра по модулю равен суммарному заряду электронов, так что атом в целом электрически нейтрален. Однако электроны могут быть выбиты из своих орбит и покинуть атом — тогда атом превращается в положительно заряженный ион.
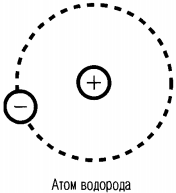
Масса электронов составляет очень малую часть общей массы атома. Например, в атоме водорода всего один электрон, и его масса в раз меньше массы ядра. Следовательно, почти вся масса атома сосредоточена в ядре — и это при том, что ядро в сто тысяч раз меньше самого атома.
Чтобы лучше почувствовать соотношение масштабов атома и ядра, представьте себе, что атом стал размером с Останкинскую телебашню ( м). Тогда ядро окажется горошиной размером мм, лежащей у вас на ладони. И тем не менее, почти вся масса атома заключена в этой горошине!
Модель атома Томсона: описание и опровержение
Модель атома Томсона – одна из ранних моделей строения атома, впоследствии признанная несостоятельной. Впервые предложена Д.Д. Томсоном в 1904 году вскоре после открытия электронов, но до открытия атомного ядра.
Предыстория
В 1897 году в физике произошло знаменательное событие: Томпсон Джозеф Джон открыл электроны, тем самым экспериментально подтвердив предположение, что атом не является «монолитной» частицей. Однако точного представления, что же из себя представляют элементарные частицы, не было. Лишь в 1911 году будет представлена более точная модель атома Резерфорда, а до этого научный мир лихорадочно бился над «загадкой столетия».
Поиск ответа
После серии экспериментов выяснилось, что электроны отрицательно заряжены, а между тем уже было известно, что атомы имеют нейтральный заряд. Томсон разумно предположил, что в атоме должен быть некий источник положительного заряда для компенсации отрицательного заряда электронов.
Английский физик представил три возможных механизма взаимодействия внутри частиц.
Внимание общественности
Модель атома Томсона в 1904 году была опубликована в мартовском выпуске Philosophical Magazine – авторитетном научном журнале Британии. По мнению автора, атомы элементов состоят из ряда отрицательно наэлектризованных корпускул (электронов), заключенных в сферу равномерной положительной электризации. Томсон отказался от более ранней своей гипотезы «туманного атома», в которой частицы состояли из нематериальных вихрей.
Публикация вызвала неподдельный интерес у научного сообщества. Однако прочных доказательств она не имела, а, следовательно, критиковалась многими авторитетными физиками. Впрочем, она соответствовала тем представлениям и экспериментальным данным, которые были известны на то время.
Описание модели
Будучи проницательным и практичным ученым, Томсон основывал свою атомную модель на известных экспериментальных данных. Предложение о положительном объеме заряда отражает характер его научного подхода к открытию, которое стало руководством к действию для будущих экспериментов.
Согласно теории, орбиты электронов внутри атомной модели Томсона были стабилизированы тем, что, когда электрон удалялся от центра положительно заряженной сферы (облака), он подвергался воздействию увеличивающейся силы притяжения. Эта сила возвращает электрон обратно, поскольку по закону Гаусса, внутри сферы более высокая концентрация положительного заряда. Согласно модели, электроны могли свободно вращаться по кольцам, которые были дополнительно стабилизированы взаимодействием между электронами, а спектроскопические значения объясняли энергетические различия между отдельными кольцевыми орбитами.
Согласно представлению того времени, электроны располагались в положительно заряженной сфере словно изюминки в пироге, или кусочки фруктов в любимом англичанами десерте – сливовом пудинге. Поэтому концепцию еще называют «пудинговой» моделью атома.
Дилемма несоответствия
По мере накопления экспериментальных данных все отчетливее наблюдалось несоответствие данной теории. Томсон безуспешно пытался переделать свою модель, чтобы объяснить некоторые из основных спектральных линий, экспериментально выявленных для нескольких элементов.
В 1909 году Ганс Гейгер и Эрнест Марсден под кураторством профессора Эрнеста Резерфорда провели эксперименты с тонким листом золота, рассеивая альфа-частицы на золотой фольге. Данные оказались отличными от ожидаемых. В 1911 году Резерфорд после долгих размышлений опубликовал собственную концепцию, названную впоследствии моделью атома Резерфорда. Он предположил наличие очень маленького ядра с сильнейшим положительным зарядом в центре атомов золота, достаточного для удержания порядка ста электронов.
Дальнейшее развитие
Данная работа послужила базисом для создания Нильсом Бором полуклассической модели атомов в 1913 году. Она напоминает взаимодействие светила и планет в Солнечной системе, но только с квантовыми ограничениями.
Значение для науки
Модель атома Томсона послужила толчком для стремительного развития ядерной физики. Концепция «сливового пудинга» с одним электроном использовалась физиком Артуром Эрихом Хаасом в 1910 году для оценки численного значения постоянной Планка и боровского радиуса атомов водорода. Работа Хааса была опубликована за три года до выводов Нильса Бора. Следует отметить, что боровская модель обеспечивает достаточно точные прогнозы для атомных и ионных систем, имеющих один эффективный электрон.
Кроме того, теория «пудинга» позволяет определить оптимальное распределение равных точечных зарядов на единичной сфере, называемой проблемой Томсона. Кстати, физическая система, воплощенная в проблеме Томсона, является частным случаем одной из восемнадцати нерешенных математических задач, предложенных математиком Стивом Смейлом – «Распределение точек на двумерной сфере».
Проблема Томсона является естественным следствием модели «пучкового пудинга» в отсутствие равномерного положительного фонового заряда. Электростатическое взаимодействие электронов, ограниченных сферическими квантовыми точками, также аналогично их обработке в атомной модели Томсона. В этой классической задаче квантовая точка моделируется как простая диэлектрическая сфера (вместо однородной, положительно заряженной сферы, как в модели «пучкового пудинга»), в которой находятся свободные или избыточные электроны.
Планетарная модель атома
теория по физике 🧲 квантовая физика
Одним из самых важных открытий в области современной физики стало открытие сложного строения атома. В процессе изучения этого строения были открыты новые законы, которые применимы только для описания движения микрочастиц. Такие законы называют законами квантовой механики.
Строение атома по Томсону
Правильное представление о строении атома сложилось не сразу. Первую модель строения частицы вещества предложил английский физик Дж. Дж. Томсона, которому принадлежит открытие электронов. Сравнить эту модель можно с кексом. Положительный заряд атома, играющий роль теста, занимает весь атомарный объем. Причем его плотность одинакова во всех точках. Электроны, словно изюминки в тесте, равномерно распределяются в объеме, занятом положительным зарядом.
Так, согласно представлениям Томсона, атом водорода представляет собой небольшой положительно заряженный шарик радиусом в 10 –10 м. И внутри него расположен один электрон. У более сложных атомов электронов больше.
Опыты Резерфорда
Модель Томсона подверглась критике уже тогда, поскольку она абсолютно противоречила уже открытым к тому времени свойствам атома. Одно из главных свойств — устойчивость.
Известно, что масса электронов в несколько тысяч раз меньше массы атомов. Но в целом атом является нейтральным. Значит, основная масса приходится на его положительно заряженную часть. Для экспериментального исследования распределения положительного заряда, а значит, и массы внутри атома Эрнест Резерфорд предложил в 1906 г. применить зондирование атома с помощью α-частиц. Такие частицы образуются при распаде радия и некоторых других химических элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона. По сути, α-частицы — это лишенные электронов атомы гелия. Двигаются они со скоростью, равной 1/15 скорости света.
Такими частицами Резерфорд в своих экспериментах бомбардировал атомы тяжелых элементов. Известно, что электроны неспособны изменить траекторию движения α-частиц, потому что они слишком мало весят. Ведь небольшой камешек, врезавшийся в автомобиль, не может существенно повлиять на его скорость.
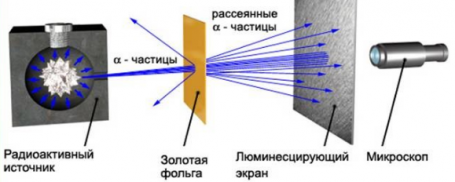
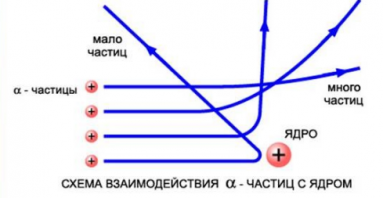
Изменить направление движения α-частиц может только положительный заряд атома. Так, если бомбардировать этими частицами атом, то по их рассеянию можно узнать, каким образом распределяется положительный заряд внутри него. Схема опыта резерфорда выглядит так:
Резерфорд поместил в цилиндр радиоактивное вещество. Вдоль цилиндра ученый высверлил узкий канал, из начал исходить пучок α-частиц. Этот поток попадал на тонкую золотую фольгу. Пройдя ее, частицы попадали на полупрозрачный экран, покрытый сульфидом цинка. За экраном стоял микроскоп, с помощью которого можно было наблюдать столкновение полностью ионизированных атомов гелия с экраном. Ведь при каждом столкновении на экране можно было наблюдать вспышку — сцинтилляцию. Вся установка находилась внутри сосуда, из которого был выкачан воздух — это гарантировало отсутствие других факторов, которые могли бы повлиять на исход опыта.
Если провести опыт без фольги, то глядя в микроскоп, можно было наблюдать следующую картину: на экране формировался кружок, образованный сцинтилляциями от удара α-частиц об экран.
Но если на пути потока этих частиц поставить тонкую фольгу из золота, то картина меняется. Кружок, состоящий из сцинтилляций, становится больше.
Такой результат эксперимента нельзя было предсказать, если считать, что атом действительно имеет такое строение, какое предположил Томсон. Ведь при распределении по всем объему атома положительный заряд не может создать сильное электрическое поле. Поэтому он не смог бы отклонить траекторию движения α-частиц кардинально. Максимальная сила отталкивания в этом случае может быть рассчитана путем применения закона Кулона:
q a — заряд α-частицы, q — положительный заряд атома, R — радиус атома, а k — коэффициент пропорциональности. Напряженность электрического поля равномерно заряженного шара максимальна на поверхности шара и убывает до нуля по мере приближения к центру. Поэтому чем меньше радиус R, тем больше сила, отталкивающая α-частицы.
Определение размеров атомного ядра
Резерфорд сделал вывод о том, что α-частица могла быть отброшена назад только случае, если положительный заряд атома и его масса сконцентрированы в небольшом пространстве. Так ученый пришел к мысли о существовании атомного ядра. По его представлению, это было тело малых размеров, в котором сконцентрирована почти вся масса и весь положительный заряд атома.
На рисунке выше изображены траектории α-частиц, пролетающих на различных расстояниях от ядра. Подсчитывая количество α-частиц, рассеянных на различные углы, Резерфорд дал оценку размерам ядра. Выяснилось, что его диаметр равен примерно 10 –12 –10 –13 см. Такой разброс связан с тем, что размеры ядер атомов разных веществ различны. Размер же самого атома равен 10 –8 см. Это в 10–100 тыс. раз больше размера атомного ядра.
Планетарная модель атома
Основываясь на результатах опыта, Резерфорд создал планетарную модель атома. Согласно ей, в центре атома расположено положительно заряженное ядро. В нем сосредоточена почти вся масса атома. Но в целом атом является нейтральной частицей. Это связано с тем, что положительный заряд ядра уравновешивается отрицательным зарядом электронов, которые вращаются вокруг этого ядра подобно тому, как вращаются планеты вокруг Солнца. Но если планеты вращаются под действием гравитационных сил, то электроны вращаются под действием сил кулоновских (со стороны ядра).
Так, в атоме водорода вокруг ядра вращается только лишь один электрон. Его ядро имеет положительный заряд, равный по модулю заряду электрона. Причем его масса примерно в 1836,1 раза больше массы электрона. Это ядро было названо протоном и стало рассматриваться как элементарная частица. Размер атома водорода определяется радиусом орбиты его электрона.
Простая и наглядная планетарная модель атома имеет прямое экспериментальное обоснование. Она кажется совершенно необходимой для объяснения опытов по рассеиванию α-частиц. Но даже это модель не объяснить факт существования атома, его устойчивость. Ведь движение электронов по орбитам происходит с ускорением, и оно очень велико. Ускоренно движущийся заряд по законам электродинамики Максвелла должен излучать электромагнитные волны с частотой, равной частоте его обращения вокруг ядра. Излучение сопровождается энергетическими потерями. Теряя энергию, электроны должны приближаться к ядру так, как спутник приближается к Земле при торможении о верхние слои атмосферы. По расчетам, электрон должен упасть на ядро за 10 –8 с. Но этого не происходит. Атомы устойчивы и в невозбужденном состоянии могут существовать бесконечно. При этом они не излучают электромагнитные волны.
Опыты Э. Резерфорда по рассеянию α-частиц показали, что
А. почти вся масса атома сосредоточена в ядре.
Б. ядро имеет положительный заряд.
Какое(-ие) из утверждений правильно(-ы)?
Алгоритм решения
Решение
Резерфорд направил пучок радиоактивного излучения на золотую фольгу. Альфа-частицы, проходя сквозь нее, попадали на экран и оставляли след. Если без фольги след представлял собой более менее четко ограниченный круг, то в случае с фольгой, четких границ круга не было. Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
pазбирался: Алиса Никитина | обсудить разбор | оценить
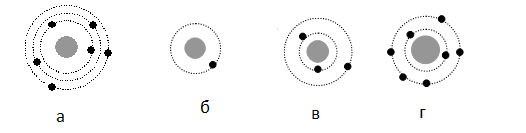
На рисунке изображены схемы четырёх атомов, соответствующие модели атома Резерфорда. Чёрными точками обозначены электроны. Атому 63 Li соответствует схема:
Алгоритм решения
Решение
Планетарная модель атома подразумевает наличие положительно заряженного ядра, вокруг которого вращаются по орбитам электроны. Причем количество протонов равно количеству электронов. Зарядовое число у лития равно 3. Следовательно, на орбитах вокруг ядра должно вращаться 3 электрона — как на рисунке «в».
pазбирался: Алиса Никитина | обсудить разбор | оценить
Ядро атома содержит 3 нейтрона и 4 протона, вокруг ядра обращаются 2 электрона. Эта система частиц является
а) нейтральным атомом углерода 9 6C б) ионом бериллия 7 4Be в) ионом лития 9 3Li г) нейтральным атомом бериллия 7 4B
Алгоритм решения
Решение
Согласно условию, содержится 4 протона и всего 2 электрона. Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
pазбирался: Алиса Никитина | обсудить разбор | оценить