Молекула воды полярна что это значит
Полярные и неполярные молекулы – две группы, на которые подразделяются все диэлектрики.
Полярные по-другому называются дипольными. А неполярные являются нейтральными или бездипольными.
Что такое полярность в химии
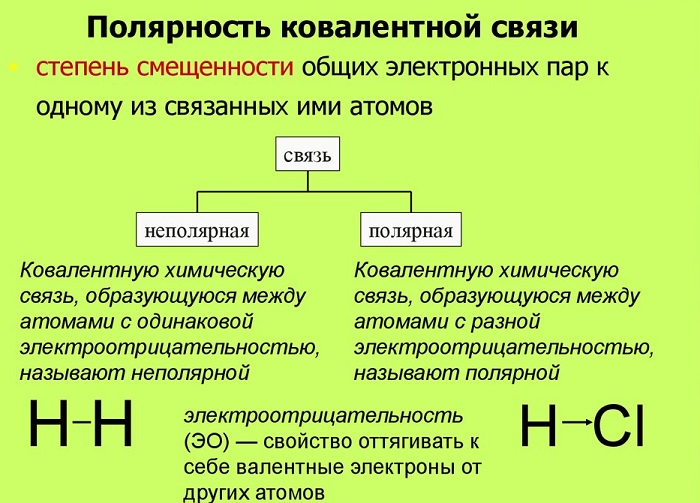
Полярность – свойство, показывающее изменение распределения электронной плотности около ядер, если сравнивать с изначальным ее распределением в образующих данную связь нейтральных частицах.
Поляризуемость — способность поляризоваться под воздействием электрического поля.
Мерой полярности называется электрический момент диполя. В нейтральных соединениях он равен нулю. Его значение зависит от разности электроотрицательностей элементов.
Длина диполя — расстояние между его полюсами. Данная характеристика также влияет на степень полярности.
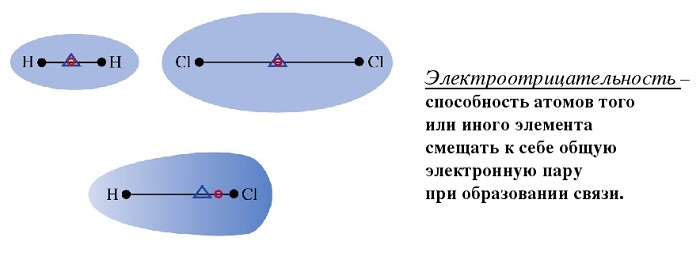
Любое соединение состоит из ядра (положительные частицы) и электронов (отрицательные частицы). И положительные, и отрицательные частицы имеют свой электрический центр тяжести.
Если центры тяжести частиц совпадают, то соединение считается неполярным. Если же полюса не накладываются друг на друга, то в этом случае речь идет о дипольной связи.
Примеры полярных молекул
Эта связь образуется, если вещество состоит из атомов разных элементов и ассиметрична (имеются неспаренные электроны). Такие соединения имеют угловую, изогнутую геометрическую форму.
Примеры неполярных молекул
Эта связь также может встречаться в соединениях, состоящих из атомов разных элементов и при этом являющихся симметричными (линейные, тетраэдрические и т. д.). Такими веществами являются: BeH2, BF3, CH4, CO2(углекислый газ) и SO3.
При нейтральной связи электронное облако равномерно распределяется между ядрами всех атомов данного вещества. Поэтому ядра действуют на него в равной мере.
Как определить полярность молекулы и от чего она зависит
Чтобы определить, является ковалентная связь дипольной или нет, необходимо посмотреть на химическую формулу вещества.
Если молекула состоит из атомов одного и того же вещества, то она в любом случае нейтральна.
Если же молекулярное строение является сложным, то речь может идти как о полярной, так и неполярной ковалентной связи. Это зависит от геометрической формы.
Молекула воды полярна что это значит
ХИМИЯ ЕГЭ | Химический кампус | Регина Ли запись закреплена
Полярная молекула или неполярная?
#ХимКампус_статья
Такие вопросы попадаются в тренировочных заданиях по теме «Химическая связь». Важно заметить, что полярная связь не равно полярная молекула! Полярность определяется неравномерным распределением электронной плотности вокруг молекулы.
Если электронная плотность распределена равномерно, то молекула считается неполярной. Если какой-то участок молекулы перетягивает на себя эту электронную плотность, то молекула – полярная (появляется разные полюсы – области частичного заряда).


Полярная молекула имеет асимметричную форму, неподеленную электронную пару или центральный атом, связанный с другими атомами с разными значениями электроотрицательности. Обычно полярная молекула содержит ионные или полярные ковалентные связи. Приведем примеры:
Полярные молекулы часто гидрофильны («любят воду») и растворимы в полярных растворителях. Полярные молекулы часто имеют более высокие температуры плавления, чем неполярные молекулы с аналогичными молярными массами. Это связано с межмолекулярными силами между полярными молекулами, такими как водородная связь!

Неполярные молекулы образуются либо тогда, когда электроны одинаково распределяются между атомами в молекуле, либо когда расположение электронов в молекуле симметрично, так что дипольные заряды компенсируют друг друга. Приведем примеры неполярных молекул:
Неполярные молекулы обладают некоторыми общими свойствами. Они, как правило, нерастворимы в воде при комнатной температуре, гидрофобны («боятся воды») и способны растворять другие неполярные соединения.
Мы помним золотое правило «подобное растворяется в подобном». Это означает, что полярные растворители растворяют полярные вещества, и наоборот. Это объясняет, почему спирт и вода полностью смешиваются (как полярные) и почему масло и вода не смешиваются (неполярные с полярными).
Дополнительную информацию и объяснение на примерах можно почитать в файлике ниже!
Полярные и неполярные молекулы (Пример)
Полярные молекулы это соединения молекулы которых характеризоваться электрическим дипольным моментом. Примеры полярных молекул: вода — H2O, аммиак — NH3, диоксид серы — SO2.
Неполярные молекулы это соединения электроны которых одинаково распределяются между атомами в молекуле вещества или ихнее расположение в молекуле симметрично, поэтому дипольные заряды компенсируют друг друга.
Примеры неполярных молекул: любой из двухатомный газ H2, N2, O2, Cl2, углекислый газ — CO2 и другие.
ЧТО ТАКОЕ ПОЛЯРНЫЕ И НЕПОЛЯРНЫЕ МОЛЕКУЛЫ
Во всякой молекуле имеются как положительно заряженные частицы — ядра атомов, так и отрицательно заряженные — электроны.
Для каждого рода частиц (или, вернее, зарядов) можно найти такую точку, которая будет являться как бы их «электрическим центром тяжести».
Эти точки называются полюсами молекулы. Если в молекуле электрические центры тяжести положительных и отрицательных зарядов совпадут, то молекула будет неполярной.
Пример неполярной молекулы
Рис.. Схемы полярной и не полярной молекул: а — полярная молекула; б—неполярная молекула.
Но если молекула построена несимметрично, например состоит из двух разнородных атомов, то, как мы уже говорили, общая пара электронов может быть в большей или меньшей степени смещена в сторону одного из атомов.
Очевидно, что в этом случае, вследствие неравномерного распределения положительных и отрицательных зарядов внутри молекулы, их электрические центры тяжести не совпадут и получится полярная молекула (рис.).
Полярные молекулы это
Полярные молекулы являются диполями. Этим термином обозначают вообще всякую электронейтральную систему, т. е. систему, состоящую из положительных и отрицательных зарядов, распределенных таким образом, что их электрические центры тяжести не совпадают.
Расстояние между электрическими центрами тяжести тех и других зарядов (между полюсами диполя) называется длиной диполя.
Длина диполя характеризует степень полярности молекулы. Понятно, что для различных полярных молекул длина диполя различна; чем она больше, тем резче выражена полярность молекулы.
На практике степень полярности тех или иных молекул устанавливают путем измерения так называемого дипольного момента молекулы т, который определяется как произведение длины диполя l на заряд его полюса е:
Величины дипольных моментов связаны с некоторыми свойствами веществ и могут быть определены экспериментальным путем.
Рис. 2. Схемы строения молекул СO2 и CS2
Ниже приведены дипольные моменты молекул некоторых неорганических веществ.
Дипольные моменты
Дипольные моменты некоторых веществ
Хлористый водород……. 1,04
Двуокись углерода……. 0
Йодистый водород…….. 0,38
Окись углерода ……. 0,11
Определение величин дипольных моментов позволяет сделать много интересных выводов относительно строения различных молекул. Рассмотрим некоторые из этих выводов.
Как и следовало ожидать, дипольные моменты молекул водорода и азота равны нулю; молекулы этих веществ совершенно симметричны и следовательно, электрические заряды в них распределены равномерно.
Отсутствие полярности у двуокиси углерода и у сероуглерода показывает, что их молекулы также построены симметрично. Строение молекул этих веществ схематически изображено на рис. 2.
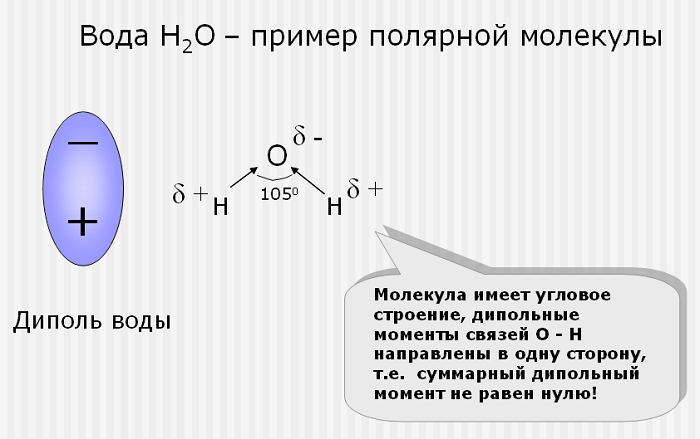
Несколько неожиданным является наличие довольно большого дипольного момента у воды. Так как формула воды аналогична формулам двуокиси углерода и сероуглерода, то следовало ожидать, что её молекулы будут построены так же симметрично, как и молекулы CS2 и СО2.
Рис. 3. Схема строения молекулы воды.
Почему молекула воды полярная
Ввиду экспериментально установленной полярности молекул воды (полярности молекул) это предположение приходится отбросить.
В настоящее время молекуле воды приписывают несимметричное строение (рис. 3): два атома водорода соединены с атомом кислорода так, что их связи образуют угол около 105°.
Аналогичное расположение атомных ядер имеется и в других молекулах такого же типа (H2S, SO2), обладающих дипольными моментами.
Полярностью молекул воды объясняются многие ее физические свойства.
Статья на тему Полярные и неполярные молекулы
Похожие страницы:
Понравилась статья поделись ей
Уникальные свойства воды
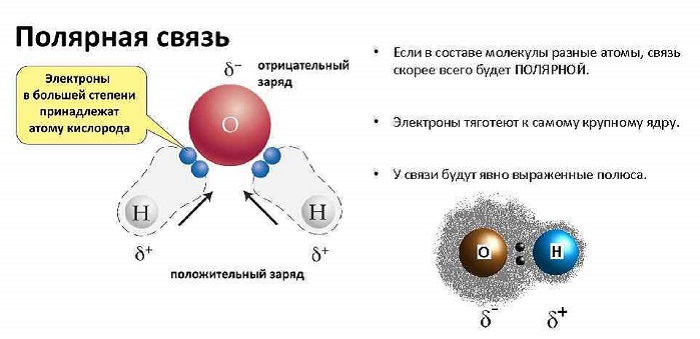
1. Вода полярная. Молекулы воды полярны, с частичным положительным зарядом на атомах водорода, частичным отрицательным зарядом на кислороде и изогнутой общей структурой. Это связано с тем, что кислород более электроотрицателен, а это означает, что он лучше, чем водород, притягивает электроны.
2. Вода отличный растворитель. Вода обладает уникальной способностью растворять многие полярные и ионные вещества. Это важно для всех живых существ, потому что, когда вода проходит через круговорот воды, она забирает с собой много ценных питательных веществ!
3. Вода обладает высокой теплоемкостью. Чтобы повысить температуру определенного количества воды на градус, требуется много энергии, поэтому вода помогает регулировать температуру в окружающей среде. Например, это свойство позволяет температуре воды в пруду оставаться относительно постоянной днем и ночью, независимо от изменения температуры воздуха.
4. Вода имеет высокую теплоту испарения. Люди (и другие животные, которые потеют) используют высокую теплоту испарения воды для охлаждения. Вода превращается из жидкой формы в пар при достижении теплоты испарения. Поскольку пот состоит в основном из воды, испаряющаяся вода поглощает избыточное тепло тела, которое выделяется в атмосферу. Это называется испарительным охлаждением
5. Вода обладает когезионными и адгезионными свойствами. Молекулы воды обладают сильными силами сцепления из-за их способности образовывать водородные связи друг с другом. Силы сцепления ответственны за поверхностное натяжение тенденцию поверхности жидкости сопротивляться разрыву, когда она находится под напряжением или напряжением. Вода также обладает адгезионными свойствами, которые позволяют ей прилипать к другим веществам, кроме нее самой.
Эти когезионные и адгезионные свойства необходимы для переноса жидкости во многих формах жизни. Например, они позволяют транспортировать питательные вещества к верхушке дерева против силы тяжести.
6. Вода менее плотная в твердом виде, чем в жидкой. Когда вода замерзает, молекулы образуют кристаллическую структуру, которая разделяет молекулы дальше, чем в жидкой воде. Это означает, что лед менее плотный, чем жидкая вода, поэтому он плавает.
Это свойство важно, поскольку оно защищает пруды, озера и океаны от замерзания и позволяет жизни продолжать процветать под ледяной поверхностью.
Распространенные ошибки и заблуждения
• Вода растворяет все, потому что это «универсальный растворитель». Вода обладает способностью растворять многие вещества, но термин «универсальный растворитель» вводит в заблуждение. Вода способна растворять другие полярные молекулы и ионы, такие как сахара и соли. Однако неполярные молекулы, такие как масла, не имеют частичных положительных или частичных отрицательных зарядов, поэтому они не притягиваются к молекулам воды. Вот почему неполярные вещества, такие как масло, остаются отдельными при добавлении в воду.
Химическая полярность
Полярные молекулы должны содержать полярные связи из-за разницы в электроотрицательности между связанными атомами. Полярная молекула с двумя или более полярными связями должна иметь асимметричную геометрию по крайней мере в одном направлении, чтобы диполи связи не компенсировали друг друга.
Классификация
Полярность связи обычно делится на три группы, которые основаны на разнице в электроотрицательности между двумя связанными атомами. По шкале Полинга :
Полинг основал эту схему классификации на частичном ионном характере связи, который является приблизительной функцией разницы в электроотрицательности между двумя связанными атомами. Он оценил, что разница в 1,7 соответствует 50% ионному характеру, так что большая разница соответствует связи, которая является преимущественно ионной. [3]
Хотя молекулы можно описать как «полярные ковалентные», «неполярные ковалентные» или «ионные», это часто относительный термин, когда одна молекула просто более полярна или более неполярна, чем другая. Однако для таких молекул характерны следующие свойства.
Полярные молекулы
Полярная молекула имеет чистый диполь в результате противоположных зарядов (т.е. имеющих частичные положительные и частичные отрицательные заряды) от полярных связей, расположенных асимметрично. Вода (H 2 O) является примером полярной молекулы, поскольку она имеет небольшой положительный заряд с одной стороны и небольшой отрицательный заряд с другой. Диполи не компенсируются, в результате чего получается чистый диполь. Из-за полярной природы самой молекулы воды другие полярные молекулы обычно могут растворяться в воде. Дипольный момент воды зависит от ее состояния. В газовой фазе дипольный момент составляет ≈ 1,86 Дебая (Д), [5], тогда как жидкая вода (≈ 2,95 Д) [6] и лед (≈ 3,09 Д) [7] выше из-за различных сред с водородными связями. Другие примеры включают сахара (например, сахарозу ), которые имеют много полярных кислородно-водородных (-ОН) групп и в целом очень полярны.
Если дипольные моменты связи молекулы не сокращаются, молекула полярна. Например, молекула воды (H 2 O) содержит две полярные связи O-H в изогнутой (нелинейной) геометрии. Дипольные моменты связи не отменяются, так что молекула образует молекулярный диполь с отрицательным полюсом у кислорода и положительным полюсом на полпути между двумя атомами водорода. На рисунке каждая связь соединяет центральный атом O с отрицательным зарядом (красный) с атомом H с положительным зарядом (синий).
Неполярные молекулы
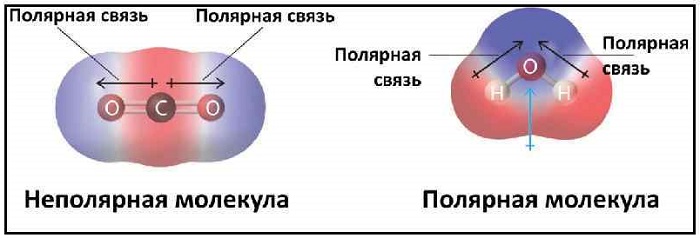
Молекула может быть неполярной либо при равном распределении электронов между двумя атомами двухатомной молекулы, либо из-за симметричного расположения полярных связей в более сложной молекуле. Например, трифторид бора (BF 3 ) имеет тригонально-планарное расположение трех полярных связей под углом 120 °. Это не приводит к общему диполю в молекуле.
Углекислый газ (CO 2 ) имеет две полярные связи C = O, но геометрия CO 2 является линейной, так что два дипольных момента связи сокращаются и нет суммарного молекулярного дипольного момента; молекула неполярна.
В молекуле метана (CH 4 ) четыре связи C − H расположены тетраэдрически вокруг атома углерода. Каждая связь имеет полярность (хотя и не очень прочную). Связи расположены симметрично, поэтому в молекуле нет полного диполя. Молекула двухатомного кислорода (O 2 ) не имеет полярности в ковалентной связи из-за равной электроотрицательности, следовательно, в молекуле нет полярности.
Амфифильные молекулы
Большие молекулы, которые имеют один конец с присоединенными полярными группами, а другой конец с неполярными группами, описываются как амфифильные или амфифильные молекулы. Они являются хорошими поверхностно-активными веществами и могут способствовать образованию стабильных эмульсий или смесей воды и жиров. Поверхностно-активные вещества уменьшают межфазное натяжение между маслом и водой за счет адсорбции на границе раздела жидкость-жидкость.
| Формула | Описание | Пример | Имя | Дипольный момент | |
|---|---|---|---|---|---|
| Полярный | AB | Линейные молекулы | CO | Монооксид углерода | 0,112 |
| HA x | Молекулы с одним H | ВЧ | Фтористый водород | 1,86 | |
| А х ОН | Молекулы с ОН на одном конце | С 2 Н 5 ОН | Спирт этиловый | 1,69 | |
| O x A y | Молекулы с буквой O на одном конце | H 2 O | Воды | 1,85 | |
| N x A y | Молекулы с буквой N на одном конце | NH 3 | Аммиак | 1,42 | |
| Неполярный | А 2 | Двухатомные молекулы одного и того же элемента | O 2 | Дикислород | 0,0 |
| C x A y | Большинство углеводородных соединений | С 3 Н 8 | Пропан | 0,083 | |
| C x A y | Углеводород с центром инверсии | С 4 Н 10 | Бутан | 0,0 |
Вопреки распространенному заблуждению, электрическое отклонение струи воды от заряженного объекта не зависит от полярности. Отклонение происходит из-за электрически заряженных капель в потоке, который индуцирует заряженный объект. Поток воды также можно отклонить в однородном электрическом поле, которое не может воздействовать на полярные молекулы. Кроме того, после того, как поток воды заземлен, его больше нельзя отклонить. Слабый прогиб возможен даже для неполярных жидкостей. [8]