Молочные ферменты что это
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
ВНИМАНИЕ: Уважаемые клиенты и дистрибьюторы!
Глава 1. Ферменты сырого коровьего молока, их свойства и значение. Общие сведения о ферментах
Ферменты – это биокатализаторы, которые составляют функциональный аппарат клеток растительного, микробного и животного происхождений и характеризуются исключительно высокими специфичностью и молекулярной активностью. Исключительно велика роль ферментов в технологии пищевых продуктов, в основе производства которых лежат либо биохимические (ферментативные), либо физико-химические процессы, либо эти процессы взаимосвязаны. В отличие от неорганических катализаторов, ферменты имеют свои особенности: скорость ферментативного катализа на несколько порядков выше (от 103 до 109); действие каждого фермента специфично, то есть фермент действует только на определенный субстрат (вещество, на которое действует фермент) или группу родственных субстратов; ферменты катализируют реакции в мягких условиях – при обычном давлении, невысокой температуре и при значениях рН среды в большинстве случаев близких к нейтральной, то есть совпадающими с физиологическими значениями рН живой клетки.
Большинство ферментов являются растворимыми глобулярными белками. По химическому строению одни ферменты представляют собой простые белки – однокомпонентные, состоящие из полипептидных цепей аминокислот, другие – сложные – двухкомпонентные. Сложные белки состоят из белкового компонента – апофермента и термостойкого компонента небелковой природы – кофактора. При этом оба компонента лишены ферментативной активности, и только образованный ими комплекс – холофермент приобретает свойства биокатализатора. Тип связи между апоферментом и кофактором различен. В некоторых случаях они существуют отдельно и связываются только во время реакции – в этом случае кофактор называют коферментом. В других случаях апофермент и кофактор связаны постоянно, иногда прочно, ковалентными связями, и при этом кофактор называют простетической группой. К кофакторам относятся и ионы металлов, прочность связи которых в молекуле фермента зависит от вида металла и от того, с какими химическими группами он связан. К коферментам относятся большинство производных витаминов, некоторые пептиды, нуклеотиды и их производные, а также другие соединения. Примером простетической группы может служить гемогруппа цитохрома с, ковалентно связанная с апоферментом. Ионы металлов выполняют или функцию мостика, связывающего фермент с субстратом, или непосредственно каталитическую функцию. Коферменты обычно являются промежуточными переносчиками электронов, некоторых атомов или химических групп с одного соединения – донор, на другое – акцептор. Кроме того, они могут участвовать в поддержании нативной конформации фермента (В. Л. Кретович).
Фермент, как любой белок, имеет трехмерную структуру. Первичная структура определяется последовательностью аминокислот в полипептидной цепи белка, а также поперечными связями между отдельными полипептидными цепями. Эта структура создается в основном ковалентными пептидными и дисульфидными связями, которые довольно прочные и разрушаются только при ферментативном воздействии (энергия ковалентной связи составляет 30. 100 ккал/моль). Вторичная структура определяется пространственным расположением полипептидных цепей в молекуле белка и обусловливает образование спиралевидной или реже – складчатой конфигурации (α- и β-структур, β-изгиб и др.). Стабильность вторичной структуры зависит от образования системы слабых водородных связей (энергия водородной связи составляет 2. 10 ккал/моль), которые могут распадаться при обработке молока, что ведет к развертыванию полипептидной цепи, а также дисульфидными мостиками. Третичная структура определяется пространственным расположением молекулы белка в целом (укладкой полипептидной цепи в определенном объеме). Ее стабильность обусловливается нековалентными и слабыми ионными, гидрофобными, а также водородными связями.
Указанные структуры в целом определяют нативную конформацию молекулы фермента, обеспечивающей жесткость его структуры, ее компактность и упорядоченность. От первичной и третичной структур белковой молекулы фермента в основном зависит его каталитическая активность.
Роль кофактора состоит либо в изменении трехмерной структуры белка, способствующей лучшему связыванию фермента с субстратом, либо в непосредственном участии в ферментативной реакции в качестве дополнительного субстрата. Кофактор в роли кофермента оказывает защитное действие на апофермент, что не позволяет пептидным связям апофермента развертываться и, следовательно, препятствует его денатурации (Диксон М., Уэбб Э., 1982; Плакунов В. К., 2001; Полыгалина Г. В., Чередниченко В. С, Римарева Л. В., 2003).
Некоторые ферменты состоят из субъединиц, которые имеют либо идентичную, либо различную первичную структуру и содержат более одного субстратсвязывающего участка (на молекулу). Изменение конформации одной из субъединиц может привести к изменениям каталитических свойств фермента в целом. Непрочно связанные между собой нековалентными связями субъединицы образуют димеры, тетрамеры и полимеры, в результате чего формируется четвертичная структура ферментов. Эти комплексы субъединиц проявляют максимальную каталитическую активность. При определенных условиях они могут обратимо диссоциировать на субъединицы.
Существует две категории ферментов: конститутивные – постоянно присутствуют в клетках организма как обязательные их компоненты (основные ферменты клеточного обмена), и адаптивные (индуцируемые) – образуются вновь в присутствии соответствующего субстрата, или же образование их усиливается в результате адаптации организма к условиям внешней среды. Некоторые ферменты синтезируются непосредственно в активной форме, другие – в виде неактивных проферментов, которые при определенных условиях приобретают активную форму.
Размеры молекул ферментов различны. Молекулярная масса их составляет десятки, сотни тысяч и может достигать нескольких миллионов дальтон.
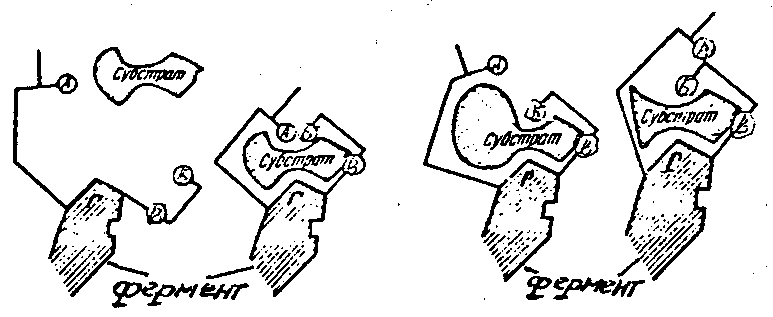
Каталитическую функцию ферментов выполняет часть его молекулы – активный центр, представляющий собой уникальную пространственную комбинацию различных химических группировок (функциональные группы). Важной составной частью активного центра является его участок, который вступает в непосредственное взаимодействие с субстратом (рис. 1).
Кроме активного центра в молекуле фермента могут быть и другие – аллостерические регуляторные центры, которые связывают различные реагенты (эффекторы). Эффекторы регулируют активность фермента, вызывая снижение или увеличение ее вследствие изменения конформации молекулы фермента.
В однокомпонентных ферментах активный центр образуется в результате определенной ориентации аминокислотных остатков полипептидной цепи. Функциональные группы этих аминокислот могут принадлежать звеньям полипептидной цепи весьма удаленными друг от друга, и их сближение связано с формированием третичной структуры фермента.
Рис. 1. Изменение активного центра фермента (по Кретович В. Л.):
А, Б, В – функциональные группы активного центра; Г – субстратный центр
В двухкомпонентных ферментах активный центр представляет собой комплекс, например, коферментов и некоторых примыкающих к нему аминокислотных остатков. Ион металла может находиться либо в активном центре апофермента, либо входить в состав более крупной молекулы кофермента. В первом случае он способствует формированию каталитически активной конформации апофермента, а во втором случае служит мостиком между апоферментом и органической молекулой кофермента. В активном центре различают контактный (якорный) участок, который связывает субстрат и каталитический участок, где происходит превращение субстрата в продукты реакции после его связывания контактным участком.
Многие ферменты, катализирующие одну и ту же реакцию и встречающиеся в организме одного вида, имеют множественные формы. Те множественные формы ферментов, появление которых связано с генетическими различиями в первичной структуре молекулы, относятся к изоферментам.
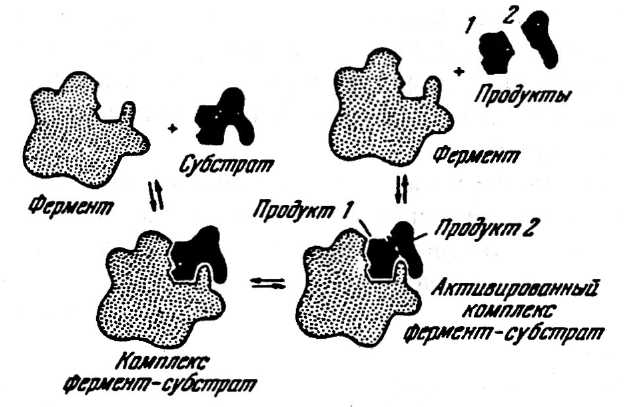
Механизм действия ферментов состоит в том, что фермент специфическим образом связывает субстрат и реакция протекает внутри фермент-субстратного комплекса. Это промежуточное соединение нестойкое; при его распаде фермент остается в первоначальном виде, а субстрат расщепляется на продукты (рис. 2). Ферменты часто катализируют реакции, протекающие с участием двух или большего числа субстратов, приводящие к образованию большого числа продуктов. Фермент может обладать не одной, а несколькими каталитическими активностями, и в проявлении каждой из них участвуют функциональные химические группы фермента в различных комбинациях. Ферменты могут ускорять как прямую, так и обратную реакцию. Для многих ферментативных реакций положение равновесия сдвинуто в какую-либо сторону, а другие реакции протекают легко в обоих направлениях.
Активность ферментов определяется температурой, рН, Еh среды и концентрацией образующихся продуктов реакции.
В основе всех теорий, объясняющих механизм действия ферментов, лежит представление о том, что фермент вызывает изменение молекулы субстрата таким образом, что энергия активации, которую необходимо придать этой молекуле для того, чтобы она прореагировала, значительно снижается. В этом отношении важна природа связей между ферментом и субстратом. Так, при наличии в молекулах субстрата заряженных групп связывание его с ферментом происходит преимущественно за счет электростатических сил. При этом распределение зарядов в молекулах субстрата и фермента должно быть комплементарным. При отсутствии заряженных групп у гидрофильных (полярных) субстратов взаимодействие с ферментами должно обусловливаться водородными связями. В случае незаряженных гидрофобных (неполярных) субстратов это взаимодействие обусловливается гидрофобными (ван-дер-ваальсовыми) силами, а у металлоферментов взаимодействие с субстратами может быть обусловлено образованием координационных связей между лигандными группами субстрата и атомом металла.
Рис. 2. Взаимодействие фермента с субстратом (по Кретович В. Л.)
Фермент характеризуется двумя кинетическими константами: скорости V – число молей субстрата или в случае субстрата – биополимера – число разрываемых (синтезируемых) связей, реагирующих с одним молем фермента в единицу времени (обычно за 1 мин или 1 с), что составляет эффективность действия фермента, и константой Михаэлиса Км – концентрация субстрата, при которой скорость реакции достигает половины максимальной (Vмакс). Км имеет размерность моль/л и является мерой сродства фермента к субстрату. По значению Км различают высокоактивные (низкая Км) и низкоактивные (высокая Км) ферменты.
Отличительным признаком ферментативной реакции является высокая скорость, которая служит мерой количества и активности ферментов. Vмакс достигается в случае практически полного насыщения молекулы фермента субстратом.
Важнейшим фактором, определяющим скорость ферментативной реакции, является концентрация реагирующих веществ – субстрата и фермента. При протекании ферментативной реакции может иметь место ингибирование фермента избытком субстрата, а также регулирование активности фермента путем ингибирующего или активирующего воздействия на него продукта или продуктов реакции (Фёршт Э., 1980; Мусил Я., Новакова О., Кунц К., 1981).
Важным свойством ферментов является способность избирательно действовать на субстрат, определять путь его превращения.
Для каждого фермента свойственны определенные оптимумы рН и температуры. За пределами этих значений скорость ферментативной реакции уменьшается.
Поскольку фермент является белком и содержит различные ионизирующие группы, изменение рН среды влияет на состояние ионизации этих групп, а следовательно, и на заряд белковой молекулы, от величины которого зависит взаимодействие фермента с субстратом. Таким образом, рН среды влияет на стабильность структуры фермента и превращение комплекса фермент – субстрат (см. рис. 1 и 2).
Важным фактором проявления активности ферментов является температура. При 0°С или ниже действие большинства ферментов прекращается, и наоборот. Изменение скорости реакции принято выражать температурным коэффициентом Q10, представляющим собой изменение скорости реакций при изменении температуры на каждые 10 °С (для ферментативных реакций величина Q10 обычно находится в пределах 1. 2, а химических – 2. 4), и величиной Z – изменение температуры, необходимой для изменения степени реакции в 10 раз.
При оптимальных условиях большинство ферментативных реакций протекает во много раз быстрее, чем неферментативные реакции. Ускорение ферментативной реакции может достигать величины 1015.
Различают несколько основных типов специфичности ферментов: субстратная специфичность – фермент катализирует превращение только одного субстрата (абсолютная специфичность) или ряда субстратов, обладающих определенными типами атомных группировок (групповая или относительная специфичность); специфичность к типу реакции – фермент катализирует определенный тип реакции; стереохимическая специфичность – фермент действует на определенный оптический изомер (L-или D-форму, цис- или трансформу молекулы субстрата). Ферменты, обладающие относительной специфичностью, действуют сразу на многие субстраты, имеющие ряд общих структурных свойств. Для этих ферментов важны тип связи и химическая структура лишь одного из компонентов, образующих эту связь, тогда как структура другого компонента может меняться. Однако есть ферменты, имеющие более широкую относительную специфичность, для которых важен лишь тип связи. Они допускают изменение химической природы обоих компонентов этой связи (Жеребцов Н. А. и др., 1999). Действуя на одну и ту же группировку в молекуле различных соединений, фермент небезразличен к составу субстрата в целом.
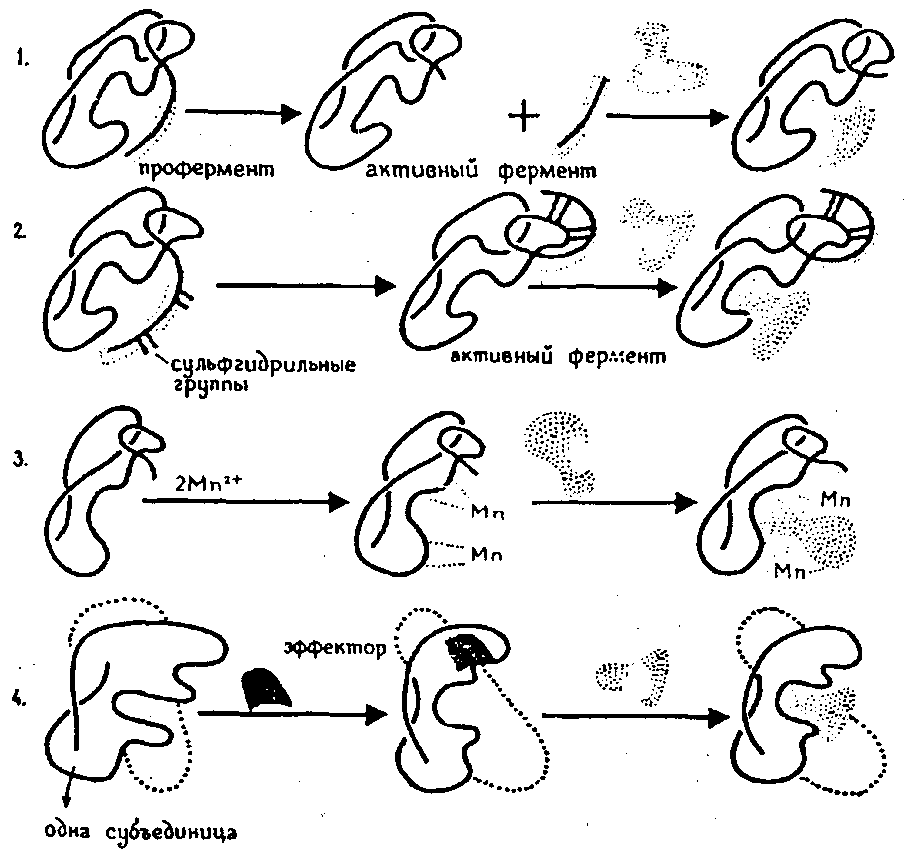
Большое влияние на активность ферментов оказывает присутствие в среде ряда химических соединений – активаторов и ингибиторов, которые соответственно ускоряют или замедляют ферментативную реакцию. Установлено, что активирование ферментов происходит в основном несколькими путями. Например, действие многих протеолитических ферментов активируется в присутствии небольших количеств веществ, содержащих SН-группы, которые восстанавливают S–S-связи неактивных ферментов или превращение проферментов в активные ферменты (рис. 3).
Ингибиторы ферментов относятся к специфическим химическим соединениям, каждое из которых подавляет действие одного или группы ферментов со специфическими функциями.
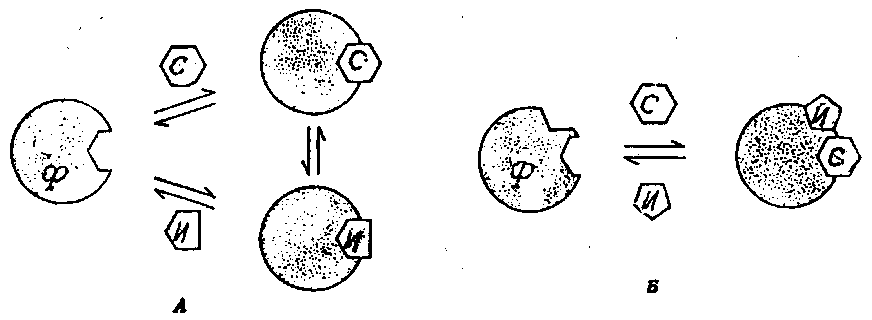
Среди ингибиторов ферментов наиболее важными являются конкурентные и неконкурентные. Конкурентный ингибитор обладает структурным сходством с субстратом и соединяется с активным центром фермента, заменяя собой субстрат. В присутствии ингибитора снижается сродство фермента к субстрату – величина Км повышается, а Vмакс – не изменяется. Такое ингибирование обратимо, и активность фермента может быть восстановлена путем добавления избытка субстрата. Неконкурентный ингибитор структурно отличается от субстрата и взаимодействует с апоферментом, или коферментом, или простетической группой, или ионами металлов, при этом величина Км не изменяется, а Vмакс – снижается. Такое ингибирование не может быть снято добавлением субстрата (рис. 4).
Рис. 3. Активирование ферментов (по Мусил Я. и др., 1981):
1 – отщепление олигопептида от профермента; 2 – образование S–S-связей, делающее доступным активный центр; 3 – образование комплекса с ионами металлов; 4 – аллостерическая активация
Во время ферментативной реакции низкомолекулярные метаболиты (продукты реакции) могут регулировать активность фермента. Это действие может быть как ингибирующим, так и активирующим. Ингибирование ферментативной реакции ее продуктами может происходить или в результате связывания продукта с ферментом или другим компонентом системы, или в результате влияния продуктов на сдвиг равновесия в обратную сторону.
Значительный вклад в развитие энзимологии внесли отечественные ученые А. Н. Бах, Н. В. Березин, А. Е. Браунштейн, А. А. Клесов, В. Л. Кретович, Б. И. Курганов, В. В. Мосолов, В. А. Яковлев и др.
В соответствии с номенклатурой, разработанной комиссией по ферментам (последняя редакция 1984 г. и дополнение 1992 г.) Международного биохимического союза, все ферменты разделяются на шесть основных классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и лигазы (синтетазы). В каждый класс включены ферменты, катализирующие общий тип реакций.
Принято два типа названия ферментов: рабочее, или тривиальное, и систематическое. Рабочее название складывается из названия субстрата, к корню которого добавляется окончание «аза» (например, амилоза – амилаза, протеин – протеиназа). В названии многих ферментов указывается также тип катализируемой реакции (например, лактат + дегидрогеназа → лактатдегидрогеназа). Систематическое название фермента складывается из названия субстрата, типа катализируемого превращения и окончания «аза» (например, L-лактат: NAD+-оксидоредуктаза).
По номенклатуре ферментов каждый фермент имеет свое кодовое число (четырехзначный шифр), перед которым стоят две буквы – КФ. Первое число указывает класс, к которому принадлежит фермент. Второе число означает подкласс фермента и указывает природу той группы в молекуле субстрата, которая подвергается изменению, например, окислению, природу переносимой группы, тип гидролизуемой связи, тип катализируемой реакции изомеризации, тип вновь образуемой связи. Третье число означает подкласс фермента и уточняет тип участвующего в реакции акцептора, или образовавшегося продукта реакции, или тип переносимой группы или гидролизуемой связи, или природу образующегося соединения. Четвертое число означает порядковый номер фермента в данном подклассе.
Молекулярная активность (число оборотов) фермента – это число молекул субстрата, которое превращается молекулой фермента за 1 мин.
УДК 637.334.2
Цикуниб А.Д., Гончарова С.А.
Лаборатория нутрициологии и экологии НИИ комплексных проблем АГУ
Аннотация. В статье представлена сравнительная характеристика основных молокосвертывающих ферментов, используемых в молочной промышлености. Рассмотрены преимущества и недостатки молокосвертывающих ферментов различного происхождения. Ключевые слова: молокосвертывающие ферменты, реннин, микробиальные ферменты, растительные коагулянты молока, ферментативная коагуляция молока, иммобилизованные ферменты
Tsikunib A.D., Goncharova S.A.
Nutrition and Environment Laboratory , of Scientific Research Institute of complex Problems of Adyghe State University
MILK-CLOTTING ENZYMES: COMPARATIVE CHARACTERISTICS
Abstract. The article provides a comparative summary of the major MIS-Lokomotiva enzymes used in the dairy industry. The advantages and disadvantages of milk-clotting enzymes of different origin.
Key words: milk-clotting enzymes, renin, microbial enzymes, vegetable coagulants milk, enzymatic coagulation of milk, immobilized enzymes
В основе технологии производства сыров лежит способность молока коагулировать в казеиновый комплекс под воздействием определенных протеолитических ферментов, получивших название молокосвертывающих [8, 10].
Целью нашей работы явилось рассмотрение видов молокосвертывающих ферментов, свойств, источников и их применения в сыроделии.
Наиболее известным ферментом традиционно используемым для коагуляции молока является сычужный фермент реннин или химозин (КФ 3.4.23.4). Фермент относится к классу аспартатных протеиназ [19], находится в соке четвертого отдела желудка телят. Как и пепсин, он образуется в главных клетках желудка из зимогена (прореннина) и активируется катионами водорода (рН
На сегодня в молочной промышленности применяется широкий спектр сычужных ферментов (таблица 1).
Таблица 1. Состав, торговое название и производители сычужных препаратов на основе сычужного фермента (КФ 3.4.23.4)
90÷95% химозин, 10÷5% говяжий пепсин
«Завод эндокринных ферментов», Московская обл.
96% химозин, 4% говяжий пепсин
Calf rennet Clerici 96/4
« Caglificio Clerici SPA », Италия
90% химозин, 10% говяжий пепсин
95% химозин, 5% говяжий пепсин
Bioren Liquid Rennet Premium 95L
90% химозин, 10% говяжий пепсин
50% химозин, 50% говяжий пепсин
«МЗСФ», Москва; «Шоко», Ростовская обл.
50% химозин, 50% говяжий пепсин
« Caglificio Clerici SPA », Италия
50% химозин, 50% говяжий пепсин
Bioren Liquid Rennet Standart 50L
«Hundsbichler GmbH», Австрия
25% химозин, 75% говяжий пепсин
50% куриный пепсин,50% говяжий пепсин
30÷40% химозин, 30÷40% говяжий пепсин, 40% куриный пепсин
«Завод эндокринных ферментов», Московская обл.
Быстрое расширение молочного производства и нехватка животных сычугов способствовали появлению новых коагулянтов для молока микробного и растительного происхождения. Заменители сычужного фермента микробного происхождения за рубежом или коммерческие ферменты, применяют лишь для производства отдельных видов сыров (рассольных, с подплавлением сырной массы, или для сырья в производстве плавленых сыров) [16]. В соответствии с большими трудностями классификации микробных протеиназ, их классификация в первую очередь основана на источнике, из которого выделен фермент. В таблице 2 представлены микробиальные молокосвертывающие ферменты, наиболее часто используемые в пищевой промышленности.
Таблица 2. Номенклатура, продуценты и производители микробиальных молокосвертывающих ферментов
Название фермента/ КФ*
Аспергиллопепсин I (aspergillopepsin I)
Aspergillus niger var. awamori
«С h r. Hansen», Дания
« Meito Sangyo », Япония
«CSK food enrichment», Нидерланды
*КФ – код фермента по Международной классификации ферментов (энзимов)
Наряду с ферментными препаратами животного и микробного происхождения для сквашивания молока используются так же препараты растительного происхождения. Экстракты растений, которые традиционно считались ферментными коагулянтами молока, такими не являются, так как они имеют другой механизм действия или, возможно, они содержат микробы, обладающие способностью к свертыванию молока [1, 3, 20].
Одним из давно известных растительных коагулянтов является сок фигового дерева (Fісus саrіса), используемый в районах его произрастания [2, 20] Многие экстракты растительного происхождения способны свертывать молоко, но некоторые из них имеют слишком высокую протеолитическую активность (например, папаин из азимины (Саrіса рарауа), бромелин из ананаса (Ananassatiа) и рицин из семян клещевины (Ricinus communis)). Примером использования растительного экстракта может служить выработка португальского сыра Sena da Estrela из овечьего молока с помощью водной вытяжки цветков кардона [23]. В таблице 3 представлены экстракты растений, наиболее применяемые в молочной промышленности.
Таблица 3. Растения, экстракты которых используются для коагуляции молока
Ciraumand Carlina spp.
Achillea millef olium
Преимуществом использования микробиальных и растительных ферментных препаратов является низкая себестоимость, а недостатками – низкий выход продукта, более короткий срок хранения по сравнению с сычужными сырами и снижение качества производимых сыров.
Установлено так же, что экстракты некоторых растений ядовиты, например, гемлок (Conium maculatum ) и рицин семян клещевины ( Ricinus communis ) вызывают комбинированное свертывание с помощью кислоты и фермента, используемое, в основном, для выработки сыров с мягким тестом [23].
Широкое применение в промышленности нашли молокосвертывающие ферментные препараты на основе рекомбинантного химозина. Структура рекомбинантного химозина, почти, идентична структуре традиционного телячьего. Его получают путем пересадки гена прохимозина из сычужной ткани телят некоторым микроорганизмам. На основе данной разработки получен ферментный препарат CHY-Max [1, 20], однако, исследования, проведенные М.В. Полковниковой и Л.Н. Азолкиной, показали, что в сгустках, полученных с использованием препаратов животного происхождения, сыворотка отделяется равномернее, чем из сгустка, полученного с применением рекомбинированного препарата. Микробиальные и рекомбинированные препараты образуют более мягкий сгусток по сравнению с ферментными препаратами животного происхождения [3].
Известно, что использование ферментов, как сычужного, так и микробиального происхождения, производится однократно, в связи с этим, является актуальным использование и разработка приемов позволяющих многократно использовать ферменты. Одним из таких приемов является иммобилизация, т.е. включение молекул фермента в какую-либо изолированную фазу, которая отделена от фазы свободного раствора, но способна обмениваться с находящимися в ней молекулами субстрата, эффектора или ингибитора [24]. Иммобилизованные ферменты имеют ряд преимуществ в сравнении со свободными молекулами. Прежде всего, такие ферменты, представляя собой гетерогенные катализаторы, легко отделяются от реакционной среды, могут использоваться многократно и обеспечивают непрерывность каталитического процесса. Кроме того, иммобилизация ведет к изменению свойств фермента: субстратной специфичности, устойчивости, зависимости активности от параметров среды. Иммобилизованные ферменты долговечны и в тысячи и десятки тысяч раз стабильнее свободных энзимов [26]. В настоящее время преимущества использования иммобилизованных ферментов очевидны, поэтому их применение ежегодно расширяется. Несмотря на широкий выбор носителей, и методов иммобилизации, проблема поиска, разработки и исследования новых способов и носителей для иммобилизации ферментов является одной из актуальных задач фундаментальной химической науки. При этом наиболее перспективны методы иммобилизации, позволяющие максимально сохранять каталитическую активность ферментов в процессе иммобилизации и повышающие стабильность иммобилизованных препаратов при последующем использовании. [25].
1. Скотт Р. Робинсон Р.К., Уилби Р.А.. Производство сыра: научные основы и технологии
СПб.: Профессия, 2005. 464 с.
2. Гудков А.В. Сыроделие: технологические, биологические и физико-химические аспекты. 2-е изд., испр. и доп. М.: ДеЛи принт, 2004. 804 с.
3. Полковникова М.В., Азолкина Л.Н. Исследование свойств различных молокосвертывающих ферментов // Современные проблемы техники и технологии пищевых производств: сб. материалов международ. науч.-практ. конф. Алтай, 2012. С. 73.
5. Белов А.Н., Ельчанинов В.В., Коваль А.Д. Молокосвертывающие препараты // Молочная промышленность. 2003. № 2. С. 45-47.
6. К вопросу о моделировании сычужного свертывания мо лока / Ю.Я. Свириденко, Г.В.Мурунова, В.Н. Краюшкина, В.В.Смирнов // Сыроделие и маслоделие. 2004. № 5. С. 39-42.
7. Ларичев О.В. Влияние ферментов на качество сыров // Сыроделие и маслоделие. 2003. №3. С. 22-23.
8. Колесникова С. С. Ферменты для коагуляции молока в сыроделии // Молочное дело. 2006. № 8. С. 50 52; № 9. С. 50-51.
9. Федотова А.В. Правильный выбор молокосвертывающих ферментных препаратов-гарантия качества выпускаемых сыров // Молочное дело. Киев, 2006. № 6. С. 39.
11. Tubesha Z.A., Al-Delaimy K.S. Rennin-like milk coagulant enzyme produced by a local isolate of Mucor // Int. J. Dairy Technol. 2003. № 56. P. 237-241.
12. Ayhan F., Celebi S.S., Tanyolac A. The effect of fermentation parameters on the production of Mucor miehei acid protease in a chemically defined medium // J. Chem. Technol. Biotechnol. 2001. № 76. P. 153-160.
13. Hashem A.M. Purification and properties of a milk-clotting enzyme produced by Penicillium oxalicum // Biores. Technol. 2000. № 75. P. 219-222.
15. Ahmed S.A. Biochemical studies on some enzymes used in industry // Ph. D Thesis. Cairo: Cario University, 2003. – P. 109-135.
17. Nath, A. Chattopadhyay P.K. // J. Food Ingen. 2007. P. 80.
18. Liyana-Pathirana C. Shahidi F. // Food Chem. 2005. P. 93, 47-56.
20. Смирнова И.А., Гралевская И.В., Штригуль В.К., Смирнов Д.А. Исследование способов коагуляции молока с целью формирования микропартикулятов белков молока // Техника и технология пищевых производств. Кемерово, 2012. № 3.
24. Клюева М.В. Основные аспекты иммобилизации ферментов на примере липаз // Молодой ученый. 2014. № 8. С. 320-325.
25. Бектенова Г.А. Иммобилизация ферментов на неорганических и органических полимерных носителях: автореф. дис. … д-ра хим.наук. Алматы, 2000.
26. Лукин А.А., Ребезов М.Б. Особенности использования иммобилизованных ферментов в пщевой промышленности // Проблемы развития АПК СаянАлтая: сб. материалов межрегион. научн.-практ. конф. Абакан: КрГАУ, 2009. С. 33-36.