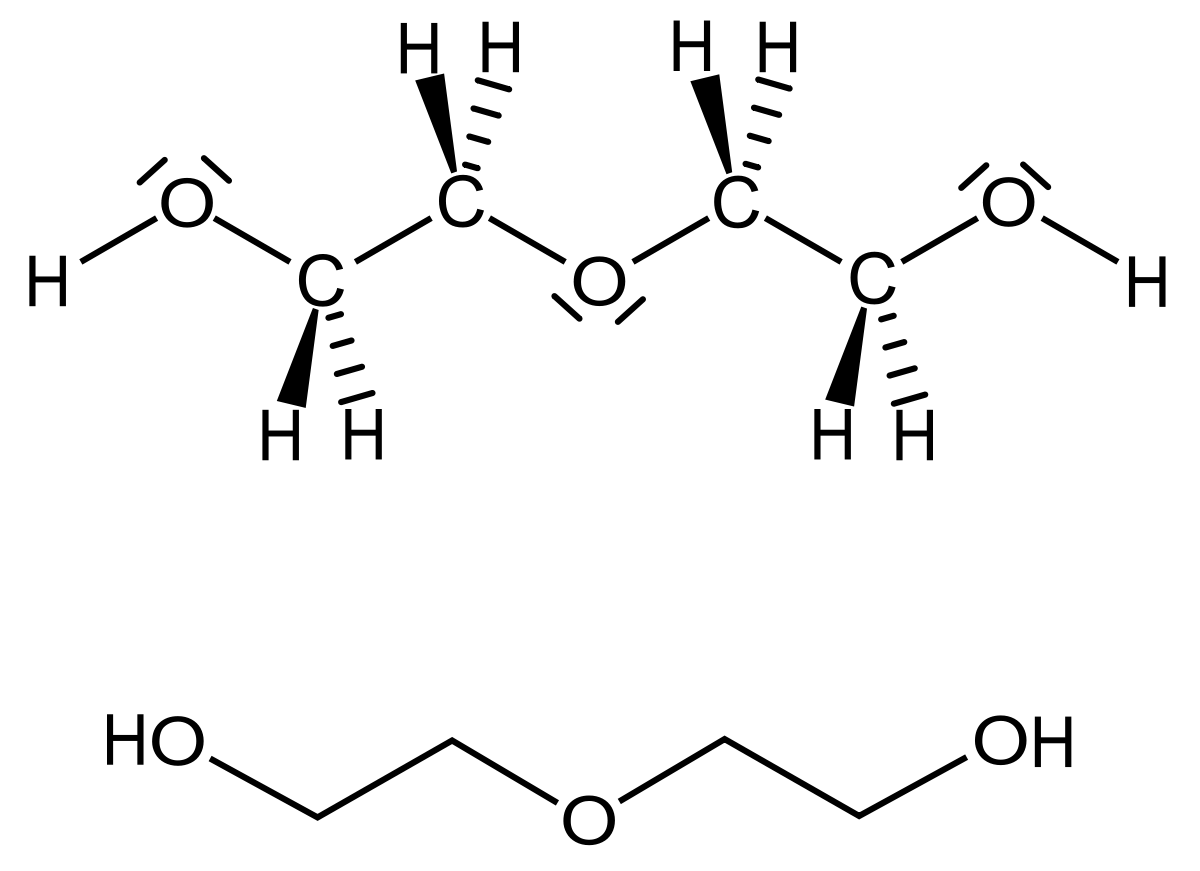
Моноэтиленгликоль и диэтиленгликоль в чем разница
Что такое диэтиленгликоль и чем он отличается от моноэтиленгликоля?
Часто на специализированных форумах можно встретить вопрос: есть ли разница между этиленгликолем и моноэтиленгликолем (МЭГ)? Специалисты уверенно утверждают, что это одно и то же вещество, обладающие аналогичными физическими свойствами и рабочими характеристиками при использовании в качестве антифриза. А вот разница между моно- и диэтиленгликолем действительно присутствует.
Диэтиленгликоль (в литературе встречается название дигликоль или ДЭГ) обладает лучшей растворимостью, более высокой вязкостью и температурой кипения, а также меньшей летучестью. Температура замерзания у ДЭГ чуть выше, чем у моноэтиленгликоля, но это не сказывается на сфере применения и способностях проводить тепло.
Важно заметить, что дигликоль отлично растворяется в воде и смешивается с многими органическими соединениями – пропиленгликолем, одноатомными спиртами (этанол), карбитолами, целлозольвами, фенолом, ацетоном, пиридином, фурфуролом. Растворимость остается высокой в широком диапазоне рабочих температур. ДЭГ не взаимодействует с растительными и минеральными маслами и не растворяется в них.
Сфера применения
На практике водные растворы диэтиленгликоля используются в качестве антифриза реже, чем привычная нам моноэтиленгликолевая смесь. Это объясняется не физическими характеристиками вещества (они не различаются столь существенно), а различными объемами производства и доступностью на рынке. Теплоноситель на основе пропиленгликоля или этиленгликоля более доступен, да и стоимость его производства не так высока.
Помимо инженерных систем дигликоль широко используется как селективный растворитель при экстракции нефтепродуктов и ароматических углеводородов – бензола, толуола, ксилола. Он отлично растворяет перечисленные вещества и не оказывает влияние на нафтеновые и парафиновые углеводороды. За счет лучшей растворимости в воде растворитель на основе ДЭГ гораздо эффективнее, что позволяет получать на химическом производстве готовый продукт различной степени чистоты.
Еще одно направление использования – удаление водяного пара из прокачиваемого по трубопроводным системам газа. Решение этой задачи позволяет минимизировать риск образования конденсата и ледяных пробок внутри труб. Кроме того, диэтиленгликоль позволяет эффективно очищать газ от посторонних примесей – диоксида углерода и сероводорода.
Дигликоль незаменим при производстве некоторых полимерных материалов – термостойких и огнестойких полиуретанов, ненасыщенных полиэфирных смол, устойчивых к воздействию щелочи алкидных смол, модифицирующих компонентов. Это синтез активаторов полимеризации, стабилизаторов, пластификаторов, антиоксидантов, отвердителей эпоксидных смол.
Технология изготовления и безопасность
Сегодня в химической промышленности распространены две технологии получения диэтиленгликоля: совместный синтез с МЭГ и получение непосредственно из этиленгликоля.
Что касается мер предосторожности, то токсичность дигликоля ниже, чем у привычных нам соединений на основе МЭГ. Это существенно расширяет сферу применения теплоносителей, имеющих в составе диэтиленгликоль. Пары не представляют опасности даже при вдыхании, токсичен лишь прием вещества внутрь. Отработанная в инженерных системах водная смесь утилизируется или очищается ионно-обменными смолами.
широкого применения

для дезинфекции на объектах железнодорожного транспорта, пищевой промышленности, ЛПУ, ветеринарного надзора
Моющие средства
| Раствор | Температура замерзания | Плотностьпри 20˚С | Раствор | Температура замерзания | Плотностьпри 20˚С |
| Пропиленгликоль 30% | -13˚С | 1,023 | Этиленгликоль 30% | -15˚С | 1,038 |
| Пропиленгликоль 35% | -20˚С | 1,028 | Этиленгликоль 35% | -20˚С | 1,045 |
| Пропиленгликоль 40% | -25˚С | 1,032 | Этиленгликоль 40% | -25˚С | 1,052 |
| Пропиленгликоль 45% | -30˚С | 1,035 | Этиленгликоль 45% | -30˚С | 1,058 |
| Пропиленгликоль 50% | -35˚С | 1,038 | Этиленгликоль 50% | -35˚С | 1,064 |
| Пропиленгликоль 55% | -45˚С | 1,040 | Этиленгликоль 55% | -43˚С | 1,071 |
| Пропиленгликоль 60% | -55˚С | 1,042 | Этиленгликоль 60% | -50˚С | 1,077 |
| Пропиленгликоль 65% | -60˚С | 1,043 | Этиленгликоль 65% | -60˚С | 1,083 |
| Пропиленгликоль 70% | -65˚С | 1,044 | Этиленгликоль 70% | -70˚С | 1,088 |
Из-за склонности растворов гликолей к переохлаждению фактическая температура замерзания может отличаться в пределах 2˚С.
Плотность водных растворов этиленгликоля при различных температурах
| Температура,˚С | Концентрация этиленгликоля ГОСТ 19774 высшего сорта в водном растворе (по массе) | |||||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 100% | |
| -45 | 1,11 | 1,125 | 1,137 | |||||||
| -40 | 1,108 | 1,122 | 1,134 | |||||||
| -35 | 1,087 | 1,105 | 1,12 | 1,131 | ||||||
| -30 | 1,086 | 1,103 | 1,118 | 1,129 | ||||||
| -25 | 1,068 | 1,085 | 1,101 | 1,115 | 1,126 | |||||
| -20 | 1,067 | 1,083 | 1,098 | 1,112 | 1,123 | 1,133 | ||||
| -15 | 1,066 | 1,081 | 1,096 | 1,109 | 1,12 | 1,13 | 1,137 | |||
| -10 | 1,017 | 1,32 | 1,048 | 1,064 | 1,079 | 1,094 | 1,107 | 1,117 | 1,127 | 1,134 |
| -5 | 1,016 | 1,31 | 1,047 | 1,062 | 1,077 | 1,091 | 1,104 | 1,114 | 1,123 | 1,131 |
| 0 | 1,015 | 1,03 | 1,046 | 1,061 | 1,075 | 1,088 | 1,101 | 1,111 | 1,12 | 1,127 |
| 5 | 1,014 | 1,029 | 1,044 | 1,059 | 1,073 | 1,085 | 1,097 | 1,108 | 1,116 | 1,124 |
| 10 | 1,013 | 1,027 | 1,042 | 1,056 | 1,07 | 1,083 | 1,094 | 1,105 | 1,113 | 1,120 |
| 15 | 1,012 | 1,026 | 1,041 | 1,054 | 1,067 | 1,08 | 1,091 | 1,102 | 1,10 | 1,117 |
| 20 | 1,011 | 1,024 | 1,038 | 1,052 | 1,064 | 1,077 | 1,088 | 1,098 | 1,106 | 1,113 |
| 25 | 1,009 | 1,022 | 1,036 | 1,05 | 1,061 | 1,074 | 1,084 | 1,094 | 1,102 | 1,11 |
| 30 | 1,007 | 1,021 | 1,034 | 1,047 | 1,058 | 1,071 | 1,081 | 1,091 | 1,099 | 1,106 |
| 35 | 1,006 | 1,019 | 1,032 | 1,045 | 1,055 | 1,067 | 1,078 | 1,087 | 1,096 | 1,103 |
| 40 | 1,004 | 1,017 | 1,029 | 1,041 | 1,052 | 1,064 | 1,074 | 1,084 | 1,093 | 1,099 |
| 45 | 1,002 | 1,014 | 1,026 | 1,038 | 1,049 | 1,06 | 1,071 | 1,081 | 1,089 | 1,096 |
| 50 | 0,999 | 1,012 | 1,023 | 1,035 | 1,046 | 1,057 | 1,067 | 1,077 | 1,085 | 1,093 |
| 55 | 0,996 | 1,009 | 1,021 | 1,032 | 1,043 | 1,054 | 1,064 | 1,073 | 1,082 | 1,089 |
| 60 | 0,994 | 1,006 | 1,018 | 1,029 | 1,04 | 1,051 | 1,06 | 1,069 | 1,078 | 1,085 |
| 65 | 0,991 | 1,003 | 1,014 | 1,026 | 1,037 | 1,047 | 1,057 | 1,065 | 1,074 | 1,081 |
| 70 | 0,988 | 1,0 | 1,011 | 1,023 | 1,034 | 1,044 | 1,053 | 1,062 | 1,07 | 1,078 |
| 75 | 0,986 | 0,997 | 1,008 | 1,019 | 1,029 | 1,04 | 1,05 | 1,058 | 1,066 | 1,074 |
| 80 | 0,983 | 0,994 | 1,005 | 1,016 | 1,026 | 1,036 | 1,046 | 1,054 | 1,063 | 1,07 |
| 85 | 0,979 | 0,99 | 1,001 | 1,012 | 1,022 | 1,032 | 1,042 | 1,05 | 1,059 | 1,067 |
| 90 | 0,976 | 0,987 | 0,997 | 1,009 | 1,018 | 1,028 | 1,038 | 1,046 | 1,055 | 1,063 |
| 95 | 0,973 | 0,983 | 0,993 | 1,005 | 1,014 | 1,024 | 1,034 | 1,043 | 1,051 | 1,059 |
| 100 | 0,969 | 0,98 | 0,99 | 1,0 | 1,01 | 1,02 | 1,03 | 1,04 | 1,047 | 1,055 |
Значения плотности растворов этиленгликоля в воде приведены в г/см3.
Разница между этиленгликолем и диэтиленгликолем
В ключевое отличие между этиленгликолем и диэтиленгликолем заключается в том, что молекула этиленгликоля представляет собой отдельную молекулу, тогда как молекула диэтиленгликоля образована комбинацие
Содержание:
В ключевое отличие между этиленгликолем и диэтиленгликолем заключается в том, что молекула этиленгликоля представляет собой отдельную молекулу, тогда как молекула диэтиленгликоля образована комбинацией двух молекул этиленгликоля через эфирную связь.
Что такое этиленгликоль?
Есть два способа производства этиленгликоля; производство в промышленных масштабах и биологический путь производства этиленгликоля. В промышленном масштабе этиленгликоль получают из этилена. Этилен превращается в оксид этилена, который затем превращается в этиленгликоль посредством реакции между оксидом этилена и водой. Эта реакция катализируется кислотами или основаниями. Если реакция проводится в среде с нейтральным pH, тогда реакционная смесь должна быть снабжена тепловой энергией. Биологический путь производства этиленгликоля заключается в разложении полиэтилена кишечными бактериями гусеницы восковой моли.
Что такое диэтиленгликоль?
В чем сходство этиленгликоля и диэтиленгликоля?
В чем разница между этиленгликолем и диэтиленгликолем?
Этиленгликоль против диэтиленгликоля
И этиленгликоль, и диэтиленгликоль производятся из одного и того же исходного материала; этилен. Разница между этиленгликолем и диэтиленгликолем заключается в том, что молекула этиленгликоля представляет собой отдельную молекулу, тогда как молекула диэтиленгликоля образована комбинацией двух молекул этиленгликоля через эфирную связь.
Все, что нужно знать, о диэтиленгликоле и триэтиленгликоле
Диэтиленгликоль и триэтиленгликоль, основные сопродукты производства моноэтиленгликоля, за последние десятилетия нашли на рынке собственные узкие ниши, где их использование экономически выгодно, а ограниченные объемы производства – достаточны. Они используются как сырье и растворители в нефтехимической отрасли, а триэтиленгликоль даже можно добавлять в косметику и пищу.
Невольные попутчики
При выпуске моноэтиленгликоля методом гидратации окиси этилена формируется два сопродукта со схожими свойствами – диэтиленгликоль (ДЭГ) и триэтиленгликоль (ТЭГ). Они – прозрачная, бесцветная и вязкая жидкость без запаха со сладковатым привкусом, менее летучи и обладают более высокой температурой кипения.

ДЭГ менее токсичен, чем моноэтиленгликоль и относится к третьему классу опасности. ТЭГ еще более безопасен, но, несмотря на это, оба вещества остаются ядовитыми для человека, вызывая тяжелое отправление в случае проглатывания. Пары не токсичны и не представляют опасности даже при долговременном вдыхании.
Есть два наиболее распространенных варианта производства диэтиленгликоля:
На данный момент в России всего два крупных производителя ди- и триэтиленгликоля – «СИБУР-Нефтехим» и входящий в ТАИФ «Нижнекамскнефтехим». До 2011 года оба продукта также выпускал другой актив ТАИФа – «Казаньоргсинтез», но затем компания отказалась от производства триэтиленгликоля.
Внутренние объемы производства не покрывают растущий спрос, так что сопродукты, в основном – ТЭГ, российским потребителям приходится закупать в Европе. Основной импортер – немецкая корпорация BASF.
Достойная замена
Гликоли стали активно использоваться в промышленности только в начале 20 века, хотя впервые моноэтиленгликоль французский химик Шарль Адольф Вюрц синтезировал в 1859 году, а во время Первой мировой войны он использовался для производства взрывчатых веществ.
Сопродукты моноэтиленгликоля получили широкое распространение еще позже, чем исходный компонент. Гликоли заменили глицерин сначала в области производства динамита, а затем – как компонент охлаждающих жидкостей, так как были эффективней технически и экономически.
После 1936 года они выиграли конкуренцию у глицерина как абсорбент для осушки углеводородных газов.
Несмотря на свое более позднее распространение, ТЭГ имеет преимущества перед ДЭГ в нефтегазовой сфере за счет более низкого давления над раствором и более высокой температуры разложения.

Каждому – свое место
Отличия диэтиленгликоля и триэтиленгликоля от МЭГ определило специфику их использования. За счет более низкой летучести и более высокой температуры кипения и вязкости в некоторых сферах предпочтение производителей отдается именно диэтиленгликолю.
Он используется как:
Еще одной крупной сферой применения ДЭГ с его высокой гигроскопичностью является газовая отрасль. Там он выполняет роль осушителя газов и используется в трубопроводах для удаления конденсата и влажных паров, предотвращая образование ледяных пробок. Также он помогает убирать углекислый газ и сероводород.
Способность поглощать влагу делает его полезным для поддержания необходимой влажности табачных изделий и бумаги.
Диэтиленгликоль применяется при производстве целлофана, клеев, пленок. Также за счет высокой теплоемкости он может использоваться в качестве топлива для переносных горелок.
В то же время как компонент антифриза диэтиленгликоль хоть и применяется, но намного реже, чем моноэтиленгликоль. Но это никак не связано с конкретными свойствами веществ, так как параметры замерзания водных растворов МЭГ и ДЭГ серьезно не отличаются.

Просто объемы производства моноэтиленгликоля существенно выше, а сам компонент – более привычен в качестве сырья для нефтехимии. При этом в некоторых случаях использование в производстве охлаждающих жидкостей обоих веществ позволяет добиться их более высоких эксплуатационных показателей.
Ближе к людям
Сферы применения триэтиленгликоля во многом определяет его сниженная летучесть и относительная безопасность по сравнению с МЭГ и ДЭГ. Вещество используется в тех продуктах, с которыми потребитель контактирует напрямую или в течение долгого времени.
Например, триэтиленгликоль выступает растворителем и пластификатором для лаков и лакокрасочных материалов. Он также используется в качестве дезинфицирующего средства. Ограниченно применяется в фармацевтике и на предприятиях пищевой промышленности. Так, за счет более низкой токсичности, ТЭГ в некоторых странах разрешен к применению в малых дозах в косметических и лекарственных препаратах.
Относительная безопасность сопродуктов моноэтиленгликоля стала причиной «антифризного» скандала в сфере виноделия в Австрии. В 1985 году в ходе стандартной проверки винной продукции немецкая лаборатория обнаружила в некоторых видах австрийской продукции повышенное содержание диэтиленгликоля.
Выяснилось, что отдельные производители в Австрии добавляли ДЭГ, который маскирует в вине дополнительные объемы сахара, который виноделам приходилось добавлять в неудачные годы, когда виноград не успевал вызреть и набрать нужное количество природного сахара.
Помимо этого, диэтиленгликоль делал напитки более сладкими, а букет – более полным. После выявления ДЭГ в составе продажи австрийских вин рухнули во всем мире и еще более 15 лет не могли вернуться на прежние уровни, даже несмотря на то, что из-за их потребления не было жертв. По расчетам экспертов, отравиться насмерть можно было только аяв течение двух недель по 28 бутылок вина с ДЭГ ежедневно.
В целом, как отмечает глава Центра отраслевых исследований Андрей Костин, диэтиленгликоль и триэтиленгликоль со временем нашли свои определенные ниши потребления, хоть и не очень крупные. По его словам, это напрямую связано с небольшими объемами производства сопродуктов. Но, говорит эксперт, наращивать объемы этих продуктов отдельно – невозможно экономически оправданным способом, это реально только вместе с увеличением производства основного продукта – МЭГ.
Моноэтиленгликоль и этиленгликоль в чем разница
Часто на специализированных форумах можно встретить вопрос: есть ли разница между этиленгликолем и моноэтиленгликолем (МЭГ)? Специалисты уверенно утверждают, что это одно и то же вещество, обладающие аналогичными физическими свойствами и рабочими характеристиками при использовании в качестве антифриза. А вот разница между моно- и диэтиленгликолем действительно присутствует.
Диэтиленгликоль (в литературе встречается название дигликоль или ДЭГ) обладает лучшей растворимостью, более высокой вязкостью и температурой кипения, а также меньшей летучестью. Температура замерзания у ДЭГ чуть выше, чем у моноэтиленгликоля, но это не сказывается на сфере применения и способностях проводить тепло.
Важно заметить, что дигликоль отлично растворяется в воде и смешивается с многими органическими соединениями – пропиленгликолем, одноатомными спиртами (этанол), карбитолами, целлозольвами, фенолом, ацетоном, пиридином, фурфуролом. Растворимость остается высокой в широком диапазоне рабочих температур. ДЭГ не взаимодействует с растительными и минеральными маслами и не растворяется в них.
Сфера применения
На практике водные растворы диэтиленгликоля используются в качестве антифриза реже, чем привычная нам моноэтиленгликолевая смесь. Это объясняется не физическими характеристиками вещества (они не различаются столь существенно), а различными объемами производства и доступностью на рынке. Теплоноситель на основе пропиленгликоля или этиленгликоля более доступен, да и стоимость его производства не так высока.
Помимо инженерных систем дигликоль широко используется как селективный растворитель при экстракции нефтепродуктов и ароматических углеводородов – бензола, толуола, ксилола. Он отлично растворяет перечисленные вещества и не оказывает влияние на нафтеновые и парафиновые углеводороды. За счет лучшей растворимости в воде растворитель на основе ДЭГ гораздо эффективнее, что позволяет получать на химическом производстве готовый продукт различной степени чистоты.
Еще одно направление использования – удаление водяного пара из прокачиваемого по трубопроводным системам газа. Решение этой задачи позволяет минимизировать риск образования конденсата и ледяных пробок внутри труб. Кроме того, диэтиленгликоль позволяет эффективно очищать газ от посторонних примесей – диоксида углерода и сероводорода.
Дигликоль незаменим при производстве некоторых полимерных материалов – термостойких и огнестойких полиуретанов, ненасыщенных полиэфирных смол, устойчивых к воздействию щелочи алкидных смол, модифицирующих компонентов. Это синтез активаторов полимеризации, стабилизаторов, пластификаторов, антиоксидантов, отвердителей эпоксидных смол.
Технология изготовления и безопасность
Сегодня в химической промышленности распространены две технологии получения диэтиленгликоля: совместный синтез с МЭГ и получение непосредственно из этиленгликоля.
Что касается мер предосторожности, то токсичность дигликоля ниже, чем у привычных нам соединений на основе МЭГ. Это существенно расширяет сферу применения теплоносителей, имеющих в составе диэтиленгликоль. Пары не представляют опасности даже при вдыхании, токсичен лишь прием вещества внутрь. Отработанная в инженерных системах водная смесь утилизируется или очищается ионно-обменными смолами.
широкого применения
для дезинфекции на объектах железнодорожного транспорта, пищевой промышленности, ЛПУ, ветеринарного надзора
для железнодорожного транспорта, сертифицированные ВНИИЖТ- «Фаворит К» и «Фаворит Щ», внутренняя и наружная замывка вагонов.
Основной промышленный метод получения этиленгликоля — гидратация этилена окиси при 10 ат и 190—200°С или при 1 ат и 50—100°С в присутствии 0,1—0,5% серной (или ортофосфорной) кислоты; в качестве побочных продуктов при этом образуются диэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Важным свойством этиленгликоля является способность понижать температуру замерзания воды, поэтому вещество нашло широкое применения как компонент автомобильных антифризов и тормозных жидкостей. Корозионно активен, поэтому применяется с ингибиторами коррозии.
Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Также применяется в производстве целлофана, полиуретанов и ряда других продуктов. В ограниченных масштабах этиленгликоль так же применяют как растворитель печатных и некоторых других красок, в производстве чернил и паст для шариковых ручек, в органическом синтезе.
Меры безопасности
| Этиленгликоль | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование | этандиол-1,2 |
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол |
| Хим. формула | C2H6O2 |
| Рац. формула | C2H4(OH)2 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 62,068 г/моль |
| Плотность | 1,113 г/см³ |
| Термические свойства | |
| Т. плав. | −12,9 °C |
| Т. кип. | 197,3 °C |
| Т. всп. | 111 °C |
| Пр. взрв. | 3,2 ± 0,1 об.% [1] |
| Давление пара | 0,06 ± 0,01 мм рт.ст. [1] |
| Химические свойства | |
| pKa | 15,1 ± 0,1 [2] |
| Оптические свойства | |
| Показатель преломления | 1,4318 |
| Классификация | |
| Рег. номер CAS | 107-21-1 |
| PubChem | 174 |
| Рег. номер EINECS | 203-473-3 |
| SMILES | |
| RTECS | KW2975000 |
| ChEBI | 30742 |
| ChemSpider | 13835235 |
| Безопасность | |
| ПДК | 5 мг/м 3 |
| ЛД50 | 4700 мг/кг (крысы, перорально) |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. [3]
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана [4] или комплекса диметилсульфат-ДМФА [5] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Похожие записи:
Моноэтиленгликоль и этиленгликоль в чем разница
Часто на специализированных форумах можно встретить вопрос: есть ли разница между этиленгликолем и моноэтиленгликолем (МЭГ)? Специалисты уверенно утверждают, что это одно и то же вещество, обладающие аналогичными физическими свойствами и рабочими характеристиками при использовании в качестве антифриза. А вот разница между моно- и диэтиленгликолем действительно присутствует.
Диэтиленгликоль (в литературе встречается название дигликоль или ДЭГ) обладает лучшей растворимостью, более высокой вязкостью и температурой кипения, а также меньшей летучестью. Температура замерзания у ДЭГ чуть выше, чем у моноэтиленгликоля, но это не сказывается на сфере применения и способностях проводить тепло.
Важно заметить, что дигликоль отлично растворяется в воде и смешивается с многими органическими соединениями – пропиленгликолем, одноатомными спиртами (этанол), карбитолами, целлозольвами, фенолом, ацетоном, пиридином, фурфуролом. Растворимость остается высокой в широком диапазоне рабочих температур. ДЭГ не взаимодействует с растительными и минеральными маслами и не растворяется в них.
Сфера применения
На практике водные растворы диэтиленгликоля используются в качестве антифриза реже, чем привычная нам моноэтиленгликолевая смесь. Это объясняется не физическими характеристиками вещества (они не различаются столь существенно), а различными объемами производства и доступностью на рынке. Теплоноситель на основе пропиленгликоля или этиленгликоля более доступен, да и стоимость его производства не так высока.
Помимо инженерных систем дигликоль широко используется как селективный растворитель при экстракции нефтепродуктов и ароматических углеводородов – бензола, толуола, ксилола. Он отлично растворяет перечисленные вещества и не оказывает влияние на нафтеновые и парафиновые углеводороды. За счет лучшей растворимости в воде растворитель на основе ДЭГ гораздо эффективнее, что позволяет получать на химическом производстве готовый продукт различной степени чистоты.
Еще одно направление использования – удаление водяного пара из прокачиваемого по трубопроводным системам газа. Решение этой задачи позволяет минимизировать риск образования конденсата и ледяных пробок внутри труб. Кроме того, диэтиленгликоль позволяет эффективно очищать газ от посторонних примесей – диоксида углерода и сероводорода.
Дигликоль незаменим при производстве некоторых полимерных материалов – термостойких и огнестойких полиуретанов, ненасыщенных полиэфирных смол, устойчивых к воздействию щелочи алкидных смол, модифицирующих компонентов. Это синтез активаторов полимеризации, стабилизаторов, пластификаторов, антиоксидантов, отвердителей эпоксидных смол.
Технология изготовления и безопасность
Сегодня в химической промышленности распространены две технологии получения диэтиленгликоля: совместный синтез с МЭГ и получение непосредственно из этиленгликоля.
Что касается мер предосторожности, то токсичность дигликоля ниже, чем у привычных нам соединений на основе МЭГ. Это существенно расширяет сферу применения теплоносителей, имеющих в составе диэтиленгликоль. Пары не представляют опасности даже при вдыхании, токсичен лишь прием вещества внутрь. Отработанная в инженерных системах водная смесь утилизируется или очищается ионно-обменными смолами.
широкого применения
для дезинфекции на объектах железнодорожного транспорта, пищевой промышленности, ЛПУ, ветеринарного надзора
для железнодорожного транспорта, сертифицированные ВНИИЖТ- «Фаворит К» и «Фаворит Щ», внутренняя и наружная замывка вагонов.
Основной промышленный метод получения этиленгликоля — гидратация этилена окиси при 10 ат и 190—200°С или при 1 ат и 50—100°С в присутствии 0,1—0,5% серной (или ортофосфорной) кислоты; в качестве побочных продуктов при этом образуются диэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Важным свойством этиленгликоля является способность понижать температуру замерзания воды, поэтому вещество нашло широкое применения как компонент автомобильных антифризов и тормозных жидкостей. Корозионно активен, поэтому применяется с ингибиторами коррозии.
Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Также применяется в производстве целлофана, полиуретанов и ряда других продуктов. В ограниченных масштабах этиленгликоль так же применяют как растворитель печатных и некоторых других красок, в производстве чернил и паст для шариковых ручек, в органическом синтезе.
Меры безопасности
| Этиленгликоль | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование | этандиол-1,2 |
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол |
| Хим. формула | C2H6O2 |
| Рац. формула | C2H4(OH)2 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 62,068 г/моль |
| Плотность | 1,113 г/см³ |
| Термические свойства | |
| Т. плав. | −12,9 °C |
| Т. кип. | 197,3 °C |
| Т. всп. | 111 °C |
| Пр. взрв. | 3,2 ± 0,1 об.% [1] |
| Давление пара | 0,06 ± 0,01 мм рт.ст. [1] |
| Химические свойства | |
| pKa | 15,1 ± 0,1 [2] |
| Оптические свойства | |
| Показатель преломления | 1,4318 |
| Классификация | |
| Рег. номер CAS | 107-21-1 |
| PubChem | 174 |
| Рег. номер EINECS | 203-473-3 |
| SMILES | |
| RTECS | KW2975000 |
| ChEBI | 30742 |
| ChemSpider | 13835235 |
| Безопасность | |
| ПДК | 5 мг/м 3 |
| ЛД50 | 4700 мг/кг (крысы, перорально) |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу. [3]
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана [4] или комплекса диметилсульфат-ДМФА [5] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).