Мутация при онкологии что это такое
Что такое мутация? Каким образом она вызывает рак?
Рак является генетическим заболеванием на клеточном уровне. Рак возникает результате накопления мутаций в генах, которые контролируют размножение клеток и их отношения друг с другом. Итак, чем же является то, что мы определяем как повреждение ДНК (мутация)?
Внутри в наших клеток находится основная молекула управления, ДНК. ДНК, с помощью содержащихся в ней генов, позволяет реализовать жизненно важные функции в нашем организме. ДНК представляет собой двухцепочечную структуру, состоящую из повторяющихся блоков, образованных в форме лестницы нуклеотидов. Многие факторы с которыми мы сталкиваемся в нашей повседневной жизни, такие как курение, некоторые химические вещества, инфекционные агенты и ультрафиолетовые лучи, могут нарушить структуру ДНК и разорвать взаимные последовательности нуклеотидов. Когда данное событие происходит в ДНК, его называют повреждение ДНК или мутация.
Чтобы описать мутацию примером из нашей из повседневной жизни; представим, что вся наша генетическая информация (геном), это книга. Алфавитом в этой книге являются 4 нуклеотида, которые формируют структуру ДНК, а каждый заголовок отображает наши гены. Если из книги удалить какую нибудь букву или вырвать какую нибудь страницу, она начнет становится бессмысленной. Точно также происходит и повреждение генов в организме человека.
Наш организм разработал ряд систем обороны против повреждения ДНК. Эти системы называются системами репарации ДНК. Мутации, происходящие в генах данной системы, являются одной из главных причин возникновения рака. Поврежденные в результате лечения гены раковых клеток, ремонтируются посредством данной системы. Одним из актуальных направлений исследований в области рака в последние годы, является разработка методов лечения, нацеленных на системы репарации ДНК, таких как (Олапариб и Нирапариб.
Накопление повреждений ДНК, вызывает рак
Мутации делятся на два вида, зародышевые (репродуктивные клетки) и соматические (клетки тела)
a) Мутация в зародышевой линии: Мутации, возникающие в репродуктивных клетках (гаметы), переходят потомству. В этом случае, мутации происходят в каждой клетке организма. Причиной наследственных синдромов рака являются поврежденные гены, которые передаются потомству. Например мутации происходящие в генах BRCA1 и BRCA2 в зародышевой линии, повышают риск наследственного рака груди или яичников. Наследственный рак составляет 10% всех случаев рака.
Более чем в 50% раковых заболеваний человека, присутствует повреждение гена P53. Мутация зародышевой линии, редко наблюдается в гене P53. Поскольку ген P53 представляет собой ген управления, он способствует началу образования рака, если в результате повреждения, начинается неконтролируемая работа этого гена, то остальные гены также перестают нормально функционировать.
b) Соматическая мутация: Повреждения, возникающие в клетках тела. Эти повреждения потомству не переходят. Повреждения, происходящие в генах, остаются в организме человека на протяжении всей его жизни. Образ жизни (Ожирение, солнечное воздействие, курение, инфекции) являются наиболее важным фактором в возникновении генных повреждений. Такие факторы, как курение, ультрафиолетовое излучение (УФ), вирусы и возраст, вызывают повреждение гена в клетках. Рак, возникающий в результате повреждения гена в клетках тела, называется спорадическим раком. Они составляют 80 процентов всех случаев рака.
Для того, чтобы объяснить причину возникновения рака, повреждение ДНК (мутация), имеет важное место в исследованиях рака. Следует подчеркнуть, что многие виды рака связаны не только с одним геном. Рак возникает в результате отношений нескольких генов друг с другом и с окружающей средой. В последние годы, более глубокое понимание повреждений ДНК стало возможным благодаря эпигенетической науке, которая изучает взаимосвязь между генами и окружающей средой.
1. Krishna L. Kanchi.
Integrated analysis of germline and somatic variants in ovarian cancer.
Nature Communications 5, Article number: 3156 (2014)
2. Greenman, Christopher et al.
“Patterns of Somatic Mutation in Human Cancer Genomes.”
Nature 446.7132 (2007): 153–158. PMC. Web. 4 Nov. 2016
Соматические мутации в опухоли
Мутация — любое изменение в молекуле ДНК либо структуре хромосом. Изменения, которые происходят в гаметах — половых клетках, называют герминальными, в любых других клетках организма — соматическими. Герминальные мутации передаются от родителей по наследству в виде генетических заболеваний. Соматические изменения не наследуются, а возникают в результате внешних воздействий (курения, радиоактивного излучения и других).
Доказано, что злокачественные опухоли в 90–95 % случаев возникают в результате соматических мутаций (спорадический рак). Наследственный рак, развивающийся в результате герминальных изменений, составляет 5–10 % от всех случаев заболевания.
Клеточные механизмы возникновения рака: протоонкогены и онкосупрессоры
Соматические мутации увеличивают шанс превращения здоровых клеток в раковые за счет активации онкогенов — генов, стимулирующих образование злокачественных опухолей. Онкогены образуются из обычных генов — протоонкогенов.
Деление клеток опухоли и разрастание опухолевой ткани тормозят антионкогены — гены-супрессоры. Протоонкогены и гены-супрессоры образуют систему стимуляции и подавления злокачественного процесса.
В подавляющем большинстве случаев раковые опухоли возникают из одной клетки в результате двух последовательных мутаций: первичной (герминальной) и вторичной (соматической). Для развития новообразования достаточно 3–6 таких повреждений. Вызванные ими изменения постепенно накапливаются в ДНК, вызывают неконтролируемое размножение пораженных клеток и образование атипичных тканей.
Драйверные соматические мутации и их использование для лечения злокачественных опухолей
В этиологии опухолей изменения в клетках вызывают ошибки копирования ДНК при делении — соматические драйверные мутации. В одних органах и тканях стволовые клетки делятся чаще, чем в других. В них злокачественные новообразования образуются чаще, чем в других структурах организма. По данным международного агентства по исследованию рака IARC, риск заболеть раком, а также выживаемость раковых клеток на 70–80 % зависят от интенсивности деления стволовых клеток и увеличиваются с возрастом.
Генетические маркеры опухолей (изменения в структуре белков в результате соматических драйверных мутаций) можно использовать как мишень и прицельно блокировать с помощью фармакологических препаратов. На этом принципе основан один из наиболее результативных современных методов лечения рака — таргетная терапия. Она позволяет:
Выявление драйверных соматических мутаций для диагностики злокачественных опухолей
Чем больше генетических маркеров известно, тем более адекватно подбирается лечение. Для выявления соматических мутаций при диагностике злокачественных опухолей используют следующие методики:
Целесообразность использования того или иного метода в каждом конкретном случае определяет врач.
Соматические мутации опухолей: влияние на диагностику и лечение
В процессе роста злокачественные новообразования приспосабливаются к факторам онкологического лечения — лучевой, химио- и иммунотерапии. Молекулы онкологических клеток, выжившие после того или иного лечебного этапа, нередко мутируют. Соматические мутации опухолей способствуют прогрессированию болезни и её более агрессивному (рецидивирующему и метастатическому) течению. Из-за индивидуальных различий на молекулярном уровне общеклинические стратегии лечения того или иного вида рака могут быть неэффективны для отдельных пациентов.
Чтобы максимально снизить риск рецидивов, улучшить качество жизни больных и увеличить её продолжительность, соматические мутации в опухолях в ответ на фармако- и химиотерапию необходимо учитывать. Для их выявления разработан инновационный метод исследования — молекулярное профилирование. Результаты этого вида диагностики позволяют врачу назначать наиболее оптимальное персонализированное лечение.
Путь клетки «из греков в варяги». Малигнизация: причины и следствия
Малигнизация — один из самых загадочных процессов. Что же на самом деле направляет клетку на тернистый путь перерождения?
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Недуг, прозванный чумой XXI века. В наши дни рак является одним из самых страшных заболеваний. В 2010 году более семи миллионов людей по всему свету умерли от рака. В Соединенных Штатах каждая третья женщина и каждый второй мужчина рано или поздно заболеют раком. По прогнозам ВОЗ, число случаев заболевания будет продолжать расти от 14 миллионов в 2012 году до 22 миллионов в следующие десятилетия. Пугающие числа, от которых невольно бросает в дрожь. Однако процесс ракового перерождения, или малигнизации, не только страшен, но и интересен, и в этой статье мы разберемся, почему же некоторые «избранные» клетки решают свернуть не туда и как это влияет на самого «изменника».
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Гончие еще играют во дворе, но дичи не уйти,
как ни мчится она уже сейчас по лесам.
Франц Кафка
На «Биомолекуле» опубликовано немало статей о молекулярных основах канцерогенеза. Но каждая из них, как правило, посвящена какой-то одной стороне этого патологического процесса, в то время как среди наших читателей наверняка есть люди, которые хотели бы, прежде чем углубляться в детали, получить общее представление о раковой клетке. Обзорная статья Анны Батуевой удачно заполняет этот пробел и дает общее представления о ключевых молекулярных механизмах злокачественного перерождения. — Ред.
Под малигнизацией понимают приобретение здоровыми клетками черт злокачественности, которые мы подробно рассмотрим ниже. Процесс злокачественного изменения можно уподобить дичи из цитаты Кафки, ведь клетка, однажды встав на этот путь, не сможет вернуться и получить свое клеточное здоровье обратно. Важную роль в понимании основ перерождения клеток и их дальнейшего функционирования сыграла медицина, а следом за ней и молекулярная биология. Но начнем с истоков истории рака.
Часть 1. Биография рака
Первые упоминания о раке встречаются в папирусе Эдвина Смита, датируемом 16 веком до нашей эры [1]. Там же отмечается, что данное заболевание не поддается лечению.
Во времена Гиппократа, около 400 года до нашей эры, появилось специальное обозначение рака — karkinos. Разросшаяся опухоль напомнила Гиппократу краба, окутывающего все вокруг клешнями. Современное название онкологии произошло от греческого слова onkos, которое греки использовали для описания опухолей. Однако врачи того времени не различали доброкачественные и злокачественные новообразования, и karkinos Гиппократа не имеет ничего общего с истинным раком.
Гиппократ выдвинул гуморальную теорию, суть которой состояла в том, что каждый недуг является следствием переизбытка одного из четырех гуморов: крови, слизи, желтой желчи и черной желчи.
Гален, греческий врач, практиковавший в Риме около 160 года нашей эры, довел теорию Гиппократа до совершенства. Он заявил, что рак образуется из-за переизбытка черной желчи. Гален умер в 199 году нашей эры, но его «черная желчь» еще долго будоражила умы онкологов.
Только спустя пять столетий, в 1538 году, Андреас Везалий опроверг теорию Галена, делая вскрытия в Парижском университете. Окончательно похоронил галенову теорию лондонский анатом Мэтью Бейли, который в 1793 году опубликовал учебник «Патологическая анатомия некоторых наиболее важных частей человеческого тела» [2], в котором представил рисунки и описания раковых опухолей, где не было и следа «черной желчи».
Изобретение микроскопа повлекло за собой первые цитологические исследования рака. В 1801 году французский физиолог Франсуа Биша и в 1838 году Иоганн Мюллер определили, что опухоли имеют клеточную структуру. После этого Жан Крювелье высказал гипотезу «канцероматозной дегенерации», основанную на предположении, что клетка проходит несколько этапов, прежде чем окончательно превратиться в раковую. Немецкий хирург Карл Тирш доказал, что раковая опухоль происходит из эпителиальной ткани, а саркома — из соединительной.
Первая половина XX века породила еще одну теорию канцерогенеза, недалеко ушедшую от истины. В 1911 году Пейтон Раус, работая в Рокфеллеровском университете в Нью-Йорке, открыл вирус, способный вызывать опухоли у кур. Ученые по всему свету бросились искать вирусы, ответственные за рак именно у человека, однако ничего не могли найти. В 1974 году в Medical World News вирус рака у человека ставили в один ряд с НЛО, снежным человеком и лохнесским чудовищем. Вирус СВ-40 и вирус папилломы человека, вызывающие рак у людей, были открыты в 1960 и 1983 годах соответственно.
В 1970 году генетик Говард Темин, работавший в лаборатории Макардла в Висконсине и изучавший вирус саркомы Рауса (ВСР, или VSR), представил свою работу на Десятом Международном онкологическом конгрессе. Он открыл у ВСР обратную транскрипцию — синтез ДНК по РНК — и положил начало изучениям ретровирусов. Позднее он отказался от вирусной теории канцерогенеза, а в 1979 году ученые Майкл Бишоп и Харолд Вармус открыли первый протоонкоген — src (сарк), содержащийся в ВСР. Это положило начало новому этапу в истории онкологии, люди наконец-то поняли, как запускается процесс канцерогенеза. Но этого бы не произошло без изучения раковой клетки и ее странной физиологии.
Часть 2. Что заставляет клетку измениться?
В этой главе мы разберем причины злокачественного перерождения клетки. Первым толчком к началу этого изменения является мутация в ДНК.
Но не всякие повреждения ДНК обязательно приведут к появлению раковой клетки, а лишь те, что затронут определенные гены. Наиболее важную роль в канцерогенезе играют три группы генов: протоонкогены, онкогены и гены — супрессоры опухолей.
Протоонкогены
Протоонкогены — это «здоровые» предшественники онкогенов, которые в результате мутации могут вызвать развитие опухоли. Такими причинами являются различные мутации или суперэкспрессия гена. Как правило, протоонкогены кодируют белки, участвующие в процессах жизненного цикла клетки. В результате мутаций появляются сбои в регуляции клеточного деления и дифференцировки.
Основные изменения, происходящие с протоонкогенами:
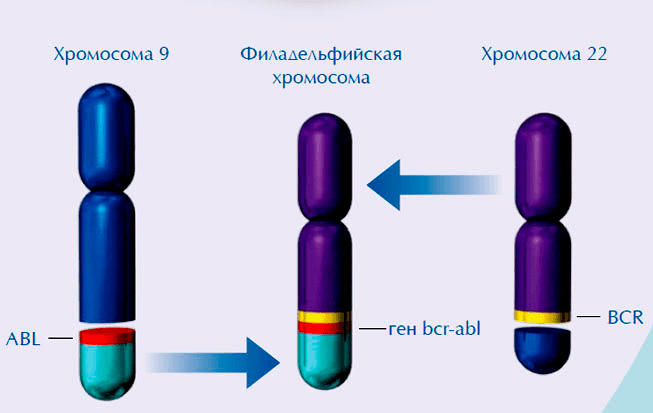
Рисунок 1. Химерный ген BCR-ABL образуется при слиянии участка 9 хромосомы, несущей ген ABL, с участком 22 хромосомы, несущей ген BCR
В некоторых случаях канцерогенез запускается вирусами. Онкогены в геноме вирусов являются ранее захваченными в клетках-хозяевах нормальными генами, которые со временем превратились в злокачественные. Когда такие онкогенные вирусы попадают в клетку, начинается считывание информации с вирусной ДНК или РНК, в цитоплазме накапливаются онкогенные белки и начинается процесс перерождения.
Онкогены
Онкогены — это гены, активность которых стимулирует образование и развитие злокачественной опухоли. Как уже было упомянуто выше, первый вирусный онкоген был открыт в 1979 году.
Биохимические продукты онкогенов
Онкогены кодируют белки с различной структурой и функциями. К основным продуктам деятельности онкогенов относят:
Все вышеперечисленные продукты онкогенов являются сигналами к запуску неконтролируемого клеточного деления. Внешние факторы больше не играют никакой роли в жизни клетки, потому что пролиферацию запускают внутренние сигнальные белки.
Гены и белки — супрессоры
В здоровой клетке существуют защитные механизмы, следящие за процессами и регулирующие клеточный цикл. К таким механизмам относят деятельность белков — супрессоров опухолей: p21, p53, pRb, PTEN и др.
Белок p53 — наиболее изученный белок-супрессор. Он является продуктом гена TP53, мутации которого обнаруживаются в клетках многих опухолей [7]. p53 синтезируется во всех клетках организма, но активируется только при повреждениях ДНК. Этот белок способен остановить клеточный цикл и не допускать дальнейшее деление клетки, пока не произойдет репарация ДНК. При сильных повреждениях он также может запускать процесс апоптоза.
Одной из главных функций p53 является сохранение генетической идентичности всех клеток организма. При неправильной работе этого белка клетка получает возможность делиться даже при поврежденной ДНК, что увеличивает вероятность мутаций и накопления дефектных онкогенов. Важную роль в подавлении p53 играет белок MDM2, который в норме регулирует активность p53. Однако при повышенном синтезе он связывается с p53 и ингибирует его противоопухолевое действие.
Эпигенетические факторы рака
Важными факторами канцерогенеза являются эпигенетические события. Эпигенетика изучает процессы, затрагивающие активность генов, но не изменяющие структуру ДНК. К ним относится изменение метилирования ДНК.
Метилирование — это присоединение метильной группы к нуклеотидам в особых, строго определенных участках генома, называемых CpG-островками. Такое изменение не влияет на структуру молекулы, однако может влиять на экспрессию отдельных генов. В частности, если в участке ДНК много метильных групп, то транскрипция этого участка прекращается.
Особенно активно метилирование проходит в эмбриональный период жизни, а у взрослого человека метилировано около 2% генома. В норме баланс между метилированием и деметилированием строго регулируется и соблюдается, однако в старости начинают преобладать процессы метилирования, что может в итоге привести к канцерогенезу. В процессе онкогенеза происходит гиперметилирование CpG-островков, что приводит к общей геномной нестабильности и накоплению еще большего количества мутаций. В большинстве случаев метилированные участки являются промоторами и влияют на активацию или, наоборот, инактивацию генов, что с виду похоже на действие точечных мутаций.
Однако хотя нарушения в эпигенетической регуляции сопровождают развитие злокачественного перерождения, они, как правило, не являются его первопричиной, а лишь одним из сопутствующих факторов.
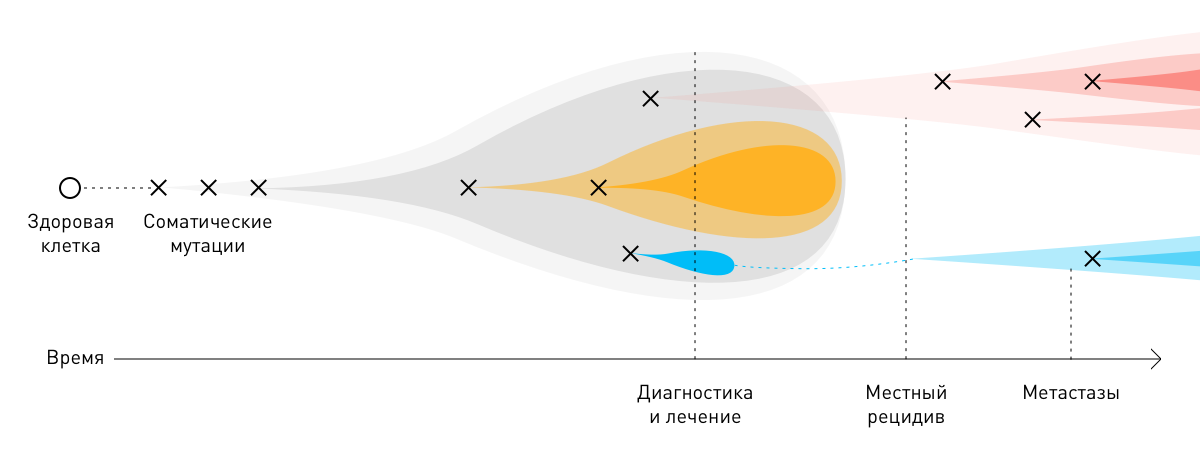
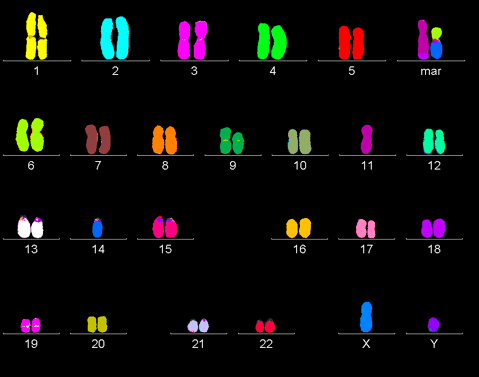
По отдельности каждое из вышеперечисленных нарушений не может спровоцировать раковое перерождение. Все они работают совместно и слаженно. Так, онкогенез запускается, только если одновременно активированы онкогены и инактивированы гены-супрессоры в обеих копиях ДНК. Впервые теорию двойного канцерогенеза высказал Альфред Кнудсон, изучавший ретинобластому: «По всей видимости, — писал он, — в возникновении рака у детей ключевую роль играют два типа генов. Первый, онкогены, действует посредством повышенной, аномальной активности. Второй же класс, антионкогены, в онкогенезе рецессивен: рак происходит лишь тогда, когда обе нормальные копии удалены или изменены» [8]. В процессе жизнедеятельности раковая клетка накапливает все большее количество мутаций, поэтому раковый геном часто очень сильно отличается от генома здоровой клетки (рис. 2).
Рисунок 2. Раковый геном. В процессе жизнедеятельности раковая клетка накапливает огромное количество мутаций и нередко характиризуется полиплоидностью.
Часть 3. Физиологические последствия малигнизации
Основное последствие малигнизации — клеточное бессмертие. Оно может поддерживаться несколькими способами: активацией фермента теломеразы, блокировкой регуляторов митохондриального пути апоптоза и в некоторых случаях активацией механизма ALT (alternative lengthening of telomeres, альтернативного удлинения теломер [14]).
Обратная сторона «вечной молодости»
Впервые клеточное бессмертие раковых клеток было продемонстрировано в 1951 году на клеточной линии HeLa, взятой у Генриетты Лакс, вскоре скончавшейся от рака шейки матки (рис. 3) [9].
Рисунок 3. Клеточная линия HeLa — «бессмертная» линия раковых клеток. С 50-х годов прошлого столетия используется для изучения поведения раковых клеток и выявления новых противораковых препаратов.
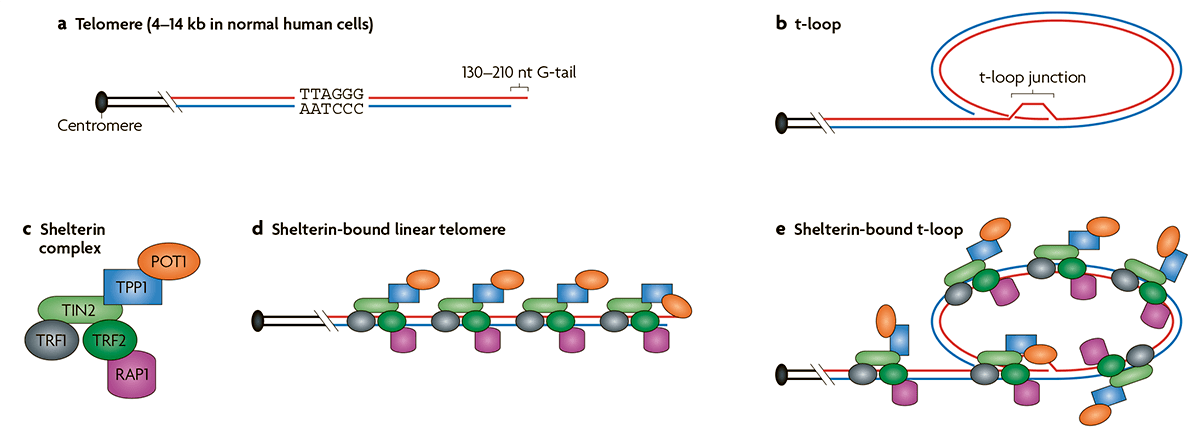
Как правило, малигнизация сопровождается активацией фермента теломеразы. На концах хромосом находятся короткие повторяющиеся участки ДНК, названные теломерами [10]. После каждого деления теломеры укорачиваются, что в итоге приводит к их полному исчезновению и невозможности продолжать деление. Количество возможных делений для клетки названо пределом Хейфлика. Действие теломеразы заключается в восстановлении теломер и превращении клетки в фактически бессмертную, позволяя ей делиться бесконечно долго. Существуют нормальные клетки, в которых также экспрессируется теломераза. Это клетки, которым надо часто делиться: половые, стволовые и клетки эпителия кишечника. Однако теломераза активна в подавляющем большинстве раковых клеток, что играет важную роль в их жизненном цикле.
С другой стороны, в некоторых злокачественных клетках, наравне с активной теломеразой, существует так называемое альтернативное удлинение теломер, или сокращенно ALT [11]. При ALT происходит гомологичная рекомбинация концевых участков хромосом (рис. 4). В норме рекомбинация происходит в процессе мейоза, однако раковые клетки научились достраивать теломеры, используя теломеры другой хромосомы как матрицу [12].
Рисунок 4. Принцип действия ALT, основанный на гомологичном достраивании концов теломер. Такой механизм «бессмертия» является основным для ряда опухолей.
Важно отметить, что раковое бессмертие контролируется не только теломерами, но и ингибированием путей апоптоза, главным из которых является митохондриальный путь. В норме, из митохондрий в цитоплазму выходят митохондриальные белки и образуют апоптотический комплекс — апоптосому, которая и запускает апоптоз. При неправильной работе регуляторных белков, а к ним относятся белки семейства BCL-2, нарушается выход апоптотических белков, что приводит к сбою в процессе апоптоза. В раковых клетках обнаружены нарушения в работе белков BAX и BAK, а также экспрессия ингибиторов клеточной смерти.
Часть 4. Заключение
Ежедневно в нашем организме появляются клетки, вступившие на путь ракового перерождения. Но далеко не все из них дойдут до конца и образуют злокачественную опухоль. С другой стороны, интересно клеточное поведение в процессе малигнизации, когда клетка способна «выключать» отдельные гены, мешающие ее перерождению. Современные исследования в области молекулярной онкологии и раковой геномики дают повод надеяться на окончательное понимание основ малигнизации и физиологии злокачественных клеток. Также в последнее время проводятся разработки новых противораковых препаратов, направленных на исправление дефектных сторон «больных» клеток. Возможно, изучение именно особенностей раковой клетки приведет к созданию лекарства, способного снизить страшные прогнозы Всемирной организации здравоохранения.
BRCA1 и BRCA2: что делать, если обнаружена мутация в этих генах?
Несмотря на множество теорий развития злокачественных опухолей специалисты и сегодня нередко затрудняются ответить на вопрос, почему развивается рак того или иного органа. Однако уже не вызывает сомнений тот факт, что некоторые его разновидности могут быть связаны с наследственной предрасположенностью, выявить которую позволяет специальное генетическое исследование.
Анализ BRCA1 и BRCA2. В каких случаях и для чего его проводят? Об этом и многом другом мы беседуем с врачом-акушером-гинекологом «Клиника Эксперт» Курск Татьяной Ивановной Еремеевой.
— Татьяна Ивановна, среди названий исследований, проводимых при подозрении на онкологическое заболевание, упоминаются такие аббревиатуры, как BRCA1 и BRCA2. Что они означают?
— Так называются гены, которые выступают в роли опухолевых супрессоров. Это значит, что они являются своеобразными «контролёрами», препятствующими неконтролируемому и нарушенному процессу деления клетки. Если в этих генах появляются мутации, то гены утрачивают способность отслеживать изменения в геноме клетки, а это, в свою очередь, может привести к атипичным трансформациям в клетках и развитию злокачественных опухолей.
— То есть получается, что можно унаследовать эти гены с такими мутациями и, соответственно, иметь повышенный риск развития опухоли?
— Да, это возможно. Если дети получают повреждённые гены BRCA1 и BRCA2 от родителей, то у них возрастает риск возникновения рака молочной железы, рака яичников и ряда других разновидностей злокачественных новообразований. Однако следует помнить, что ребёнок получает половину генома от матери, а вторую часть от отца, поэтому вероятность передачи генов с дефектами равна 50 % и она не зависит от пола ребёнка (то есть мутировавший ген может получить как девочка, так и мальчик).
— Может ли мутация встречаться лишь в одном из этих генов?
— Да, может. На сегодняшний день изучено более двух тысяч разновидностей мутаций в генах BRCA1 и BRCA2. На практике можно встретить как сочетанные дефекты обоих генов, так и изолированные повреждения одного из них. Среди населения нашей страны превалируют мутации в гене BRCA1 – они составляют около 80 % от общего количества повреждений в обоих генах. Причём здесь гораздо чаще встречаются повторяющиеся мутации, тогда как большинство дефектов гена BRCA2 уникальны.
— Кому и в каких случаях необходимо сдать анализ на мутации BRCA1 и BRCA2? Судя по тому, что вы сказали ранее, это не всегда только женщины?
— Да, верно. Такую диагностику проводят и мужчинам. Связано это с тем, что повреждение генов BRCA1 и BRCA2 указывает на высокую вероятность развития не только рака молочных желез или яичников, но и злокачественных новообразований других органов, в частности, рака поджелудочной железы, желудка, кишечника и других.
К примеру, если у мужчины обнаружена мутация гена BRCA1, это может говорить о высоком риске развития рака простаты. Согласно зарубежным исследованиям любые BRCA-мутации повышают вероятность развития нескольких разновидностей опухолей у мужчин в 8 раз. Поэтому такой вид диагностики для них также актуален.
Необходимость в определении мутации генов BRCA1 и BRCA2 возникает тогда, когда пациент (независимо от того, мужчина это или женщина) принадлежит к группе риска. Вероятность наследственной предрасположенности высока, если:
— Татьяна Ивановна, расскажите, пожалуйста, о процедуре проведения исследования на мутации в генах BRCA1 и BRCA2
— Начну с того, что прежде, чем сдать анализ на выявление повреждений в BRCA1 и BRCA2, проводится консультация с врачом-генетиком. Доктор информирует пациента о содержании проводимого исследования, а также о значении положительного и отрицательного результатов. Это делают с целью психологической подготовки пациента к возможному результату.
В качестве материала для генетического анализа служит кровь. Специальной подготовки перед сдачей анализа не предусмотрено. В нашей стране это исследование проводят методом ПЦР (полимеразной цепной реакции).
Подробнее о методе ПЦР читайте в нашей статье: Диагностика инфекций методом ПЦР: что это такое?
— Предположим, что анализ выявил мутацию. Что человеку делать дальше?
— Следует вновь обратиться к врачу-генетику. Если обнаружены мутации в BRCA1 и/или BRCA2, специалист даст пациенту необходимые рекомендации по дальнейшей профилактике онкологических заболеваний.
Важно помнить, что выявление подобных генетических дефектов – это не диагноз. Наличие повреждений в этих генах указывает только на возможность развития онкологической патологии в молочных железах или других органах. Хочу также заметить, что положительный анализ не позволяет утверждать, что мутация генов непременно обнаружится у всех близких родственников (мамы, дочери, тёти).
С другой стороны, отрицательный результат не означает, что у пациента никогда не разовьётся опухолевый процесс. В таком случае нет лишь повышенного риска развития злокачественного новообразования вышеуказанных органов.
Подчеркну, что независимо от результатов диагностики на наличие повреждений в генах BRCA1 и BRCA2 не отменяются, в частности, регулярные скрининговые меры профилактики рака молочной железы у женщин – это консультация врача-маммолога и проведение маммографии.
Беседовала Севиля Ибраимова
Редакция рекомендует:
Для справки:
Еремеева Татьяна Ивановна