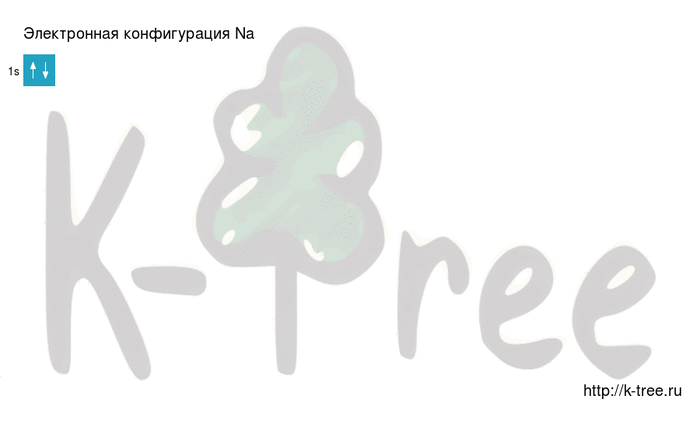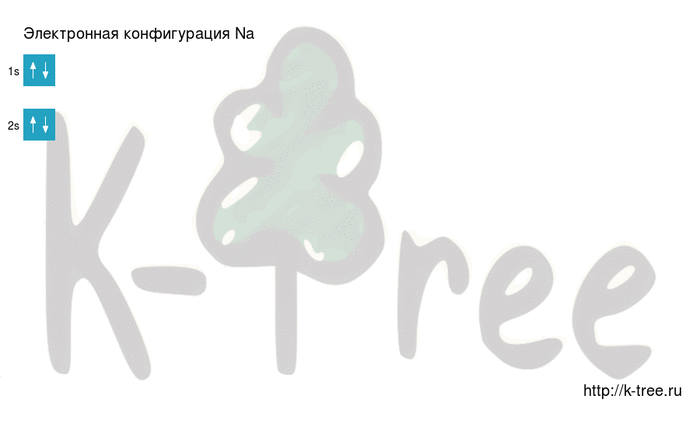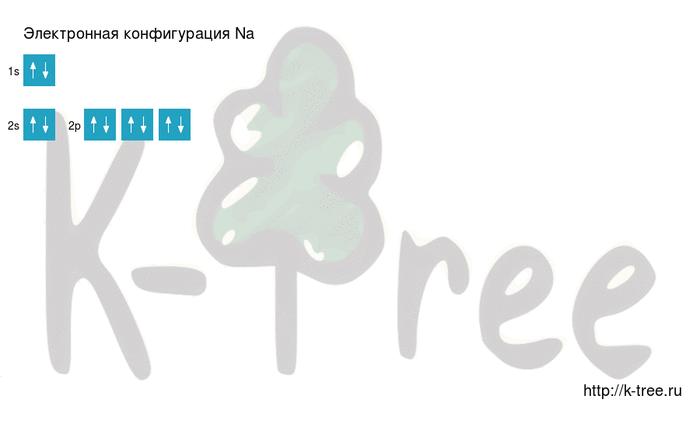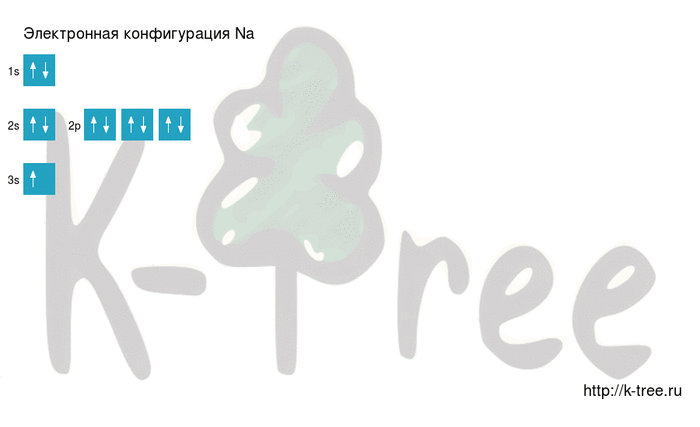Натрий по таблице менделеева все что знаете по этой таблице
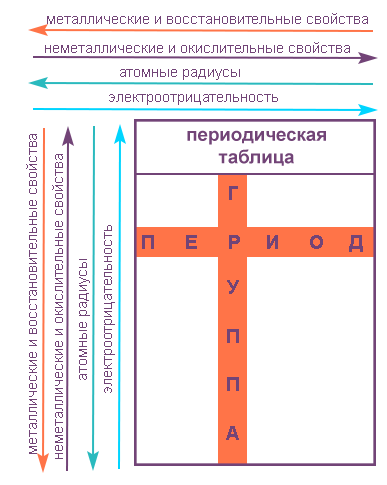
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Натрий Na
Натрий в таблице менделеева занимает 11 место, в 3 периоде.
| Символ | Na |
| Номер | 11 |
| Атомный вес | 22.9897693 |
| Латинское название | Natrium |
| Русское название | Натрий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема натрия
Порядок заполнения оболочек атома натрия (Na) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
Натрий имеет 11 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
1 электрон на 3s-подуровне
Степень окисления натрия
Ионы натрия
Валентность Na
Атомы натрия в соединениях проявляют валентность I.
Валентность натрия характеризует способность атома Na к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Na
Квантовые числа определяются последним электроном в конфигурации, для атома Na эти числа имеют значение N = 3, L = 0, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Соединения натрия
| Тип | Формула | Название |
|---|---|---|
| Соль | NaHCO3 | Пищевая сода |
| Основание | NaOH | Гидроксид натрия |
| Минерал | FeCr2O4 | Хромит |
Энергия ионизации
Перейти к другим элементам таблицы менделеева
Натрий как химический элемент таблицы Менделеева
Как был открыт Натрий
Где и как добывают Натрий
Такой химический элемент как натрий в чистом виде, обычно, не встречается из-за его высокой реакционной способности. В коммерческих целях ежегодно добывается около 100 тысяч тонн натрия. Это цифра так мала потому что этот химический элемент используется исключительно в узконаправленных областях. В конце 19 века его в коммерческих целях получали путем углеродотермического восстановления из карбоната натрия. Для осуществления реакции нужна температура около 1100°C. Сегодня чистый натрий получают путем электролиза расплавленного хлорида натрия. Этот процесс был запатентован в 1924 году.
Эта реакция проводится в так называемой ячейке Даунса, в которой NaCl смешивают с хлоридом кальция, чтобы понизить температуру плавления ниже 700 °С. Поскольку кальций менее электроположителен, чем натрий, кальций не будет осаждаться на катоде. Этот метод дешевле, чем предыдущий процесс Кастнера (электролиз гидроксида натрия ).
Распространенность Натрия
По распространенности во Вселенной атомы натрия занимают 14 место. Этот химический элемент является компонентом многих небесных тел. Если взять спектральное исследование света, то желтая линия натрия присутствует во многих звездах. Так же как и в нашем солнечном свете.
Что же касается Земли, то натрий является седьмым по распространенности элементом. Так же в номинации самый распространенный металл, он занимает почетное пятое место после алюминия, железа, кальция и магния. Если рассматривать процентное соотношение, то атомы натрия составляют около 2,5% от всех атомов планеты. Сама цифра кажется небольшой, но если задуматься, то это колоссальная величина. Большим запасом натрия является морская вода. В одном литре морской воды содержится около 11 ионов натрия.
Так же в природе натрий встречается в виде естественных минералов. Самыми распространенными из которых являются альбит и алигоклаз и галит.
Применение Натрия
Применение натрия не очень широкое и узконаправленное. Его применение основано на физических и химических свойствах. В промышленных масштабах натрий используется как катализатор в реакциях при изготовлении каучука. Так же нужно отметить его в двигателях внутреннего сгорания. В ДВС выпускающие клапаны изготовленны из металла с примесью натрия, для увеличения отвода тепла и избежания повреждений. Так же во многих охлаждающих жидкостях для двигателей внутреннего сгорания имеется натриевая примесь. Еще одно применение это натриевые лампы, которые обеспечивают хорошую рассеиваемость света. Основное применение таких ламп — это уличные фонари характерного желтого цвета. Натрий так же используется в химических реакциях в качестве восстановителя для обработки таких металлов как алюминий, титан, уран или цирконий.
Стоит отметить еще химическую промышленность. Там натрий находит применение в составе противооблединительной жидкости, которыми зимой поливают дороги. Так же натриевые примеси исспользуются при изготовлении удобрений и пищевых добавок, которые встречаются в очень многих продуктах питания. Еще можно отметить отрасли производящие бумагу, стекло и мыло, в которых натрий является важнейшим компонентом.
Интересные факты
Интересных фактов связанных с натрием достаточно много. Стоит начать с обычной соли. Ведь повареная соль представляет собой соединение натрия и хлора. Доказано учеными, что содержание натрия в организме человека значительно влияет на артериальное давление. Чрезмерное употребление соли могут приводить к гипертонии. Нормой потребления соли является не более 5 граммов в сутки. Эти люди, которые придерживаются этой нормы на 15% меньше подвержены риску гипертонии.
Еще одним интересным моментом является опасность натрия. Чистый натрий при взаимодействии с водой образует гидроксид натрия и выделяет опасную концентрацию водорода, которая способна взорваться. Натриевые пожары нельзя тушить водой и пеной из-за возможности взрыва. В таких случаях применяются специальные огнетушители класса D. И стоить отметить, что не все огнетушители этого класса пригодны для тушения натриевых пожаров. О таких пожарах вы могли слышать на нефтяных и газовых месторождениях. Еще одним интересным моментом является то, что натрий очень мягкий металл. Если взять натрий в чистом виде, то его можно разрезать кухонным ножом.
Натрий
Натрий – простое вещество, расположившееся в первой группе третьего периода периодической таблицы химических элементов Д. И. Менделеева. Представляет собой очень мягкий, серебристый щелочной металл, имеющий фиолетовый оттенок, будучи разделённым на тонкие слои. Температура плавления натрия чуть ниже необходимой для закипания воды, а температура кипения – 883 градуса по Цельсию. При комнатной температуре его плотность составляет 0.968 г/см3. Из-за своей низкой плотности при необходимости, натрий возможно разрезать обычным ножом.
Натрий очень распространен на нашей планете: различные его соединения здесь можно найти как в море или земной коре, где он содержится в относительно больших количествах, так и в составе многих живых организмов, но не встречается в живой природе в чистом виде в связи со своей поразительно высокой активностью. Натрий является одним из обязательных микроэлементов, необходимых для нормальной жизнедеятельности человека – поэтому для восполнения его естественной убыли из организма необходимо употреблять около 4-5 грамм его соединения с хлором – т.е. обычной поваренной соли.
Натрий в истории
Изначально, натрий именовался sodium – производным от арабского слова, обозначающего головную боль. Слово «натрий» было позаимствовано из египетского языка и впервые, в современной истории, было использовано шведским обществом врачей как обозначение содосодержащих минеральных солей.
Химические свойства натрия
Натрий является активным щелочным металлом – т.е. он очень быстро окисляется при контакте с воздухом и его приходить хранить в керосине, при этом натрий имеет очень низкую плотность и часто всплывает на его поверхность. Являясь очень сильным восстановителем, натрий и вступает в реакции с большинством неметаллов, а будучи металлом активным, реакции с его применением зачастую проходят очень быстро и бурно. Например, если поместить в воду кусочек натрия, то он начинает активно самовоспламеняться, что в итоге приводит к взрыву. Воспламенение и выделение кислорода происходят при реакции натрия и его производных с множеством других веществ, однако с разбавленными кислотами он взаимодействует как обычный металл. С благородными газами, йодом и углеродом натрий в реакцию не вступает, и так же очень плохо реагирует с азотом, образуя при этом довольно неустойчивое вещество в виде тёмно-серых кристаллов – нитрид натрия.
Применение натрия
Основное применение натрий находит в химической промышленности и металлургии, где, чаще всего, он используется в качестве восстановителя, благодаря своим химическим свойствам. Так же его используют в качестве осушителя для таких органических растворителей как эфир и ему подобных; для производства проводов, способных выдерживать огромные напряжения. В этой же сфере натрий применяют как основной компонент в производстве натриево-серных аккумуляторов, имеющих высокую удельную энергию, т.е. меньший расход топлива. Главный недостаток этого типа аккумуляторов – это высокая рабочая температура, а, следовательно – риск воспламенения и взрыва натрия при аварии.
Ещё одна сфера применения натрия – это фармакология, где множество производных натрия используются в качестве реактивов, полупродуктов и вспомогательных веществ при создании различных сложных лекарств, а так же антисептиков. Раствор хлорида натрия относительно сходен плазме крови человека и быстро выводится из организма, поэтому его используют при необходимости поддержания и нормализации давления крови.
На сегодняшний день некоторые соединения натрия – это обязательный компонент при производстве бетона и других строительных материалов. Благодаря использованию материалов, содержащих производные от натрия компоненты их можно использовать при строительных работах во время низких температур.
Из-за своей распространенности и простоты промышленного производства, натрий имеет довольно малую стоимость. Сегодня его производят так же как и при его первом получении — подвергая различные натриесодержащие породы воздействию сильного электрического тока. Благодаря этому, а так же своей необходимости во многих видах промышленности, объемы его производства только растут.