К2о с чем реагирует
Оксид калия: формула, взаимодействие
Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
Оксид калия: формула
Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
С другими оксидами
Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.
Взаимодействие с кислотами
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
Кислород: химия кислорода
Кислород
Положение в периодической системе химических элементов
Кислород расположен в главной подгруппе VI группы (или в 16 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кислорода
Электронная конфигурация кислорода в основном состоянии :
+8O 1s 2 2s 2 2p 4 1s 

Атом кислорода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 2 неподеленные электронные пары в основном энергетическом состоянии.
Физические свойства и нахождение в природе
Озон О3 — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода.
Кислород — это самый распространённый в земной коре элемент. Кислород входит в состав многих минералов — силикатов, карбонатов и др. Массовая доля элемента кислорода в земной коре — около 47 %. Массовая доля элемента кислорода в морской и пресной воде составляет 85,82 %.
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе.
Способы получения кислорода
В промышленности кислород получают перегонкой жидкого воздуха.
Лабораторные способы получения кислорода:
Разложение перманганата калия:
Разложение бертолетовой соли в присутствии катализатора MnO2 :
2KClO3 → 2KCl + 3O2
Разложение пероксида водорода:
2HgO → 2Hg + O2
Соединения кислорода
| Степень окисления | Типичные соединения |
| +2 | Фторид кислорода OF2 |
| +1 | Пероксофторид кислорода O2F2 |
| -1 | Пероксид водорода H2O2 Пероксид натрия Na2O2 и др. |
| -2 | Вода H2O Оксиды металлов и неметаллов Na2O, SO2 и др. Соли кислородсодержащих кислот Кислородсодержащие органические вещества Основания и амфотерные гидроксиды |
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремнием с образованием оксидов:
1.3. Фосфор горит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
Но чаще фосфор сгорает до оксида фосфора (V):
1.4. С азотом кислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000 о С), образуя оксид азота (II):
N2 + O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca + O2 → 2CaO
Однако при горении натрия в кислороде преимущественно образуется пероксид натрия:
2Na + O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K + O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn + O2→ 2ZnO
2Fe + O2→ 2FeO
4Fe + 3O2→ 2Fe2O3
3Fe + 2O2→ Fe3O4
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
4FeS + 7O2→ 2Fe2O3 + 4SO2
Ca3P2 + 4O2→ 3CaO + P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
2H2S + 3O2→ 2H2O + 2SO2
Аммиак горит с образованием простого вещества, азота:
4NH3 + 3O2→ 2N2 + 6H2O
Аммиак окисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 + 5O2→ 4NO + 6H2O
CS2 + 3O2→ CO2 + 2SO2
2CO + O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Кислород окисляет азотистую кислоту :
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 + 2O2→ CO2 + 2H2O
2CH4 + 3O2→ 2CO + 4H2O
CH4 + O2→ C + 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
Оксид калия, характеристика, свойства и получение, химические реакции
Оксид калия, характеристика, свойства и получение, химические реакции.
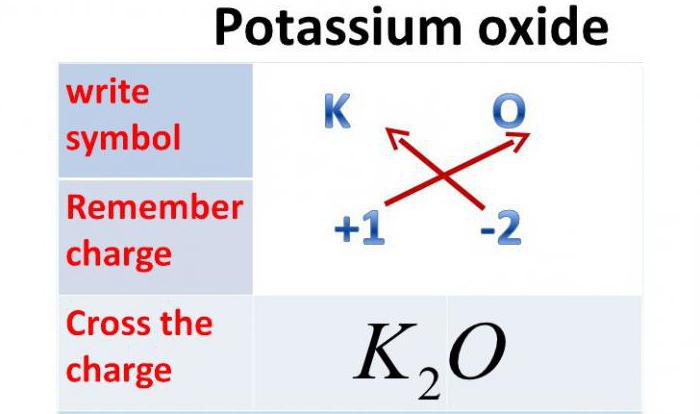
Оксид калия – неорганическое вещество, имеет химическую формулу K2O.
Краткая характеристика оксида калия:
Оксид калия – неорганическое вещество бесцветного либо бледно-желтого цвета.
Так как валентность калия равна одному, то оксид калия содержит один атом кислорода и два атома калия.
Химическая формула оксида калия K2O.
В воде не растворяется, а вступает в реакцию с ней.
Растворим в органических растворителях.
Обладает высокой гигроскопичностью.
Физические свойства оксида калия:
| Наименование параметра: | Значение: |
| Химическая формула | K2O |
| Синонимы и названия иностранном языке | potassium oxide (англ.) |
калия окись (рус.)Тип веществанеорганическоеВнешний видбесцветные (иногда бледно-желтый) кубические кристаллыЦветбесцветный, иногда – бледно-желтыйВкус—*Запах—Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.)твердое веществоПлотность (состояние вещества – твердое вещество, при 20 °C), кг/м 32320Плотность (состояние вещества – твердое вещество, при 20 °C), г/см 32,32Температура кипения, °C—Температура плавления, °C740Температура разложения, °C300Гигроскопичностьвысокая гигроскопичностьМолярная масса, г/моль94,196
Получение оксида калия:
Оксид калия получается в результате следующих химических реакций:
Вначале получают пероксид калия.
Затем пероксид калия обогащают калием.
Напрямую оксид калия путем окисления самого калия не получается.
Химические свойства оксида калия. Химические реакции оксида калия:
Химически активное вещество.
1. реакция оксида калия с галогенами:
Оксид калия бурно реагирует с галогенами, образуя соответственно две соли:
– хлорид калия и гипохлорит калия,
– бромид калия и гипобромит калия,
– йодид калия и гипойодит калия.
2. реакция оксида калия с водой:
3. реакция оксида калия с оксидом углерода (углекислым газом):
Оксид калия на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат калия.
4. реакция оксида калия с оксидом серы:
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит калия, во втором случае – сульфат калия.
5. реакция оксида калия с оксидом кремния:
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат калия.
Аналогично проходят реакции оксида калия и с другими кислотными оксидами.
6. реакция оксида калия с оксидом цинка :
Оксид цинка является амфотерным оксидом. Это значит, что как амфотерный оксид оксид цинка проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – цинкат калия.
Аналогично проходят реакции оксида калия и с другими амфотерными оксидами.
7. реакция оксида калия с плавиковой кислотой:
В результате химической реакции получается соль – фторид калия и вода.
Аналогично проходят реакции оксида калия и с другими кислотами.
8. реакция оксида калия с бромистым водородом (бромоводородом):
9. реакция оксида калия с йодоводородом:
10. реакция оксида калия с жидким аммиаком:
В результате химической реакции получается гидроксид калия и амид калия.
Применение и использование оксида калия:
Примечание: © Фото //www.pexels.com, //pixabay.com
оксид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида калия
реакции с оксидом калия
Мировая экономика
Справочники
Востребованные технологии
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Оксид калия: способы получения и химические свойства
Оксид калия K2O — Бинарное неорганическое вещество . Белый, термически устойчивый.
Относительная молекулярная масса Mr = 94,20; относительная плотность для тв. и ж. состояния d = 2,33; tпл = 740º C при избыточном давлении.
Способ получения
1. Оксид калия можно получить путем взаимодействия калия и гидроксида калия при 450º С, в результате образуется оксид калия и водород :
2K + 2KOH = 2K2O + H2
2. При взаимодействии надпероксида калия и калия при температуре 700º C и избыточном давлении образуется оксид калия:
Химические свойства
1. При разложении оксида калия образуется пероксид калия и калий, температура при этом должна быть 350–430º С:
2. Оксид калия взаимодействует со сложными веществами:
K2O + 2HCl = 2KCl + H2O.
2.3. При взаимодействии калия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 400º C оксид калия образует карбонат калия:
2.3.2. При 150–200º C, в результате взаимодействия оксида калия, и оксидом азота (IV) образуются нитрат калия и нитрит калия:
2.3.3. Оксид калия взаимодействует с оксидом алюминия при 1000º С. При это образуется алюминат калия:
Оксид калия
Оксид калия – соединение калия с кислородом. Химическая формула – K2O. Является компонентом всех калийных и калийсодержащих удобрений.
Традиционно содержание Калия в удобрениях выражают содержанием Оксида калия. Все свойства Калия, как питательного элемента описаны в статье Калий.
Химические и физические свойства
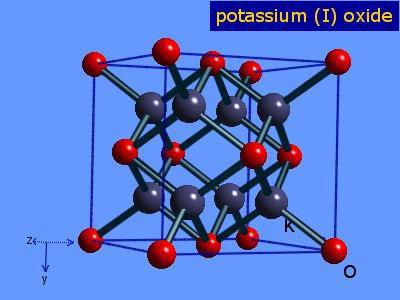
Оксид калия – твердое кристаллическое вещество, образующее бесцветные кристаллы. Имеет две устойчивые кристаллические модификации: кубическую (до 372°С) и гексагональную (выше 372°С).
Оксид калия на воздухе расплавляется и, поглощая CO2, дает K2CO3. Бурно взаимодействует с водой с образованием КОН. Реагирует с эфиром и спиртом.
При температуре 250°С вступает в реакцию с H2. При этом образуются КОН. При этой же температуре взаимодействует с NH3, образуя КОН и KNH2.
Трехмерная модель молекулы
Энергично вступает в реакции взаимодействия с галогенами, расплавленной серой, различными кислотами. При нагревании с оксидами бора, алюминия, кремния образует соответственно бораты, алюминаты и полисиликаты.
При нагревании с NO2 образуется смесь KNO3 и KNO2.
Оксид калия получают:
Содержание оксида калия в почве и удобрениях
Доступность калия для растений зависит от формы доступности калия в почве. Катионы ППК и водорастворимые соединения калия являются основными источниками калийного питания растений. В этой связи степень обеспеченности почвы калием для нужд питания растений выражают содержанием в подвижной форме и через оксид калия K2O. Эта величина обозначает суммарное количество обменного и водорастворимого кальция в мг/кг почвы. [1]
Удобрения содержат различное количество оксида калия. Например, хлористый калий включает в себя 57–60 % калия в пересчете на K2O. Фиксированный почвой калий из удобрений доступен для растений. При этом степень его доступности тем выше, чем больше его фиксировано почвой. [2]
Калийные удобрения отличаются высокой растворимостью в воде. При внесении в почву они быстро растворяются и на основании обменных реакций вступают во взаимодействие с ППК. Часть калия удобрений переходит в необменные фиксированные почвенные соединения. [2]