Кадмий что за металл
КАДМИЙ — токсичный, тяжелый и редкий
При почти детективных условиях был открыт металл кадмий.
Бдительный аптекарь
История началась в Магдебурге с окружного врача-инспектора. Он приказал изъять из продажи препараты с оксидом цинка — якобы, там содержится мышьяк. Аптекари возмутились, обратились к Ф. Штромейеру — главному инспектору по аптекам.
Препараты исследовали, мышьяка не нашли. Зато обнаружили оксид нового элемента. Штромейер назвал открытый элемент «кадмий», в честь героя древнегреческого мифа.
Свойства Кадмия

Кадмий тяжелый металл, наряду с осмием, свинцом, молибденом.
Имеет три модификации; отличить их можно некоторым физическим параметрам.
Где находят
Месторождения кадмиевых руд в природе отсутствуют, это рассеянный металл. Кадмиевые минералы существуют, но промышленного значения не имеют.
Известно 6 кадмиевых минералов:
Металл почти всегда присутствует в медных, цинковых, свинцовых рудах.
Как производят
Производство связано с получением цинка. Кадмий является побочным продуктом извлечения цинка из его минералов. Этот способ получения амальгамный.
Гидроэлектрометаллургический способ состоит из стадий:
Далее при надобности металл рафинируют, доводят до высокой чистоты.
Сплавы
Кадмиевые сплавы делятся на:
В составе припоев 1 часть кадмия заменяет 5 частей олова.
Медно-кадмиевые сплавы почти полностью сохраняют электропроводность меди, и обладают повышенной прочностью к истиранию и высоким сопротивлением на разрыв.
Плюсы и минусы
| Достоинства кадмированных изделий | Недостатки |
| Отлично проявляют себя в среде, содержащей Cl (например, морской воде) | Бесполезно кадмировать изделия, работающие в присутствии серы и ее соединений |
| Обладают высокой пластичностью | Сварка разрушает кадмиевые покрытия |
| Допускается сопряжение с оксидированным алюминием и цинком | Кадмий и его соединения опасны для здоровья |
Применение
Большая часть кадмиевых покрытий применяется для защиты:
Много произведенного кадмия используют в сплавах легкоплавких, антифрикционных, в сплавах с драгоценными металлами.
Пятая часть добытого металла применяется в батареях и аккумуляторах.
Атомная промышленность применяет кадмий для производства регулирующих стержней. Входит в состав экранов защиты от нейтронного излучения.
На подъеме производство солнечных батарей с CdTe.
Часть металла идет на производство красящих пигментов.
В ювелирном производстве используют сплавы с золотом. В зависимости от процентного содержания составляющих они имеют цвета от ярко-желтого до зеленоватого.
Радиоактивные изотопы используют в лечении онкологических болезней.
Стоимость
Цена кадмия марки КдО 1100 рублей за килограмм; марка 5N — 6500 рублей/кг; металл чистотой 99,9999% марки 6N стоит 15000 рубля/кг.
Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
КАДМИЙ
КАДМИЙ (Cadmium) Cd, – химический элемент II группы Периодической системы. Атомный номер 48, относительная атомная масса 112,41. Природный кадмий состоит из восьми стабильных изотопов: 106 Cd (1,22%), 108 Cd (0,88%), 110 Cd (12,39%), 111 Cd (12,75%), 112 Cd (24,07%), 113 Cd (12,26%), 114 Cd (28,85%) и 116 Cd (7,58%). Степень окисления +2, редко +1.
Кадмий был открыт в 1817 немецким химиком Фридрихом Штромейером (Stromeyer Friedrich) (1776–1835).
При проверке оксида цинка, вырабатываемого одной из шенебекских фабрик, появилось подозрение, что он содержит примесь мышьяка. При растворении препарата в кислоте и пропускании через раствор сероводорода выпадал желтый осадок, похожий на сульфиды мышьяка, однако более тщательная проверка показала, что этого элемента нет. Для окончательного заключения образец подозрительного оксида цинка и другие цинковые препараты (в том числе карбонат цинка) с этой же фабрики послали Фридриху Штромейеру, занимавшему с 1802 кафедру химии в Геттингенском университете и должность генерального инспектора ганноверских аптек.
Распространенность кадмия в природе и его промышленное извлечение.
Содержание кадмия в земной коре составляет 1,6·10 –5 %. Он близок по распространенности к сурьме (2·10 –5 %) и в два раза более распространен, чем ртуть (8·10 –6 %). Для кадмия характерна миграция в горячих подземных водах вместе с цинком и другими химическими элементами, склонными к образованию природных сульфидов. Он концентрируется в гидротермальных отложениях. Вулканические породы содержат до 0,2 мг кадмия на кг, среди осадочных пород наиболее богаты кадмием глины – до 0,3 мг/кг, в меньшей степени – известняки и песчаники (около 0,03 мг/кг). Среднее содержание кадмия в почве – 0,06 мг/кг.
У кадмия есть собственные минералы – гринокит CdS, отавит CdCO3, монтепонит CdO. Однако своих месторождений они не образуют. Единственным промышленно значимым источником кадмия являются руды цинка, где он содержится в концентрации 0,01–5%. Кадмий накапливается также в галените (до 0,02%), халькопирите (до 0,12%), пирите (до 0,02%), станните (до 0,2%). Общие мировые ресурсы кадмия оцениваются в 20 млн. т, промышленные – в 600 тыс. т.
Характеристика простого вещества и промышленное получение металлического кадмия.
В сухом воздухе кадмий устойчив. Во влажном воздухе он быстро тускнеет, а при нагревании легко взаимодействует с кислородом, серой, фосфором и галогенами. С водородом, азотом, углеродом, кремнием и бором кадмий не реагирует.
Пары кадмия взаимодействуют с парами воды с выделением водорода. Кислоты растворяют кадмий с образованием солей этого металла. Кадмий восстанавливает нитрат аммония в концентрированных растворах до нитрита аммония. Он окисляется в водном растворе катионами некоторых металлов, например меди(II) и железа(III). С растворами щелочей, в отличие от цинка, кадмий не взаимодействует.
Основные источники кадмия – промежуточные продукты цинкового производства. Осадки металлов, полученные после очистки растворов сульфата цинка действием цинковой пыли, содержат 2–12% кадмия. Во фракциях, образующихся при дистилляционном получении цинка, содержится 0,7–1,1% кадмия, а во фракциях, полученных при ректификационной очистке цинка – до 40% кадмия. Кадмий извлекают и из пыли свинцовых и медеплавильных заводов (она может содержать до 5% и 0,5% кадмия, соответственно). Пыль обычно обрабатывают концентрированной серной кислотой, а затем сульфат кадмия выщелачивают водой.
Из растворов сульфата кадмия действием цинковой пыли осаждают кадмиевую губку, затем ее растворяют в серной кислоте и очищают раствор от примесей действием оксида цинка или карбоната натрия, а также методами ионного обмена. Металлический кадмий выделяют электролизом на алюминиевых катодах либо восстановлением цинком.
Для удаления цинка и свинца металлический кадмий переплавляют под слоем щелочи. Расплав обрабатывают алюминием, чтобы удалить никель, и хлоридом аммония, чтобы избавиться от таллия. Применяя дополнительные методы очистки, можно получить кадмий с содержанием примесей 10 –5 % по массе.
В год производится около 20 тыс. т кадмия. Объем его производства в большой степени связан с масштабами производства цинка.
Важнейшей областью применения кадмия является производство химических источников тока. Кадмиевые электроды используются в батареях и аккумуляторах. Отрицательные пластины никель-кадмиевых аккумуляторов изготовлены из железных сеток с губчатым кадмием в качестве активного агента. Положительные пластины покрыты гидроксидом никеля. Электролитом служит раствор гидроксида калия. На основе кадмия и никеля изготавливают и компактные аккумуляторы для управляемых ракет, только в этом случае в качестве основы устанавливают не железные, а никелевые сетки.
Процессы, протекающие в никель-кадмиевом щелочном аккумуляторе, можно описать суммарным уравнением:
Cd + 2NiO(OH) + 2H2O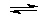
Никель-кадмиевые щелочные аккумуляторы более надежны, чем свинцовые (кислотные). Эти источники тока отличаются высокими электрическими характеристиками, стабильностью работы, длительным сроком эксплуатации. Их можно зарядить всего за один час. Однако никель-кадмиевые аккумуляторы нельзя подзаряжать без полной предварительной разрядки (в этом отношении они уступают металлогидридным аккумуляторам).
Кадмий широко используется для нанесения антикоррозионных покрытий на металлы, особенно в случаях их контакта с морской водой. Кадмируются наиболее важные детали кораблей, самолетов, а также различные изделия, предназначенные для работы в условиях тропического климата. Раньше железо и другие металлы кадмировали погружением изделий в расплавленный кадмий, сейчас кадмиевое покрытие наносят электролитически.
У кадмиевых покрытий есть некоторые преимущества по сравнению с цинковыми: они более устойчивы к коррозии, их легче сделать ровными и гладкими. Высокая пластичность таких покрытий обеспечивает герметичность резьбовых соединений. К тому же кадмий, в отличие от цинка, устойчив в щелочной среде.
Однако у кадмирования есть свои проблемы. При электролитическом нанесении кадмия на стальную деталь в металл может проникнуть содержащийся в электролите водород. Он вызывает у высокопрочных сталей так называемую водородную хрупкость, приводящую к неожиданному разрушению металла под нагрузкой. Для предотвращения этого явления в кадмиевые покрытия вводят добавку титана.
Кроме того, кадмий токсичен. Поэтому, хотя кадмированную жесть применяют довольно широко, для изготовления кухонной утвари и тары для пищевых продуктов использовать ее запрещено.
Примерно десятая часть мирового производства кадмия расходуется на производство сплавов. Кадмиевые сплавы используют главным образом как антифрикционные материалы и припои. Сплав, содержащий 99% кадмия и 1% никеля, применяют для изготовления подшипников, работающих в автомобильных, авиационных и судовых двигателях в условиях высоких температур. Поскольку кадмий недостаточно стоек к действию кислот, в том числе и содержащихся в смазочных материалах органических кислот, иногда подшипниковые сплавы на основе кадмия покрывают индием.
Легирование меди небольшими добавками кадмия позволяет делать более износостойкими провода на линиях электрического транспорта. Медь с добавкой кадмия почти не отличается по электропроводности от чистой меди, но заметно превосходит ее прочностью и твердостью.
Кадмий входит в легкоплавкого сплава Вуда (Wood’s metal), содержащего 50% висмута, 25% свинца, 12,5% олова, 12,5 % кадмия. Сплав Вуда можно расплавить в кипящей воде. Любопытно, что первые буквы компонентов сплава Вуда образуют аббревиатуру ВОСК. Он был изобретен в 1860 не очень известным английским инженером Б.Вудом (B.Wood). Часто это изобретение ошибочно приписывают его однофамильцу – знаменитому американскому физику Роберту Уильямсу Вуду, который родился лишь спустя восемь лет. Легкоплавкие сплавы кадмия используют как материал для получения тонких и сложных отливок, в автоматических противопожарных системах, для спайки стекла с металлом. Припои, содержащие кадмий, довольно устойчивы к температурным колебаниям.
Резкий скачок спроса на кадмий начался в 1940-е и был связан с применением кадмия в атомной промышленности – выяснилось, что он поглощает нейтроны и из него стали делать регулирующие и аварийные стержни атомных реакторов. Способность кадмия поглощать нейтроны строго определенных энергий используется при исследовании энергетических спектров нейтронных пучков.
Соединения кадмия.
Кадмий образует бинарные соединения, соли и многочисленные комплексные, в том числе металлоорганические, соединения. В растворах молекулы многих солей, в частности галогенидов, ассоциированы. Растворы имеют слабокислотную среду вследствие гидролиза. При действии растворов щелочей, начиная с рН 7–8, осаждаются основные соли.
Оксид кадмия CdO получают при взаимодействии простых веществ или прокаливанием гидроксида либо карбоната кадмия. В зависимости от «термической истории» он может быть зеленовато-желтым, коричневым, красным или почти черным. Это частично обусловлено размером частиц, но в большей степени является результатом дефектов кристаллической решетки. Выше 900° С оксид кадмия летуч, а при 1570° С полностью возгоняется. Он обладает полупроводниковыми свойствами.
Оксид кадмия легко растворяется кислотах и плохо – в щелочах, легко восстанавливается водородом (при 900° С), монооксидом углерода (выше 350° С), углеродом (выше 500° С).
Оксид кадмия используют в качестве материала электродов. Он входит в состав смазочных масел и шихты для получения специальных стекол. Оксид кадмия катализирует ряд реакций гидрогенизации и дегидрогенизации.
Гидроксид кадмия Cd(OH)2 выпадает в виде белого осадка из водных растворов солей кадмия(II) при добавлении щелочи. При действии очень концентрированных растворов щелочей он превращается в гидроксокадматы, такие как Na2[Cd(OH)4]. Гидроксид кадмия реагирует с аммиаком с образованием растворимых комплексов:
Кроме того, гидроксид кадмия переходит в раствор под действием цианидов щелочных элементов. Выше 170° С он разлагается до оксида кадмия. Взаимодействие гидроксида кадмия с пероксидом водорода в водном растворе приводит к образованию пероксидов разнообразного состава.
Применяют гидроксид кадмия для получения других соединений кадмия, а также как аналитический реагент. Он входит в состав кадмиевых электродов в источниках тока. Кроме того, гидроксид кадмия используется в декоративных стеклах и эмалях.
Фторид кадмия CdF2 мало растворим в воде (4,06% по массе при 20° С), не растворим в этаноле. Его можно получить действием фтора на металл или фтороводорода на карбонат кадмия.
Фторид кадмия используется в качестве оптического материала. Он входит в состав некоторых стекол и люминофоров, а также твердых электролитов в химических источниках тока.
Хлорид кадмия CdCl2 хорошо растворим в воде (53,2% по массе при 20° С). Его ковалентный характер обусловливает сравнительно низкую температуру плавления (568,5° С), а также растворимость в этаноле (1,5% при 25° С).
Хлорид кадмия получают при взаимодействии кадмия с концентрированной соляной кислотой или хлорированием металла при 500° С.
Хлорид кадмия является компонентом электролитов в кадмиевых гальванических элементах и сорбентов в газовой хроматографии. Он входит в состав некоторых растворов в фотографии, катализаторов в органическом синтезе, флюсов для выращивания полупроводниковых кристаллов. Его используют как протраву при крашении и печатании тканей. Из хлорида кадмия получают кадмиеорганические соединения.
Бромид кадмия CdBr2 образует чешуйчатые кристаллы с перламутровым блеском. Он очень гигроскопичен, хорошо растворим в воде (52,9% по массе при 25° С), метаноле (13,9% по массе при 20° С), этаноле (23,3% по массе при 20° С).
Получают бромид кадмия бромированием металла или действием бромоводорода на карбонат кадмия.
Бромид кадмия служит катализатором в органическом синтезе, является стабилизатором фотоэмульсий и компонентом вирирующих составов в фотографии.
Иодид кадмия CdI2 образует блестящие кристаллы в виде листочков, у них слоистая (двумерная) кристаллическая структура. Известно до 200 политипов иодида кадмия, различающихся последовательностью расположения слоев с гексагональной и кубической плотнейшей упаковкой.
В отличие от других галогенов, иодид кадмия не гигроскопичен. Он хорошо растворяется в воде (46,4% по массе при 25° С). Получают иодид кадмия иодированием металла при нагревании или в присутствии воды, а также действием иодоводорода на карбонат или оксид кадмия.
Иодид кадмия служит катализатором в органическом синтезе. Он является компонентом пиротехнических составов и смазочных материалов.
Сульфид кадмия CdS был, вероятно, первым соединением этого элемента, которым заинтересовалась промышленность. Он образует кристаллы от лимонно-желтого до оранжево-красного цвета. Сульфид кадмия обладает полупроводниковыми свойствами.
В воде это соединение практически не растворяется. К действию растворов щелочей и большинства кислот он также устойчив.
Получают сульфид кадмия взаимодействием паров кадмия и серы, осаждением из растворов под действием сероводорода или сульфида натрия, реакциями между кадмий- и сераорганическими соединениями.
Сульфид кадмия – важный минеральный краситель, раньше его называли кадмиевой желтью.
В малярном деле кадмиевая желть впоследствии стала применяться шире. В частности, ею красили пассажирские вагоны, потому что, помимо прочих достоинств, эта краска хорошо противостояла паровозному дыму. Как красящее вещество сульфид кадмия использовали также в текстильном и мыловаренном производствах. Соответствующие коллоидные дисперсии применяли для получения цветных прозрачных стекол.
В последние годы чистый сульфид кадмия вытесняется более дешевыми пигментами – кадмопоном и цинкокадмиевым литопоном. Кадмопон – смесь сульфида кадмия и сульфата бария. Его получают, смешивая две растворимые соли – сульфат кадмия и сульфид бария. В результате образуется осадок, содержащий две нерастворимые соли:
CdSO4 + BaS = CdS Ї + BaSO4 Ї
Цинкокадмиевый литопон содержит еще и сульфид цинка. При изготовлении этого красителя в осадок выпадают одновременно три соли. Литопон – кремового цвета или цвета слоновой кости.
С добавками селенида кадмия, сульфида цинка, сульфида ртути и других соединений сульфид кадмия дает термически устойчивые пигменты с яркой окраской от бледно-желтой до темно-красной.
Сульфид кадмия придает пламени синюю окраску. Это его свойство используют в пиротехнике.
Кроме того, сульфид кадмия применяется как активная среда в полупроводниковых лазерах. Он случит в качестве материала для изготовления фотоэлементов, солнечных батарей, фотодиодов, светодиодов, люминофоров.
Селенид кадмия CdSe образует темно-красные кристаллы. Он не растворяется в воде, разлагается соляной, азотной и серной кислотами. Получают селенид кадмия сплавлением простых веществ или из газообразных кадмия и селена, а также осаждением из раствора сульфата кадмия под действием селеноводорода, реакцией сульфида кадмия с селенистой кислотой, взаимодействием между кадмий- и селенорганическими соединениями.
Селенид кадмия является люминофором. Он служит в качестве активной среды в полупроводниковых лазерах, является материалом для изготовления фоторезисторов, фотодиодов, солнечных батарей.
Селенид кадмия является пигментом для эмалей, глазурей и художественных красок. Селенидом кадмия окрашивают рубиновое стекло. Именно он, а не оксид хрома, как в самом рубине, сделал рубиново-красными звезды московского Кремля.
Теллурид кадмия CdTe может иметь окраску от темно-серой до темно-коричневой. Он не растворяется в воде, но разлагается концентрированными кислотами. Его получают взаимодействием жидких или газообразных кадмия и теллура.
При нарушении стехиометрии или введении примесей (например, атомов меди и хлора), теллурид кадмия приобретает светочувствительные свойства. Это используется в электрофотографии.
Кадмиеорганические соединения CdR2 и CdRX (R = CH3, C2H5, C6H5 и другие углеводородные радикалы, Х – галогены, OR, SR и др.) обычно получают из соответствующих реактивов Гриньяра. Они термически менее устойчивы, чем их цинковые аналоги, однако в целом менее реакционноспособны (обычно не воспламеняются на воздухе). Их наиболее важной областью применения является получение кетонов из хлорангидридов кислот.
Биологическая роль кадмия.
Кадмий обнаруживается в организмах практически всех животных (у наземных около 0,5 мг на 1 кг массы, а у морских – от 0,15 до 3 мг/кг). Вместе с тем его относят к наиболее токсичным тяжелым металлам.
Кадмий сосредотачивается в организме преимущественно в почках и печени, при этом содержание кадмия в организме к старости повышается. Он накапливается в виде комплексов с белками, которые участвуют в ферментативных процессах. Попадая в организм извне, кадмий оказывает ингибирующее действие на целый ряд ферментов, разрушая их. Его действие основано на связывании группы –SH цистеиновых остатков в белках и ингибировании SH-ферментов. Он может также ингибировать действие цинксодержащих ферментов, замещая цинк. Из-за близости ионных радиусов кальция и кадмия, он может замещать кальций в костной ткани.
Классическим примером хронического отравления кадмием является заболевание, впервые описанное в Японии в 1950-е и получившее название «итай-итай». Болезнь сопровождалась сильными болями в поясничной области, болью в мышцах. Появлялись и характерные признаки необратимого поражения почек. Были зафиксированы сотни смертельных исходов «итай-итай». Заболевание приняло массовый характер в силу высокой загрязненности окружающей среды в Японии в то время и специфики питания японцев – преимущественно рисом и морепродуктами (они способны накапливать кадмий в высоких концентрациях). Исследования показали, что заболевшие «итай-итай» потребляли до 600 мкг кадмия в сутки. В дальнейшем в результате мероприятий по охране окружающей среды, частота и острота синдромов, подобных «итай-итай» заметно снизилась.
В США была обнаружена зависимость между содержанием кадмия в атмосфере и частотой смертельных случаев от сердечно-сосудистых заболеваний.
Считают, что без вреда для здоровья в организм человека в сутки может поступать около 1 мкг кадмия на 1 кг собственного веса. В питьевой воде кадмия не должно содержаться более 0,01 мг/л. Противоядием при отравлении кадмием является селен, однако употребление продуктов, богатых этим элементом, приводит к понижению содержания серы в организме, и в этом случае кадмий снова становится опасным.
Кадмий
(молярная масса)
(первый электрон)
Кадмий — элемент двенадцатой группы (в устаревшей классификации — побочной подгруппы второй группы), пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 48. Обозначается символом Cd (лат. Cadmium ). Простое вещество кадмий при нормальных условиях — мягкий ковкий тягучий переходный металл серебристо-белого цвета. Устойчив в сухом воздухе, во влажном на его поверхности образуется плёнка оксида, препятствующая дальнейшему окислению металла. Кадмий и его соединения ядовиты.
Содержание
История открытия
Открыт немецким профессором Ф. Штромейером в 1817 году. Провизоры Магдебурга при изучении оксида цинка ZnO заподозрили в нём примесь мышьяка. Штромейер выделил из ZnO коричнево-бурый оксид, восстановил его водородом и получил серебристо-белый металл, который получил название кадмий.
Происхождение названия
Штромейер назвал кадмий по греческому названию руды, из которой в Германии добывали цинк, — καδμεία. В свою очередь, руда получила своё название в честь Кадма, героя древнегреческой мифологии.
Нахождение в природе
Среднее содержание кадмия в земной коре — 130 мг/т, в морской воде — 0,11 мкг/л. Кадмий относится к редким, рассеянным элементам: он содержится в виде изоморфной примеси во многих минералах и всегда в минералах цинка. Известно всего лишь 6 кадмиевых минералов. Весьма редкими минералами кадмия являются гринокит CdS (77,8 % Cd), хоулиит (то же), отавит CdCO3, монтепонит CdO (87,5 % Cd), кадмоселит CdSe (47 % Cd), ксантохроит CdS(H2O)х (77,2 % Cd). Основная масса кадмия рассеяна в большом числе минералов (более 50), преимущественно в сульфидах цинка, свинца, меди, железа, марганца и ртути. Максимальная концентрация отмечена в минералах цинка и, прежде всего, в сфалерите (до 5 %). В большинстве же случаев содержание кадмия в сфалерите не превышает 0,4—0,6 %. В других сульфидах, например, в станине содержание кадмия — 0,003—0,2 %, в галените — 0,005—0,02 %, в халькопирите — 0,006—0,12 %; из этих сульфидов кадмий обычно не извлекается.
Кадмий не образует самостоятельных месторождений, а входит в состав руд месторождений других металлов. Относительно высоко содержание кадмия в рудах среднетемпературных свинцово-цинковых и частично медно-колчеданных месторождений.
Почва содержит 0,06 мг/кг, глина — 0,3 мг/кг.
Нахождение в продуктах
ПДК кадмия в воде согласно СанПиН 2.1.4.1074-01 «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. Гигиенические требования к обеспечению безопасности систем горячего водоснабжения» — 1 мкг/л
Ископаемый уголь, древесный уголь, ПЭТ тара, древесные гранулы пеллеты (до 0,5 мг/кг), рыба (0,2 мг/кг), какао-порошок (0,5 мг/кг), почки животных (1 мг/кг), рис (0,06 мг/кг), сигарета (0,002 мг/кг), пшеничный хлеб (0,03 мг/кг), маргарин (0,042 мг/кг), говядина/свинина (0,016 мг/кг), креветки (1,2 мг/кг)
Получение
Единственный минерал, который представляет интерес в получении кадмия — гринокит, так называемая «кадмиевая обманка». Его добывают вместе со сфалеритом при разработке цинковых руд. В ходе переработки кадмий концентрируется в побочных продуктах процесса, откуда его потом извлекают. В настоящее время производится около 20000 тонн кадмия в год.
Физические свойства
Кадмий — серебристо-белый мягкий металл с гексагональной решёткой. Температура плавления — 321 °C, температура кипения — 770 °C. Если кадмиевую палочку изгибать, то можно услышать слабый треск — это трутся друг о друга микрокристаллы металла (так же трещит и пруток олова); любые примеси в металле уничтожают этот эффект. Кадмий твёрже олова, но мягче цинка — его можно резать ножом. При нагревании выше 80 °C кадмий теряет упругость до такой степени, что его можно истолочь в порошок.
Химические свойства
Сплавы
Кадмий используется как компонент твёрдых припоев (сплавов на основе серебра, меди, цинка) для снижения их температуры плавления. Около 10 % производимого кадмия — компонент ювелирных и легкоплавких сплавов. Сплав кадмия с золотом имеет зеленоватый цвет.
Защитные покрытия
40 % производимого кадмия используется для нанесения антикоррозионных покрытий на металлы. Кадмирование стальных деталей даёт большую устойчивость против коррозии, особенно в морской воде.
Кадмирование — это электролитическая процедура нанесения кадмиевых покрытий на поверхность металлоизделий. Кадмием покрывают высокоуглеродистые, инструментальные и нержавеющие стали, а кадмирование хлористо-аммонийное наносят на высокопрочные стали.
Химические источники тока
Около 20 % кадмия идёт на изготовление кадмиевых электродов, применяемых в аккумуляторах (никель-кадмиевых и серебряно-кадмиевых), нормальных элементах Вестона, в резервных батареях (свинцово-кадмиевый элемент, ртутно-кадмиевый элемент) и др.
Пигменты
Около 20 % кадмия используется для производства неорганических красящих веществ (сульфиды и селениды, смешанные соли, например, сульфид кадмия — кадмий лимонный).
Другие сферы применения
Ограничение применения
В 2016 году принят Технический регламент Евразийского экономического союза «Об ограничении применения опасных веществ в изделиях электротехники и радиоэлектроники» (ТР ЕАЭС 037/2016), по которому содержание кадмия в изделиях электротехники и радиоэлектроники не должно превышать 0,01 % по весу однородного материала (Приложение N 2). В Европе действует аналогичная норма (Директива 2002/95/EC).
Физиологическое действие
Кадмий и все его соединения ядовиты. Особенно опасным случаем является вдыхание паров его оксида (CdO). Вдыхание в течение 1 минуты воздуха с содержанием 2,5 г/м 3 оксида кадмия, или 30 секунд при концентрации 5 г/м 3 является смертельным. Кадмий является канцерогеном.
Пары кадмия, все его соединения токсичны, что связано, в частности, с его способностью связывать серосодержащие ферменты и аминокислоты.
Симптомы острого отравления кадмием — рвота и судороги.
В питьевой воде ПДК для кадмия 0,001 мг/дм³ (СанПиН 2.1.4.1074-01).
Механизм токсического действия
Механизм токсического действия кадмия заключается, по-видимому, в связывании карбоксильных, аминных и особенно сульфгидрильных групп белковых молекул, в результате чего угнетается активность ферментных систем. Растворимые соединения кадмия после всасывания в кровь поражают центральную нервную систему, печень и почки, нарушают фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
Кадмий в норме в небольших количествах присутствуют в организме здорового человека. Кадмий легко накапливается в быстроразмножающихся клетках (например, в опухолевых или половых). Он связывается с цитоплазматическим и ядерным материалом клеток и повреждает их. Он изменяет активность многих гормонов и ферментов. Это обусловлено его способностью связывать сульфгидрильные (-SH) группы.
Изотопы
Из восьми природных изотопов кадмия шесть стабильны, для двух изотопов обнаружена слабая радиоактивность. Это 113 Cd (изотопная распространённость 12,22 %, бета-распад с периодом полураспада 7,7⋅10 15 лет) и 116 Cd (изотопная распространённость 7,49 %, двойной бета-распад с периодом полураспада 3,0⋅10 19 лет).
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au











