Как и чем формируется уровень возбудимости нейронов
Как и чем формируется уровень возбудимости нейронов
При образовании потенциалов действия (спайное) в химических синапсах между нейронами происходит высвобождение медиаторов из пузырьков пресинаптической мембраны. Медиатор проходит через синаптическую щель и активирует рецепторы, встроенные в постсинаптическую мембрану нейрона-мишени. Рецепторы, в свою очередь, активируют медиаторозависимые ионные каналы, изменяющие поляризацию нейрона-мишени. При смещении показателей мембранного потенциала от уровня потенциала покоя (-70 мВ) в отрицательную сторону (например, — 80 мВ и более) происходит гиперполяризация мембраны, а при смещении в положительную сторону — деполяризация.
а) Электротонические потенциалы. Первоначальный ответ нейрона-мишени на воздействие возбуждающих импульсов заключается в формировании локальных ступенчатых электротонических потенциалов. Положительные злектротонические потенциалы обычно возникают в мультииолярных нейронах в результате деполяризации, обусловленной активацией медиаторозависимых ионных каналов. При низкочастотном стимулирующем воздействии по дендритам распространяются небольшие волны деполяризации, угасающие в течение 2-3 мс.
В триггерной зоне чувствительных нейронов черешнях и спинномозговых нервов формируется так называемый рецепторный потенциал. В этой области расположено большое количество ионных каналов, активирующихся под воздействием специфических чувствительных стимулов и вызывающих ступенчатое распространение волны деполяризации.
Определение триггерной области миелинизированных нервных волокон не вызывает затруднений: у мультиполярных нейронов эта область граничит с первым миелиновым сегментом с его проксимальной стороны, а у периферических чувствительных нейронов — с последним миелиновым сегментом с его дистальной стороны.
Тормозные (гиперполяризующие) постсинаптические потенциалы возникают при открытии ионных каналов, генерирующих выходящий ток (например, калиевых каналов). Распространение тормозных потенциалов также является угасающим.
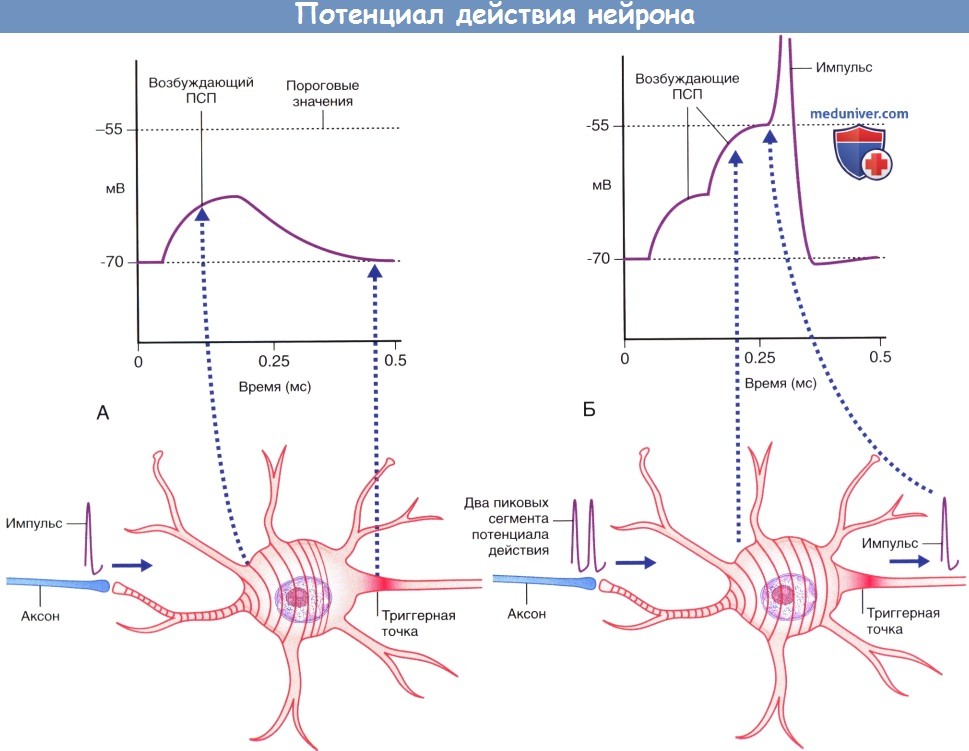
(А) Аксон чувствительного нейрона (выделен голубым цветом) передает единичный импульс двигательному нейрону,
вызывающий возбуждающему постсинаптический потенциал (ПСП), значения которого не достигают пороговых величин, вследствие чего этот потенциал затухает.
(Б) Аксон чувствительного нейрона передает два импульса.
Происходит временная суммация импульсов с достижением в начальном сегменте аксона пороговых значений возбуждения,
что приводит к формированию потенциала действия, который в дальнейшем распространяется по аксону двигательного нейрона. 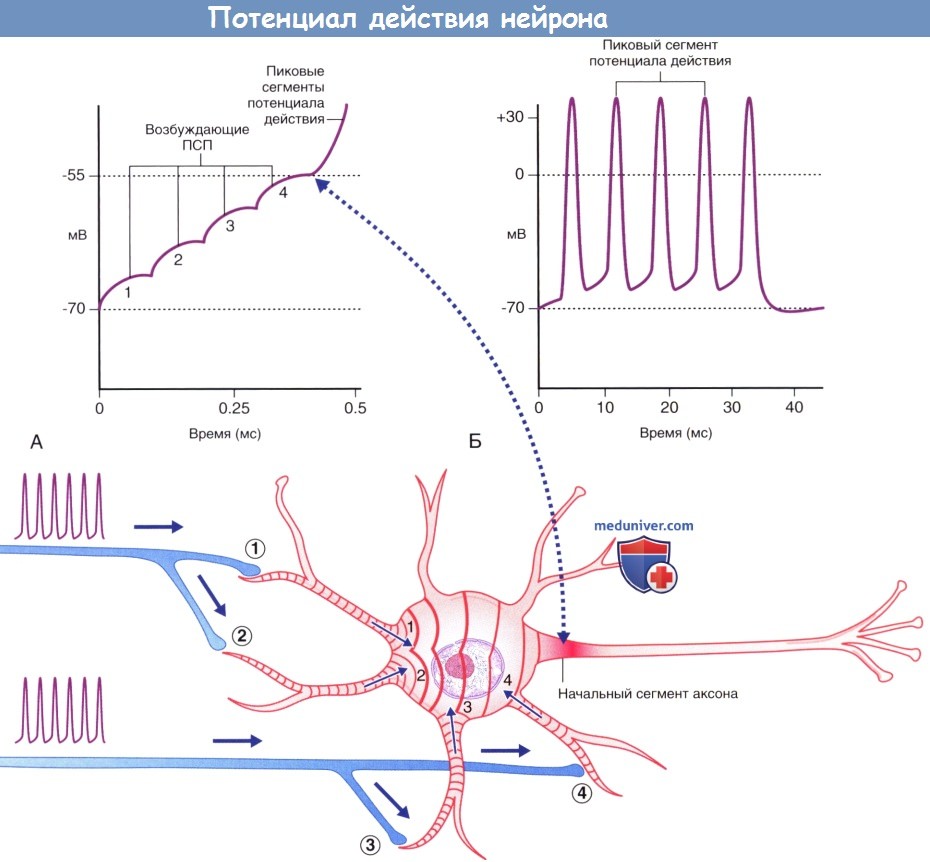
(Б) Генераторные потенциалы достаточной силы формируют множественные пиковые потенциалы. 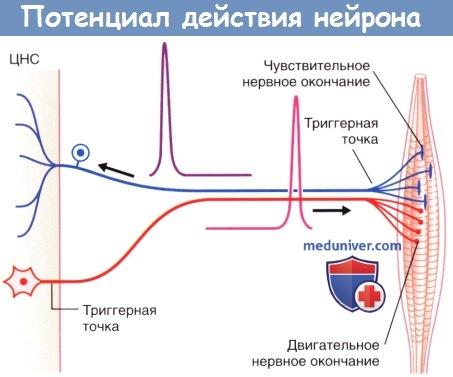
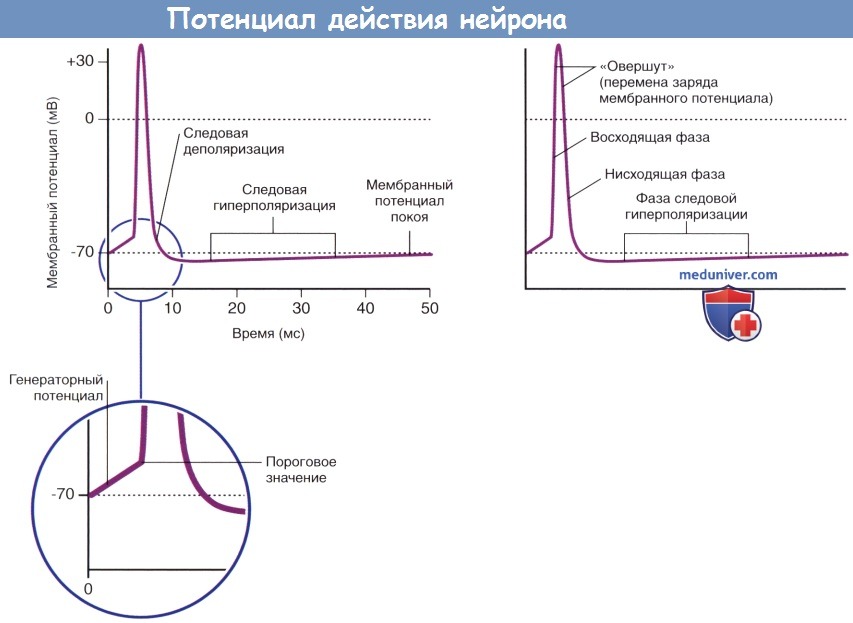
Возникновение фазы следовой гиперполяризации объясняют тем, что после полной инактивации потенциалозависимых натриевых каналов многие калиевые каналы остаются открытыми. Восстановление ионных градиентов обеспечивает натрий-калиевый насос.
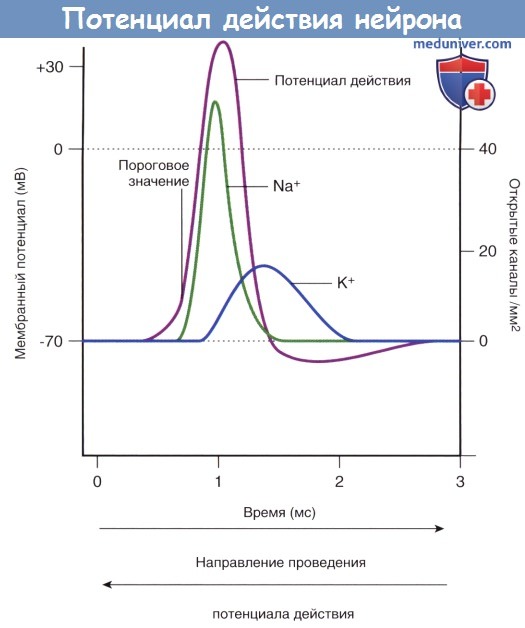
В ходе подробного изучения натриевых каналов было обнаружено, что их регуляция осуществляется двумя путями. В состоянии покоя (-70 мВ) активационные ворота, расположенные в средней части натриевых и калиевых каналов, закрыты. Первыми на пороговое раздражение реагируют натриевые каналы: происходят открытие активационных ворот и быстрый выход ионов Na + в клетку по концентрационному и электрическому градиентам. При достижении потенциалом действия пиковых значений (+35 мВ) происходит открытие калиевых каналов, а натриевые каналы закрываются инактивационными воротами, представленными глобулярным белком. При реполяризации и восстановлении мембранного потенциала (-70 мВ) активационные натриевые ворота закрываются, а затем вновь открываются инактивационные натриевые ворота, тем самым приводя натриевые каналы в исходное состояние.
Работа потенциалозависимых калиевых каналов регулирует одноворотный механизм: этими каналами управляют только активационные ворота.
Потенциал действия, возникающий в ответ на деполяризацию, подчиняется принципу «все или ничего», согласно которому при достижении пороговых показателей возбуждения происходит открытие потенциалозависимых натриевых каналов. С этой точки зрения потенциал действия отличается от медиаторозависимых потенциалов, суммирующихся для развития потенциалов действия. Кроме того, отличие потенциала действия от других ступенчатых потенциалов заключается в отсутствии затухания; потенциал действия распространяется в полном объеме от сомы вдоль нервного волокна к нервному окончанию (это расстояние для нейронов нижних конечностей может составлять более метра).
Во время фазы нарастания и в начале фазы реполяризации потенциала действия нейрон находится в абсолютно рефрактерном состоянии и не может воспринимать следующие импульсы в результате инактивации потенциалозависимых натриевых каналов. Вслед за этим периодом наступает интервал относительной рефрактерности, во время которого стимул, превышающий исходный более чем на 15 мВ, способен вызвать формирование повторного потенциала действия. Часто для достижения показателя 35 мВ генераторный потенциал производит от 50 до 100 импульсов в секунду (частота составляет от 50 до 100 Гц).
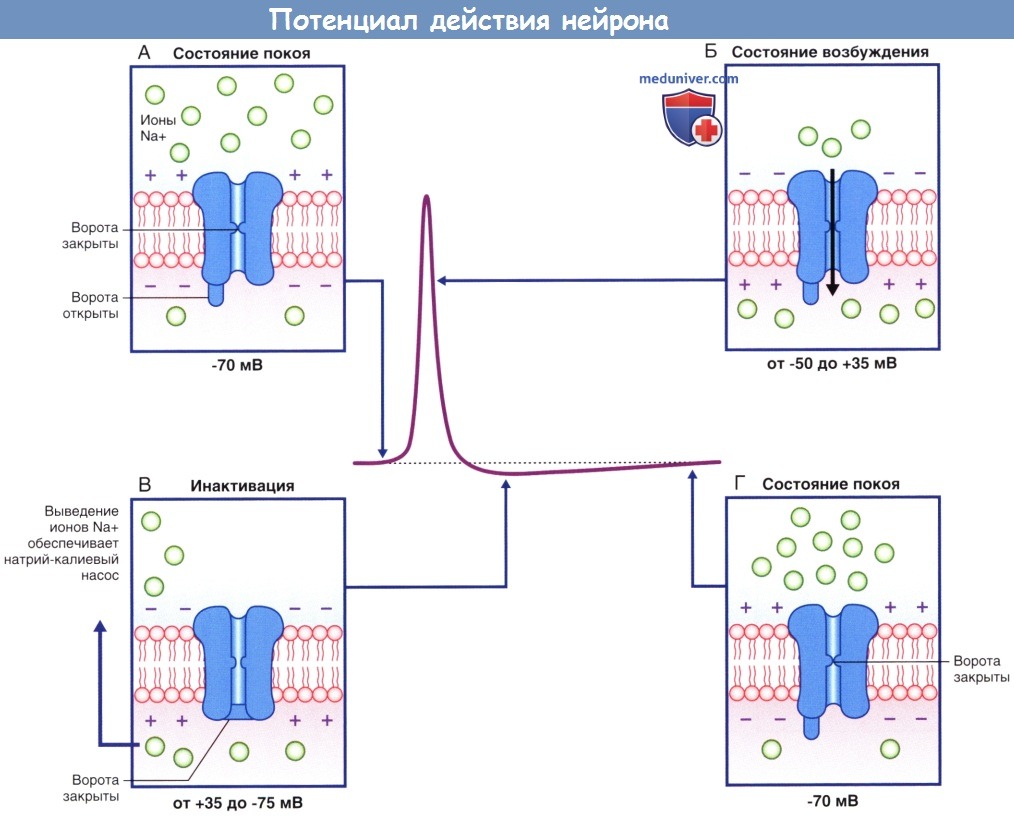
(А) В состоянии покоя, предшествующем возбуждению, активационные ворота находятся в закрытом состоянии, а инактивационные — в открытом.
(Б) При преодолении порога возбуждения происходит открытие активационных ворот, что приводит к полному открытию ионного канала.
(В) Инактивационные ворота закрываются, что приводит к закрытию ионного канала.
(Г) При восстановлении потенциала покоя активационные ворота закрываются, а инактивационные — открываются.
Ионный канал возвращается в исходное состояние. 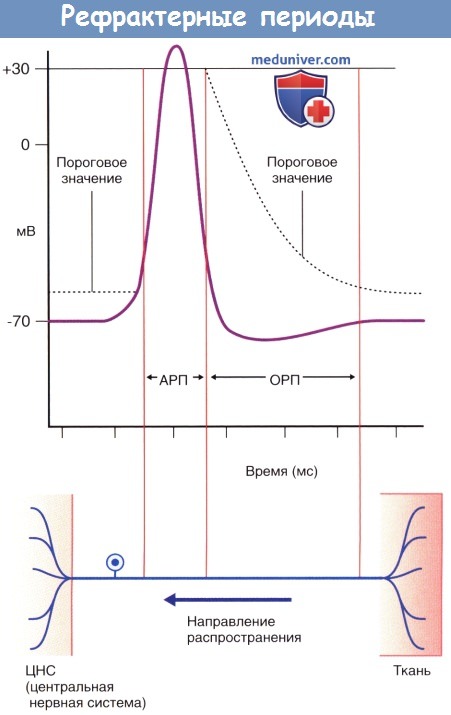
АРП — абсолютный рефрактерный период;
ОРП — относительный рефрактерный период.
в) Передача нервных импульсов. Изменение потенциала триггерной зоны распространяется вдоль аксона в соответствии с электротонической траекторией. Положительные заряды внутренней стороны мембраны распространяются в обоих направлениях через аксоплазму. Положительные заряды внешней стороны мембраны аналогичным образом проходят через внеклеточную жидкость и нейтрализуют отрицательный заряд на внешней стороне мембраны. Прилежащий проксимальный участок мембраны достаточно рефрактерен и способен противостоять деполяризации. Одновременно с этим в прилежащем дистальном сегменте возникает локальный ответ (деполяризация), который достигает пороговых величин и распространяется далее вдоль ствола и ветвей аксона к нервным окончаниям, обеспечивая проведение потенциала действия.
Проведение импульса по немиелинизированному нервному волокну происходит непрерывно, а по миелинизированному — сальтаторно (скачкообразно). Миелиновая оболочка выполняет функцию изолятора и располагается между перехватами Ранвье, где сконцентрированы натриевые каналы. В связи с этим в каждом перехвате Ранвье последовательно возникают потенциалы действия за счет распространения положительного тока вдоль аксоплазмы миелинизированного участка аксона и его выхода в области следующего перехвата Ранвье. При распространении тока в обратном направлении по внеклеточной жидкости для повторного заряда деполяризованного участка мембраны снятие положительного заряда приводит к деполяризации следующего перехвата Ранвье.
г) Скорость проведения нервных импульсов. Скорость проведения нервного импульса по немиелинизированным нервным волокнам прямо пропорциональна диаметру аксона. В первую очередь это связано с тем, что больший объем аксоплазмы обеспечивает более высокую скорость продольного распространения возбуждения. Кроме того, чем больше диаметр аксона, тем больше площадь поверхности его плазматической мембраны, следовательно, на ней расположено большее количество ионных каналов, а деполяризация и восстановление заряда мембраны происходят быстрее. Диаметр аксонов варьирует от 0,2 до 2 мкм, а скорость проведения импульсов — от 2 до 25 м/с.
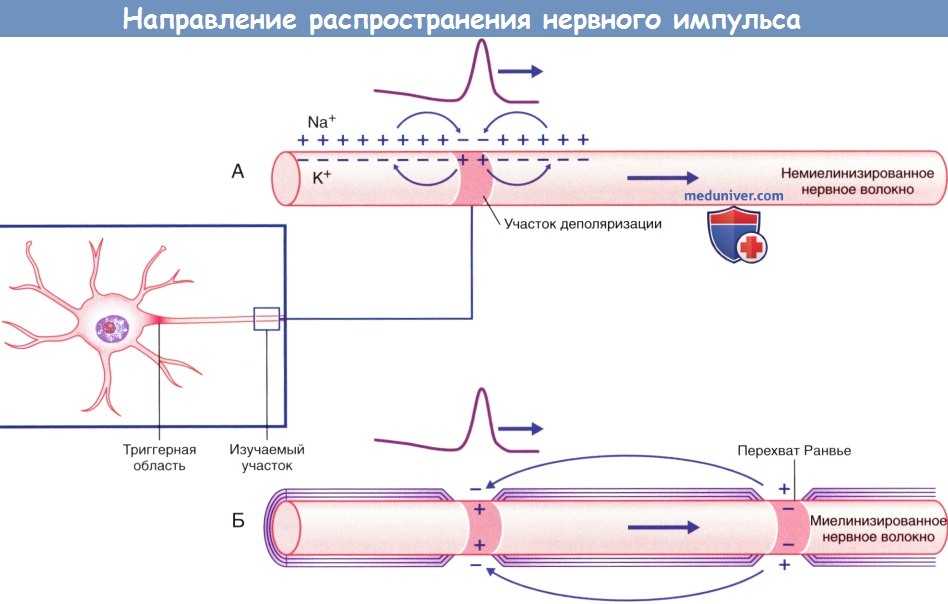
(А) Непрерывное проведение импульса по немиелинизированному нервному волокну.
(Б) Скачкообразное проведение импульса по миелинизированному нервному волокну.
д) Механизм действия местных анестетиков. При применении местных анестетиков происходит обратимая блокировка проведения нервных импульсов за счет инактивации натриевых каналов, особенно потенциалозависимых, вследствие чего деполяризация мембраны становится невозможной. Молекулы местных анестетиков связывают белок, окружающий ионные каналы. В течение времени действия анестетика происходит связывание белка, окружающего ионные каналы. Для доступа к этим белкам местные анестетики должны быть хорошо растворимы в жирах. При введении анестетика вблизи периферического нерва в первую очередь происходит инактивация немиелинизированных и тонко миелинизированных Аб-волокон. При воздействии на смешанный нерв может возникнуть временный двигательный паралич.
Большинство местных анестетиков — производные амидов (бупивакаин, лидокаин) или сложных эфиров (бензокаин, новокаин). И те, и другие вызывают местное расширение сосудов за счет прямого расслабления гладкой мускулатуры артериол, что приводит к ускорению их выведения. В связи с этим в растворы для местной анестезии часто добавляют адреналин, вызывающий сокращение гладкой мускулатуры и сужение сосудов.
Первоначальная реакция мультиполярного нейрона на возбуждающий стимул заключается в формировании угасающих волн положительного электротонуса. В результате их временной и/или пространственной суммации происходит образование генераторного потенциала в начальном сегменте аксона. При достижении пороговых значений (-55 мВ) потенциалозависимые ионные каналы генерируют потенциал действия, распространяющийся по нервному волокну. Тормозные стимулы вызывают формирование волн отрицательного электротонуса, суммация которых приводит к гиперполяризации мембраны, тем самым отдаляя величины ее потенциала от пороговых значений.
При достижении потенциала действия максимальных значений происходит открытие потенциалозависимых калиевых каналов, и поток ионов Na + в клетку сменяется потоком ионов К + из клетки, что приводит к реполяризации и следовой гиперполяризации мембранного потенциала.
В течение 1 мс после воздействия первоначального импульса триггерная зона начального сегмента аксона характеризуется абсолютной рефрактерностью к восприятию следующих импульсов, а в течение 3 мс—относительной рефрактерностью. Возникновение потенциалов действия подчиняется принципу «все или ничего» и распространяется по всей длине нервного волокна и его ветвям. Проведение нервных импульсов по немиелинизированным аксонам осуществляется непрерывно, а по миелинизированным—сальтаторно (скачкообразно от одного перехвата Ранвье к другому). Сальтаторное проведение характеризуется большей скоростью. Миелинизированные участки длиннее у волокон с большим диаметром, и скорость проведения импульсов по этим волокнам выше.
Редактор: Искандер Милевски. Дата публикации: 11.11.2018
Мозг, общение нейронов и энергетическая эффективность
По всей видимости, в эволюции сформировались энергетически эффективные механизмы кодирования и передачи информации в мозге. Подпись: «Усердно пытаюсь минимизировать энергозатраты».
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (
40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (
4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
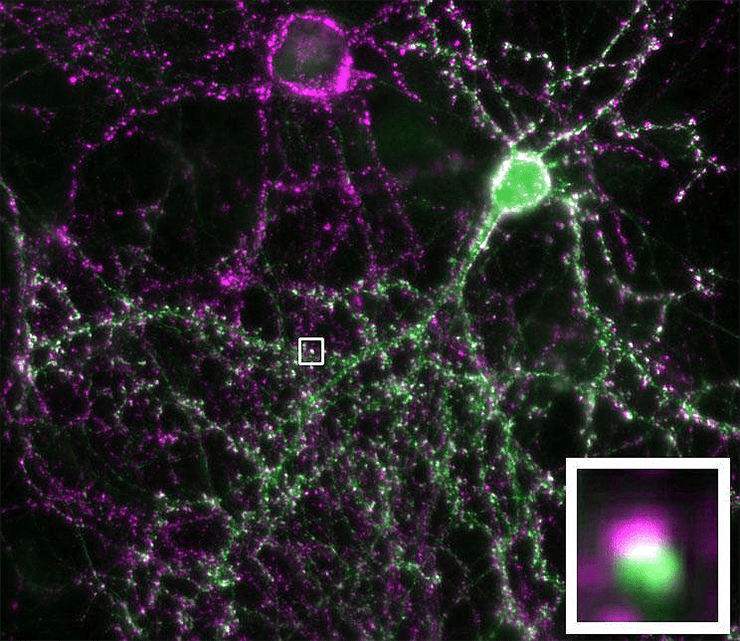
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Что такое интернейроны?
Нейроны центральной нервной системы разделяются на активирующие (образуют активирующие синапсы) и тормозящие (образуют тормозящие синапсы). Последние в значительной степени представлены интернейронами, или промежуточными нейронами. В коре больших полушарий и гиппокампе они ответственны за формирование гамма-ритмов мозга [15], которые обеспечивают слаженную, синхронную работу других нейронов. Это крайне важно для моторных функций, восприятия сенсорной информации, формирования памяти [9], [11].
Интернейроны отличаются способностью генерировать значительно более высокочастотные сигналы, чем другие нейроны. Они также содержат больше митохондрий, главных органелл энергетического метаболизма, «фабрик» по производству АТФ. Последние к тому же содержат большое количество белков цитохром-с оксидазы и цитохрома-с, являющихся ключевыми для метаболизма. Так, интернейроны являются крайне важными и, в то же время, энергозатратными клетками [8], [9], [11], [16].
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Поиск оптимума
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
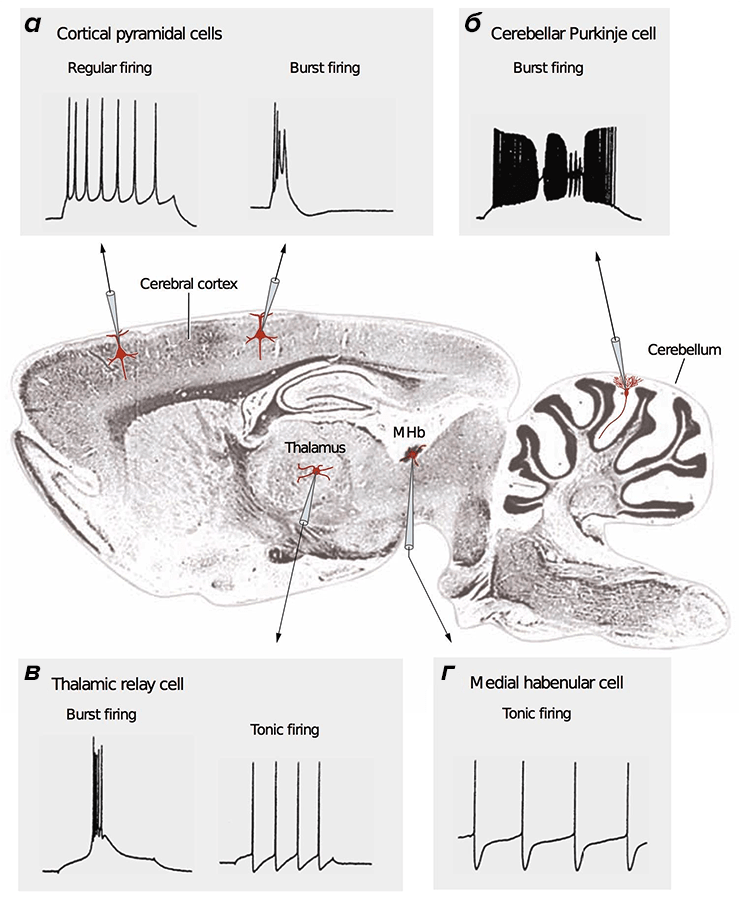
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
Что такое потенциал действия?
ПД — это относительно сильное по амплитуде скачкообразное изменение мембранного потенциала.
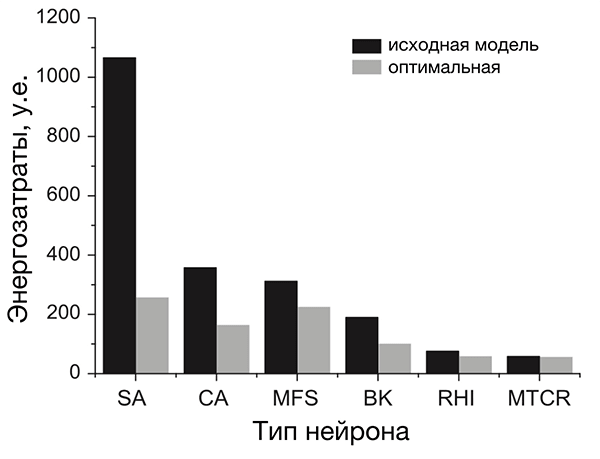
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
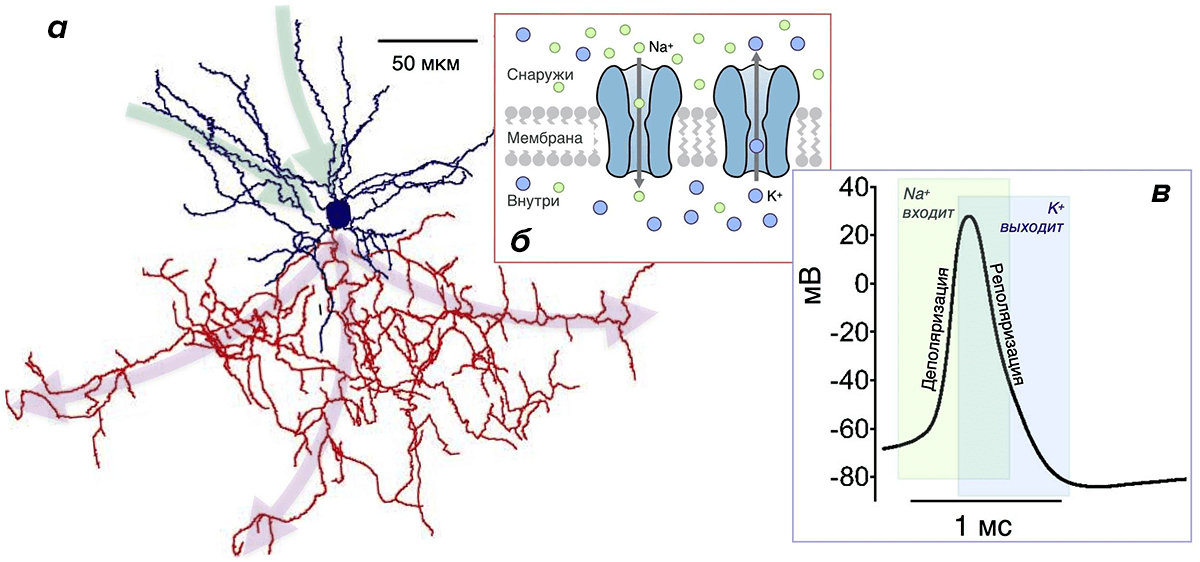
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает. «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.