Как определить что это химический элемент
Химические элементы
Химический элемент
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов равно числу электронов.
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия, кислорода, меди. Решение вы найдете ниже.
Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 1. Атомы и химические элементы
В уроке 1 «Атомы и химические элементы» из курса «Химия для чайников» рассмотрим, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выясним, что из себя представляет химический элемент и каким образом обозначается.
Все, что нас окружает, мы сами, Земля, на которой мы живем, состоит из самых разнообразных веществ. А из чего состоят сами вещества? Ведь их можно дробить на более мелкие части, а те, в свою очередь, на еще более мелкие. Где предел такого деления? Что представляют собой частицы, которые дальше уже нельзя раздробить обычными способами? Над этими вопросами задумывались ученые еще в глубокой древности.
Атомное строение веществ
Первые представления об атомах как мельчайших, далее неделимых частицах веществ появились у философов Древней Греции еще за 400 лет до н. э. Они считали, что каждое вещество составлено из присущих только ему атомов, т. е. существуют атомы, например, мяса, песка, дерева, воды и т. д. Другими словами, сколько есть веществ, столько и видов атомов.
Доказательств существования атомов в то время, конечно, не было, и это учение было забыто почти на две тысячи лет. И только в самом начале XIX в. идея атомного строения веществ была возрождена английским ученым Дж. Дальтоном.
Согласно его теории все вещества состоят из очень маленьких частиц — атомов. В процессе химических превращений атомы не разрушаются и не возникают вновь, а только переходят из одних веществ в другие. Они являются как бы деталями конструктора, из которых можно собирать всевозможные изделия.
Атомы — мельчайшие, химически неделимые частицы.
Химические элементы
Общее число атомов во Вселенной невообразимо велико. Однако видов атомов сравнительно немного. Каждый такой определенный вид атомов называется химическим элементом.
Химический элемент — определенный вид атомов.
Позже, после изучения строения атома, вы узнаете более точное определение этого понятия.
Всего в настоящее время известно 118 химических элементов. Атомы одного и того же элемента имеют одинаковые размеры, практически одинаковое строение и массу. Атомы разных элементов различаются между собой, прежде всего, строением, размерами, массой и целым рядом других характеристик.
На заметку: Из 118 химических элементов в природе встречается только 92, а остальные 26 получены искусственно с помощью специальных физических методов.
Из атомов такого небольшого числа химических элементов построены все вещества, существующие в природе и полученные химиками в лабораториях. А это более 60 млн веществ. Все они представляют собой самые различные сочетания атомов тех или иных элементов. Так же, как из 33 букв алфавита составлены все слова русского языка, из атомов относительно небольшого числа элементов состоят все известные вещества.
Символы химических элементов
Каждый элемент имеет свое название и условное обозначение — химический символ (знак).
Химический символ (знак) — условное обозначение химического элемента с помощью букв его латинского названия.
Символы химических элементов состоят из одной или двух букв их латинских названий. Понятно, что вторая буква нужна, чтобы различать элементы, в названиях которых первая буква одинакова. Например, элемент углерод обозначается первой буквой С его латинского названия — Carboneum (карбонеум), а элемент медь — двумя первыми буквами Cu его латинского названия — Cuprum (купрум).
Современные символы и названия наиболее распространенных элементов, необходимые вам на начальном этапе изучения химии, приведены в таблице под спойлером.
| Название химического элемента | Химический знак элемента | Относительная атомная масса (округленная) |
| Азот | N | 14 |
| Алюминий | Al | 27 |
| Водород | H | 1 |
| Железо | Fe | 56 |
| Золото | Au | 197 |
| Калий | K | 39 |
| Кальций | Ca | 40 |
| Кислород | O | 16 |
| Кремний | Si | 28 |
| Магний | Mg | 24 |
| Медь | Cu | 64 |
| Натрий | Na | 23 |
| Ртуть | Hg | 201 |
| Свинец | Pb | 207 |
| Сера | S | 32 |
| Серебро | Ag | 108 |
| Углерод | C | 12 |
| Фосфор | P | 31 |
| Хлор | Cl | 35,5 |
| Цинк | Zn | 65 |
Если вы хотите познакомиться с названиями и символами всех химических элементов, загляните сюда. Там представлена периодическая система элементов, о которой вы узнаете позже.
Распространенность химических элементов в природе крайне неравномерна. Самый распространенный элемент в земной коре (слое толщиной 16 км) — кислород О. Его содержание составляет 49,13 % от общего числа атомов всех элементов. Доли остальных элементов показаны на рис. 28.
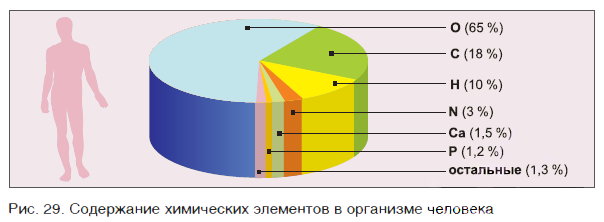
В организме человека на долю атомов кислорода приходится 65 % от массы тела, в то время как доля атомов углерода — 18 %, водорода — 10 %, азота — 3 % (см. рис. 29).
Во всей нашей Галактике почти 92 % от общего числа всех атомов приходится на долю водорода Н, 7,9 % — на долю гелия He и только 0,10 % — на атомы всех остальных элементов. Именно эти два самых легких элемента составляют основу звездной материи.
Краткие выводы урока:
Надеюсь урок 1 «Атомы и химические элементы» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Химический элемент
Формой существования химических элементов в свободном виде являются простые вещества (одноэлементные) [3]
Содержание
История становления понятия
Слово «элемент» (лат. elementum ) использовалось еще в античности (Цицероном, Овидием, Горацием) как часть чего-то (элемент речи, элемент образования и т. п.). В древности было распространено изречение «Как слова состоят из букв, так и тела — из элементов». Отсюда — вероятное происхождение этого слова: по названию ряда согласных букв в латинском алфавите: l, m, n, t («el» — «em» — «en» — «tum»). [4]
Благодаря Джону Дальтону в начале XIX в. в химии возобладала атомно-молекулярная гипотеза, рассматривающая химический элемент как отдельный вид атомов и указывающая на природу простых и сложных веществ, как состоящих, соответственно, из атомов одного или различного видов. Дальтон же впервые указывает на атомный вес как важнейшее свойство элементов, определяющее его химическую природу. Благодаря усилиям Йенса Берцелиуса и его последователей были весьма точно определены атомные веса (атомные массы) известных элементов. Середина XIX в. ознаменовалась целым рядом открытий новых элементов. На международном съезде химиков в г. Карлсруэ в 1860 г. были приняты определения понятий молекулы и атома.
Ko времени открытия Периодического закона Д. И. Менделеевым (1869) было известно 63 элемента. Именно атомный вес был выделен им как свойство атомов, определяющее периодический характер изменения свойств химических элементов, а также образуемых ими простых и сложных веществ. Менделеев определял химические элементы как «материальные части простых или сложных тел, к-рые придают им известную совокупность физических и химических свойств». Oткрытие Mенделеева позволило предвидеть существование, a также свойства ряда неизвестных в то время элементов и послужило научной основой для их классификации.
Однако с открытием изотопов стало ясно, что различные совокупности атомов одного и того же элемента могут иметь различающиеся атомные массы; так, радиогенный гелий, выделенный из урановых минералов, в связи с преобладанием изотопа 4 He имеет атомную массу больше, чем гелий космических лучей.
Известные химические элементы
Право предложить название новому химическому элементу предоставляется первооткрывателям. Сообщение о новом открытии проверяется в течение нескольких лет независимыми лабораториями, и, в случае подтверждения, Международный союз теоретической и прикладной химии (ИЮПАК, IUPAC, en:International Union for Pure and Applied Chemistry) официально утверждает название нового элемента.
Не все из известных на сегодня 118 элементов имеют утвержденные ИЮПАК постоянные названия. Самым тяжёлым из официально признанных элементов, имеющих официальные постоянные названия, является 116-й, получивший в мае 2012 года имя ливерморий вместе со 114-м элементом флеровием.
Названия сверхтяжёлых элементов с номерами 113, 115, 117, 118, полученные в 2002—2010 годах в России и США, официально пока не утверждены. Они имеют временные систематические названия.
Символы химических элементов
Символы химических элементов используются как сокращения для названия элементов. В качестве символа обычно берут начальную букву названия элемента и в случае необходимости добавляют следующую или одну из следующих. Обычно это начальные буквы латинских названий элементов: Cu — медь (cuprum), Ag — серебро (argentum), Fe — железо (ferrum), Au — золото (aurum), Hg — ртуть (hydrargirum). Такая система химических символов была предложена в 1811 г. шведским химиком Я. Берцелиусом.
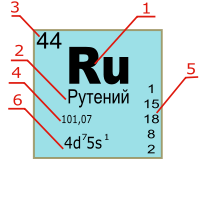
Цифрами меньшего размера возле символа элемента обозначаются: слева вверху — атомная масса, слева внизу — порядковый номер, справа вверху — заряд иона, справа внизу — число атомов в молекуле [7] :
| атомная масса | заряд иона |
| Символ элемента | |
|---|---|
| порядковый номер | число атомов в молекуле |
Временные символы элементов состоят из трёх букв, представляющих аббревиатуру их атомного номера на латыни.
В Периодической таблице карточка химического элемента обычно включает следующие характеристики:
Распространённость химических элементов в природе
Из всех химических элементов в природе найдено 88; такие элементы, как технеций Tc (порядковый номер 43), прометий Pm (61), астат At (85) и франций Fr (87), а также все элементы, следующие за ураном U (порядковый номер 92), впервые получены искусственно. Некоторые из них в исчезающе малых количествах обнаружены в природе.
Из химических элементов наиболее распространены в земной коре кислород и кремний. Эти элементы вместе с элементами алюминий, железо, кальций, натрий, калий, магний, водород и титан составляют более 99 % массы земной оболочки, так что на остальные элементы приходится менее 1 %. В морской воде, помимо кислорода и водорода — составных частей самой воды, высокое содержание имеют такие элементы, как хлор, натрий, магний, сера, калий, бром и углерод. Массовое содержание элемента в земной коре называется кларковым числом или кларком элемента.
Содержание элементов в коре Земли отличается от содержания элементов в Земле, взятой как целое, поскольку химсоставы коры, мантии и ядра Земли различны. Так, ядро состоит в основном из железа и никеля. В свою очередь, содержания элементов в Солнечной системе и в целом во Вселенной также отличаются от земных. Наиболее распространённым элементом во Вселенной является водород, за ним идёт гелий. Исследование относительных распространённостей химических элементов и их изотопов в космосе является важным источником информации о процессах нуклеосинтеза и об эволюции Солнечной системы и небесных тел.
Классификация химических элементов
Химические элементы как составная часть химических веществ
Химические вещества могут состоять как из одного химического элемента (простое вещество), так и из разных (сложное вещество или химическое соединение).
В обычных условиях 11 элементов существуют в виде газообразных простых веществ (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), 2 — жидкости (Br и Hg), остальные элементы образуют твёрдые тела.
См. также
Ссылки
Примечания
 | Химический портал — мир химии, веществ и превращений на страницах Википедии. |
Полезное
Смотреть что такое «Химический элемент» в других словарях:
химический элемент — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN chemical element A substance made up of atoms with the same atomic number; common examples are hydrogen, gold, and iron. (Source: MGH)… … Справочник технического переводчика
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — совокупность атомов, имеющих одинаковый заряд ядра и, следовательно, одинаковое число электронов в электронной оболочке. Многие из них имеют несколько (см.). Хим. элементы обозначают знаками химическими (см. (9)), а их закономерную взаимосвязь… … Большая политехническая энциклопедия
химический элемент — совокупность атомов с одинаковым зарядом ядра Z (одинаковым порядковым, или атомным, номером в периодической системе химических элементов). В таблицу химических элементов, издаваемую ИЮПАК, на 1998 внесено 109 элементов, имеющих названия (имеются … Энциклопедический словарь
химический элемент — ▲ атом ↑ с, определенный, заряд, атомное ядро элемент, химический элемент вид атомов, обладающих одинаковым зарядом ядра (железо #). атомный [порядковый] номер равен числу протонов в атомном ядре. атомный вес. ▼ водород, гидроген. кислород,… … Идеографический словарь русского языка
химический элемент — cheminis elementas statusas T sritis chemija apibrėžtis Atomų rūšis, turinti vienodą branduolio krūvį. atitikmenys: angl. chemical element; element rus. химический элемент; элемент ryšiai: sinonimas – elementas … Chemijos terminų aiškinamasis žodynas
химический элемент — cheminis elementas statusas T sritis Standartizacija ir metrologija apibrėžtis Atomų rūšis, turinti vienodą branduolio krūvį. atitikmenys: angl. chemical element vok. chemisches Element, n rus. химический элемент, m pranc. élément chimique, m … Penkiakalbis aiškinamasis metrologijos terminų žodynas
химический элемент — cheminis elementas statusas T sritis chemija apibrėžtis Elektrocheminio elemento tipas. atitikmenys: angl. chemical element rus. химический элемент … Chemijos terminų aiškinamasis žodynas
химический элемент — cheminis elementas statusas T sritis fizika atitikmenys: angl. chemical element vok. chemisches Element, n rus. химический элемент, m pranc. élément chimique, m … Fizikos terminų žodynas
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — вид атомов, обладающих одинаковым зарядом ядра. X. э. в свободном состоянии являются простыми (не разложимыми хим. методами на более простые) в вами. Мн. X. э. состоят из неск. изотопов. Взаимосвязь X. э. отражает периодическая система элементов… … Большой энциклопедический политехнический словарь
ХИМИЧЕСКИЙ ЭЛЕМЕНТ — совокупность атомов с одинаковым зарядом ядра Z (одинаковым порядковым, или атомным, номером в периодической системе химических элементов). В таблицу X. э., издаваемую ИЮПАК, на 1998 внесено 109 элементов, имеющих названия (есть сведения о… … Естествознание. Энциклопедический словарь
Чем химический элемент отличается от вещества?
Кратко:
– химический элемент это вид атомов с одинаковым зарядом ядра;
– простое вещество образовано атомами одного химического элемента.
Химический элемент – это условная запись в периодической таблице. Простое вещество – то, с чем мы имеем дело на практике.
Химический элемент – это атомы с одинаковым зарядом ядра.
Можно сказать, что химический элемент это условная выборка атомов по заряду ядра. Химические элементы представлены в периодической таблице Менделеева, но на практике мы всегда имеем дело с простыми веществами.
Обратите внимание: в определении химического элемента указан заряд ядра, но не масса ядра или атома. Почему?
Всё дело в том, что у многих (большинства) химических элементов в природе встречаются изотопы.
Изотопы (греч. isos – одинаковый + topos – место) – это разновидности одного и того же химического элемента, имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
А масса атома, прежде всего складывается из числа протонов и нейтронов. Именно поэтому в определении химического элемента используют понятие заряда ядра. Этим, кстати, объясняются дробные значения у большинства химических элементов в периодической таблице (но не у всех).
Примеры изотопов есть на сайте – изотопы водорода.
Известно, что примерно 75% содержащегося в природе хлора представлено изотопами хлора с атомной массой 35. Тогда как примерно 25 % хлора в природе имеет атомную массу равную 37.
Рассчитаем примерное среднее значение относительной атомной массы хлора:
Ar (Cl) = (35/100% * 75%) + (37/100 % * 25%) = 35,5
Относительная атомная масса — значение массы атома, выраженное как отношение массы атома данного элемента к 1⁄12 массе атома изотопа углерода 12 C.
Можно спросить, а как быть с элементами, у которых нет изотопов? Почему у них дробная масса?
Всё дело в так называемом дефекте массы. Опытным путём было доказано, что масса ядра оказывается меньше, чем масса протонов и нейтронов, из которых состоит ядро. Но почему?
Ответ даёт уравнение Эйнштейна: E = mc 2
Нуклоны (протоны и нейтроны) в ядре атома удерживаются силами ядерного взаимодействия, которое выражается формулой выше. Эта величина называется энергией связи ядра. Именно энергия связи порождает дефект массы и создает дробные значения относительной атомной массы у химических элементов без изотопов.
Простое вещество – это вещество, образованное атомами одного химического элемента.
На сегодняшний день известно более 400 простых веществ, но химических элементов в таблице Менделеева около 120. Откуда же еще 300 веществ? Один и тот же химический элемент может образовывать сразу несколько простых веществ.
Аллотро́пия — существование двух и более простых веществ одного и того же химического элемента. Явление аллотропии обусловлено либо различным состоянием молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
Безусловным рекордсменом по числу аллотропных модификаций является углерод. Наиболее известные: алмаз, графит, графены, фуллерены, нанотрубки, нановолокна, карбин и графин.
Известные примеры других веществ: кислород и озон, красный и белый фосфор.
Итак, если химический элемент это совокупность атомов с одинаковым зарядом ядра, то простое вещество образовано из этих атомов.
В этом и заключается разница. Химический элемент – это условный вид атомов, вещество – это то, с чем мы имеем дело в жизни.
Путаница может возникнуть ввиду того, что зачастую названия простого вещества и элемента совпадают (кислород, азот, водород, углерод и т.д.).
Как понять когда речь идёт о химическом элементе, а когда – о простом веществе?
Химический элемент не обладает химическими свойствами и физическими характеристиками (температуры плавления и кипения, электрическая проводимость, растворимость, запах, цвет и т.п. – см. подробнее).
Вот пример из учебника 7-го класса.
В каком случае речь идёт о водороде как о простом веществе:
а) водород присутствует в организме человека;
б) водород малорастворим в воде;
в) массовая доля водорода в воде равна 11%;
г) при обычных условиях водород находится в газообразном агрегатном состоянии;
д) в атмосфере водорода живые организмы погибают;
е) в состав оксидов водород не входит?
а) Водород входит в состав большинства органических молекул поэтому речь идёт о химическом элементе.
б) У химического элемента нет такой характеристики как растворимость.
в) В состав воды входят атомы водорода, а не водород как простое вещество.
г) Агрегатное состояние – характеристика простого вещества.
д) Речь идет об атмосфере, т.е. газе. Агрегатное состояние характеристика простого вещества.
е) Простое вещество не может входит в состав вещества сложного (см. определения), а вот атомы – могут.
А что такое сложное вещество?
Сложное вещество – это вещество, образованное атомами разных химических элементов.
Во Вселенной преобладают простые вещества: водород и гелий. Но в окружающем нас мире (на Земле) преобладают сложные вещества. Какое из них самое распространенное? Наверное вода? А вот и нет!
Основная масса Земли сосредоточена в мантии (
30%). Ядро Земли состоит преимущественно из железа и никеля; а мантия – из оксидов кремния, магния и железа в виде различных минералов.
Как видите, масса поверхности Земли ничтожно мала. Да, в мантии тоже присутствует вода и, по оценкам учёных, по объему её содержание сопоставимо со всем мировым океаном. Но даже этого количества ничтожно мало.
Таким образом, самым распространенным (по массе) сложным веществом на Земле является оксид кремния, на втором месте – оксид магния, и на третьем месте – оксиды железа.
А вот если говорить о поверхности Земли, то первое место займет… самый обычный песок! Вода – на втором месте.