Как определяется состояние термодинамической системы и что означает ее равновесное состояние
ФизМат
суббота, 25 мая 2013 г.
[Физика зачет 21] Состояние термодинамической системы. Равновесное состояние. Обратимые процессы. Термодинамические параметры газа. Изопроцессы и их графики. Абсолютный нуль. Термодинамическая температурная шкала. Связь между температурой и кинетической энергией молекул. Постоянная Больцмана. Уравнение Клапейрона-Менделеева. Универсальная газовая постоянная.
Состояние термодинамической системы.
Термодинамические параметры газа.
| Параметр | Обозначение | Единицы в СИ |
| Масса молекулы | M0 | Кг |
| Скорость молекулы | 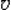 | М/c |
| Cредняя квадратичная скорость движения молекул | 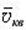 | М/c |
| Средняя кинетическая энергия поступательного движения | 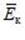 | Дж |
| Параметр | Обозначение | Единицы в СИ | Способ измерения (косвенный способ) |
| Масса газа | M | Кг | Весы |
| Объем сосуда | V | М3 | Мерный цилиндр с водой; измерение размеров и расчет по формулам геометрии |
| Давление | P | Па | Манометр |
| Температура | T | К | Термометр |
| Плотность | | Кг/м3 | Измерение массы, объема и расчет |
| Концентрация | N | 1/м3 = м-3 | Измерение плотности и расчет с учетом молярной массы |
| Cостав (молярная масса и соотношение количеств ) | М1, М2, |
Изопроцессы и их графики.
Термодинамическая температурная шкала.
Термодинамическая температурная шкала
Связь между температурой и кинетической энергией молекул.

Универсальная газовая постоянная.
Газовая постоянная (R) – одна из основных физических постоянных, входит в уравнение состояния 1 моля идеального газа: pV = RT, где р – давление, V – объем моля газа, Т – абсолютная температура. Газовая постоянная численно равна работе расширения 1 моля идеального газа под постоянным давлением при нагревании на 1 K.
R = pV/T = 1.01•10 5 •22.4•10-3/273[Па•м 3 /моль]/K =8.31(44) Dж/(моль•K)
Термодинамическая система. Параметры состояния системы. Равновесное и неравновесное состояние



ОПРЕДЕЛЕНИЕ: Термодинамической системой называется совокупность тел, обменивающихся энергией, как друг с другом, так и с окружающими телами.
Примером системы может служить жидкость и находящийся в равновесии с ней пар. Система может состоять и из одного тела: жидкость, газ, твердое тело.
Всякая система может находиться в различных состояниях, отличающихся температурой, давлением, объемом и т.д.
ОПРЕДЕЛЕНИЕ: Совокупность физических величин, однозначно определяющих состояние системы, называется параметрами системы.
Не всегда какой-либо параметр имеет определенное значение. Если, например, температура в разных точках тела неодинакова, то телу нельзя приписать определенное значение параметра “T”. В этом случае состояние называется неравновесным. Если такое тело изолировать от других тел и предоставить самому себе, то температура выровняется и примет одинаковое для всех точек значение “T” – тело перейдет в равновесное состояние. Это значение температуры не изменится до тех пор, пока тело не будет выведено из равновесного состояния воздействием извне.
То же самое может иметь место и для других параметров системы, например для давления “p”.
А что же будем называть равновесным состоянием?
ОПРЕДЕЛЕНИЕ: Равновесным состоянием системы будем называть такое состояние, при котором все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго.
Если по координатным осям откладывать значения каких-либо 2 х параметров, то любое равновесное состояние может быть изображено точкой на этом графике (например, точкой 1). Неравновесное состояние не может быть изображено таким способом, т.к. в неравновесном состоянии хотя бы один из параметров не имеет определенного значения.
Процесс перехода системы из неравновесного состояния в равновесное называется процессом релаксации. Время, затрачиваемое на такой переход, называют временем релаксации. В качестве времени релаксации принимается время, за которое первоначальное отклонение какой-либо величины от равновесного значения уменьшается в “e” раз. Для каждого параметра имеется свое время релаксации. Наибольшее из этих времен играет роль времени релаксации системы.
Всякий процесс, т.е. переход системы из одного состояния в другое связан с нарушением равновесия системы. Следовательно, при протекании в системе какого-либо процесса она проходит через последовательность неравновесных состояний. В предельном случае бесконечно медленный процесс будет состоять из последовательности равновесных состояний.
ОПРЕДЕЛЕНИЕ: Процесс, состоящий из последовательности равновесных состояний, будет называться равновесным (равновесный процесс – абстракция).
Равновесный процесс может быть изображен на графике соответствующей сплошной кривой. Неравновесные процессы будем условно изображать пунктирными линиями.
Равновесный процесс может быть проведен в обратном направлении, причем система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Поэтому равновесные процессы также называются обратимыми.
Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики строго применимы только к равновесным состояниям и обратимым процессам.
Термодинамическое равновесие
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объём, энтропия) в условиях изолированности от окружающей среды. В общем, эти величины не являются постоянными, они лишь флуктуируют (колеблются) возле своих средних значений. Если равновесной системе соответствует несколько состояний, в каждом из которых система может находиться неопределенно долго, то о системе говорят, что она находится в метастабильном равновесии. В состоянии равновесия в системе отсутствуют потоки материи или энергии, неравновесные потенциалы (или движущие силы), изменения количества присутствующих фаз. Отличают тепловое, механическое, радиационное (лучистое) и химическое равновесия. На практике условие изолированности означает, что процессы установления равновесия протекают гораздо быстрее, чем происходят изменения на границах системы (то есть изменения внешних по отношению к системе условий), и осуществляется обмен системы с окружением веществом и энергией. Иными словами, термодинамическое равновесие достигается, если скорость релаксационных процессов достаточно велика (как правило, это характерно для высокотемпературных процессов) либо велико время для достижения равновесия (этот случай имеет место в геологических процессах).
В реальных процессах часто реализуется неполное равновесие, однако степень этой неполноты может быть существенной и несущественной. При этом возможны три варианта:
В неравновесных системах происходят изменения потоков материи или энергии, или, например, фаз.
Устойчивость термодинамического равновесия
Состояние термодинамического равновесия называется устойчивым, если в этом состоянии не происходит изменения макроскопических параметров системы.
Критерии термодинамической устойчивости различных систем:
Равновесная термодинамика
Вы будете перенаправлены на Автор24
Методологии термодинамики в физике присущ настолько обобщающий характер, что она с равнозначным успехом возможна к применению в отношении объектов практически любой физической природы. Помимо всего прочего, в рамках такой теории становится возможным составление представления о закономерностях протекания довольно широкого круга химико-физических процессов.
Рисунок 1. Термодинамическое равновесие. Автор24 — интернет-биржа студенческих работ
Значимость термодинамического подхода в представлении о физических явлениях и материи может условно быть поделена на такие части:
Понятие равновесной термодинамики
В условиях изучения термодинамики (в частности, равновесной) выявляется фигурирование в ее основе не более четырех законов, а также существенное множество математических выражений (частного порядка). Ближайшее рассмотрение позволяет выяснить, что подобные выражения и преобразования включают в себя довольно ограниченный круг определенных параметров, которые сходны на первый взгляд и совершенно различны при ближайшем рассмотрении.
Феноменологический характер подхода в рамках изложения основных методов и принципов термодинамики до определенной степени превращается в причину ее незначительной популярности и абстрактности, если сравнивать с остальными разделами физики.
Готовые работы на аналогичную тему
Наряду с тем, безусловным преимуществом термодинамического подхода выступает факт описания им и установления соотношения наблюдаемых непосредственно параметров разных веществ, что возможно и без наличия специальных знаний относительно их внутренней атомно-молекулярной структуры.
Так, при оперировании всего несколькими законами и ограниченным числом переменными, становится возможным получение огромного количества информацию касательно сложных систем с содержанием множества индивидуальных молекул. Еще одним достоинством термодинамики можно выделить независимость ее выводов от физико-технического характера системы, которая должна рассматриваться.
Равновесная термодинамика работает по принципу описания системы в состоянии термодинамического равновесия (или близкого к нему), и при этом абсолютно исключает учет ее предыстории и специфику направления перехода от одного (изначального) состояния к другому (итоговому).
Основные положения равновесной термодинамики
Рисунок 2. Равновесное состояние термодинамической системы. Автор24 — интернет-биржа студенческих работ
В качестве основных положений молекулярно-кинетической теории можно выделить следующие:
Термодинамика, при исследовании тепловых явлений, исключает учет молекулярного строения тел. Тепловые явления в ней будут описываться посредством привлечения величин, которые регистрируются специальными приборами (давление, температура, удельный объем).
Исходя из опытов, термодинамические процессы будут считаться необратимыми. При приведении в соприкосновение двух нагретых тел, более нагретое начнет передавать энергию менее нагретому. Обратный процесс при этом становится невозможным, что происходит по причине стремления всякой системы к состоянию термодинамического равновесия (когда тела пребывают в положении покоя касательно друг друга с равными температурами и давлением).
При достижении подобного состояния, система уже не может сама из него выйти, что объясняет необратимость приближенных к равновесию термодинамических процессов.
Термодинамическое равновесие в природе
Рисунок 3. Термодинамическое равновесие. Автор24 — интернет-биржа студенческих работ
Термодинамическое равновесие показывает такое состояние для системы, при котором сохраняются неизменными во времени ее макроскопические величины, что происходит при условии изолированности от окружающей среды.
Такие величины, в принципе, не считаются постоянными, всего лишь наблюдается их колебание около собственных средних значений. При соответствии равновесной системе нескольких состояний, в каждом из которых система может пребывать неопределенно долго, о системе можно будет сказать, что ее положение характеризуется метастабильным равновесием.
Отличают такие виды равновесия: тепловое (термодинамическое), механическое, гидроаэромеханическое (гидростатическое), радиационное (лучистое) и также химическое. В реальных процессах частой будет реализация неполного (относительного, подвижного, динамического) равновесия, но при этом степень подобной неполноты может оказаться значимой или несущественной. При этом допускаются такие варианты:
Термодинамические параметры состояния системы
Вы будете перенаправлены на Автор24
Термодинамической системой называют совокупность макрообъектов (тел, полей), которые обмениваются энергией друг с другом и внешними (по отношению к системе) объектами. Такую систему называют замкнутой (изолированной), если у нее нет ни какого обмена энергией с внешними телами. Если нет обмена только теплотой, то система адиабатический изолирована. Систему называют закрытой, если нет массообмена у нее с внешней средой.
Величины, которые характеризуют состояние термодинамической системы, называют термодинамическими параметрами. Два состояния системы считают разными, если у этих состояний отличается хотя бы один из параметров. Состояние системы называют стационарным, если параметры системы не изменяются во времени. Стационарное состояние системы равновесно, если система находится в стационарном состоянии не благодаря какому-либо внешнему процессу.
Термодинамические параметры имеют связи между собой. Поэтому для однозначного определения состояния термодинамической системы достаточно ограниченного числа термодинамических параметров. Основными параметрами состояния термодинамической системы являются: давление, температура, удельный объем ($V_u$) (или молярный$<(\ V>_<\mu >)$).
Готовые работы на аналогичную тему
Для однородного тела удельный объем:
Температурой (t, или T) называют физическую величину, характеризующую степень нагретости тела. Различают несколько видов температуры (в зависимости от используемой шкалы измерения). В состоянии термодинамического равновесия все тела системы (все части системы) имеют равные температуры.
В соответствии с правилом Гиббса состояние однородной (в физическом смысле) термодинамической системы полностью определяется двумя параметрами. Уравнение, которое связывает параметры термодинамической системы, называют уравнением состояния. Так, например, можно записать уравнение для внутренней энергии (в общем виде):
Макроскопические термодинамические параметры, описывающие систему целиком, имеют смысл средних значений (за большой промежуток времени) каких-то функций, характеризующих динамическое состояние системы.
Кроме параметров термодинамические системы описывают с помощью функций состояния (иногда об этих физических величинах говорят как о параметрах состояния термодинамической системы).
Важнейшими функциями состояния в термодинамике являются: внутренняя энергия (U), энтальпия (H), энтропия (S).
Внутренняя энергия идеального газа часто выражается следующим образом:
Энтальпия идеального газа зависит только от T и пропорциональна m:
Бесконечно малое приращение внутренней энергии идеального газа задано формулой:
Из уравнения Менделеева-Клайперона выразим температуру (T), помним, что давление постоянно:
Подставим (1.2) в (1.1), получим:
Найдем изменение внутренней энергии газа:
где i =5 по условию задачи, так как газ двухатомный.
Задание: Азот массы 1 кг нагрели на 100 К при постоянном объеме. Найти количество теплоты, полученное газом в заданном процессе. Работу газа, изменение внутренней энергии.
Сразу дадим ответ относительно работы газа. Так как процесс изохорный (изменения объема нет), то работа газа равна нулю.
Изменение внутренней энергии газа можно записать как:
\[\triangle U=\frac<2>\nu R\triangle T\left(2.1\right),\]
молярная масса азота находится с помощью таблицы Менделеева, она равна:
Все данные в задаче в системе СИ, молекула азота состоит из двух атомов, число степеней свободы равно 5, поэтому проведем расчет:
\[\triangle U=\frac<2>\frac
По первому началу термодинамики для изохорного процесса получаем:
\[\triangle Q=\triangle U\left(2.3\right).\]
Можем записать ответ.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021







