Как понять что связь ионная
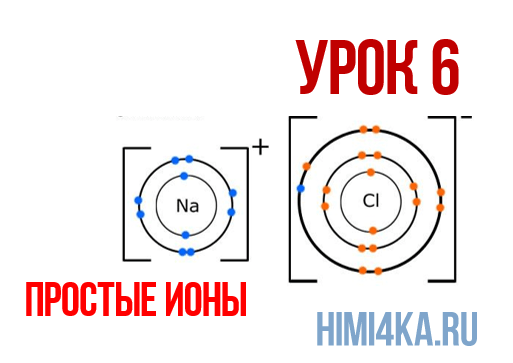
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
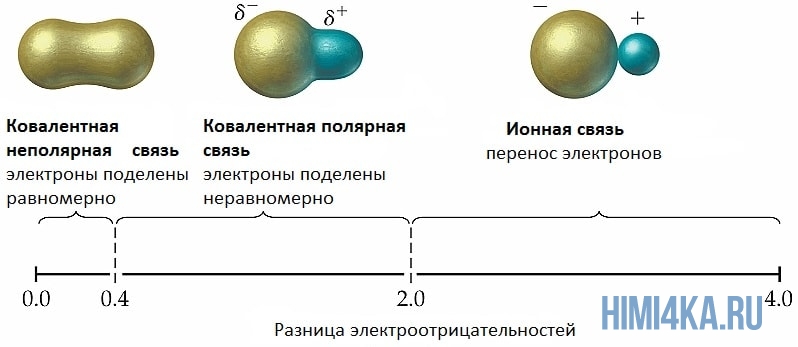
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
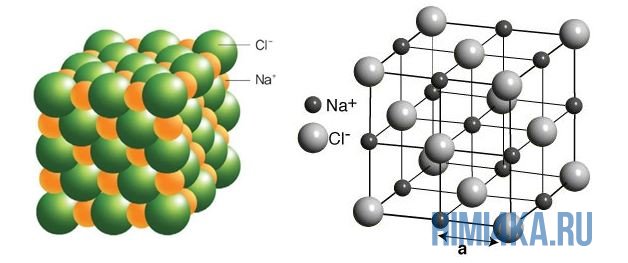
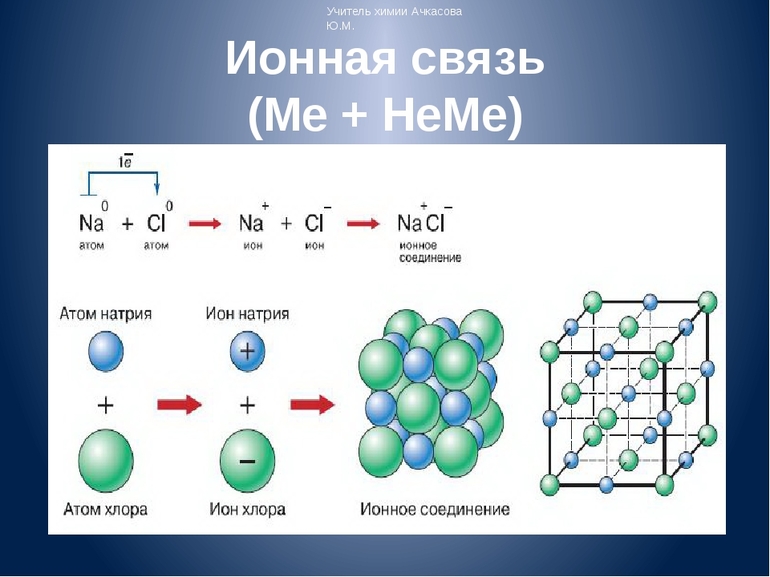
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
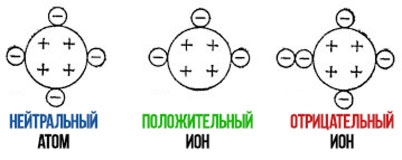
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Ионная связь.
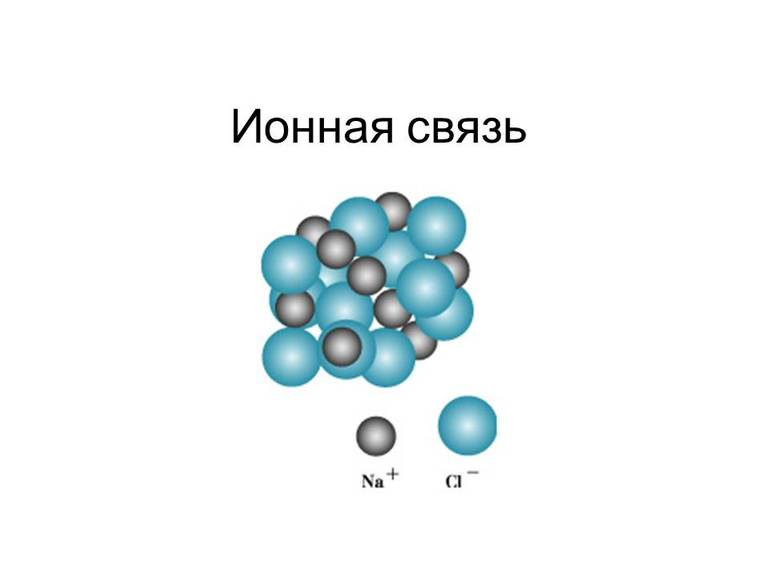
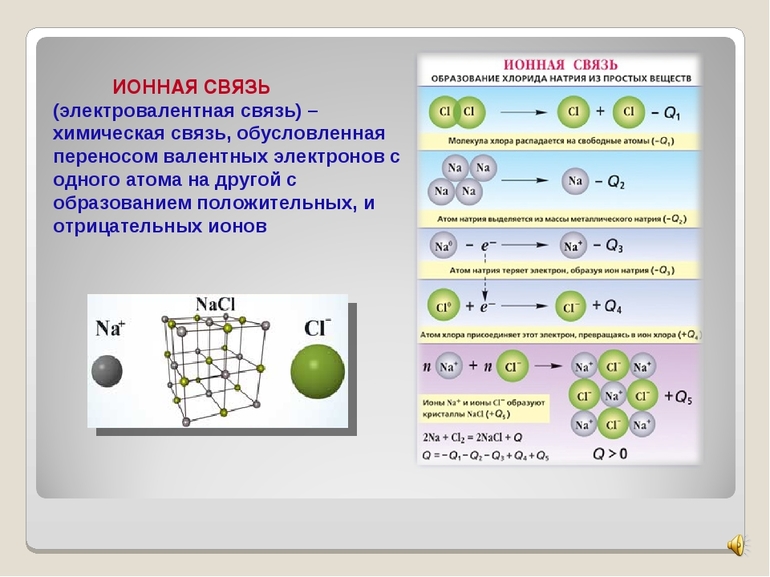
Ионная связь – химическая связь, образованная электростатическим притяжением между катионами и анионами.
Катионы – положительно заряженные ионы, образующийся в результате отдачи атомом электрона (например, K 



Анион – отрицательно заряженный ион, образующийся в результате приобретения атомом электрона (Cl 



По значению заряда ионы подразделяются на:
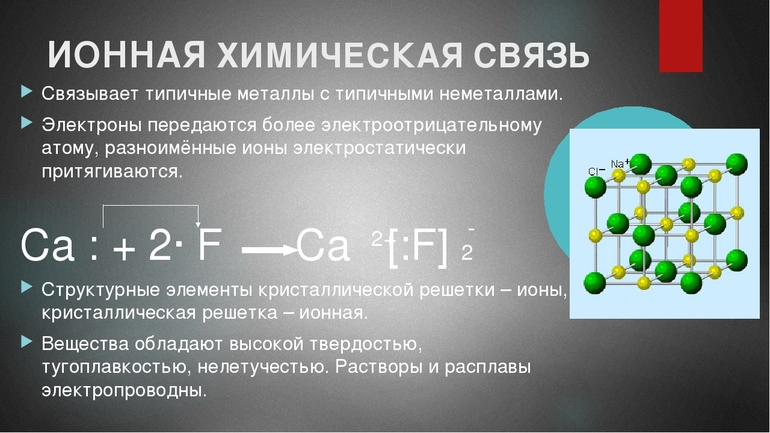
В образовании ионной связи участвуют атомы металлов и неметаллов. Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности в результате перехода электронов от атомов одних элементов, к другим.
При образовании ионной связи атом неметалла принимает электроны на внешний энергетический уровень и достраивает его до устойчивой конфигурации с восьмью электронами (правило октета).
Рассмотрим механизм образования ионной связи на примере. Реакция образования хлорида натрия: атом щелочного металла теряет электрон (образуется катион натрия), а атом галогена – приобретает (образуется хлорид-ион). Ионы образуют соединение за счет электростатического притяжения между ними.
Для ионной связи характерно:
Пример. Схема образования ионного соединения:



Ключевая информация
В химической науке существует четыре основных типа связи — ковалентная, ионная, металлическая и водородная. Металлическая возникает между элементами-металлами, водородная — между молекулами, состоящими из водорода и атомов с высокой электроотрицательностью (азотом, кислородом, фтором).
Самые разнообразные соединения относятся к ковалентной и ионной связям, которые представляют по своему составу смешанный тип. Для ионной связи ковалентная в определенном смысле выполняет материнскую функцию.
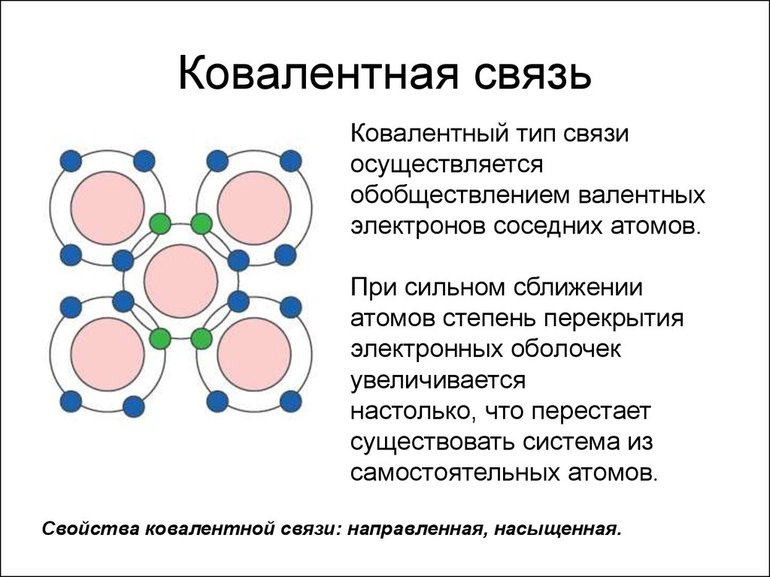
Наиболее частым и распространенным видом химической связи считается именно ковалентная. Это соединение, в процессе формирования которого обобществляется (перекрывается) пара валентных электронных облаков. Количество таких связей, образованных атомом элемента, — это показатель ковалентности.
Ковалентная связь бывает двух типов — неполярная и полярная. Определяющими факторами для типа связи служат значения электроотрицательности взаимодействующих атомов химических элементов. Если эти показатели у атомов:
Электростатическое притяжение частиц в ионной связи очень сильное. Эта особенность обусловливает высокие температуры плавления и кипения для веществ с такой связью. Однако стопроцентного ионного соединения не существует. Электронная пара не переходит к более электроотрицательному атому полностью. В качестве яркого примера наиболее сильного смещения электронов стоит привести фторид цезия CsF. Так называемая «степень ионности» в этом соединении достигает 97%.
Заряды частиц и их классификация
По определению ионная химическая связь — это соединение ионов с разным зарядом (положительным и отрицательным). Это частный случай ковалентной полярной связи или, иначе говоря, крайний случай поляризации.
Положительно заряженные ионы называются катионами. Примеры: K+ (ион калия), Fe 2 + (ион железа) и так далее. Катионы образуются в результате отдачи (потери) атомом одного электрона или нескольких. У них положительный заряд ядра превышает число отрицательно заряженных электронов.
По значению заряда ионы классифицируются на соответствующие категории (в скобках приведены примеры ионов, входящих в группу):
Одна из особенностей связи разноименных ионов — при их взаимодействии друг с другом их заряды полностью разделяются. Это связано с большой разностью электроотрицательностей атомов в паре.
Процесс взаимодействия
В отличие от металлической связи, где соединение образуется парой элементов-металлов, в процессе образования ионного соединения в качестве участников выступают атомы металлов и неметаллов. Типичные металлы охотно делятся электронами, а типичные неметаллы не менее охотно их принимают. Отдающий атом называется донорным, а принимающий — акцепторным.
При возникновении соединения атом неметалла забирает электроны на свой внешний энергетический уровень, достраивая его таким методом. В результате он приобретает устойчивую конфигурацию из восьми электронов (согласно правилу октета). То есть суть механизма образования ионной связи заключается в следующем: после взаимного притяжения друг к другу противоположно заряженные ионы образуют стабильное соединение.
Атомы с почти полной или почти пустой внешней (валентной) оболочкой вступают в химические реакции максимально охотно. Заполненность этого слоя играет ключевую роль в электронном обмене. Малое количество пустых орбиталей на внешней оболочке повышает шансы атома на получение электронов извне. А мизерное количество электронов, расположенных на валентной оболочке, напротив, увеличивает вероятность отдачи атомом электрона.
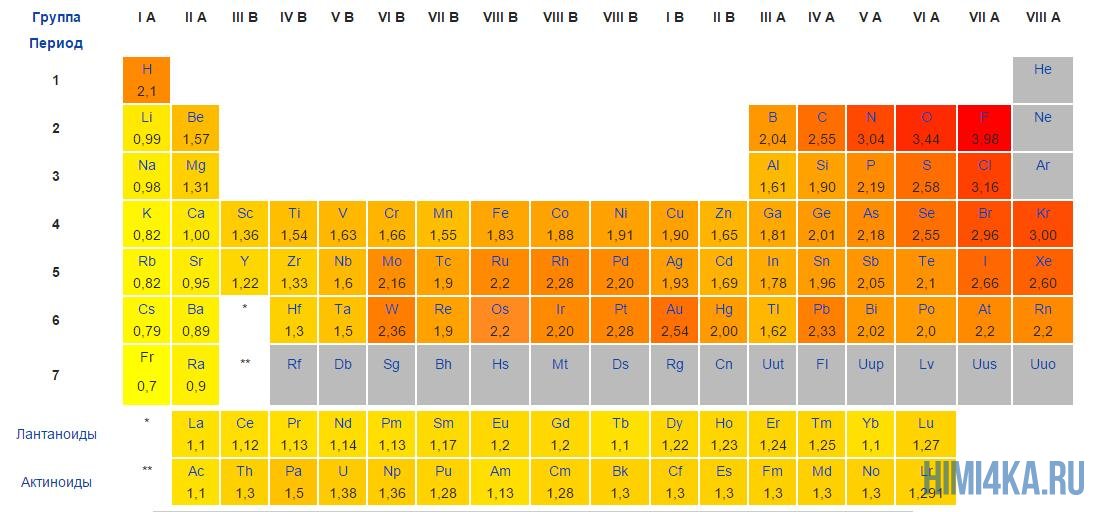
Электроотрицательность атома химического элемента выражается в его способности к притяжению электронов к своему внешнему слою. Именно поэтому чем полнее заполнена валентная оболочка атома, тем больше значение его электроотрицательности. Показатели электроотрицательности связаны с расположением элементов в периодической таблице Менделеева — чем дальше они находятся друг от друга (расстояние оценивают в основном по группе), тем больше разница между показателями. По этой причине ионные соединения особенно характерны для металлов и неметаллов, расположенных в системе наиболее удаленно (например, в I и VII группах).
Помимо простой связи ионов, стоит особо отметить ее молекулярную разновидность. Главная особенность такого соединения заключается в том, что в качестве ионов в ней выступают целые молекулы, а не отдельные атомы, как в обычной связи.
Примеры возникновения
Подробно рассмотреть, как взаимодействие атомов с разноименными зарядами приводит к образованию связи ионов, стоит на нескольких простых примерах.
Первый пример — общее описание механизма возникновения. Для этого подойдет химическая реакция формирования такого соединения, как хлорид натрия или, проще говоря, поваренная соль. В процессе участвуют атомы щелочного металла (натрий Na) и галогена (хлор Cl). У первого на внешнем энергетическом уровне находится один электрон, а у второго — семь, то есть ему как раз нужен один электрон для завершения своего внешнего слоя.
Единственный валентный электрон атома металла имеет слабую связь с его ядром, поэтому Na легко отдает эту частицу. В результате у него освобождается место на внешнем энергетическом уровне. Таким образом оба участника соединения получили полностью заполненные внешние оболочки. После отдачи электрона атом металла превращается в катион натрия Na+, а принявший этот электрон атом неметалла преображается в хлорид-ион Cl-. Образовавшиеся ионы притягиваются друг к другу — возникает ионное соединение.
Схема процесса превращения атомов натрия и хлора в ионы соответствующих элементов и образование ими ионного соединения выглядит следующим образом (скобками отмечены электронные слои строения атома): Na 0 )2e)8e)1e + Cl 0 )2e)8e)7e = [Na+)2e)8e] + [Cl-)2e)8e)8e] = [Na+)2e)8e][Cl-)2e)8e)8e]. Этот же процесс в виде формулы выглядит так: Na 0 + Cl 0 = Na+ + Cl- = Na+Cl-
Таким образом, формула вещества с ионной связью (в приведенном примере это поваренная соль) имеет следующий вид: Na+Cl- (то есть один участник в ходе взаимодействия приобретает положительный заряд, а другой, наоборот, отрицательный). Ионные вещества всегда имеют сложный состав — они не состоят из одного элемента. Это соединение характерно для следующих веществ:
Они обладают кристаллическими решетками ионного типа.
Что касается элементов, то для примера ионной связи натрий — один из самых подходящих элементов периодической таблицы Менделеева. Это связано с его низкой электроотрицательностью и наличием на внешней оболочке единственного электрона. Второй пример формирования ионного соединения также будет с натрием. Рассматриваемое вещество — фторид натрия. Участники процесса — натрий Na и фтор F.
По наиболее важным для изучаемого процесса характеристикам фтор схож с хлором — у него высокая электроотрицательность и семь электронов на внешнем слое. Поэтому он также очень подходит для рассмотрения эталонной связи ионов.
Фторид натрия образуется в результате окислительно-восстановительной реакции между атомами натрия и фтора. Металл отдает свой внешний электрон неметаллу. Последняя внешняя орбиталь атома фтора заполняется, валентный слой натрия освобождается. Оба атома, превращаясь в ионы с разноименными зарядами, приобретают стабильную электронную конфигурацию. Затем между ними возникает электростатическое притяжение, в результате чего они образуют ионное соединение.
Особенности связи
Для соединений ионов характерна кристаллическая структура. Яркий пример типичной формы таких веществ — это поваренная соль NaCl.
Эти соединения очень прочные — настолько, что их крайне проблематично разрушить посредством тепловой энергии. Однако из-за довольно низкого радиуса ионного взаимодействия эти соединения получили такую незавидную характеристику, как ломкость. Что касается энергии самой связи, то она прямо пропорциональна кратности соединения, то есть числу общих электронных пар.
Соединения ионов отлично растворяются в полярных растворителях — воде, кислотах и прочих. Эта особенность обусловлена заряженностью частей молекулы. Помимо растворимости, ионные соединения обладают такими характеристиками:
Два последних характерных свойства ионной связи отличают ее от прочих видов химических соединений. Эти особенности обусловливают факт тяготения кристаллов ионных веществ к различным плотнейшим упаковкам соответствующих ионов.
Типы химических связей: ионная, ковалентная, металлическая
Природа химической связи состоит в действии электростатических сил, которые являются силами взаимодействия между электрическими зарядами. Такие заряды имеют электроны и ядра атомов.
Электроны, расположенные на внешних электронных уровнях (валентные электроны) находясь дальше всех от ядра, слабее всего с ним взаимодействуют, а значит способны отрываться от ядра. Именно они отвечают за связывание атомов друг с другом.
Типы взаимодействия в химии
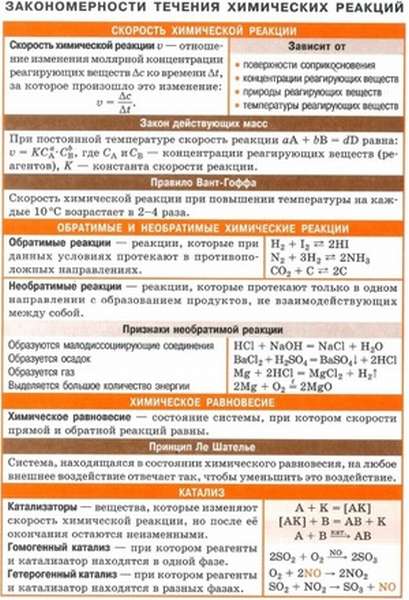
Типы химической связи можно представить в виде следующей таблицы:
| внутримолекулярные | межмолекулярные |
| ионное | водородное |
| металлическое | вандерваальсовое |
| ковалентное | ион-дипольное |
| диполь-дипольное |
Характеристика ионной связи
Наименьшими показателями электроотрицательности обладают типичные металлы, а наибольшими — типичные неметаллы. Ионы, таким образом, образуются при взаимодействии между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая электроны внешних электронных уровней, а неметаллы принимают электроны, превращаясь таким образом в отрицательно заряженные ионы (анионы).
Атомы переходят в более устойчивое энергетическое состояние, завершая свои электронные конфигурации.
Ионная связь ненаправленная и не насыщаемая, так как электростатическое взаимодействие происходит во все стороны, соответственно ион может притягивать ионы противоположного знака во всех направлениях.
Расположение ионов таково, что вокруг каждого находится определённое число противоположно заряженных ионов. Понятие «молекула» для ионных соединений смысла не имеет.
Примеры образования
Na0 — 1 е = Na + (катион)
Cl0 + 1 е = Cl (анион)
В хлориде натрия вокруг катионов натрия расположено шесть анионов хлора, а вокруг каждого иона хлора шесть ионов натрия.
При образовании взаимодействия между атомами в сульфиде бария происходят следующие процессы:
Металлическая химическая связь

Строение вещества металла таково: кристаллическая решётка является остовом вещества, а между её узлами электроны могут свободно перемещаться.
Можно привести следующие примеры:
Ковалентная: полярная и неполярная
Ковалентное взаимодействие может образовываться по обменному механизму или по донорно-акцепторному.
Обменный механизм реализуется, если у каждого из атомов есть неспаренные электроны на внешних электронных уровнях и перекрывание атомных орбиталей приводит к возникновению пары электронов, принадлежащей уже обоим атомам. Когда же у одного из атомов есть пара электронов на внешнем электронном уровне, а у другого свободная орбиталь, то при перекрывании атомных орбиталей происходит обобществление электронной пары и взаимодействие по донорно-акцепторному механизму.
Ковалентные разделяются по кратности на:
Двойные обеспечивают обобществление сразу двух пар электронов, а тройные трёх.
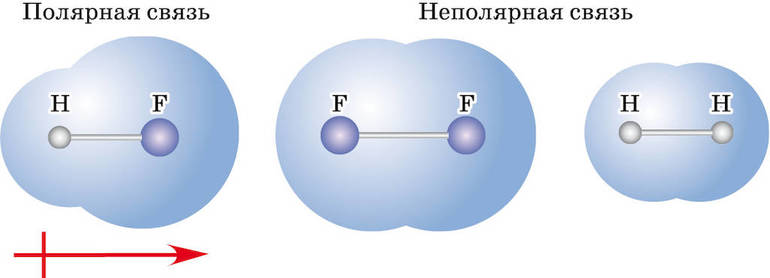
По распределению электронной плотности (полярности) между связываемыми атомами ковалентная связь делится на:
Неполярную связь образуют одинаковые атомы, а полярную — разные по электроотрицательности.
Взаимодействие различающихся по электроотрицательности элементов приводит к образованию полярных связей. Общие электронные пары при таком типе взаимодействия притягиваются более электроотрицательным элементом, но полностью к нему не переходят (то есть образования ионов не происходит). В результате такого смещения электронной плотности на атомах появляются частичные заряды: на более электроотрицательном отрицательный заряд, а на менее положительный.
Свойства и характеристика ковалентности
Основные характеристики ковалентной связи:

H· + ·H → H-H молекула имеет одинарную неполярную связь,
O: + :O → O=O молекула имеет двойную неполярную,
Ṅ: + Ṅ: → N≡N молекула имеет тройную неполярную.
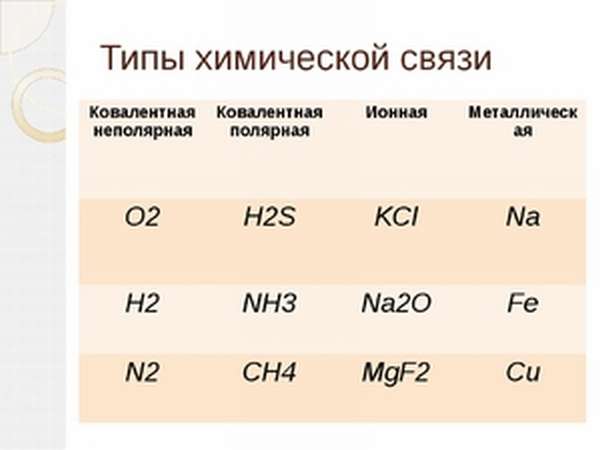
В качестве примеров ковалентной связи химических элементов можно привести молекулы углекислого (CO2) и угарного (CO) газа, сероводорода (H2S), аммиака (NH3), соляной кислоты (HCL), воды (H2O), метана (CH4), оксида серы (SO2) и многих других.
В молекуле CO2 взаимосвязь между углеродом и атомами кислорода ковалентная полярная, так как более электроотрицательный водород притягивает к себе электронную плотность. Кислород имеет два неспаренных электрона на внешнем уровне, а углерод может предоставить для образования взаимодействия четыре валентных электрона. В результате образуются двойные связи и молекула выглядит так: O=C=O.
Как определить химическую связь вещества
Для того чтобы определиться с типом связи в той или иной молекуле, достаточно рассмотреть составляющие её атомы. Простые вещества металлы образуют металлическую, металлы с неметаллами ионную, простые вещества неметаллы ковалентную неполярную, а молекулы, состоящие из разных неметаллов, образуются посредством ковалентной полярной связью.