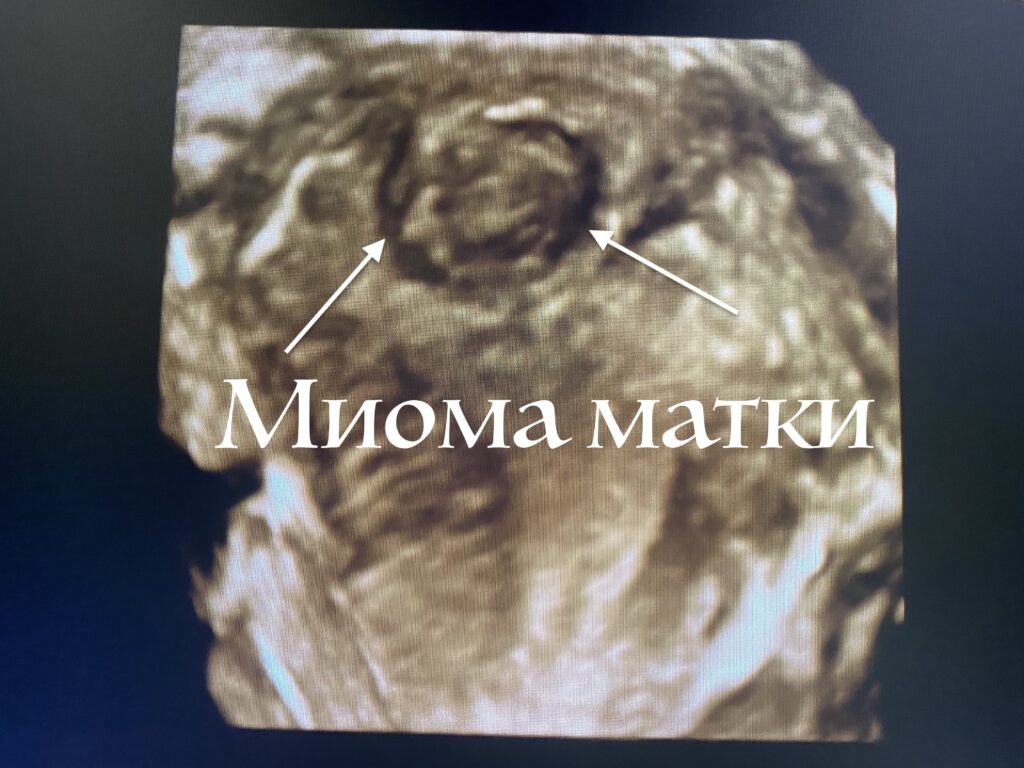
Как вылечить миому матки о чем не расскажет врач
Миома: лечить нельзя оставить
Самое важное о миоме матки, причинах ее возникновения, видах лечения и мифах об этом заболевании рассказывают Дмитрий Лубнин, акушер-гинеколог, и Борис Бобров, эндоваскулярный хирург, ведущие специалисты Центра Лечения Миомы Матки, функционирующего на базе Юсуповской Больницы и Европейской Клиники.
Что такое миома матки
Миома — доброкачественная опухоль женской репродуктивной системы, которая образуется в матке. Это заболевание очень распространено: по словам Дмитрия Лубнина, миомы развиваются у более чем 80% женщин. Однако у многих из них заболевание не вызывает никаких симптомов.
Проводились аутопсийные исследования, в которых изучали матки женщин, погибших от разных причин. Ученые изучали тонкие срезы матки с интервалом 2 мм, при этом фиксировались даже микроскопические зачатки будущих опухолей. Согласно этим исследованиям, частота встречаемости миомы достигает 87%. Но клинически заболевание проявляется лишь у 30-35% женщин старше 35 лет, — поясняет гинеколог.
Отдельным негативным проявлением миомы матки являются трудности с наступлением и вынашиванием беременности. Наступлению беременности могут мешать узлы, растущие в полость матки и деформирующие ее. По сути миомы занимают пространство, в котором должна развиваться беременность, — уточняет Лубнин.
Картина заболевания разная у каждой конкретной женщины: у кого-то может развиться одна миома, у кого-то — десяток миоматозных узлов. Миомы могут прогрессивно расти, сильно отличаться размерами — от нескольких миллиметров до десятков сантиметров, а также могут внезапно останавливаться в росте.
Рост миоматозного узла начинается с дефекта в одной гладкомышечной клетке матки. При недостаточном кровоснабжении рост узлов может также происходить за счет накопления соединительной ткани. При этом формируются плотные фиброзные узлы, которые нередко называют «фибромой матки». По локализации различают субсерозные узлы — растущие снаружи матки, интрамуральные — непосредственно в стенке матки и субмукозные, рост которых направлен в полость матки. Бывают смешанные локализации узлов, то есть узел может занимать несколько слоев матки. Отдельно выделяют узлы «на ножке», то есть растущие снаружи матки на тонком основании, и интралигаментарные узлы — располагающиеся в широкой связке матки, — перечисляет Дмитрий Лубнин.
 |
Причины
Точная причина развития миомы неизвестна. По словам Дмитрия Лубнина, из-за своей распространенности миома может рассматриваться как вариант физиологической реакции матки на ее «работу» в неестественных условиях. Под такими условиями в данном случае понимается множество менструальных циклов при малом количестве беременностей.
Предполагается, что множество менструальных циклов создает условия для возникновения дефектов в гладкомышечных клетках: происходит сбой, и часть клеток не подвергается апоптозу (программируемой клеточной гибели), а продолжает расти. И в следующем цикле формируются зачатки роста миоматозных узлов. Согласно другой теории, дефект в клетках может возникать во время внутриутробного периода, когда гладкомышечные клетки матки длительное время находятся в нестабильном состоянии: их развитие происходит вплоть до 38 недели беременности, в то время как развитие гладкомышечных клеток других систем заканчивается до 13 недели, — комментирует Лубнин.
Рост миоматозных узлов связывают с воздействием женских половых гормонов, так как развитие миом обычно приходится на репродуктивный возраст, когда уровень этих гормонов самый высокий, и прекращается после наступления менопаузы.
Основным гормоном, стимулирующим рост клеток миомы матки, является прогестерон — гормон, ответственный за начало и поддержание беременности. Иммуногистохимические исследования выявили преобладание на клетках миомы рецепторов к этому гормону. Активное деление клеток миомы происходит во второй фазе менструального цикла и во время беременности, то есть в те периоды, когда концентрация прогестерона в организме наибольшая и прогрессивно нарастает. Ранее предполагалось, что за развитие миомы матки отвечает другой женский гормон — эстрадиол, а прогестерон, являясь «контргормоном», может использоваться для лечения этого заболевания. Это ошибочное представление привело к повсеместному внедрению в практику препарата «Дюфастон» для лечения миомы матки, и в результате заболевание только прогрессировало, — объясняет Дмитрий Лубнин.
Факторы риска
— Раса. Вероятность развития миомы у женщин африканского происхождения в несколько раз выше. Как правило, у таких женщин миомы могут возникать в более раннем возрасте и сопровождаться более тяжелыми симптомами.
— Наследственность. Наличие миоматозных узлов у близких родственниц (мамы, сестры), повышает риск.
— Другие факторы. К ним относятся раннее начало менструаций, дефицит витамина Д, ожирение.
Диагностика
По словам Дмитрия Лубнина, диагностика миомы матки не представляет большого труда:
В подавляющем большинстве случаев достаточно обычного ультразвукового исследования. МРТ малого таза необходимо только при очень больших размерах матки и узлов. Желательно, чтобы любое ультразвуковое заключение всегда дополнялось графической схемой расположения узлов в матке, так как даже самое подробное описание узлов не позволяет точно указать локализацию образования и его отношение к полости матки, что имеет принципиальное значение при выборе метода лечения.
Лечение
Наличие миомы не означает, что лечение обязательно потребуется. Существуют конкретные ситуации, когда следует обратиться к врачу:
— Беременность не наступает или прерывается, и все другие причины исключены;
Для оценки скрытой кровопотери обязательно назначаются общий анализ крови, а также оценка уровня железа, ферритина и общей железосвязывающей способности сыворотки. Выявленная железодефицитная анемия (при исключении других причин) является показанием для лечения миомы матки даже при отсутствии у пациентки субъективных жалоб. Кроме этого, важным фактором для принятия решения о лечении и выборе его метода являются репродуктивные планы: хочет женщина забеременеть в ближайшее время или нет, — уточняет Дмитрий Лубнин.
По словам гинеколога, лечение миомы матки должно быть подобрано в соответствии с определенными требованиями:
1. Лечение должно быть органосохраняющим, то есть воздействовать только на узлы миомы и не причинять вреда матке;
2. Эффект лечения должен сохраняться на максимально длительный срок;
3. Лечение должно позволить женщине восстановить или сохранить репродуктивную функцию, если она в этом заинтересована;
4. В результате лечения узлы должны быть или удалены из матки, или лишены возможности расти дальше, или уменьшиться в размере на максимально длительный срок
Сейчас медицина располагает тремя основными методами лечения миомы матки.
Медикаментозный метод. Используется лечение, способное уменьшать миоматозные узлы. Эффект временный, то есть после окончания через некоторое время (период может значительно различаться) рост узлов возобновляется.
Оптимально использовать фармакотерапию для лечения маленьких, впервые выявленных узлов, предотвращая тем самым их прогрессирование до клинически значимых размеров. Кроме этого, такая терапия будет оправдана у пациенток, планирующих беременность, при наличии небольших узлов, деформирующих полость матки, но недоступных для хирургического удаления, — поясняет Лубнин.
Хирургический метод. Удаление миоматозных узлов из матки — миомэктомия.
Хирургическое удаление узлов миомы — временная «реставрация» матки для осуществления беременности. Подобный метод лечения оправдан только в случае, если пациентка планирует беременность, а имеющиеся узлы могут препятствовать этому. Частота рецидивов миомы матки после хирургического удаления узлов повышается на 7-14 % в каждый год после операции: уже через несколько лет после удаления узлы вырастают вновь более чем в половине случаев, — говорит Дмитрий Лубнин.
Борис Бобров отмечает, что по всей вероятности, хирургическая травма матки – процесс, который может запускать развитие других миоматозных узлов. Кроме того, в результате удаления множества узлов или особенно крупных узлов, на матке остаются рубцы, которые могут создать проблемы во время вынашивания беременности.
Еще один хирургический метод лечения миомы — удаление матки (гистерэктомия). Однако способ не соответствует принципам лечения этого заболевания.
Применение этого метода целесообразно только в очень запущенных случаях, когда матка, измененная узлами, достигает гигантских размеров, или имеется сопутствующая гинекологическая патология (пограничные или уже онкологические заболевания), — объясняет Дмитрий.
Кроме рисков, связанных с хирургическим вмешательством, у гистерэктомии существуют и другие возможные «побочные эффекты». Есть данные, что удаление матки в репродуктивном возрасте в отдаленном периоде повышает риск инфарктов и инсультов.
В российской науке существует такой термин – постгистерэктомический синдром. Это комплекс нарушений и расстройств – от физиологических до психологических, которые возникают у пациентки после удаления матки. Среди прочих последствий есть даже психологические опасения: «испуг потерять семью из-за ощущения себя неполноценной женщиной». Впрочем, за пределами нашей страны последствия гистерэктомии в отдельный симптомокомплекс не выделяют, — комментирует Борис Бобров.
Эндоваскулярный метод. Речь идет об эмболизации маточных артерий (ЭМА). Суть метода заключается в лишении кровоснабжения всех миоматозных узлов в матке с помощью введения в сосуды, питающие узлы, взвеси эмболов — микроскопических полимерных шариков.
Без кровоснабжения все миоматозные узлы погибают: уменьшаются в размере и замещаются соединительной тканью. Эффективность эмболизации маточных артерий, по данным разных исследований, составляет 94-99%, рецидивы заболевания исключительно редки — менее процента, — описывает Дмитрий.
По словам Бориса Боброва, термин «эмболизация маточных артерий» не точен.
Пациенток пугает, что мы «закрываем» саму маточную артерию, но это не так. Эмболы вводятся в периферические ответвления маточной артерии, располагающиеся внутри миоматозных узлов. ЭМА может быть показана любой пациентке с симптомной или растущей миомой матки. При наличии репродуктивных планов ЭМА тоже можно проводить, если возможность выполнения другого метода затруднена, либо таково желание пациентки: например, она не хочет иметь дела с наркозом, поскольку ЭМА требует только местной анестезии и может проводиться даже амбулаторно, — объясняет Борис Бобров.
 |
Рост миоматозных узлов непредсказуем, он не зависит ни от каких внешних факторов, за исключением периода беременности. Распространенный миф о влиянии бань, саун, массажа, загара и физиопроцедур на рост узлов миомы матки не имеет никаких достоверных научных подтверждений, как и мнение о том, что доброкачественная миома способна «переродиться» в злокачественную опухоль.
Узлы миомы могут годами не изменяться в размерах, а после дать довольно стремительный рост. В целом, скорость роста узлов за редким исключением составляет не более 1-2 см в год. Иногда узел может самостоятельно погибнуть, лишив себя кровоснабжения. Подобное явление также возникает после беременности. Если во время первых двух триместров узлы миомы активно растут под воздействием нарастающей концентрации прогестерона, то в третьем триместре происходит перераспределение кровоснабжения матки. Ее стенки имеют очень скудное кровоснабжение, большая часть которого направлена плоду. В этих условиях миоматозные узлы часто «погибают», — поясняет Дмитрий Лубнин.
По словам Бориса Боброва, при миоме часто неоправданно назначают гистерэктомию — удаление матки:
Частота с которой в нашей стране пациенткам с миомой рекомендуют удаление матки, совершенно не объяснима с научной точки зрения. Мы — единственная страна в мире, где можно всерьез услышать от гинеколога нечто вроде: «Ну, смотрите, матка с миомой уже больше 12 недель, значит, нужно удалять матку». Это не базируется ни на каких научных данных. Опыт наблюдения за гинекологическими стационарами показывает, что около ¾ операций, которые там проводятся, — удаление матки. Рискну сделать осторожное предположение, что многие из этих операций, скорее всего, не были показаны.
Профилактика
Никакой специфической профилактики этого заболевания, основанной на данных научных исследований, не существует. Дмитрий Лубнин рекомендует женщинам старше 20 лет ежегодно проходить УЗИ, чтобы выявить возможную проблему на ранней стадии. Однако подчеркнем, что эта информация является мнением специалиста: никаких официально рекомендованных скрининговых программ, выявляющих миому матки, сейчас не существует.
8 самых популярных вопросов про миому матки
Главная / Статьи / 8 самых популярных вопросов про миому матки
Продолжаем собирать вопросы, которые чаще всего задают пациенты на приеме врачу на определенную тему по гинекологии. Сегодня на них отвечает врач гинеколог-эндокринолог Комарская Татьяна Александровна.
Миома матки можно ли забеременеть?
К ответу на этот вопрос нужно подходить дифференцированно. Однозначно ответить нельзя. При определенных ситуациях миома мешает забеременеть, при других нет.
В каких случаях миома матки препятствует имплантации и вынашиванию беременности:
Какая миома не мешает беременности:
Каким способом удаляют миому матки?
Хирургические методы лечения применяют строго по показаниям. Наличие самой миомы не повод чтобы идти на операцию. Если все же на удаление миомы отправил врач, то выбор будет стоять между следующими гинекологическими операциями:
Лапароскопическая миомэктомия
Щадящая операция. Делается без абдоминального разреза. В области пупка и овздошных костей делаются надрезы размером 2 см. Через них в живот вводятся трубки с видеокамерой и резектоскопом. Под контролем зрения врач вылущивает все видимые узлы на матке.
Гистерэктомия (надвлагалищная ампутация маки)
Может выполнятся лапароскопическим доступом если размеры миомы не превышают 12 недель или класическим способом путем рассечения передней брюшной стенки. Во время операции удаляется матка с миоматозными узлами, остается только шейка матки.
Через 10 дней пациентку выписывают со стационара, дальнейшее полное востановление организма занимает 30 дней.
Минус в том, что детородная функция полностью теряется. Плюс практически нет риска рецидива опухоли.
Пангистерэктомия (экстерпация матки)
Имеется несколько техник ее выполнения влагалищный доступ, разрез через переднюю брюшную стенку, лапароскопическим путем. При операции удаляется матка с опухолью в том числе и шейка матки. Современные хирурги рекомендуют именно этот объем оперативного лечения пациенткам старшей возрастной группы после 40 лет. При такой операции нет риска появления узлов в культе шейки матки и необходимости в повторном оперативном лечении, а также это одновременно, и профилактика рака шейки матки.
ЭМА эмболизация маточных артерий
В сосуд, питающий миоматозный узел вводится специальное вещество которое блокирует поступление крови к опухоли. Без питания миоматозный узел отмирает и уменьшатся в размерах. Такую процедуру предпочитают проводить пациенткам молодого возраста, для которых крайне важно сохранить репродуктивную функцию, при условии, что миоматозные узлы единичные.
При каких размерах удаляют миому матки?
Если размеры матки превышают 12 недель или узел превышает 5 см. такую миому гинекологи рекомендуют удалять. Оперативное лечение требуется и в других ситуациях, когда размеры миомы намного меньше. Если у женщины узел 2 см. расположен под слизистой и сопровождается обильными кровотечениями, это тоже показание для операции. Или узел один небольших размеров 3-4 мм. растет в сторону полости матки он становится причиной того что беременность не наступает, это тоже повод для хирургического лечения.
Когда делать УЗИ при миоме матки?
Ультразвуковой контроль проводится при миоме ежегодно. Исследование необходимо делать для контроля роста опухоли. Если на УЗИ рост узла составляет за год более 10 мм. то контрольные исследования назначаются чаще 2-4 раза в год. При себе необходимо всегда иметь последние заключения УЗИ для оценки динамики роста. Желательно делать УЗИ у одного и того же специалиста и на одном и том же аппарате для исключения погрешности измерений.
Когда начинаются месячные после удаления миомы матки?
После консервативной миом эктомии, когда удаляются только узлы на матке, месячные после операции приходят в срок. Конечно сбиться цикл может и менструация может прийти либо раньше либо задержаться на 14 дней. Но в целом менструальный цикл не нарушается.
Если выполнялась операция с удалением тела матки, то как таковые месячные пропадают. В дни менструального цикла могут быть скудные кровянистые выделения.
Какая миома матки считается большой?
Если говорить о медицинской классификации когда врач пишет в диагнозе, что миома матки большая то отметим два критерия на которые он опирается:
После удаления миомы матки можно ли загорать?
Часто мы слышим от пациентов, что им врач запретил загорать так как у него есть миома. Это одно из самых глубоких заблуждений врачей идущее из медицинских взглядов которые были 20 лет назад. Достоверно известно, что ультрафиолетовые лучи не влияют на рост клеток миомы. Это гормонально зависимая опухоль. У нее много рецепторов к женским половым гормонам именно поэтому изменение гормонального фона является основным фактором ее роста. Поэтому нет смысла ограничивать женщин с миомой и запрещать нежится под лучами солнца. Ведь солнышко синтезирует в организме витамин Д основной элемент для укрепления иммунитета.
Можно ли ставить спираль при миоме матки?
Сама по себе миома не является противопоказанием для установки спирали. Этот метод контрацепции подойдет если узлы небольшие, не вызывают изменения формы полости матки и отсутствует подслизистый узел.
Если узлы более 2 см. но менее 5 см. и нет деформации полости рекомендуют ставить спираль Мирена. Это гормональная система высвобождающая микро дозы гормона действуя на миометрий приводит к торможению роста узлов. На фоне гормональной ВМС миома уменьшается в размере и новые узлы не появляются.
Абсолютно не допустимо введение спирали если есть субмукозные узлы или общий размер матки превышает 10 недель беременности соответственно.
Литература
Неоперативные методы лечения миомы матки
Лейомиома матки — одно из самых распространенных заболеваний у женщин, однако, несмотря на успехи в диагностике миомы матки, до настоящего времени не существует «золотого» стандарта лечения, что обусловлено как нерешенными проблемами патогенеза миомы матк
Лейомиома матки — одно из самых распространенных заболеваний у женщин, однако, несмотря на успехи в диагностике миомы матки, до настоящего времени не существует «золотого» стандарта лечения, что обусловлено как нерешенными проблемами патогенеза миомы матки, так и традиционно сложившимися представлениями «о бесполезности» матки при реализованной репродуктивной функции. Поэтому наиболее распространенным методом лечения миомы матки остается гистерэктомия. Подобный радикализм у большинства больных не обоснован, поскольку практически отсутствует риск озлокачествления и отмечается прогресс в появлении методов, тормозящих рост опухоли и вызывающих регресс симптомов заболевания [1, 4] Использование малоинвазивных и неинвазивных методов лечения на ранних этапах развития миомы матки позволяет остановить развитие заболевания, привести к его регрессу и не допустить в дальнейшем нарушения репродуктивной функции [2, 3].
Эпидемиология. Факторы риска
Частота возникновения миомы матки составляет 15–17% у женщин старше 30 лет и 30–35% у женщин, достигших пременопаузального возраста [1, 5]. Однако в последние годы наблюдается тенденция к «омоложению» миомы матки — возникновение ее у женщин до 30 лет, что обусловлено как совершенствованием диагностики, так и широким распространением «агрессивных» акушерских и гинекологических вмешательств. Частое сочетание миомы матки с доброкачественными заболеваниями эндометрия, эндометриозом осложняет течение заболевания и затрудняет тактику лечения.
Средний возраст выявления миомы матки составляет 32,8 ± 0,47 года, а показания к активному хирургическому лечению появляются примерно к 45 годам. Установлено, что развитие этой опухоли занимает в среднем 5 лет и в 84% случаев узлы являются множественными [1, 5,].
Эпидемиологические исследования выявили ряд факторов риска развития этой опухоли — этнические, генетические, паритет, вредные привычки, питание [1, 7]. У афро-американских женщин встречаемость миомы матки самая высокая, причем возникают в более молодом возрасте, достигают больших размеров и частота анемий выше, особенно по сравнению с кавказскими и азиатскими женщинами. Объяснением служит повышенный уровень циркулирующих эстрогенов по сравнению с женщинами другой расы.
Исследования близнецов и семей выявили генетический фактор риска [1]. Так, вероятность развития этой опухоли значительно выше и возникает в более молодом возрасте у женщин, матери и/или сестры которых страдали этим заболеванием. Недавно был определен фактор наследственности, как предполагают, играющий роль в этиологии опухоли матки. Хотя 50–60% миом матки являются кариотипически нормальными, однако часто встречаются аберрации, которые затрагивают хромосомы 6, 7, 12 и 14 (Gross K. L., 2001). Перестройки в этих хромосомах последовательно влияют на две недавно обнаруженные группы генов белка — HMGIC и HMGIY. Они кодируют те белки, которые, вероятно, играют роль в транскрипции и могут играть свою роль в аномальном росте миом. Однако, несмотря на доказательство наследования, не выявлено, какие именно генные мутации могут привести к развитию данного заболевания, а следовательно, не существует и превентивных мер.
Отсутствие детей и раннее наступление менархе повышает в 2–3 раза риск развития миомы. Причем степень уменьшения риска тем выше, чем больше детей в семье, — так у женщин с тремя доношенными беременностями риск снижается на 50–90%, хотя не выявлено никакой корреляции между возрастом при первых родах и миомами, а также для женщин 45 лет и старше защитный эффект parity не столь очевиден [7]. Объяснить это можно либо более высокой степенью риска вследствие более длительного периода с момента последних родов, либо более длительного периода воздействия стероидных гормонов в целом. Противоречивы данные о действии оральных контрацептивов. Однако в большинстве работ доказано, что применение оральных контрацептивов не повышает риск развития миомы матки. Так же как и нет никаких доказательств увеличения роста и количества миоматозных узлов на фоне приема заместительной гормональной терапии (ЗГТ) (Luoto R., 2002).
Избыточный вес, особенно в сочетании с низкой физической активностью на фоне хронического стресса, повышает риск миомы матки в 2–3 раза, причем прибавка веса после 18 лет влияет более значительно, чем ожирение в детском и пубертатном возрасте. Это объясняется повышенной периферической конверсией в жировых клетках андрогенов в эстрогены под воздействием ароматазы и более высокой биодоступностью факторов роста, типа инсулиноподобного фактора роста-1 (ИПФР-1).
Не выявлено корреляций с курением, хотя теоретически курение могло бы снижать риск миомы матки, поскольку напоминает состояние, характерное для относительного дефицита эстрогена, т. е. с характерными признаками остеопороза, ранней менопаузой и более низкими показателями рака эндометрия [5]. Однако данные, которыми мы располагаем сегодня, достаточно противоречивы, и только некоторые исследователи отмечают среди курильщиц уменьшение риска на 30–50% [1, 16].
Аналогии между опухолями гладкой мускулатуры и атеросклеротическими бляшками и, следовательно, возможную корреляцию между атерогенными факторами и риском миомы матки изучали Faerstein et al. Исследователи зафиксировали увеличение риска миом в 2,1 раза у пациенток до 35 лет с артериальной гипертензией, принимающих гипотензивную терапию дольше пяти лет и при длительности заболевания не менее пяти лет.
Таким образом, дальнейшие исследования, особенно посвященные цитогенетическим и молекулярным аспектам миом, приведут нас к определению тех генетических локусов, которые играют важную роль в индуцировании данных опухолей.
Патоморфология. Патогенез
Лейомиома матки представляет собой доброкачественную опухоль моноклонального происхождения, развивающуюся из гладкомышечных клеток и содержащую различное количество волокнистой соединительной ткани. Большинство ученых считают, что миома матки соответствует критериям истинной опухоли, о чем свидетельствуют: моноклональный характер развития миомы (как и большинство опухолей, в том числе и злокачественных), большие размеры и автономный рост опухоли, обусловленный воздействием факторов роста и цитокинов, активизация процесса неоангиогенеза, генетическая нестабильность (до 40% миом имеют генетические нарушения), т. е. вследствие мутаций уменьшается точность воспроизведения генетического аппарата, нарушается механизм репарации ДНК, изменяется регуляция клеточного цикла в поврежденных клетках, что приводит к неуклонной опухолевой прогрессии [1, 4, 25].
По мнению большинства ученых, миомы возникают в результате множественных соматических мутаций в нормальных клетках миометрия, что ведет к постепенному снижению регуляции их роста. Опухоль растет из клетки-прародительницы, в которой произошла первоначальная мутация и является следствием нарушения тканевого гомеостаза, поддерживаемого балансом клеточной пролиферации и апоптоза. В последнее десятилетие установлено, что образование и рост опухоли связаны с изменениями сложных взаимодействий между стероидными гормонами и их рецепторами, местными факторами роста и состоянием внеклеточного матрикса [20, 25, 12].
В настоящее время наибольшее подтверждение находит теория Fujii S., согласно которой развитие гладкомышечных клеток мезодермального происхождения происходит на эмбриональном этапе длительно: от 14 до 30 недель внутриутробного периода развития. Поэтому эти еще недифференцированные клетки за счет длительного периода внутриутробного развития могут подвергаться воздействию многочисленных факторов из организма матери (тропных гормонов, половых стероидов, факторов роста) и окружающей среды. Эти клетки-предшественники (уже с соматическими мутациями) сохраняются в миометрии и начинают расти после менархе. Их рост продолжается в течение многих лет на фоне выраженной активности яичников под действием как эстрогенов, так и прогестерона [12, 20, 27].
Также возможен и другой путь образования клеток-предшественников, при котором неопластическая трансформация миометрия может происходить в результате соматических мутаций нормального миометрия под влиянием половых стероидов и факторов роста. Однако молекулярные изменения, инициирующие эту трансформацию, до конца неизвестны.
Этиология и патофизиология остаются малопонятными, хотя к настоящему времени и определены основные молекулярно-генетические детерминанты возникновения этого заболевания. К ним относятся цитогенетические нарушения, изменения половых стероидов и гормональной чувствительности тканей, нарушение процесса ангиогенеза. В ткани миоматозных узлов в 40–50% имеются опухоль-специфические дефекты хромосом, определяемые кариотипически, что подтверждает роль генетических механизмов в росте и развитии миомы матки. Согласно современным представлениям, рост миомы происходит главным образом за счет пролиферации, стимулированной половыми стероидами через факторы роста по аутокринно-паракринному механизму, при относительно низкой готовности опухолевых клеток к апоптозу.
Несомненно, миома матки является гормонозависимой опухолью. До настоящего времени не известны механизмы, запускающие рост опухоли, но несомненна центральная роль половых стероидов — эстрогенов, прогестерона и их рецепторов в моделировании роста, дифференцировки и функции миометрия. Известно, что ключевую роль в контроле роста и развития миоматозных узлов играют эстрогены. Подтверждением этому служит повышенный уровень экспрессии эстрогеновых рецепторов в ткани узлов, по сравнению с неизмененным миометрием [8], а также стимулирующий эффект эстрогенов на синтез ДНК и клеточную пролиферацию в тканях матки. Также имеются данные о повышении уровня антигена клеточной пролиферации Ki-67 в нормальном миометрии [11] и усиление роста миомы матки преимущественно в лютеиновую фазу [20], что подтверждает роль прогестерона в индуцировании митогенного эффекта факторов роста. Очевидно, влияние эстрогенов и прогестерона комплементарны, т. е. эстроген создает условия для стимуляции пролиферации прогестероном [13]. Это подтверждается и работами, в которых прогестерон вызывает увеличение экспресии PCNA и эпидермального фактора роста в клетках миомы, тогда как эстрадиол в тех же клетках увеличивает экспрессии PCNA и ЭФР-рецептора [25, 11]. Следовательно, сочетанное действие эстрадиола и прогестерона стимулирует пролиферативный потенциал клеток миомы.
Другим потенциальным механизмом образования миомы матки является торможение механизмов апоптоза [12, 17]. В многочисленных работах доказано влияние половых стероидов не только на пролиферативные процессы, но и на регуляцию апоптоза в миометрии. Установлено, что протеин Bcl-2, тормозящий апоптоз, значительно меньше экспрессируется при лейомиоме по сравнению с нормальным миометрием. Причем эстрадиол, подавляя экспрессию этого протеина, снижает апоптоз.
Таким образом, развитие пролиферативных процессов, к которым относится и лейомиома матки, обусловлено не только повышенной пролиферацией клеток, но, возможно, и ослаблением индукции апоптоза.
В реализации влияния половых стероидов участвуют местные ауто- и паракринные факторы (факторы роста, цитокины и др.), продукция которых находится под контролем эстрогенов и прогестерона. Митогенное действие эстрогенов опосредовано местными регулирующими ростовыми факторами. Результатом их избыточной продукции является ускорение клеточной пролиферации, гипертрофия клеток, увеличение объема межклеточного матрикса, и нередко отмечается сочетание этих явлении [8]. Наиболее значимыми факторами роста для миомы являются трансформирующий фактор роста-бета (ТФР-бета), стимулирующее влияние на продукцию которого оказывает также и прогестерон. Эстрогены действуют и на межклеточный матрикс, оказывая непосредственное стимулирующее влияние на коллаген типа I и III и протеин коннексин-43 щелевидных межклеточных контактов [14].
Таким образом, стероидные гормоны могут оказывать стимулирующее влияние на пролиферацию опухолевой ткани путем воздействия и на местные факторы роста, продуцируемые гладкомышечными клетками и фибробластами [14, 25]. Влияние медиаторов различных факторов клеточного роста, также как и половых стероидов, осуществляется через клеточные рецепторы, концентрация и чувствительность которых играют важную роль в регуляции опухолевого роста. Основными модуляторами клеточного роста, обладающими выраженными митогенными свойствами на миометрий и ткань миомы, являются ИПФР-1, эпидермальный фактор роста (ЭФР), ТФР-бета и группа ангиогенных факторов роста. В настоящее время ангиогенез рассматривается как ключевой фактор в развитии опухолевых процессов. Это касается и роли ангиогенеза в патогенезе миомы матки. Основными индукторами процесса ангиогенеза являются сосудистый эндотелиальный фактор роста (СЭФР-А), ангиогенин и основной фактор роста фибробластов (ФРФ-2).
Противоположным действием на ангиогенез и, следовательно, ограничивающим рост опухолевой ткани обладают ингибиторы ангиогенеза. Одним из основных является эндостатин, который является не только мощным ингибитором ангиогенеза, но и специфическим ингибитором пролиферации клеток эндотелия. СЭФР — является важнейшим фактором, определяющим процессы образования новых сосудов и повышенную сосудистую проницаемость. Гипоксия ткани внутри миоматозного узла стимулирует экспрессию СЭФР и, таким образом, вызывает отек узла, что обусловлено способностью СЭФР повышать проницаемость сосудов [38]. Экспрессия СЭФР в тканях матки и яичников может регулироваться гормональным путем — половыми стероидами. Следует отметить, что ТФР-бета и ФРФ могут являться и факторами, модулирующими рост сосудов; ФРФ являются потенциальными митогенами, в то время как ТФР-бета — выраженный ингибитор пролиферации клеток эндотелия. Полагают, что ФРФ стимулируют ангиогенез, непосредственно воздействуя на эндотелиальные клетки, в то время как ТФР-бета оказывает опосредованное непрямое влияние, стимулируя другие клеточные типы к выделению факторов, стимулирующих клетки эндотелия.
Процессы ангиогенеза в миомах неразрывно связаны с морфогенезом этих опухолей и в значительной степени определяют особенности возникновения, характер роста и клинико-морфологические варианты (простая и пролиферирующая миома матки), и, по мнению ряда авторов, методы лечения миомы матки в перспективе должны быть связаны с возможностью воздействия на процессы ангиогенеза [6, 14].
Следовательно, половые стероиды осуществляют регуляцию роста миомы посредством комплекса факторов, регулирующих пролиферацию, апоптоз и ангиогенез в опухолевой ткани.
Таким образом, многочисленные исследования, посвященные патогенезу данного заболевания, выявили ряд факторов роста и рецепторов, влияющих на пролиферацию гладкомышечных клеток, апоптоз, продукцию межклеточного вещества, на пролиферацию и миграцию эндотелиоцитов, играющих важную роль в процессе развития опухоли. Полученные научные данные внесли не только определенную ясность в понимание механизмов влияния половых стероидов на рост миомы матки, но наметили новые направления в медикаментозном лечении.
Диагностика. Клиника
Основными инструментальными методами диагностики миомы матки являются ультразвуковое исследование (УЗИ), значительно реже — компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). В последние два десятилетия гистероскопия и лапароскопия обеспечили новый метод диагностики и лечения миомы матки. Информативным методом распознавания субмукозной и интерстициальной с центропетальным ростом миомы матки является гистероскопия (точность достигает 99,2%). Достоинство метода — возможность одновременной биопсии эндометрия, с целью диагностики сопутствующих гиперпластических процессов. Лапароскопия используется преимущественно при необходимости дифференциальной диагностики миомы и опухоли яичника, а также для распознавания вторичных изменений в миоматозных узлах, являющихся противопоказанием к консервативной терапии.
У половины пациентов болезнь протекает бессимптомно и диагностируется только при гинекологическом или ультразвуковом исследовании. Но у каждой второй женщины возникают симптомы заболевания, которые ухудшают качество жизни и требуют лечения. Симптомы зависят от количества, размеров и расположения миоматозных узлов, а также от степени вторичных дегенеративных и воспалительных изменений в ткани узлов. Основные симптомы лейомиомы матки: 1) обильные, длительные менструации и/или ациклические кровотечения, которые сопровождаются слабостью, утомляемостью, приводят к развитию железодефицитной анемии, 2) тянущие боли внизу живота (у 20–30% больных), очень редко возникают острые боли, связанные с нарушением кровотока в миоматозных узлах, и сопровождаются повышением температуры, слабостью, 3) при больших размерах лейомиомы матки может происходить давление на соседние органы: мочевой пузырь, прямую кишку, что проявляется учащенным мочеиспусканием, запорами, 4) бесплодие, невынашивание беременности, осложнения во время родов наблюдаются у каждой третьей пациентки с множественными миомами.
Тактика ведения
Несмотря на то, что миома матки является наиболее часто выявляемым заболеванием, в тактике ведения больных данной патологией остается много нерешенных вопросов и противоречий. В разных странах имеются различные подходы к лечению заболевания, отличаются и показания к радикальным операциям. Тактика ведения больных миомой матки включает три основных направления: выжидательное, консервативное и активное воздействие на опухоль.
Выжидательное ведение больных с миомой матки возможно только при отсутствии симптоматики и небольших по размеру (до 10–12 недель) опухолях при реализованной репродуктивной функции и заключается в активном амбулаторном наблюдении: динамическое ультразвуковое исследование, цитологический контроль состояния эпителия шейки матки и эндометрия, определение уровня онкомаркеров. Однако, учитывая частоту встречаемости сопутствующей патологии при миоме матки, только у небольшого числа пациентов мы можем ограничиться выжидательной тактикой ведения.
Консервативное ведение больных миомой матки заключается преимущественно в гормональном лечении, хотя в последние годы предложены противофибротические средства, антиангиогенные, аналоги соматостатина (в настоящий момент эти препараты находятся на стадии клинических испытаний). Среди гормональных препаратов несомненное лидерство принадлежит аналогам гонадолиберина и антигестагенному препарату — мифепристону (RU 486). Эти препараты используются как в качестве самостоятельного лечения, показания к которому четко определены, так и в качестве адъювантной терапии, имеющей определенные преимущества и недостатки.
Активная тактика ведения больных с миомой матки делится на два основных направления: хирургическое лечение и малоинвазивные вмешательства. Хирургический метод продолжает оставаться основным методом лечения данной категории больных — до 80% больных подвергаются гистерэктомии или миомэктомии. Однако многие женщины в наше время стремятся отложить деторождение на более поздний возраст, когда, к сожалению, значительно чаще развивается лейомиома матки. Поэтому совершенствование медикаментозного лечения и малоинвазивных, органосохраняющих технологий является основной тенденцией в современных условиях.
Методы лечения
Поиск и применение новых лекарственных средств и малоинвазивных технологий, приближающихся по эффективности к гистерэктомии и не вызывающих побочных эффектов, является альтернативным лечением миомы матки.
В настоящее время можно выделить три основных подхода к лечению миомы матки.
Традиционно терапевтическое лечение миомы матки основывается на воспроизведении медикаментозной псевдоменопаузы и/или индукции гипоэстрогении. Медикаментозная терапия в качестве монотерапии, как правило, назначается пациенткам при бессимптомном течении заболевания и при небольших (соответствующих менее 12 нед беременности) размерах опухоли [1, 15, 16). На протяжении довольно длительного времени использовались гестагены: норэтистерон (Норколут, Примолют-нор), дидрогестерон (Дюфастон) и др. Однако результаты лечения были малоэффективны. Основываясь на прогестероновой гипотезе развития миомы матки, малоэффективные результаты лечения производными прогестерона вполне объяснимы. В настоящее время применение гестагенов оправдано только при сочетании миомы матки (небольших размеров) с гиперпластическими процессами эндометрия и аденомиозом у женщин позднего репродуктивного или пременопаузального периода при постоянном динамическом наблюдении. Современное медикаментозное лечение включает применение агонистов гонадотропин-релизинг гормона (аГн-РГ) либо в качестве долгосрочной монотерапии, либо как этап комбинированного метода [15, 16].
Однако при несомненной эффективности этих препаратов, даже при минимальном курсе лечения (3–4 месяца), они обладают выраженным побочным действием, связанным с развитием эстроген-дефицитного состояния. Механизм действия этих препаратов заключается в подавления гонадотропной функции гипофиза, вследствие которой развивается гипоэстрогения и блокада продукции прогестерона. Очевидно, агонисты гонадолиберина действуют непосредственно и на опухолевую ткань, что подтверждается наличием рецепторов к гонадолиберину, снижением уровня рецепторов к эпидермальному фактору роста, подавлением продукции ТФР-бета и пролактина непосредственно в ткани лейомиомы матки (при лечении этими препаратами). Возможна также непосредственная стимуляция аналогами гонадолиберина процессов апоптоза в опухолевой ткани, что подтверждается повышением экспрессии рецепторов Fas и их лигандов (маркеры апоптоза). Десенситизация гипофиза и подавление функции яичников приводят к уменьшению объема матки и лейомиомы примерно на 50–65% и прекращению меноррагий, благодаря развитию аменореи, что позволяет скорректировать анемию до операции. Оптимальным режимом введения данных препаратов является короткий 3–4-месячный курс с ежемесячными инъекциями. Важной особенностью действия аГн-РГ является снижение кровоснабжения узлов, что стимулирует процесс апоптоза, а также уменьшает кровопотерю и сокращает длительность оперативного вмешательства. Побочные эффекты аГн-РГ связаны с гипоэстрогенией, проявляющейся вазомоторными симптомами, снижением минеральной плотности костной ткани, что ограничивает длительность приема и требует корригирующей терапии.
Принципиально новым препаратом, применяемым при лечении больных с миомой матки, является антипрогестин — мифепристон. Мифепристон — это синтетический стероид, обладающий одновременно антипрогестероновой и антиглюкокортикоидной активностью. Механизм действия заключается в связывании с прогестероновыми рецепторами, вследствие чего блокируется их функция. Суточная доза препарата — 50 мг в течение трех месяцев перорально, непрерывно. Эффективность препарата сравнима с эффективностью аналогов гонадолиберина — на 40–49% уменьшаются размеры матки и узлов. Основная особенность действия этого препарата — отсутствие гипоэстрогении, поэтому не наблюдается ни вазомоторных симптомов, ни снижения минеральной плотности костной ткани. У большинства женщин с миомой матки развивается аменорея при 3-месячном и более длительном курсе лечения. Первоначально мифепристон у больных с миомой матки применялся в качестве предоперационной подготовки, что являлось вполне обоснованным, так как при минимальных побочных эффектах (слабые приливы, тошнота) удается добиться снижения размеров опухоли и уменьшения менометроррагий. В настоящее время проводятся научные исследования по применению этого препарата и в качестве единственного метода лечебного воздействия в более длительном режиме [10, 22, 23].
Недавно предложены совершенно новые подходы к лечению миомы матки — блокирование действия специфических факторов роста [16, 28]. Действие одной группы препаратов (так называемая антифибротическая терапия) основывается на том, что лейомиомы содержат большое количество внеклеточного матрикса, состоящего из фибронектина, коллагена типа 1, 3 и протеогликанов. Доказано, что ТФР-бета и ФРФ увеличивают продукцию межклеточного вещества гладкомышечными клетками и снижают образование коллагеназы. Пирфенидон — антифиброзный препарат, ингибирует синтез ДНК, клеточную пролиферацию и продукцию коллагена в гладкомышечных клетках лейомиомы и нормального миометрия, вызванную вышеназванными факторами роста. Этот препарат обладает дозозависимым действием, минимальным количеством побочных эффектов и не оказывают токсического воздействия на гладкомышечные клетки. (В настоящее время проводятся клинические испытания.)
Действие другой группы препаратов основывается на ингибировании ангиогенеза [6, 14, 16]. Несколько факторов роста принимают участие в процессе ангиогенеза: ФРФ, ТФР, СЭФР (последний является важнейшим, так как синтезируется большинством линий опухолевых клеток и обладает многосторонним влиянием). Двумя основными механизмами эти факторы роста индуцируют рост лейомиомы матки: первый — усиление пролиферации, миграции гладкомышечных клеток сосудов и эндотелиоцитов; второй — стимуляция формирования кровеносных сосудов. Пока только единственный препарат, обладающий ингибирующим влиянием на ангиогенез, — интерферон-альфа прошел клиническое испытание на 20 больных с лейомиомой матки. Показано достоверное уменьшение объема образования уже после первой недели лечения. Таким образом, ингибирование ангиогенеза, посредством воздействия на перечисленные факторы роста, представляет собой одну из наиболее перспективных стратегий лечения лейомиомы матки.
Следовательно, для большинства пациентов более привлекательным остается медикаментозное лечение в качестве единственного метода. Поэтому поиск новых лекарственных средств, позволяющих избежать оперативное вмешательство и в то же время не приводящих к выраженным побочным эффектам, поможет решить важную проблему женского здоровья.
Другим направлением в органосберегающих методах лечения миомы матки, которые бы при высокой эффективности обладали и максимальной (достаточной) безопасностью, стала разработка в конце 90-х годов нового неинвазивного хирургического метода, который получил название «Неинвазивная абляция миомы матки воздействием фокусированного ультразвука (ФУЗ) под контролем ядерно-магнитно-резонансной томографии».
Об эффективности и безопасности ФУЗ-МРТ-абляции сообщали C. M. Tempany и соавт. (2000), Rabinovici J. и соавт. (2002), а Jolesz F. A., Hynynen K. (2002) назвали метод ФУЗ «идеальной операцией». Технология ФУЗ-МРТ представляет собой сочетание высокоинтенсивного фокусированного ультразвука, луч которого неинвазивно нагревает выбранные участки ткани миомы и вызывает их термический некроз, и магнитно-резонансной томографии. Звуковые волны проходят сквозь ткани, не вызывая их повреждения, и за счет фокусировки волн происходит локальный нагрев ткани миомы до 55–90 °С, что вызывает термическую коагуляцию в четко ограниченной области, не оказывая никакого вредного воздействия на окружающие ткани, т. е. ФУЗ-МРТ-абляция обеспечивает локальный селективный коагуляционный некроз в малом объеме ткани (в точке фокуса), что используется для прецизионной неинвазивной абляции опухолей.
Процесс лечения состоит в последовательных воздействиях (так называемых соникаций) на небольшие фрагменты опухоли, что приводит к нагреванию их и селективному коагуляционному некрозу. Механизм действия ФУЗ-абляции включает как прямое, так и опосредованное повреждающее воздействие. Прямое — это термическое воздействие за счет высвобождения энергии звуковой волны. Опосредованное — за счет изменения локального кровотока и нарушения питания опухолевой ткани. Доказано, что при нагревании ткани до 60 °С в течение 1 секунды происходит гибель всех клеток за счет их дегидратации, повреждения сосудистых структур, денатурации белков и разрушения коллагеновых волокон. Иммуногистохимические исследования показали, что данный метод вызывает летальное или сублетальное повреждение опухолевой ткани и исчезновение ее пролиферативной активности, при этом избирательность воздействия и полная безопасность ФУЗ для интактных тканей, окружающих миому, обусловлены также разницей в перфузии крови в миоматозном узле по сравнению с нормальным миометрием и преимущественным расположением сосудов по периферии узла миомы.
ФУЗ-МРТ-абляция особенно эффективна для лечения миомы матки вследствие высокого содержания экстрацеллюлярного матрикса, хорошо поглощающего тепло. Для доброкачественной опухоли нет необходимости элиминации каждой ее клетки, поэтому достаточно произвести коагуляцию в отдельных точках внутри миомы, что позволяет сократить объем миоматозных узлов и матки и тем самым уменьшить меноррагии, боли и давление на соседние органы малого таза, значительно улучшить качество жизни.
Продолжительность процедуры ФУЗ-абляции зависит от объема и количества узлов и в среднем составляет 3–4 часа. Эта процедура проводится амбулаторно, без общей анестезии, во время нее пациентка находится в сознании. После лечения пациентки обычно наблюдаются в стационаре в течение двух часов, что обусловлено только периодом действия седативных препаратов премедикации, и на следующий день уже трудоспособны.
Показаниями к ФУЗ-МРТ-абляции миомы матки являются: меноррагии, болевой синдром, симптомы сдавления соседних органов, размеры миоматозных узлов от 2 до 15 см, интерстициально-субсерозные, интерстициальные и интерстициально-субмукозные узлы, при количестве миоматозных узлов не более 5.
Противопоказаниями для ФУЗ-МРТ-абляции миомы следующие: субсерозные миомы на ножке, сочетанная гинекологическая патология — воспалительные процессы в малом тазу, бесплодие, образования в яичниках, гиперплазия эндометрия; онкологические заболевания, нереализованная репродуктивная функция, размеры миоматозных узлов менее 2 см, выраженное retroflexio-versio матки, грубые послеоперационные рубцы на передней брюшной стенке, ожирение II–III степени, тяжелые аллергические реакции на контрастные вещества, а также клаустрофобия, наличие крупных ферромагнитных имплантантов, наличие искусственных водителей ритма сердца (противопоказания для проведения МРТ).
Индивидуализация применения ФУЗ-МРТ-абляции миомы матки заключается в определении «доступности» миоматозных узлов для фокусированного ультразвука (предпочтительна локализация узлов по передней стенке и в дне матки), определении МРТ-типов миомы, необходимости проведения дополнительных манипуляций (висцеральный массаж, наполнение мочевого пузыря физиологическим раствором и т. д.), при этом интраоперационная эффективность ФУЗ-МРТ-абляции миомы снижается.
Обычно проводится либо «малая» процедура, при которой абляции подвергается около 30–35% объема миоматозного узла, либо «большая» — коагулируется не менее 70% объема. После «малой» процедуры не происходит значительного уменьшения размеров опухоли, тем не менее в 80% случаев отмечается значительная положительная динамика, исчезновение жалоб, болей и прекращение кровотечений. Кроме того, снижается пролиферативная активность миомы, и рост узлов прекращается. Это объясняется уменьшением плотности ткани после ФУЗ-МРТ-абляции — узлы становятся более «мягкими» и не оказывают выраженного давления на окружающие ткани. В настоящее время проводится лечение миом матки диаметром до 9 см, а в случае большого размера миомы — предварительная гормональная терапия в течение трех месяцев, с целью сокращения узлов и возможности проведения процедуры. Группой исследователей из США изучена безопасность и эффективность операций фокусированным ультразвуком под контролем МРТ для неинвазивного лечения лейомиомы матки [3, 24]. Согласно этим данным происходит уменьшение миомы через 3 мес на 37%, через 6 мес на 48% [19, 24]. За последние 2 года получено 30 беременностей у женщин, перенесших ФУЗ-МРТ-абляцию миомы матки и 13 родов без осложнений [26]. Среди осложнений ФУЗ-МРТ-абляции выделяют незначительную воспалительную реакцию (субфебрильная температура) и ожог I степени.
Таким образом, ФУЗ-МРТ-абляция имеет определенные преимущества по сравнению с малоинвазивными и инвазивными методами лечения: