Казеин igg и ige в чем разница
Казеин igg и ige в чем разница
В большинстве случаев повышенная чувствительность к пищевым аллергенам связана с иммунными механизмами, участие в которых принимают именно иммуноглобулины класса Е (IgE), что приводит к немедленным (анафилактическим) реакциям. При этом существует большое количество аллергических реакций, при которых не выявляются специфические IgE, что проявляется реакциями непереносимости, в которых участвовали иммуноглобулины класса G (IgG), иммунные комплексы, клеточный иммунитет и неиммунные механизмы (ферментопатии). В случае не-IgE-зависимых реакций пищевой непереносимости возможно выявление в крови IgG к различным пищевым аллергенам. IgG-опосредованные реакции чувствительности к пищевым аллергенам относятся к реакциям замедленного типа и могут проявлять себя после длительного поступления аллергена с пищей. Значение выявления IgG к пищевым аллергенам остается неоднозначным, тем более что интерпретация результатов затруднена тем, что положительный результат может быть вариантом нормы, так как выявленные иммуноглобулины класса G могут выполнять функции блокирующих антител, которые уменьшают выраженность аллергических реакций, протекающих с участием специфических IgE.
Тестирование на IgG-антитела к аллергенам целесообразно проводить в комплексе других исследований или в трудных случаях диагностики пищевой непереносимости, когда исключены другие возможные причины появления симптомов аллергии. Возможно использование результатов теста для индивидуального подбора наиболее рациональной диеты, что может значительно уменьшить проявление симптомов аллергии. Целесообразность выполнения и интерпретацию результатов исследования на IgG к аллергенам необходимо обсуждать с лечащим врачом или врачом-аллергологом.
Специфические иммуноглобулины класса G к казеину, казеиногену.
Синонимы английские
Мг/л (миллиграмм на литр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Казеин – это основной белок молока. Он, в свою очередь, состоит из четырех белков, видонеспецифичен, термостабилен и устойчив к кислому pH. Фракция казеина представляет 80 % всех молочных белков. Так как он не является видоспецифичным белком, при аллергии к нему возможна также повышенная чувствительность к молоку других животных и к сырам (поскольку они содержат казеин). Он не теряет своих свойств при кипячении, поэтому при наличии сенсибилизации именно к этому белку необходимо отказаться как от молока, так и от продуктов, в состав которых оно входит.
Аллергия к казеину может проявляться нарушением функции пищеварительной системы (хейлит, гастрит, колит, гастроэнтерит, синдром раздраженной кишки), кожными патологиями (атопический дерматит, крапивница, отек Квинке) и реже нарушениями функции дыхательной системы (аллергический ринит, бронхиальная астма).
IgG может быть причиной аллергической реакции немедленного или замедленного типа, пищевой непереносимости или других необычных ответов организма на прием пищи. Чаще всего это проявляется после длительного поступления аллергена с едой.
Значение выявления IgG-антител к пищевым аллергенам остается неоднозначным, так как положительный результат может быть вариантом нормы, поэтому важно в комплексе оценивать результаты всех исследований, данные пищевого дневника и анамнез заболевания.
Иммуноглобулины класса G могут служить маркером развития толерантности к пищевым аллергенам. Тестирование на IgG-антитела целесообразно проводить в комплексе с другими исследованиями или в трудных случаях диагностики пищевой непереносимости, когда исключены другие возможные причины появления симптомов аллергии. Возможно использование результатов теста для индивидуального подбора наиболее рациональной диеты, для отслеживания формирования пищевой толерантности.
Для чего используется это исследование?
Когда назначается исследование?
Что означают результаты?
Причины положительного результата:
+ определение специфических иммуноглобулинов класса E к прочим аллергенам
Кто назначает исследование?
Аллерголог, гастроэнтеролог, дерматолог, педиатр, терапевт, врач общей практики.
Лабораторные методы диагностики в аллергологии
Аллергические заболевания – группа заболеваний, характеризующихся комплексом патофизиологических процессов, ключевым звеном которых является избыточная сенсибилизация иммунной системы к определенным этиологическим факторам (аллергенам). У больного с аллергическим заболеванием при первичном контакте с аллергеном происходит образование специфических антител или специфически реагирующих Т-лимфоцитов. При повторном контакте развивается реакция гиперчувствительности, тип которой определяется видом аллергена, локализацией проникновения аллергена в организме, а также рядом внутренних и внешних факторов.
Лабораторная диагностика аллергических заболеваний становится все более важной составляющей комплексного обследования, проводимого врачом-аллергологом. Важным преимуществом такой диагностики аллергических заболеваний является о, что она, в отличие от кожных аллергопроб, практически не имеет противопоказаний к проведению исследования. Взятие крови для анализа безопасно и может быть проведено у людей любого возраста и состояния, в т. ч. у грудных детей и беременных женщин. Лабораторные исследования можно выполнять и в период повышенной сенсибилизации или обострения заболевания, проводить на фоне лечения. В ряде случаев (элиминация конкретного аллергена, анти-IgE терапия) мониторинг лечения проводят при помощи соответствующих лабораторных исследований.
Увеличению роли лабораторной диагностики в аллергологии способствуют объективные причины, связанные со значительным ростом числа аллергических заболеваний и их распространенности. Существенно увеличилось и число аллергенов, которые способны привести к тяжелым клиническим последствиям, в т. ч. новых аллергенов искусственного происхождения. В таких условиях возникает потребность скринингового обследования большого числа людей с подозрением на аллергические заболевания.
Аллергены, вызывающие патологическую иммунную реакцию у пациента, называют причинно-значимыми или причинными аллергенами. Моноаллергенами называют выделенные из причинно-значимого аллергена отдельные вещества (белки, полисахариды, гликопротеиды, металлопротеиды), к эпитопам которых вырабатываются специфические антитела или рецепторы лимфоцитов. Моноаллергены играют большую роль в современной аллергологии, так как в одном причинно-значимом аллергене может содержаться целый комплекс потенциальных моноаллергенных компонентов, но только один или несколько из них будут реальными этиологическими агентами аллергических реакций у конкретного пациента. Для определения специфических антител в наборах реагентов нового поколения используются препараты подобных аллергенов, полученные по технологиям высокой очистки экстракта природного источника или созданные путем биотехнологических процессов. Разработанные новые технологии позволяют провести анализ для выявления сразу большого числа аллергенов одновременно, выполнить скрининговое обследование без подробного выяснения анамнеза. В арсенале многих производителей наборов реагентов для аллергодиагностики тысячи аллергенов, к которым можно определять специфические антитела.
В лабораторной диагностике аллергических заболеваний определяют преимущественно уровень общих IgE-антител и специфических IgE- и IgG4-антител в сыворотке крови к отдельным аллергенам или группам аллергенов природного или искусственного происхождения. IgE-зависимая реакция возникает в течение нескольких минут после контакта с аллергеном, а IgG (IgG4)-зависимая (наиболее часто встречаемая при пищевой аллергии) развивается в более поздние сроки – через часы, иногда даже через несколько суток после контакта с аллергеном.
Показания к исследованию
Методы исследования: Для определения антител (общий IgE, специфические IgE, IgG, IgG4) используют различные иммунохимические методы исследования.
Общий IgE
В норме концентрация суммарных (общих) IgE-антител очень мала и не превышает 0,05% по сравнению с концентрацией IgG-антител. Общее количество IgE-антител начинает возрастать у ребенка после рождения и продолжает расти до 10–14 лет, после чего у здоровых людей стабилизируется на постоянном уровне и снижается после 60 лет. Повышение уровня концентрации общего IgE в крови наблюдается преимущественно при аллергических заболеваниях, развивающихся по механизму реакций гиперчувствительности I типа (атопические заболевания). В большинстве случаев повышение концентрации общих IgE выше 100 U/л у взрослых людей и более 20 U/л у детей до 4 лет может свидетельствовать об аллергическом заболевании.
Помимо аллергических заболеваний, причиной повышения уровня общих IgE могут быть:
Специфические IgE
Определение специфических IgE выполняют при наличии IgE-зависимой пищевой аллергии, а также при невозможности проведения кожных проб, в т. ч. у детей и лиц пожилого возраста, у пациентов с заболеваниями кожи, аллергическими реакциями в анамнезе и др. Интерпретация результатов исследования требует осторожности, заключение должно быть сделано врачом-аллергологом с учетом анамнеза и клинической картины заболевания.
Специфические IgG
В последние годы внимание аллергологов привлекает IgE-независимая пищевая аллергия, иммунопатогенез которой связан с выработкой различных подклассов IgG антител, участвующих в иммунопатологических реакциях с хроническими воспалительными заболеваниями и “скрытыми” формами пищевой аллергии. Для диагностики скрытой пищевой аллергии используют количественное определение подклассов IgG специфических антител (IgG1-IgG4) к индивидуальным антигенам пищевых продуктов. Как и при интерпретации результатов выявления общего и специфических IgE, заключение должно быть сделано врачом-аллергологом с учетом анамнеза и клинической картины заболевания.
Научное расследование. Что показывает ИФА на специфические IgG к пищевым антигенам?
Используемая терминология.
Антиген (англ. antigen от antibody-generator — «производитель антител») — любое вещество, которое организм рассматривает как чужеродное или потенциально опасное и против которого организм обычно начинает вырабатывать собственные антитела (иммунный ответ). Антитела (иммуноглобулины, ИГ, Ig) — белковые соединения плазмы крови, образующиеся в ответ на введение в организм человека бактерий, вирусов, белковых токсинов и других антигенов. Связываясь с активными участками (центрами) бактерий, грибов или вирусов, антитела нейтрализуют выделяемые ими токсические вещества, препятствуют размножению, обеспечивают их разрушение в реакциях фагоцитоза. Гиперчувствительность (hypersensitivity) – повышенная чувствительность организма к определенным веществам — антигенам. Опосредуется специфическими рецепторами или антителами, находящимися в свободном состоянии или связанными с мембранами клеток, участвующих в иммунной защите или иммунном ответе. Может определенное время иметь латентное присутствие и не проявляться клиническими реакциями. Гиперчувствительность связана с количественными характеристиками антигенов, такими как доза (дозозависимость). Чаще гиперчувствительность является основой развития патологических (аномальных) реакций иммунной системы (ИС) на различные антигены. В таком случае гиперчувствительность – это состояние организма, при котором защитные механизмы иммунной системы, направленные на охрану постоянства внутренней среды организма, не справляются с выводом продуктов метаболитов патологических иммунных реакций из организма в условиях включения всех выделительных систем ( почки, легкие, ЖКТ, слюнные железы, кожа).
Гиперчувствительность Тип I — анафилактический тип или немедленный. В иммунном ответе на антиген синтезируются иммуноглобулины класса Е(IgE), они циркулируют в свободном состоянии и далее фиксируются на Fc-рецепторах, расположенных на базофилах, эозинофилах, тучных клетках. Повторные попадания антигена, вызывает его связывание с фиксированными антителами IgE и ответную дегрануляцию клеток с выбросом медиаторов воспаления, прежде всего гистамина.
Пищевая аллергия (food allergy) – проявляется в виде воспалительных реакций по механизмам «гиперчувствительности I типа» иммунной системы на белки или компоненты пищи, опосредованные иммуноглобулинами класса Е (IgE). Гиперчувствительность тип III – иммунокомплексный тип воспалительных реакций. Характеризуется образованием комплексов в составе антиген + специфическое антитело + компонент комплемента в состоянии циркуляции. Антителами выступают специфические иммуноглобулины классов G (IgG), М (IgM), A(IgA). Образующиеся циркулирующие иммунные комплексы должны быть элиминированы из организма с главной целью — выведение антигена. При хронической нагрузке антигенами и при активном их образовании, циркулирующие иммунные комплексы способны фиксироваться на рецепторах эндотелия мелких сосудов и клетках систем элиминации выделительных систем и вызывать воспалительные реакции к разрушенным аутоантигенам (собственным белкам) и структурам организма. Пищевая непереносимость (food intolerance): 1). Патологические реакции, возникающие на пищу или ее ингредиенты в результате генетических факторов и/или нарушения физиологических этапов пищеварения, которые запускают вторичные воспалительные реакции с участием иммунной системы. Вторичные воспалительные реакции (ВВР) развиваются по причинам контроля иммунной системой всех уровней пищеварения с целью обеспечения толерантности к пищевым антигенам. Процессы изменения антигенных характеристик пищевых продуктов нарушают их распознавание ИС на уровне иммунокомпетентных клеток. ВВР сопровождаются изменением соотношения про- и противовоспалительных цитокинов, перестройками регуляторных механизмов, направленных на обеспечение защитных реакций выведения причинных антигенов и восстановление гомеостаза организма. 2). Коммерческий термин, обозначающий суммарный комплекс патологических реакций на пищу, не принимающий во внимание закономерности системного иммунного воспаления. В связи с этим были введены и широко используются различные «тесты на пищевую непереносимость», характерные для определенной фазы взаимодействия пАГ с ИС. Иммуноферментный анализ (ИФА): (англ. Enzyme-Linked Immunosorbent Assay — ELISA) — лабораторный иммунологический метод, в основе которого лежит специфическая реакция «антиген-антитело», а определение образующегося комплекса производится благодаря ферментативной реакции окисления красителя. Чувствительность медицинского теста S1- отражает долю положительных результатов, которые правильно идентифицированы как таковые (иными словами чувствительность диагностического теста показывает вероятность того, что больной субъект будет классифицирован именно как больной), S1 = число больных, классифицируемые как больные/ общее число тестируемых больных.
Специфичность медицинского теста S2 — отражает долю отрицательных результатов, которые правильно идентифицированы как таковые (т.е. вероятность того, что не больные субъекты будут классифицированы именно как не больные), S2 = число здоровых, классифицируемые как здоровые/ общее число здоровых.
Чувствительность метода измерения — характеристика метода в виде наименьшего значения изменения физической величины, начиная с которого может осуществляться её измерение данным средством. Под чувствительностью ИФА понимается та минимальная концентрация определяемого реагента, при которой заметно различие в величине сигнала этой концентрации и образца, заведомо не содержащего определяемого реагента (отрицательный контроль). Эта разница в величине сигналов должна составлять 2 — 3 величины стандартного отклонения (СО) для отрицательного контроля.
Специфичность метода измерения подразумевает безошибочность диагностики именно требуемой физической величины или параметра: если результат ИФА положительный, значит, найдены именно те антитела или антигены, которые предполагались, а не какие-то другие.
Иммунодиетология™ — 1) термин, введенный авторами для обозначения нового направления иммунологии, изучающего различные этапы взаимодействия пищевых антигенов с иммунной системой; 2) зарегистрированный товарный знак (ТМ) компании ООО «Иммунохелс Рус».
Введение.
В конце 20-го века была выдвинута гипотеза, согласно которой при попадании пищи в желудочно-кишечный тракт, пищевые антигены (пАГ) проникают через кишечные стенки (интестинальный барьер) в кровеносную систему и, в ряде случаев, вызывают патологические реакции иммунной системы, которые в свою очередь, могут приводить к состоянию, известному в иммунологии, как состояние «гиперчувствительности» определенного типа. А состояние «гиперчувствительности», когда иммунная система не справляется с выведением из организма продуктов иммунных реакций, с большой вероятностью приводит к хроническим неинфекционным заболеваниям, часто именуемым «болезнями цивилизации». Основополагающая статья на эту тему появилась в России в 2000 г. (Розенталь В.М., Воейков В.Л., Волков А.В., Кондаков С.Э., Новиков К.Н. «Роль подбора индивидуального питания в экологической реабилитации человека». Материалы III-й международной конференции. Москва, МГУ, 24-25 ноября 2000. М.: Изд-во РАМН, 2000. с.243-247).
На протяжении последующих 20 лет учеными разных стран были разработаны тесты, позволяющие в лабораторных условиях «in vitro» регистрировать эффекты взаимодействия пАГ с иммунной системой человека, используя различные маркеры (измеряемые физические параметры) характерные для определенной фазы или типа взаимодействия пАГ с иммунной системой. Наиболее известные в США и Европе: York, ALCAT, NuTron, Cito, Prime, MRT, в России: Гемокод, РОЭ. Сравнительный анализ тестов приведен в работе (Розенштейн М.Ю., Розенштейн А.З., Кондаков С.Э., Черевко Н.А. «Современные лабораторные методы диагностики пищевой непереносимости». Бюллетень сибирской медицины, 2016, том 15, № 16, с. 69–78.).
Наиболее распространенным в клинической практике является York тест, разработанный York Nutrition Laboratories (UK) в 90-х годах прошлого века, или ИФА на специфические иммуноглобулины класса G (IgG) — в английской транскрипции ELISA IgG. Маркером в данном тесте является концентрация сывороточных специфических IgG к конкретному пАГ, измеряемая методом иммуноферментного анализа (ИФА). Впоследствии, многие известные лаборатории мира, вывели на рынок аналогичный тест, но уже под своим именем: Biomerica, Us Biotek, Genova Diagnostic, Meta Metrics, White Plane, Everly Well, Pinner test (США), ImmuPro, Dr. Fooke, R-Biopharm (Германия); Инвитро, Иммунохелс, Вектор Бест, Иммунотек, G-тест, Иммуновет (РФ). Что именно предлагается на рынках можно представить по характеру рекламы: IgG Food Intolerance Test (IgG тест на пищевую непереносимость), IgG Food Allergy Test (IgG тест на пищевую аллергию), IgG Food Sensitivity Test (IgG тест на чувствительность к пище). Заметим, что речь идет об одном и том же тесте ИФА на IgG к пищевым антигенам. При одинаковом маркере, различие только в наборе пАГ на тест- системе и методе обработки данных.
2. Существует ли критерий для корректного построения элиминационных диет на основе данных теста ИФА на IgG к пАГ и чем отличается используемая нами «методика Immunohealth™» от всех остальных тестов?
Задача данного научного расследования — дать врачам и всем заинтересованным читателям физически корректный и грамотный ответ.
Физическая модель ИФА на специфические IgG к пАГ.
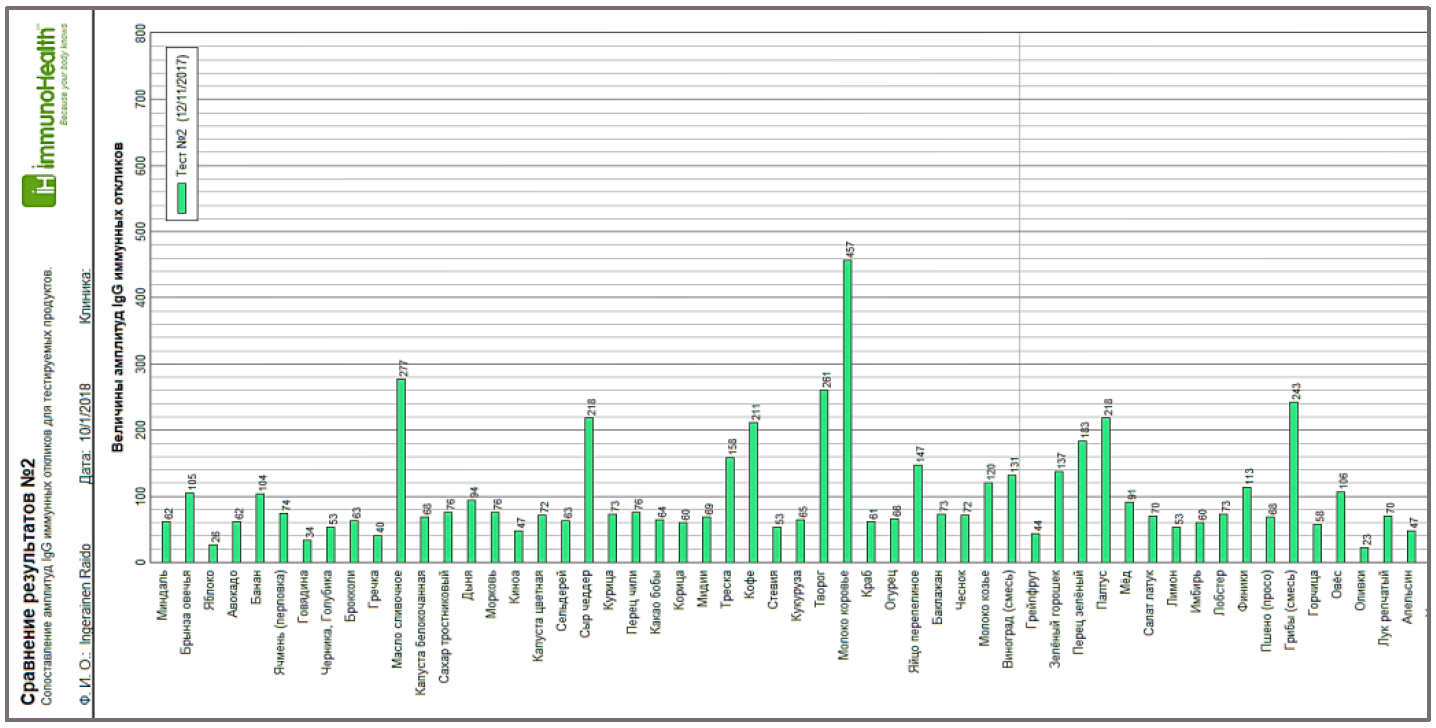
В тесте ИФА на IgG к антигенам из пищевых продуктов последние наносятся на лунки иммунологических плашек ячейки тест- системы для ИФА. В каждую ячейку добавляют равное количество сыворотки крови пациента. В результате взаимодействия специфических сывороточных антител иммунной системы (ИС) с каждым пАГ в образцах сыворотки крови получают порядка 100 иммунных откликов или 100 (для нашего случая) различных величин концентрации Сn(sIgG) специфических IgG. Таким образом, для решения задачи адаптации конкретного индивидуума к пищевой среде проводится эксперимент с его иммунной системой путем смешивания сыворотки крови со статистически представительной выборкой пАГ. Результат подобного тестирования представляет собой 100 значений величин концентраций Сn(sIgG), 1 ≤ n ≤ N, где N=100 — общее число тестируемых пАГ. Как правило, результат тестирования представляется графически в координатах «продукт — амплитуда маркера», Рис 1. Более того, в данной постановке эксперимента совершенно безразлично диагностируем ли мы здорового человека или больного аллергией или иным заболеванием. В том или другом случае, результаты теста ИФА на IgG к пАГ показывают как иммунная система каждого человека взаимодействует с тестируемым набором пищевых антигенов. Т.е. амплитуду IgG иммунных реакций ИС на каждый антиген, что и представлено на Рис 1. На этом лабораторный эксперимент по исследованию взаимодействия пАГ с ИС закончен.
Совершенно очевидно, что ИФА на IgG — диагностический тест, в ходе которого диагностируются процессы взаимодействия специфических иммуноглобулинов (sIgG) c представительной выборкой пАГ. Для описываемого метода ИФА на IgG к пАГ, как метода диагностики иммунных реакций «антиген-антитело» (пАГ-sIgG), характерны следующие оценки: — чувствительность 10−9 – 10−12 моль (вплоть до 10−21 моль в образце); — специфичность – порядка 100% (IgG); — относительная погрешность измерения единичного значения величины концентрации Сn(sIgG) мкг/мл — порядка 3.0-5.0%. Отметим, что медицинские определения «чувствительности S1» и «специфичности-S2», к тесту ИФА на IgG к пАГ, как методу диагностики иммунных реакций «антиген-антитело» (пАГ-sIgG), абсолютно неприменимы. Вывод: никакого отношения эксперимент ИФА на IgG к пАГ к диагностике «пищевой аллергии» не имеет и в этом отношении авторы солидарны с многочисленными критиками. Представьте себе мысленно физический эксперимент из школьного курса физики, аналогичный тому, что мы видим в случае ИФА на IgG к пАГ. Организм – «черный ящик» и мы по косвенным данным (однотипным откликам) должны что-то сказать о состоянии данного «ящика». Предположим, у Вас есть 100 одинаковых по размеру, но из различного материала шаров и Вы решили на расстоянии протестировать этими шарами стену дома, материал и форма которой Вам неизвестны (Рис 2).
Рис 2. Эксперимент по отражению шаров от объекта (стенки).
Вы бросаете перпендикулярно к стенке в локальную область один за другим все шары, они отскакивают от стены под разными углами и на разные расстояния, и на этом эксперимент по взаимодействию шаров со стенкой завершен. Дальнейшие ваши действия уже определяются задачей, поставленной вами перед началом эксперимента. Вас могут интересовать углы отскока, или распределение количества шаров по углам отражения, или длина отскока от стенки в зависимости от материала шаров и т.д. Эти задачи решаются методами, не имеющими отношения к самому эксперименту, только к набору данных по результатам эксперимента.
Вывод: Определение пищевой аллергии методом ИФА на IgG к пАГ является некорректно поставленной задачей тестирования.
Цель теста ИФА на IgG к пАГ.
C точки зрения прикладных задач диетологии, конечным результатом теста ИФА на IgG к пАГ, является не весь набор из 100 значений величин концентраций Сn (sIgG), найденных экспериментально (Рис 1), а только некоторая его часть, которая образована пАГ-антагонистами (пАГ–А), вызывающими патологические реакции ИС, потенциально приводящие к ситуации «гиперчувствительности Тип III» организма индивидуума. Таким образом: основной задачей и конечной целью тестирования реакций «пАГ- sIgG» на основе теста ИФА на IgG к пАГ является исключительно идентификация персонифицированных патологических иммунокомплексных реакций и соответствующих пАГ-А, инициирующих данные реакции. Именно на исключении из рациона пациента пАГ-А, найденных по результатам теста и основывается персонифицированная элиминационная диета: (Розенштейн М.Ю., Розенштейн А.З., Кондаков С.Э., Черевко Н.А. Новый методологический подход к созданию персонифицированной элиминационной диеты при пищевой непереносимости, обусловленной иммунопатологическими реакциями III типа. Бюллетень сибирской медицины, 2015, том 14, № 4, с. 60–67). Встает закономерный вопрос: а как идентифицировать именно патологические реакции по результатам многокомпонентного теста ИФА на IgG к пАГ? (многокомпонентность вызывается тем фактором, что мы проводим единичный ИФА на IgG в каждой n-й ячейке (1 ≤ n≤ N, где N — количество тестируемых пАГ) иммунологической панели. В дальнейшем мы будем использовать более краткую запись многокомпонентного теста ИФА на IgG к пАГ в виде (ELISA IgG)n.
В аллергологии вопрос идентификации патологических иммунных реакций, опосредованных иммуноглобулинами класса Е (IgE), приводящих к «гиперчувствительности Тип I» (аллергические реакции), решается путем экспериментального определения «референтных интервалов» и соответствующих критериев «норма — патология» (“cut-off” criterion), статистически достоверно связанных с наблюдаемой клинической картиной. При этом, основой идентификации реакций «гиперчувствительности Тип I» и инициирующих АГ по результатам теста ИФА на IgE (ELISA IgЕ)n, является только величина титра, или величина концентрации специфических иммуноглобулинов класса Е (IgE) к определенному аллергену (в том числе пАГ).
В отличие от аллергических реакций, опосредованных иммуноглобулинами класса Е (IgE), для иммунокомплексных реакций «пАГ-sIgG», корректное введение «референтных интервалов» и критериев «норма-патология» (в «аллергологическом смысле») принципиально невозможно, поскольку не известны значения концентраций специфических антител класса G к пАГ, при превышении которых наступает клиническая (патологическая) реакция на данный пАГ. Известны только «референтные интервалы» для концентраций общего IgG в крови (стандарт ВОЗ — WHO 67/69).
Несмотря на принципиальные отличия в биохимических свойствах иммуноглобулинов класса E и G, для идентификации патологических иммунокомплексных реакций «пАГ-sIgG», каждая лаборатория, по образу и подобию с анализом на иммуноглобулины класса Е, вводит свои собственные искусственные референтные интервалы, исходя из принятых значений калибраторов, определяющих диапазон величин титров IgG. Критерий «норма-патология», как правило, фиксируется на уровне половины диапазона измерений и является фиксированной величиной для всех тестов. Таким образом, протокол обработки данных теста ИФА на IgG к пАГ формально приводится в соответствие с протоколом, принятым в аллергологии для обработки результатов теста ИФА на IgЕ к пАГ. Именно этот подход использует большинство ведущих лабораторий мира: York-Nutrition, ImmuPro, Dr. Fooke, Biomerica, US Biotek, Genova Diagnostic, Meta Merix, Pinner и др. Аналогичный подход используется и в тестах ALCAT, NuTron, Сito.
С нашей точки зрения, подобный искусственный “аллергологический” подход является физически некорректным и приводит к существенным ошибкам в идентификации патологических иммунокомплексных реакций.
В разработанном нами подходе (методика Immunohealth™), идентификация патологических иммунокомплексных реакций «пАГ-sIgG» по результатам теста (ELISA IgG)n к пАГ, проводится на основе информации о структуре функции плотности распределения вероятности — ФПРВ (Probability Density Function), регистрируемых в эксперименте титров Сn(sIgG), в диапазоне шкалы измерений (Рис 3).
Рис 3. Вид ФРПВ для i-го теста (ELISA IgG)ni. Ti- критерий «норма-аномалия». Tf- условный критерий «норма-патология», принятый в лабораторной практике. Na- количество аномальных реакций, регистрируемых согласно критерию «норма-аномалия», Naf- количество аномальных реакций, регистрируемых согласно условному критерию «норма-патология».
В «методике Immunohealth™» величина персонифицированного критерия «норма — аномалия», c заданной точностью определяется программным путем на основе статистического анализа экспериментальных данных многокомпонентного теста (ELISA IgG)n к пАГ по разработанным алгоритмам программой Immunohealth™ IT. Базовым требованием нахождения корректного значения величины критерия «норма-аномалия», является наличие статистически представительного набора значений титров Сn(sIgG), т.е. необходимо и достаточно, чтобы величина объема выборки N тестируемых пАГ, приближенно удовлетворяла соотношению N ≥ 80.
Погрешность теста (ELISA IgG)n, как правило определяют величиной погрешности измерения амплитуды одного иммунного отклика (Рис 1), т.е. единичного значения концентрации специфических иммуноглобулинов — Сn(sIgG). В реальности, величина погрешности теста определяется не только и не столько погрешностью измерения одного иммунного отклика, а в основном, погрешностью определения числа идентифицируемых патологических иммунокомплексных реакций и соответствующих пАГ. А погрешность в определении числа пАГ-А всецело определяется значением величины титра, корректно разделяющего структуры А и В в ФРПВ (Рис 3). При фиксированном значении титра Tf, принятом в большинстве лабораторий мира на уровне половины значений шкалы измерения (Рис. 3), относительная погрешность в определении числа пАГ-А находится в пределах от 60% до 100%. Использование же персонифицированного критерия «норма — аномалия», определяемого по «методике Immunohealth™», гарантирует минимальную погрешность в определении количества пАГ-А и приводит к идентификации «кластеров» интолерантности ИС к пАГ, объединенных определенным антигенным «сродством». Таким образом, «методика Immunohealth™» позволяет не только диагностировать иммунокомплексные реакции у здоровых и больных людей, но и находить с минимальной погрешностью число пАГ-А, инициирующих патологические иммунокомплексные реакции.
Предлагаемый подход был проверен в течение более чем 15 лет на выборке более 30000 пациентов из разных популяций (США, ЕС, РФ) и на тест- системах для теста (ELISA IgG)n различных производителей. Врачи, использующие «методику Immunohealth™,» в своей практике, отмечают устойчивый положительный клинический эффект с контролем показателей системного воспаления (СОЭ, СРБ, ИЛ6, ИЛ1, ТНФ альфа и т.д.). Патогенетически этот эффект выражается в снижении нагрузки на эффекторные иммунные реакции, направленные на элиминацию причинных пищевых АГ, что достигается соблюдением персонифицированной элиминационной диеты, построенный с использованием предложенного критерия “норма – аномалия”.
Предложенная методика дает специалистам разных профилей инструмент, позволяющий использовать персонифицированную идентификацию и элиминацию причинных пАГ для лечения и профилактики неинфекционных хронических заболеваний. Это особо важно для пациентов с признаками системного воспаления, патогенеза многих неинфекционных заболеваний, таких как метаболический синдром, профилактика ожирения, современные интестинально–энтеропатические расстройства и аутовоспалительные синдромы. Одновременно методика позволяет определять статус ИС и степень пищевой адаптации по отношении к пищевым антигенам окружающей пищевой среды у здоровых людей.
Выводы научного исследования:
1. Корректно выполненный многокомпонентный иммуноферментный анализ (ELISA IgG)n, на специфические к пищевым антигенам иммуноглобулины класса G (IgG), предельно точно показывает концентрацию специфических антител, которая является отражением картины взаимодействия иммунной системы человека (здорового или больного) для каждого n –го пищевого антигена из представительной выборки из N тестируемых антигенов.
2. В «методике Immunohealth™» многокомпонентный иммуноферментный анализ (ELISA IgG)n на специфические к пищевым антигенам IgG, используется для создания индивидуальной адаптационной диеты на основе математически обоснованного критерия «норма – аномалия». Это область диетологии, а более конкретно — иммунодиетологии. Следовательно тест (ELISA IgG)n и «методика Immunohealth™» не имеют никакого отношения к диагностике «пищевой аллергии».
3. Результаты проведенных исследований позволяют сделать вывод о том, что новое направление ИММУНОДИЕТОЛОГИЯ™, базирующееся на корректно используемом многокомпонентном тесте (ELISA IgG)n к пАГ является перспективным направлением современной диетологии, в котором физически корректно учитываются индивидуальные реакции иммунной системы организма на представительную выборку пАГ.