Люминол что это такое
Люминол
| Люминол | |
|---|---|
 | |
| Общие сведения | |
| Систематическое название | 5-амино-2,3-дигидро- 1,4-фталазиндион |
| Синонимы | o-Аминофталоил гидразид |
| Молекулярная формула | C8H7N3O2 |
| SMILES | NC1=C(C(NNC2=O)=O) C2=CC=C1 |
| Молекулярная масса | 177,16 г/моль |
| Номер CAS | 521-31-3 |
| Физические свойства | |
| Агрегатное состояние | белые или бледно-желтые кристаллы |
| Растворимость в воде | нерастворим |
| Растворимость в этаноле | растворим |
| Температура плавления | 319—320 °C |
| За исключением оговоренных случаев, данные приведены для стандартных условий (при 25 °C, 100 кПа) | |
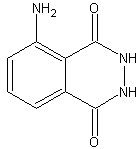
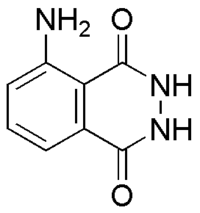
Люминол — органическое соединение с формулой C8H7N3O2. Представляет собой белые или светло-желтые кристаллы. Хорошо растворим в полярных органических растворителях, однако практически нерастворимо в воде. Люминол является веществом, способным к хемилюминесценции. Он испускает синее свечение при взаимодействии с некоторыми окислителями. Люминол используется судебными экспертами для выявления следов крови, оставленных на месте преступления, так как он реагирует с железом, содержащимся в гемоглобине крови. Также люминол используют биологи при проведении различных исследований клеток для обнаружения меди, железа и цианидов.
Содержание
Получение
В лабораторных условиях люминол может быть получен в результате двустадийного синтеза исходя из 3-нитро-фталевой кислоты [1] [2] Первой стадией является её нагревание с гидразином в высококипящем органическом растворителе, таком как, например, триэтиленгликоль. В результате реакции конденсации образуется гетероциклическая система 5-нитрофталилгидразида. Нитро-группа этого соединения может быть восстановлена при помощи NaHSO3 или сульфида аммония, дав в результате люминол.
Впервые люминол был синтезирован в Германии в 1902 году, однако название получил значительно позже, в конце 1920-х.
Хемилюминесценция
Хемилюминесцентные свойства люминола проявляются в присутствии окислителей. Для этой цели может быть использован пероксид водорода (H2O2) в растворе щелочи.
В присутствии катализаторов, таких как соли железа, пероксид водорода разлагается с образованием кислорода и воды.
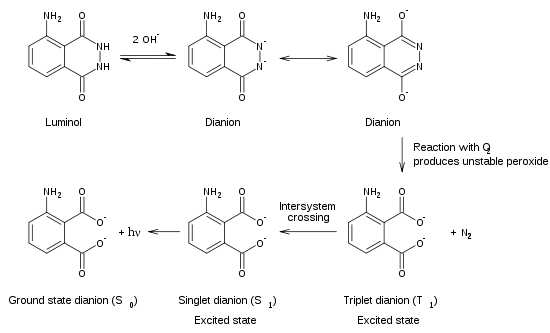
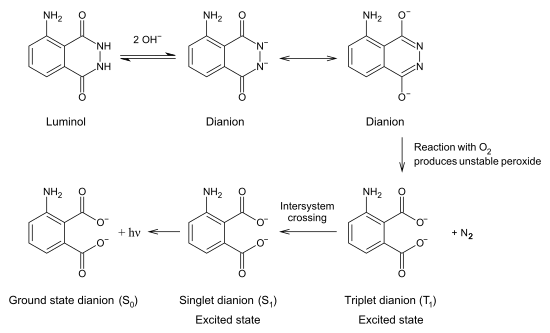
При взаимодействии люминола с гидроксид-ионами образуется дианион, который взаимодействует с кислородом. Продуктом этой реакции является крайне нестабильный органический дирадикал, который моментально распадается с образованием азота и молекулы 3-аминофталевой кислоты в возбужденном электронном состоянии. При возвращении молекулы из возбужденного в основное электронное состояние выделяется фотон.
Источники
Примечания
Полезное
Смотреть что такое «Люминол» в других словарях:
люминол — liuminolas statusas T sritis chemija formulė H₂NC₆H₃:(CO)₂(NH)₂ atitikmenys: angl. luminol rus. люминол ryšiai: sinonimas – 5 amino 1,2,3,4 tetrahidro 1,4 ftalazindionas … Chemijos terminų aiškinamasis žodynas
ЛЮМИНОЛ — (5 амино 1,2,3,4 тетрагидро 1,4 фталазиндион, гидразид 3 аминофталевой к ты, H2L), мол. м. 177,11; бесцв. или желтые кристаллы; т. пл. > 300 °С. Плохо раств. в воде (8.10 4 М при 19°С). В зависимости от рН р ра может существовать в… … Химическая энциклопедия
Гидразиды — Структурная формула гидразида карбоновой кислоты Гидразиды производные оксокислот (как карбоновых, так и других органических кислот) общей формулы RkE(=O)l(OH)m, (l ≠ 0), формально являющиеся продукта … Википедия
Индикаторы химические — вещества, введение которых в анализируемый раствор позволяет установить конец химической реакции или концентрацию водородных ионов по легко заметному признаку. И. х. используют главным образом в титриметрическом анализе (См.… … Большая советская энциклопедия
ЛЮМИНЕСЦЕНТНЫЕ ИНДИКАТОРЫ — способны люминесцировать или тушить люминесценцию при изменении рН р ра, в окислит. восстановит. р циях, при комплексообразовании или адсорбции. По характеру свечения делятся на флуоресцентные и хемилюминесцентные. Флуоресцентные индикаторы… … Химическая энциклопедия
РЕАГЕНТЫ ОРГАНИЧЕСКИЕ — в аналитической химии (ОР), орг. соединения разл. классов, служащие для качеств. обнаружения или количеств. определения хим. элементов, функц. групп и соед., а также для разделения, концентрирования, маскирования и др. вспомогат. операций,… … Химическая энциклопедия
Индикатор — (Indicator) Индикатор это информационная система, вещество, прибор, устройство, отображающий изменения какого либо параметра Индикаторы графиков валютного рынка форекс, какие они бывают и где их можно скачать? Описание индикаторов MACD,… … Энциклопедия инвестора
liuminolas — statusas T sritis chemija formulė H₂NC₆H₃:(CO)₂(NH)₂ atitikmenys: angl. luminol rus. люминол ryšiai: sinonimas – 5 amino 1,2,3,4 tetrahidro 1,4 ftalazindionas … Chemijos terminų aiškinamasis žodynas
luminol — liuminolas statusas T sritis chemija formulė H₂NC₆H₃:(CO)₂(NH)₂ atitikmenys: angl. luminol rus. люминол ryšiai: sinonimas – 5 amino 1,2,3,4 tetrahidro 1,4 ftalazindionas … Chemijos terminų aiškinamasis žodynas
Раствор люминола
Изучая в школе химию, нам часто не показывали и не рассказывали много чего интересного. И если ваши интересы в химии не угасли, следующая информация для вас. В природе существуют очень интересные реакции, например, некоторые из них заставляют светиться жидкость. В них часто используют раствор люминола.
КАК СДЕЛАТЬ СВЕТЯЩУЮСЯ ЖИДКОСТЬ Самый безопасный способ! How to Make Glowing Water Игорь Белецкий
Что такое люминол?
Люминол – это вещество, очень часто используемое в криминалистике, чтобы находить следы крови. Его используют также биологи, чтобы изучать клетки на наличие металлов, потому как он отлично реагирует на медь, железо или цианиды.
Люминол представляет собой белые или светло-желтые кристаллы, которые практически нерастворимы в воде, но отлично растворяются, если смешивать их с полярными органическими растворителями. Это органическое вещество обладает свойством хемилюминесценции, простыми словами оно способно светиться синим цветом, реагируя на некоторые химические элементы и их соединения. Светиться оно начинает в нейтральных или кислых растворах, это нужно помнить.
Где взять люминол?
Это вещество достать очень сложно, если вы, конечно, не работаете в сфере, которая стыкуется с криминалистикой. Раствор, его можно приготовить вручную или синтезировать в химической лаборатории, имея в наличии несколько ингредиентов. Но запомните, что многие вещества, которые используются в этом эксперименте, опасны для здоровья. Необходимо быть предельно внимательным и осторожным, делать все по инструкции.
Люминол продается в аптеках или в магазинах химических реактивов в виде желтого порошка. Его можно также приобрести в различных видах, к примеру, он входит в состав таблеток «Галавит», а также содержится в их аналогах – суппозиториях или ампулах (к сожалению, такой вариант будет очень дорогим). Каждая таблетка содержит приблизительно 25 мг натриевого производного люминола, а половины грамма такого вещества вполне хватит на 50 мл однопроцентного раствора люминола. Если же вы берете обычный сухой люминол, для реакции сначала его необходимо растворить в воде.
Самостоятельно изготовить такое вещество тоже вполне возможно в домашних условиях. Купите в аптеке хвойный концентрат (хватит одного грамма) и растворите его в воде. Возьмите чайную ложку борной кислоты и капайте по капле хвойного раствора туда, предельно аккуратно все перемешивая. После смешивания необходимо нагревать раствор до кипения. Причем, пузырьки, которые появятся, надо прокалывать чем-то острым, прекрасно подойдет обычная иголка.
После закипания вещество необходимо охладить, затем еще немножко добавить хвойного раствора и повторить всю процедуру. В результате таких действий у вас получится желтое вещество под названием люминофор. При воздействии яркого света (к примеру, фотовспышки) он способен светиться, но, к сожалению, не долго. Для более длительных красивых эффектов используйте приобретенный люминол.
Основные качества раствора люминола
Рецепты приготовления светящейся жидкости
Есть несколько рецептов, по которым можно создать светящуюся жидкость, используя раствор люминола.
Способ № 1
Способ № 2
Способ № 3
Способ № 4
После экспериментов
После проведения всех этим экспериментов, когда вы уже насладились красивым свечением, необходимо убраться, избавиться от веществ и вымыть тщательно всю посуду. Осторожность необходимо соблюдать до окончания всего эксперимента, не забывайте об этом.
Люминол что это такое
Вы там как, готовы к осенним распродажам? Чтобы не пропустить самые интересные и выгодные предложения, подпишитесь на полезный телеграм-канал Пикабу со скидками. Да, Пикабу не только для отдыха и мемов, но и для экономных покупок!
В «Пикабу Скидки» вы найдете актуальные предложения:
• доставки еды (KFC, Delivery Club, «Папа Джонс»);
• книги («Читай-город», «Литрес», Storytel);
• услуги и сервисы («Делимобиль», Boxberry, «Достависта»);
• маркетплейсы и гипермаркеты (Ozon, «Ашан», «Яндекс.Маркет»);
• одежда и обувь (Adidas, ASOS, Tom Tailor)
• бытовая техника и электроника («М.Видео», «Связной», re:Store);
• товары для дома (IKEA, «Леруа Мерлен», Askona);
• косметика и парфюмерия («Л’Этуаль», «Иль де Ботэ», Krasotka Pro);
• товары для детей («Детский мир», TOY, Mothercare);
• образование («Нетология», GeekBrains, SkillFactory);
• и еще куча-куча всего.
Как сделать светящуюся воду из люминола)
1)Возьмите два или три грамма люминола в виде желтого порошка. Растворите его в 100 мл обычной дистиллированной воды. Делать эксперимент лучше в колбе, не забыв одеть перчатки.
2)К раствору добавьте 80 мл перекиси водорода (обычно берут 3%).
3)Добавим щепотку медного купороса или хлорного железа. Можно взять и красную кровяную соль. Если всех вышеперечисленных ингредиентов у вас нет, можно взять обычное куриное мясо и выдавить немного крови.
4)В колбу добавим еще раствор едкого натрия, около десяти миллилитров.
5)Теперь можете выключить свет и любоваться красивым голубым свечением. Хотите перекрасить жидкость? Этого можно добиться добавлением любого флуоресцентного красителя.
1)Здесь вам потребуется высокий стакан, так как в конце эксперимента жидкость может пениться и подниматься. Растворите в воде стиральный порошок и отлейте 20 мл в высокий стакан.
2)Добавьте к порошку трехпроцентный раствор перекиси водорода, около 10 мл.
3)Необходимо добавить в смесь буквально 5 мл раствора люминола и пару растертых в порошок кристаллов марганцовки.
4)Когда вы начнете смешивать все ингредиенты, вещество начнет пениться, будьте осторожны. В финале эксперимента вы можете наблюдать очень красивое искрение и свечение.
люминол
Синонимы:
Внешний вид:
Брутто-формула (система Хилла): C8H7N3O2
Молекулярная масса (в а.е.м.): 177,11
Температура плавления (в °C): 300
Растворимость (в г/100 г или характеристика):
Метод получения 1.
В 1-литровую коническую колбу помещают 52 г (около 0,15 моля) эквимолекулярной смеси 5-нитро-2,3-дигидро-1,4-фталазиндиона и сернокислого натрия (примечание 1), 200мл воды и 75мл 15 н. водного аммиака (уд. вес 0,90). Колбу закрывают пробкой и взбалтывают ее содержимое до тех пор, пока все или почти все твердое вещество не растворится, а затем прибавляют к нему в три приема 84 г (0,4 моля) кристаллического дигидрата гидросульфита натрия Na2S2O4•2Н2О (примечание 2). Раствор разогревается (причем иногда температура достигает точки кипения) и темная оранжево-красная окраска начинает исчезать. После того как интенсивность самопроизвольной реакции слегка уменьшится, раствор в течение нескольких минут поддерживают при слабом кипении, а затем фильтруют, чтобы отделить нерастворимые примеси. Фильтрат нагревают на паровой бане или на слабом пламени горелки в течение получаса. За это время 5-амино-2,3-дигидро-1,4-фталазиндион начинает выпадать в виде светло-желтого хлопьевидного осадка или в виде корки, пристающей к стенкам колбы. Горячий раствор подкисляют ледяной уксусной кислотой до явно кислой реакции на лакмусовую бумажку и оставляют стоять в течение ночи. Желтый осадок отфильтровывают, тщательно промывают холодной водой и сушат в воздушном сушильном шкафу при 110°С или даже при более низкой температуре. Выход сухого препарата составляет 25—27 г. Он плавится при 301—305°С (с разложением) (примечание 3).
Вещество является достаточно чистым для большинства целей. Основные примеси представляют собой небольшое количество минеральных солей и следы невосстановленного нитросоединения. Если желательно получить более чистое вещество, то сырой препарат растворяют в горячей 3 н. соляной кислоте (100 мл кислоты на 5 г вещества), прибавляют к жидкости уголь для обесцвечивания, быстро фильтруют ее (примечание 4) и фильтрат нейтрализуют концентрированным раствором аммиака до слабо кислой реакции по конго. После того как смесь охладится до комнатной температуры, бледно-желтый хлопьевидный осадок отфильтровывают, тщательно промывают холодной водой и сушат в сушильном шкафу при 100°С или даже при еще более низкой температуре. Выход при перекристаллизации достигает 70—75% (примечание 5); т.пл. 329—332°С (примечание 4).
1. Применение очищенного нитросоединения не дает никакого преимущества.
2. Успех этого восстановления зависит от качества гидросульфита натрия. Реагент следует брать из свежевскрытой банки; при длительном хранении в лаборатории он, повидимому, окисляется.
3. Авторы синтеза для определения температуры плавления пользовались медным блоком Кульмана. Температура плавления чистого вещества указывается по литературным источникам в интервале от 319 до 333°.
4. 5-Амино-2,3-дигидро-1,4-фталазиндион не следует подвергать действию горячей соляной кислоты дольше, чем это является необходимым, так как, по-видимому, в некоторой степени имеет место гидролиз.
5. Выход (в процентах) нельзя вычислить точно, так как неизвестно точное количество нитросоединения, содержащегося в смеси, взятой для восстановления. Примененное количество кристаллического гидросульфита натрия достаточно для восстановления только 0,133 моля нитросоединения; выход очищенного аминосоединения соответствует примерно 80% теоретической величины, вычисленной на основании предположения о том, что гидросульфит является лимитирующим реагентом.
Люминол (C8ЧАС7N3О2) это химический что показывает хемилюминесценцияс голубым свечением при смешивании с подходящим окислитель. Люминол представляет собой твердое кристаллическое вещество от белого до бледно-желтого цвета, растворимое в большинстве полярных органических растворителей, но не растворимое в воде.
Судебно-медицинская экспертиза исследователи используют люминол для обнаружения следовых количеств кровь в места преступления, поскольку он реагирует с железом в гемоглобин. Биологи используют его в клеточных анализы обнаружить медь, утюг, цианиды, а также конкретные белки через вестерн-блоттинг. [2]
Когда люминол распыляется равномерно по площади, следовые количества активирующего окислителя заставляют люминол излучать голубое свечение, которое можно увидеть в затемненной комнате. Свечение длится всего около 30 секунд, но исследователи могут задокументировать эффект с помощью фотография с длинной выдержкой. Следователи на месте преступления должны наносить его равномерно, чтобы избежать вводящих в заблуждение результатов, поскольку следы крови кажутся более концентрированными в областях, которые получают больше брызг. Интенсивность свечения не указывает на количество крови или другого присутствующего активатора, а только показывает распределение следовых количеств в области.
Содержание
Синтез
Люминол синтезируется в двухступенчатом процессе, начиная с 3-нитрофталевая кислота. [3] [4] Первый, гидразин (N2ЧАС4) нагревают с 3-нитрофталевой кислотой в высококипящем растворителе, таком как триэтиленгликоль и глицерин. An ацильное замещение реакция конденсации происходит с потерей воды с образованием 3-нитрофтальгидразида. Сокращение нитрогруппа чтобы аминогруппа с дитионит натрия (Na2S2О4) через переходный гидроксиламин промежуточный, производит люминол.
Впервые соединение было синтезировано в Германии в 1902 г. [5] но не назывался «люминол» до 1934 года. [3] [6]
Хемилюминесценция
В лабораторных условиях часто используют феррицианид калия или периодат калия для катализатора. При судебно-медицинском обнаружении крови катализатором является железо, содержащееся в гемоглобин. [7] Ферменты в различных биологических системах может также катализировать разложение перекиси водорода.
Использование следователями на месте преступления
История
В 1928 году немецкий химик Х. О. Альбрехт обнаружил, что кровьв числе других веществ усиливал свечение люминола в щелочном растворе перекиси водорода. [8] [9] В 1936 году Карл Глеу и Карл Пфаннштиль подтвердили это улучшение в присутствии гематин, компонент крови. [10] В 1937 году немецкий судебно-медицинский эксперт Вальтер Шпехт провел обширные исследования применения люминола для обнаружения крови на местах преступления. [11] В 1939 году патологи Сан-Франциско Фредерик Проешер и А.М. Муди сделали три важных наблюдения относительно люминола: [12] [13]
Теория
Следователи на месте преступления Используйте люминол, чтобы найти следы крови, даже если кто-то очистил или удалил ее. Исследователь распыляет раствор люминола и окислителя. Железо в крови катализирует люминесценцию. Количество катализатора, необходимое для того, чтобы вызвать реакцию, очень мало по сравнению с количеством люминола, что позволяет обнаруживать даже следовые количества крови. Синее свечение длится около 30 секунд на одно нанесение. Для обнаружения свечения требуется довольно темная комната. Любое обнаруженное свечение может быть задокументировано путем длительной выдержки фотография.
Недостатки
Люминол имеет недостатки, которые могут ограничивать его использование при расследовании преступления: