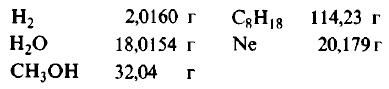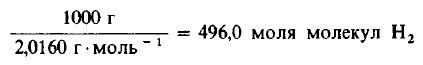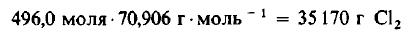М большая в химии это что
М большая в химии это что
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12 С:
Таким образом, 1 моль вещества содержит 6,02 • 10 23 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню). Например, в образце вещества содержится 12,04 • 10 23 молекул. Следовательно, количество вещества в этом образце составляет:
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:
M(CH4)=16 г/моль, т.е. 16 г CH4 содержат 6,02 • 10 23 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример 
Решение
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
Вычисление ν используется практически в каждой расчетной задаче.
Образцы решения задач
Задача №1. Вычислите массу (г) магния, взятого количеством вещества 0, 5 моль?
M (Mg ) = Ar ( Mg ) = 24 г/моль (из периодической системы)
m ( Mg ) = 24 г/моль · 0,5 моль = 12 г
Задача №2. Вычислите массу (г) 12,04 · 10 23 молекул оксида цинка Zn О ?
n (Zn O )= 12,04 * 10 23 молекул
следовательно, формула для расчёта
M(ZnO) = Ar(Zn) + Ar(O) = 65 + 16 = 81 г / моль
m = 81 г/моль · (12,04 * 10 23 /6.02 · 10 23 1/моль) = 162 г
Задания для закрепления
Заполните таблицу (округляя числа до целых )
Урок 5. Моль и молярная масса
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·10 23 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·10 23 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12 C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·10 23 ).
Молярная масса вещества
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
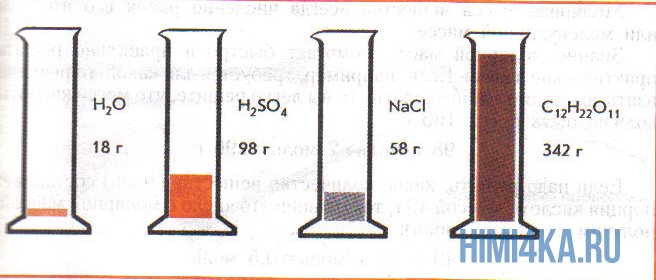
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·10 23 ; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·10 23 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·10 23 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·10 23 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·10 23 молекул/моль, что равно 2,99·10 26 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Молярная концентрация
Молярная концентрация (молярность), Сm – это характеристика раствора, способ выражения концентрации растворенного вещества в растворе. Молярная концентрация равна отношению количества растворенного вещества к объему раствора:
где νр.в. – количество растворенного вещества, моль
Vр-ра – объем раствора, л
Иногда молярную концентрацию вещества А обозначают так: [A].
Молярная концентрация измеряется в моль/л или М.
Несколько задач на молярную концентрацию.
1. Определите молярную концентрацию раствора азотной кислоты, если в 500 мл раствора содержится 6,3г азотной кислоты. Ответ: 0,2М
Решение: молярная концентрация — это отношение количества растворенного вещества к объему раствора в литрах. Количество азотной кислоты:
2. Определить молярную концентрацию раствора серной кислоты, если в 2л раствора содержится 0,98г кислоты. Ответ: 0,005М
3. Какую массу хлорида натрия надо растворить в воде, чтобы получить 1л раствора с молярной концентрацией соли 0,02моль/л? Ответ: 1,17г
4. Какое количество вещества (в моль) гидроксида калия содержится в 200мл раствора, если молярная концентрация щёлочи равна 0,9моль/л? Ответ: 0,18моль
5. Какая масса хлороводорода содержится в 250мл раствора соляной кислоты с молярной концентрацией 1 моль/л? Ответ: 9,125г
6. В каком объёме раствора серной кислоты с концентрацией 1 моль/л содержится 4,9г серной кислоты? Ответ: 50мл
7. Смешали 400мл раствора хлорида натрия с молярной концентрацией 1 моль/л и 600мл раствора хлорида натрия с концентрацией соли 2 моль/л. Определить количество вещества хлорида натрия в получившемся растворе и молярную концентрацию этого раствора. Ответ: 1,6М
Определение молярного объема при химических реакциях
Молярный объем — что это такое в химии
Молярный объем V m — является отношением объема вещества к его количеству, численно равен объему одного моля вещества.
Термин «молярный объем» применим по отношению к простым веществам, химическим соединениям и смесям. Величина зависит от следующих факторов:
Молярный объем вычисляют по формуле:
Молярный объем является характеристикой плотности упаковки молекул в рассматриваемом веществе. В случае простых веществ в некоторых ситуациях допустимо использовать понятие атомного объема.
Исходя из того, что объем газа определяется температурой и давлением, в процессе расчетов принято использовать объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимают:
Молярный объем какого-либо газа при нормальных условиях:
Молярный объем смеси
Молярный объем смеси:
Молярный объем газов
Закон Авогадро: одинаковые количества газов при одинаковых условиях занимают одинаковый объем.
Молярный объем идеального газа вычисляют с помощью формулы, которая является выводом из уравнения состояния идеального газа.
Молярный объем идеального газа:
где T — является термодинамической температурой;
R — универсальная газовая постоянная.
Молярный объем кристаллов
Объем V я элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Значения молярного объема химических элементов
Вычисление химического количества газа по его объему
Объем газа можно рассчитать по его химическому количеству. В этом случае необходимо преобразовать формулу молярного объема путем выражения из нее V :
Таким образом, объем газа равен произведению его химического количества на молярный объем. Продемонстрировать данное утверждение можно на примере. Допустим, что необходимо определить объем (н. у.) метана с химическим количеством 1,5 моль. Используя уравнение, записанное ранее, проведем вычисления:
При известном объеме газообразного вещества можно определить химическое количество рассматриваемого газа. В этом случае следует выразить из уравнения молярного объема n:
Определение объема веществ при химических реакциях
Перед тем, как приступить к расчетам объема веществ, следует ввести понятие плотности. Данный показатель определяется отношением массы вещества к его объему. Плотность измеряют в к г / м 3 (или г/л, г/мл). В случае газообразных веществ плотность принимает очень маленькие значения. Упростить расчеты химических реакций можно, если рассматривать отношение плотностей газов.
Относительной плотностью газа В по газу А называют величину, равную отношению плотностей рассматриваемых веществ или отношению молярных масс этих газов.
Данный параметр обозначают D A ( B ) и определяют по формуле:
В связи с тем, что в расчете относительной плотности используют величины одинаковой размерности, данный параметр является безразмерной величиной. Определить относительную плотность газообразных веществ по некому газу можно с помощью отношения молярных масс этих газов. Например, относительная плотность кислорода по водороду составляет:
Согласно закону Авогадро, в равных объемах различных газов, которые существуют при одинаковых температурах и давлениях, содержится одно и то же количество молекул. Данная гипотеза была представлена в 1811 году в Турине профессором физики Амедео Авогадро.
Подтверждение теория нашла во множестве экспериментальных опытах. Закон получил название закона Авогадро и стал в дальнейшем количественной основой современной химии. Закон Авогадро в точности реализуем в случае идеального газа. С увеличением разреженности газообразного вещества повышается точность расчетов по этому закону применительно к данному реальному газу.
Первое следствие из закона Авогадро: один моль (одинаковое количество молей) любого газа при одинаковых условиях занимает одинаковый объем.
Исходя из закона Авогадро, одинаковое число молекул какого-либо газа занимает при одинаковых условиях один и тот же объем. Наряду с тем, 1 моль какого-то вещества включает в себя (согласно определению) одинаковое количество частиц (к примеру, молекул). Таким образом, при определенных температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объем.
Если условия соответствуют нормальным, то есть температура равна 0 °C (273,15 К), и давление составляет 101,325 кПа, объем 1 моль газа соответствует 22,413 962(13) л. Данная физическая константа является молярным объемом идеального газа и обозначается Vm.
Вычислить молярный объем при температуре и давлении, отличных от нормальных условий, можно с помощью уравнения Клапейрона:
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Как найти объемные отношения газов в смеси
В процессе вычисления объемных отношений газов, участвующих в химических реакциях, используют закон Гей-Люссака (химический закон объемных отношений). В англоязычной литературе данный закон можно встретить под названием закона Шарля.
Закон Гей-Люссака — закон, демонстрирующий пропорциональную зависимость между объемом газообразного вещества и абсолютной температурой при постоянном давлении (то есть в изобарном процессе).
Закон получил название в честь французского физика и химика Жозефа Луи Гей-Люссака.
Математическое выражение закона Гей-Люссака:
В том случае, когда известно состояние газа при постоянном давлении и двух разных температурах, закон допустимо записывать таким образом:
По итогам химических реакций атомы не исчезают и не возникают. В результате таких процессов происходит их перегруппировка. Количество атомов до реакции и после ее протекания не меняется, что отличает их от молекул. Данное условие учитывают, расставляя стехиометрические коэффициенты в уравнениях химических реакций.
Коэффициенты в уравнениях реакций демонстрируют числа объемов газов, которые реагируют и образовываются. К примеру, 2 объема водорода и 1 объем кислорода дают 2 объема пара воды:
2 H 2 + O 2 = 2 H 2 O
V ( Н 2 ) : V ( N 2 ) : V ( N H 3 ) = 3 : 2 : 1
С другой стороны, данные соотношения справедливы лишь в случае веществ, которые участвуют в одной и той же химической реакции. Когда реагент принимает участие в двух параллельных реакциях, его химические количества в данных процессах не связаны и могут принимать любые значения.
n — количество газа.
Выразить молярный объем газов можно в л/моль:
В данной таблице использованы следующие обозначения:
Концентрации и доли. Как перевести одну концентрацию в другую.
При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
где \Large w_ — массовая доля компонента i в смеси,
\Large m_ — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть \Large m_ по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
\Large m = m_<п>+m_<с>= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
\Large w_ <с>= \frac
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно \Large m_ <1>и \Large m_ <2>. Массу полученного после смешения раствора обозначим \Large m и найдём:
\Large m = m_ <1>+ m_ <2>= 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим \Large m_ <гл. 1>и \Large m_ <гл. 2>. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
\Large m_ <гл. 1>= w_<1>\cdot m_ <1>= 0.25 \cdot 200 г = 50 г
\Large m_ <гл. 2>= w_<2>\cdot m_ <2>= 0.1 \cdot 300 г = 30 г
Таким образом, общая масса глюкозы \Large m_ <гл>:
\Large m_ <гл>= m_ <гл. 1>+ m_ <гл. 2>= 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
где \Large \phi_ — объёмная доля компонента B;
\Large V_ — объём компонента B;
\Large \sum
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
где \Large x_ — мольная доля компонента B;
\Large n_ — количество компонента B, моль;
\Large \sum
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Затем считаем сумму количеств:
\Large \sum
И находим мольную долю каждого компонента:
\Large 40.68 \% + 11.86 \% + 47.46 \% = 100\%.
И радуемся правильному решению.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na + ] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
где \Large n_ — количество вещества компонента B, моль;
\Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
\Large c_
где \Large n_ — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности \Large f_
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Теперь считаем нормальную концентрацию:
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
где \Large n_ — количество вещества компонента B, моль;
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
где \Large m_ — масса растворенного вещества, г;
\Large V — общий объём смеси, л.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.