Маб в медицине что это
Маб в медицине что это
После многолетних исследований mAb заняли свое место среди противоопухолевых препаратов. Это стало возможным благодаря техническим достижениям, среди которых следующие.
1. Гуманизация мышиных антител, не приводящая к образованию к ним антител у человека.
2. Получение высокоаффинных антител с использованием бактериофагов.
3. Получение антител различного размера и обладающих различным сродством, а также различной способностью проникать в ткани.
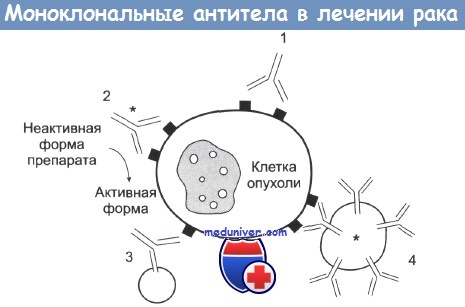
1 — антитело mAb связывается с антигеном опухолевой клетки и вызывает или ее комплемент-зависимую гибель, или гибель в результате антителозависимой атаки макрофагами.
2 — с mAb связан радиоактивный изотоп, токсин или цитокин, вызывающие гибель клетки. Также с антителами может быть связан фермент, участвующий в превращении препарата в активную форму.
3 — биспецифические mAb. Один сайт связывается с опухолевой клеткой, другой — с киллерной эффекторной клеткой.
4 — антитела mAb связаны с липосомами, которые содержат химотерапевтические препараты или токсины.
Существует много способов изменения антител для проявления у них противоопухолевого эффекта. Наиболее часто использующийся прием схематически представлен на рисунке. Подробности приведены в подписи к рисунку. Каждый из способов имеет свои возможности и ограничения.
1. Прямое цитотоксическое действие, вызываемое комплементом или антителами. При этом Fc-часть молекулы антитела должна связаться с Fc-рецептором (I или II) эффекторной клетки, но во избежание проявления ингибирующего эффекта не должна присоединяться к FcRIII. Таким механизмом цито-токсического действия обладает трастузумаб, который связывается с ERB В2 рецепторами опухоли молочной железы, а также ритуксимаб — mAb к CD20, применяющееся для лечении больных с В-клеточной лимфомой.
2. Примером mAb, доставляющих к раковой клетке токсин или радиоактивный изотоп, являются гуманизированные анти-CD33, конъюгированные с калихеамицином (гемтузумаб). Калихеамицин представляет собой агент, связывающийся с ДНК в области малой бороздки. CD33 экспрессируется на поверхности бластных клеток при остром миелоидном лейкозе. При рецидивах, устойчивых к медикаментозным препаратам, гемтузумаб вызывает ремиссию.
Подход с применением токсинов, например рицина, конъюгированных с mAb, не привел к получению клинических препаратов из-за высокой их токсичности для кровеносных сосудов. Присоединение к антителам радиоактивных изотопов (иттрия-90 или йода-131) представляет собой привлекательный путь, поскольку при этом появляется возможность воздействовать на опухолевые клетки, расположенные на некотором расстоянии от клетки-мишени. В настоящее время проходят клинические испытания aнmu-CD20, меченые иттрием-90 и анти-СЕА, меченые иодом-131.
Антитела, содержащие фермент, способный переводить лекарственный препарат в активную форму (ADEPT, antibody-dependent enzyme prodrug therapy), показали обнадеживающие результаты при лечении больных с метастазирующими колоректальными раками. Ферменты, конъюгированные с антителами, проявляют иммуногенные свойства, что ограничивает диапазон назначаемых доз.
3. Подход с использованием биспецифических антител пока еще находится на ранней стадии развития. Присоединение антител к эффекторным Т-клеткам вызывает мощный выброс цитокинов, приводящий к токсическим проявлениям. Это ограничивает применение подобных препаратов.
4. Иммунолипосомальные препараты являются эффективными средствами адресной доставки токсинов или радиоактивных изотопов к клеткам опухоли, однако получение их технически трудно. Эти препараты могут оказаться перспективными в случае, когда необходимо воздействовать на сосудистую систему опухоли.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение первично выявленного распространенного рака предстательной железы
Глава 9. Лечение первично выявленного распространенного рака предстательной железы
Тестостерон. Яички продуцируют около 95% всех андрогенов в виде тестостерона. В яичках он продуцируется клетками Лейдига в ответ на стимуляцию лютеинизирующим гормоном (ЛГ), который секретирует аденогипофиз в ответ на высвобождение рилизинг гормона лютеинизирующего гормона гипоталамуса. Соотношение гормонов определяется состоянием гипоталамо-гипофизарно-тестикулярной системы (рис. 20).
Рис. 20. Продукция тестостерона. Гипоталамо-гипофизарно-тестикулярная ось.
Механизм отрицательной обратной связи заключается в том, что при снижении уровней тестостерона гипоталамус высвобождает ЛГРГ, который в свою очередь стимулирует секрецию ЛГ, и, в конце концов, повышается секреция тестостерона. Механизм обратной связи приводит к возрастанию концентрации тестостерона, при этом уменьшаются выбросы ЛГРГ гипоталамусом.
Большая доля циркулирующего тестостерона в крови связана глобулином, связывающим половые гормоны (ГСПГ), и альбумином. Небольшая часть (2-3%) циркулирующего тестостерона не связана и, как считается, является функционально-активной формой тестостерона, который проникает в ткани предстательной железы. Свободный тестостерон пересекает мембрану клетки предстательной железы, а затем в цитозоле ферментом 5альфа-редуктазой превращается в ДГТ (рис. 21).
Рисунок 21. Механизм стимуляции функции клеток предстательной железы андрогенами.
Современные концепции лечения распространенного рака предстательной железы. Вопросы лечения гормонально-зависимых опухолей предстательной железы не могут решаться однозначно в связи со значительными изменениями, происходящими в организме больного. Это выдвигает необходимость всестороннего подхода к проблеме лечения рака предстательной железы, которая содержит еще целый ряд противоречивых вопросов.
Несмотря на то, что с тех пор, как Huggins и Hodges показали гормональную зависимость рака предстательной железы, прошло уже более 50 лет, гормонотерапия остается ведущим методом лечения распространенных форм этой опухоли. Однако эффект лечения в этих случаях временный. При наличии отдаленных метастазов рецидив заболевания возникает обычно в течение первых двух лет, а продолжительность жизни после появления рецидива обычно исчисляется месяцами. Сразу после внедрения гормонотерапии в клиническую практику начались споры об оптимальном времени ее проведения. В настоящее время гормонотерапию при распространенном раке предстательной железы стараются назначать как можно раньше в надежде на более позднее появление болевого симптома и увеличение продолжительности жизни. Однако правильность такого подхода ставится под сомнение некоторыми исследователями (Lepor Н., et al., 1982).
В 1985 году было начато исследование по сравнению немедленной и отсроченной гормонотерапии у больных с бессимптомным течением диссеминированного и местно-распространенного рака предстательной железы (Рабочая группа по изучению рака предстательной железы Совета по исследованиям в медицине, Англия). Набор больных был прекращен в конце 1993 года. Предварительные результаты этой работы были опубликованы в 1997 году. Авторы исследования получили данные о 934 больных. В группе больных, которым гормонотерапия проводилась отсрочено, 51 больной умер от сопутствующих заболеваний еще до начала лечения (только пять из этих больных были моложе 70 лет), еще 29 больных умерли до начала лечения от основного заболевания. Показанием для начала лечения одинаково часто служили как рост первичной опухоли, так и отдаленные метастазы. Появление отдаленных метастазов и боли в костях чаще наблюдались у больных, которым гормонотерапия проводилась отсрочено (р 0.033).
Маб в медицине что это
Андрогены (мужские половые гормоны) физиологически необходимы клеткам предстательной железы (ПЖ) для роста, функционирования и пролиферации. С другой стороны, тестостерон, который сам по себе не является туморогенным, представляет собой фактор, необходимый для роста и размножения опухолевых клеток ПЖ [1]. Наибольшее количество андрогенов вырабатывается в организме мужчины
в яичках, однако биосинтез 5–10 % этих гормонов происходит в надпочечниках. Интенсивность секреции тестостерона находится под контролем гипоталамо-гипофизарной системы. В гипоталамусе происходит выработка рилизинг-гормона лютеинизирующего гормона (ЛГРГ), который стимулирует секрецию ЛГ и фолликулостимулирующего гормона (ФСГ) передней долей гипофиза. ЛГ стимулирует выработку тестостерона в клетках Лейдига яичек. Поступая внутрь клеток ПЖ, тестостерон превращается в 5α-дигидротестостерон, который по активности в 10 раз превосходит его. Тестостерон, продолжающий вместе с другими андрогенами циркулировать в крови, по механизму отрицательной обратной связи тормозит секрецию ЛГРГ в гипоталамусе.
Методы АДТ
Андрогенная депривация может достигаться двумя методами. Это, во-первых, угнетение секреции андрогенов яичками путем хирургической или медикаментозной кастрации, во-вторых, блокада связывания циркулирующих андрогенов с их рецепторами – антиандрогенная терапия. Использование двух этих методов (сочетание хирургической или медикаментозной кастрации с терапией антиандрогенами) известно под термином “максимальная андрогенная блокада” (МАБ).
1. Снижение концентрации тестостерона (кастрация):
Билатеральная орхидэктомия (хирургическое удаление яичек) – легковыполнимая хирургическая манипуляция, проводимая даже под местной анестезией. При ее применении быстро (через 12 часов) достигается кастрационный уровень тестостерона, однако данный метод является необратимым видом ГТ, оказывающим негативный психологический эффект на пациента.
Эстрогенотерапия – кастрационный эффект осуществляется за счет нескольких механизмов: подавления секреции ЛГРГ, инактивации андрогенов, прямого подавления функции клеток Лейдига; в экспериментах описано также прямое цитотоксическое действие эстрогенов на клетки ПЖ. К побочным эффектам эстрогенотерапии относится выраженная кардиотоксичность, поэтому в настоящее время применение эстрогенов в качестве первой линии ГТ при РПЖ не рекомендуется.
Аналоги (агонисты) ЛГРГ (лейпрорелин, гозерелин, бусерелин, трипторелин) используются в терапии
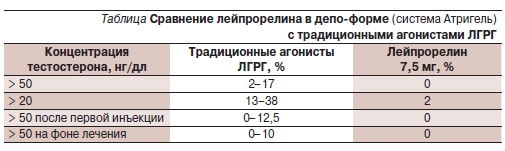
РПЖ уже более 15 лет и представляю наиболее распространенный вид ГТ. Являются синтетическими аналогами природного ЛГРГ, обычно применяются в виде депо-форм с продолжительностью действия 1–6 месяцев. Изначально аналоги ЛГРГ стимулируют рецепторы гипофиза, что приводит к временному повышению концентраций ЛГ и ФСГ с временным повышением уровня тестостерона (феномен вспышки). Активность различных агонистов ЛГРГ неодинакова. В настоящее время принято считать,
что достижение оптимальных результатов их применения возможно только при снижении уровня тестостерона 20 нг/дл выявляется в 18–38 % случаев, тогда как при применении специальной системы доставки лейпрорелина Атригель (биодеградирующий полимерный матрикс) в составе препарата Элигард превышение целевой концентрации тестостерона в 20 нг/дл наблюдается лишь среди 2 % пациентов (см. таблицу) [4].
Антагонисты ЛГРГ – в противоположность агонистам ЛГРГ антагонисты конкурентно связываются с рецепторами ЛГРГ на питуицитах, что приводит к немедленному снижению секреции ЛГ, ФСГ и тестостерона без развития феномена вспышки. Представителем данной группы является абареликс.
При прямом сравнении абареликса и лейпрорелина в исследовании III фазы не отмечено существенных различий в группах больных РПЖ между средними значениями концентраций тестостерона и простат-специфического антигена (ПСА) [5].
2. Антиандрогенная терапия:
Препараты данной группы подразделяются по химической структуре на:
• стероидные антиандрогены (ципротерона ацетат, мегестрола ацетат), не должны назначаться в качестве монотерапии [6];
• нестероидные антиандрогены (нилутамид, флутамид, бикалутамид).
ГТ перед хирургическим лечением РПЖ
Теоретически проведение ГТ перед хирургическим лечением должно способствовать уменьшению размеров опухоли. С целью изучения этого вопроса на базе отделения урологии РОНЦ им. Н.Н. Блохина было проведено исследование, в котором анализировались результаты лечения 386 больных локализованным и местнораспространенным РПЖ, подвергнутых радикальной простатэктомии.
Медиана возраста составила 61,0 ± 6,4 (43–74) года (моложе 60 лет – 40,4 %, 60 лет и старше – 59,6 %), медиана концентрации ПСА до начала лечения – 10,3 ± 12,4 нг/мл ( 20 нг/мл] ПСА до начала лечения, низкодифференцированные опухоли). В подобных случаях ГТ начинается перед курсом облучения, продолжаясь во время лучевой терапии и в течение 6 месяцев после ее окончания. Данный подход обеспечивает увеличение как беспрогрессивной, так и общей выживаемости пациентов [10]. При местнораспространенных стадиях заболевания (Т3-4N0М0) сопутствующая и адъювантная ГТ общей продолжительностью 3 года обе
спечивает повышение общей выживаемости [11].
В группе больных очень высокого риска развития рецидива РПЖ (с наличием метастатического поражения регионарных лимфатических узлов) лучевая терапия в сочетании с немедленной долгосрочной АДТ является строго рекомендованным методом лечения, поскольку подобный подход приводит к увеличению общей, опухолево-специфической и безметастатической выживаемости [12].
ГТ при метастатическом РПЖ
ГТ диссеминированного РПЖ является сегодня, по мнению Американского (AUA) и Европейского
(EAU) обществ урологов, стандартом лечения пациентов этой категории. Однако остается ряд дискуссионных вопросов, по поводу которых в мировом научном сообществе нет единого мнения, а именно: сравнение немедленной и отсроченной ГТ, целесообразность добавления антиандрогенов
к кастрационной терапии, возможность применения интермиттирующего режима ГТ.
В настоящее время монотерапия агонистами ЛГРГ является “золотым” стандартом ГТ распространенного РПЖ. Медикаментозная кастрация – привлекательная альтернатива хирургической, поскольку изменения гормонального профиля обратимы, нет хирургических осложнений и моральной травматизации пациента. Равная эффективность данного режима ГТ и хирургической кастрации доказана в 6 рандомизированных исследованиях, частота объективных ответов при ее применении достигает 80–90 %, а время до прогрессирования – 12–33 месяцев.
Однако, хотя гормональная АДТ является сегодня стандартом терапии метастатического РПЖ, по сути
своей это паллиативный метод лечения, который не оказывает значимого влияния на общую выживаемость пациентов. Кроме того, данный вид терапии ассоциирован с рядом нежелательных явлений, таких как импотенция, приливы, остеопения, анемия, гинекомастия, кардиоваскулярная и
гастроинтестинальная токсичность, тромбоэмболия легочной артерии. Это диктует необходимость оптимизации гормональной АДТ с целью улучшения качества жизни больных. В качестве возможных вариантов рассматривают отсроченное ГТ, уменьшение количества назначаемых препаратов и/или
длительности терапии.
РПЖ является относительно медленнопрогрессирующим заболеванием, вследствие чего у пациентов с бессимптомным течением метастатического процесса возможна отсрочка начала ГТ до появления жалоб. Еще до широкого внедрения в клиническую практику определения ПСА при РПЖ было проведено 4 рандомизированных исследования (VACURG I, VACURG II, MRC, ECOG 7887) по сравнению c
немедленной и отсроченной ГТ. Три из указанных исследований были включены в крупный мета-анализ Agency for Health Care Policy and Research (AHCPR) [13], показавший, что немедленное начало ГТ может замедлить прогрессирование заболевания, уменьшать частоту осложнений при распространенном РПЖ (компрессия спинного мозга, патологические переломы, обструкция мочеточников). Однако немедленная ГТ не улучшает опухолево-специфической выживаемости, обеспечивая лишь небольшое
преимущество в общей выживаемости (абсолютное уменьшение риска смерти на 5,5 % после 10 лет наблюдения). В прошлом году были опубликованы результаты исследования EORTC 30891 [14], в котором при сравнении немедленной и отложенной ГТ определение ПСА позволяло более точно контролировать течение заболевания. Медиана наблюдения составила 12,9 года, при этом отсроченное лечение потребовалось более 52 % пациентов. Было показано, что немедленная ГТ действительно обеспечивает небольшое преимущество в общей выживаемости пациентов с распространенным РПЖ, однако отсутствует преимущество в опухолево-специфической выживаемости. Авторы выделили группу пациентов, которые действительно получат преимущество от немедленного начала ГТ – это молодые мужчины ( 50 нг/мл) на момент установки диагноза.
Таким образом, согласно результатам крупных рандомизированных исследований, немедленная ГТ достоверно, но незначительно увеличивает общую выживаемость, достоверно снижает риск развития осложнений опухолевого процесса, ассоциирована с увеличением частоты развития нежелательных
явлений, но увеличивает стоимость лечения. Исходя из всего вышеперечисленного, имеющейся доказательной базы недостаточно, чтобы рекомендовать немедленную ГТ как стандарт лечения метастатического ПЖ.
Следующий вопрос – целесообразность добавления антиандрогенов к проводимой кастрационной терапии, т. е. проведения МАБ. Обоснованием усиления проводимого режима лечения с помощью добавления антиандрогенной терапии является тот факт, что местом выработки 5 % мужских половых гормонов является ткань надпочечников. Проводимая кастрационная терапия направлена на прекращение секреции тестостерона гонадами, однако никак не влияет на функцию надпочечников. Дополнительный блок андрогеногенеза в надпочечниках может повысить эффективность про-
водимой ГТ распространенного РПЖ. Оценка ГТ в режиме МАБ по сравнению с кастрационной монотерапией проводилась в ряде работ. Согласно мета-анализу [15], объединившему результаты 26 рандомизированных исследований, важную роль играет тип используемого антиандрогена. Так,
добавление к кастрационному лечению стероидных антиандрогенов приводит к снижению показателей выживаемости по сравнению с монотерапией. Напротив, проведение ГТ в режиме
МАБ с применением нестероидных антиандрогенов (в частности, 50 мг бикалутамида) снижает риск смерти на 20 % при сроках наблюдения более 5 лет. Обратной стороной медали в данном случае является повышение токсичности проводимого лечения (в основном за счет нежелательных явлений со стороны желудочно-кишечного тракта и печени), что увеличивает риск отмены терапии в 2–6 раз.
Важным показанием к использованию антиандрогенов в ГТ распространенного РПЖ является подавление феномена вспышки, описанного Dijkman и соавт. (1995). После первой инъекции агониста ЛГРГ в течение 10–14 суток происходит гиперстимуляция рецепторов ЛГРГ, что вызывает следующий каскад реакций: гиперстимуляцию рецепторов ЛГРГ → гиперсекрецию ЛГ → гиперсекрецию тестостерона в яичках → увеличение интенсивности симптомов РПЖ. В данном случае назначение на 10–14 суток нестероидных антиандрогенов, которые блокируют повышенную выработку тестостерона в гонадах, позволяет избегать усугубления проявлений заболевания.
Применение антиандрогенов также возможно при проведении второй линии ГТ, целью которой является отсрочка начала химиотерапевтического лечения за счет увеличения беспрогрессивной выживаемости. Согласно рекомендациям EAU, добавление антиандрогенов к проводимой
кастрационной терапии приводит значимому снижению уровня ПСА (> 50 %) на срок 4–6 месяцев у 60 % пациентов. При регистрации неэффективности ГТ в режиме МАБ (повторный рост ПСА) рекомендована замена одного нестероидного антиандрогена на другой, что также позволяет добиваться снижения уровня ПСА приблизительно 60 % больных. К сожалению, данная манипуляция со сменой препарата для антиандрогенной терапии теряет свою эффективность спустя 4–6 месяцев. В дальнейшем отмена антиандрогенной терапии также способна приводить к улучшению состояния 30–40 % пациентов на срок до 6 месяцев.
Большой интерес вызывает и возможность применения интермиттирующего режима ГТ при распространенном РПЖ. Проведено более 10 рандомизированных исследований III фазы, оценивающих возможность данного подхода. Дизайн исследований был схожим: в них включали как первичных пациентов с вновь установленным диагнозом диссеминированного РПЖ, так и больных с рецидивами после лечения по поводу локализованного и местнораспространенного рака (после лучевой терапии и радикальной простатэктомии). На первом этапе всем пациентам проведен индукционный курс в режиме МАБ в течение 6 месяцев. Затем больные, у которых уровень ПСА снизился 10 нг/мл. По результатам проведенных исследований оказалось, что интермиттирующая АДТ обеспечивает общую выживаемость, равную таковой при постоянном режиме терапии, характеризуясь лучшим качеством жизни в периоды без лечения. По данным исследования SEUG 9401 (2009) [16], у больных группы интермиттирующего режима реже развивались такие нежелательные явления, как приливы, гинекомастия, головная боль, кожная сыпь. В периоды
без лечения восстанавливалась сексуальная активность в 30 % случаев. Установлено, что критериями неблагоприятного прогноза ПСА-ответа на индукционную ГТ (18–37 % пациентов) являются исходный высокий уровень ПСА, показатель Глисона ≥ 7 баллов, категория M+ (наличие ≥ 6 метастатических очагов).
При проведении ГТ в интермиттирующем режиме не выявлено увеличения гормонально-чувствительного статуса, не получено данных на увеличение специфической выживаемости. Применение интермиттирующего режима не ухудшало результатов лечения пациентов с рецидивами заболевания после предыдущего радикального хирургического [17] или лучевого лечения [18] по сравнению с постоянной терапией, при этом выраженность побочных эффектов достоверно реже
регистрировалась в группе прерывистой терапии. С экономической точки зрения интермиттирующий режим выглядит предпочтительней, поскольку в среднем около 50 % времени при прерывистом режиме пациент не получает терапию, за счет чего снижается его стоимость. В экспериментальных
моделях было, что прерывистая терапия замедляет развитие рефрактерности к кастрации.
Таким образом, кандидатами на проведение интермиттирующей ГТ являются хорошо информированные и готовые к регулярным обследованиям пациенты, у которых подтверждено наличие местнораспространенного или диссеминированного РПЖ с минимальным количеством метастазов (категория М+ без костных метастазов или с единичными очагами в костях), относительно низким уровнем ПСА до начала лечения ( 100 нг/мл до начала терапии, при значительной распространенности опухолевого процесса.
Литература
1. Walsh PC. Physiologic basis for hormonal therapy in carcinoma of the prostate. Urol Clin North Am;2(1):125–40.
2. Huggins C, Stevens RE Jr, Hodges CV. Studies on prostate cancer. II. The effect of castration on
advanced carcinoma of the prostate gland. Arch Surg 1941;43:209–23.
3. McLeod DG. Hormonal therapy: historical perspective to future directions. Urology 2003;61(2 Suppl 1):3–7.
4. Perez-Marreno R, Chu FM, Gleason D, et al. A six-month, open-label study assessing a new formulation of leuprolide 7.5 mg for suppression of testosterone in patients with prostate cancer. Clin Ther 2002;24:1902–14.
5. Trachtenberg J. A phase 3, multicenter, open label, randomized study of abarelix versus leuprorelin plus daily antiandrogen in men with prostate cancer. J Urol 2002;167(4):1670–74.
6. Moffat LE. Comparison of Zoladex, diethylstilbestrol and cyproterone acetate treatment in advanced prostate cancer. Eur Urol 1990;18(Suppl 3):26–7.
7. Черняев В.А., Матвеев В.Б., Волкова М.И. и др. Факторы прогноза биохимического рецидива локализованного и местнораспространенного рака простаты после радикальной простатэктомии //
Онкоурология. 2012. № 4. С. 58–64.
8. McLeod DG, Iversen P, See WA, et al. Casodex Early Prostate Cancer Trialists’ Group. Bicalutamide 150 mg plus standard care vs standard care alone for early prostate cancer. BJU Int 2006;97(2):247–54.
9. Shelley MD, Kumar S, Wilt T, еt al. A systematic review and meta-analysis of randomised trials of neo-adjuvant hormone therapy for localised and locally advanced prostate carcinoma. Cancer Treat Rev 2009;35(1):9–17.
10. Zelefsky MJ, Pei X, Chou JF, et al. Dose escalation for prostate cancer radiotherapy: predictors of
long term biochemical tumor control and distant metastases-free survival outcomes. Eur Urol 2011;60(6):1133–39.
11. Horwitz EM, Bae K, Hanks GE, et al. Tenyear follow-up of radiation therapy oncology group protocol 92–02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 2008;26(15):2497–504.
12. Lawton CA, Winter K, Grignon D, et al. Androgen suppression plus radiation versus radiation alone
for patients with D1/pathologic node-positive adenocarcinoma of the prostate: updated results based on a national prospective randomized trial, RTOG 85-31. J Clin Oncol 2005;23(4):800–7.
13. Seidenfeld J, Samson DJ, Aronson N. Relative effectiveness and cost-effectiveness of methods
of androgen suppression in the treatment of advanced prostate cancer. Evid Rep Technol Assess (Summ). 1999 May;(4):i-x,1- 246,I1-36, passim.
14. Studer UE, Collette L, Whelan P, et al. Using PSA to guide timing of androgen deprivation in patients with T0-4 N0-2 M0 prostate cancer not suitable for local curative treatment (EORTC 30891). Eur Urol 2011;53:941–49.
15. Klotz L, Schellhammer P. Combined androgen blockade: the case for bicalutamide. Clin Prostate Cancer 2005;3(4):215–19.
16. Calais da Silva FE, Bono AV, Whelan P, et al. ntermittent androgen deprivation for locally advanced and metastatic prostate cancer: results from a randomised phase 3 study of the South European Uroncological Group. Eur Urol 2009;55(6):1269–77.
17. Tunn U. The current status of intermittent androgen deprivation (IAD) therapy for prostate cancer: putting IAD under the spotlight. BJU Int 2007;99(Suppl 1):19–22; discussion 23–4.
18. Crook JM, O’Callaghan CJ, Duncan G. et al. Intermittent androgen suppression for rising PSA level after radiotherapy. N Engl J Med 2012;367(10):895–903.
19. Scholz MC, Jennrich RI, Strum SB, et al. Intermittent use of testosterone inactivating pharmaceuticals using finasteride prolongs the time off period. J Urol 2006;175(5):1673–78.
20. Buchan NC, Goldenberg SL. Intermittent versus continuous androgen suppression therapy: do we have consensus yet? Curr Oncol 2010;17(Suppl 2):S45–48.