Магний обязательный компонент молекул чего
Магний (Mg, Magnesium)
История магния
Магний в виде металла был впервые получен Гемфри Дэви в 1808 году. Английский химик проводил процесс электролиза между влажной смесью белой магнезии и оксидом ртути, в результате чего получил сплав ртути с неизвестным металлом (амальгаму). После выгонки ртути Дэви получил новое вещество – порошок металла, который был назван магнием (calorizator). Через два десятилетия, в 1828 году француз А.Бюсси получил чистый металлический магний.
Общая характеристика магния
Магний является элементом главной подгруппы II группы III периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 12 и атомную массу 24,305. Принятое обозначение – Mg (от латинского Magnesium).
Нахождение в природе
По количеству содержания в земной коре магний занимает 8-е место среди минеральных веществ, он очень распространён. Природными источниками магния являются морская вода, ископаемые минеральные отложения и рассолы.
Физические и химические свойства
Магний является лёгким и ковким металлом, его цвет – серебристо-белый с явным металлическим блеском. В обычном состоянии покрыт плёнкой оксида магния, которую можно разрушить, нагрев металл до 600-650˚С. Магний сгорает, выделяя ослепительно белое пламя и образуя оксид и нитрид магния.
Суточная потребность в магнии
Суточная потребность в магнии зависит от возраста, пола и физического состояния человека. Для здорового взрослого человека составляет от 400 до 500 мг.
Продукты питания богатые магнием
В продуктах питания содержится различное количество магния, расположим их по мере убывания содержания полезного микроэлемента:
Усвояемость магния
Всасывание органических соединений магния в основном происходит в двенадцатиперстной и толстой кишках, при чрезмерном употреблении кофеина, алкоголя и калия организм теряет значительную часть магния с мочой.
Взаимодействие с другими
Для организма важен баланс между кальцием и магнием, потому что именно эти минералы отвечают за нормальное состояние костной ткани и зубов. В аптечных витаминно-минеральных комплексах количество кальция и магния содержится в оптимальных количествах.
Натрий, магний и фосфор регулируют процессы в нервной системе и отвечают за мышечную активность. Обменные процессы магния в организме происходят с помощью витаминов В6, D, Е и калия.
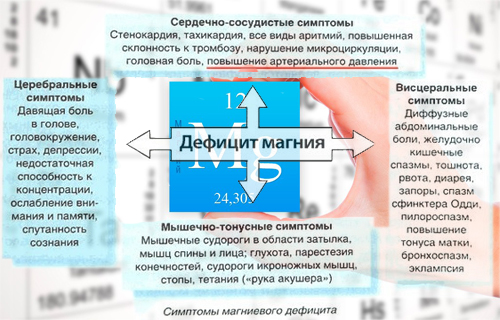
Признаки нехватки магния
Нехватку магния в организме могут вызвать болезни почек, расстройство желудка, приём мочегонных средств и некоторых контрацептивов, чрезмерное увлечение алкоголем и кофеином. Признаками нехватки магния считают бессонницу, раздражительность, головокружения, нарушения сердцебиения и скачки кровяного давления, частые головные боли, чувство усталости, мерцающие точки перед глазами, судороги, мышечные спазмы, выпадение волос.
Признаки избытка магния
Признаками избытка магния считают:
Полезные свойства магния и его влияние на организм
Магний важен для эффективного функционирования нервов и мышц, важен для превращения сахара крови в энергию. Магний поддерживает здоровое состояние зубов, помогает предупредить отложения кальция, камни в почках и желчном пузыре, приносит облегчение при несварении. Организм человека содержит приблизительно 21 г магния.
Магний нормализует деятельность сердечно-сосудистой и эндокринной систем организма, функции головного мозга, оказывает помощь при выведении токсинов и тяжёлых металлов.
Применение магния в жизни
Соединения магния (сплавы) используются в самолётостроении и автомобильном производстве из-за прочности и лёгкости магниевых сплавов. Магний применяется как химический источник тока, в медицине, военном деле, в фотографии.
Почему так значим для растительной клетки Mg? помогите оч срочно!
Магний поглощается корнями растений главным образом как катион Mg++, и в растении остается преимущественно в ионной форме, регулируя, как жизненно важный антагонист во взаимодействии с калием и кальцием, оводненность клеточных коллоидов. Магний — обязательный компонент хлорофилла. В органических соединениях он содержится (вместе с кальцием) в фитине и пектиновых веществах. Магний активизирует многие ферменты, в особенности фосфорилазы. Поэтому ом имеет большое значение в энергетическом обмене и тем самым во всех других важных процессах обмена веществ, таких как фотосинтез, углеводный, жировой и белковый обмены. При недостатке магния хотя и происходит синтез аминокислот, но их связывание до высокомолекулярных белковых веществ ограничивается. Это происходит в рибосомах, интегрирующей составной частью которых является магний. Вследствие ограничения синтеза протеина отношение белкового азота к растворимому сдвигается в пользу последнего.
Доля магния, содержащаяся в хлорофилле, составляет лишь около 15-20% общего содержания магния в растении, и, таким образом, даже при недостатке магния его всегда еще достаточно для образования хлорофилла. Гораздо больше страдают от недостатка магния многие коллоиды плазмы и ферментативные реакции, так как следствием этого бывает затруднение не только ассимиляции, но и синтеза белка. Через образование хлоропластов это сказывается также на образовании хлорофилла и тем самым на окраске растений.
Магний (Mg) входит в молекулу хлорофилла, является кофактором ряда ферментов, обеспечивает стабильность нуклеиновых кислот. Магний участвует в процессе фотосинтеза, регуляции избирательной проницаемости клеточных мембран.
Магний – незаменимый микроэлемент для организма
Магний называют «генеральным контролёром», необходимым для множества биохимических реакций в нашем теле. К примеру, магний отвечает за репликацию ДНК и РНК, участвует в обмене веществ, синтезе белковых молекул – главного материала для мышц и костей.
Этот химический элемент помогает управлять стрессом, способствует передаче нервных импульсов, регулирует сокращение мышц. Магний поддерживает функции памяти, речи, мышления, внимания.
Он незаменим для выведения токсинов и защиты клеток, поскольку без него не синтезируется глутатион – самый сильный из антиоксидантов. К тому же, магний помогает усвоению кальция и, таким образом, защищает нас от остеопороза и кариеса.
И наконец, энергия. Магний играет важную роль в образовании более 300 ферментов, участвующих в реакциях производства энергии в клетке.
Эти и множество других процессов в нашем теле обеспечиваются всего лишь 25-ю граммами магния, содержащимся в организме. Поэтому следует поддерживать ежедневное поступление магния для сохранения хрупкого баланса.
Недостаток магния
Дефицит магния – распространенная проблема во всем мире. Однако клинически очевидные симптомы дефицита проявляются довольно редко. К тому же, анализ крови часто неинформативен, поскольку 99% микроэлемента находится в костях, мышцах, мягких тканях.
Р екомендуемая суточная потребность магния у здорового человека составляет около 400-600 мг. При этом считается, что около 30% людей испытывают дефицит этого вещества, то есть, поступление его с едой недостаточно.
Определенные факторы могут повлиять на хроническую нехватку элемента в организме. Например, крайне важно принимать магний пациентам с сахарным диабетом, астмой, гипертонией, атеросклерозом, остеопорозом.
Повышенную потребность в магнии испытывают беременные и кормящие, подростки в период интенсивного роста и пожилые люди. Отметим, что с возрастом дефицит усугубляется, достигая максимума к 70 годам.
Наш организм особенно нуждается в магнии при тяжелых физических нагрузках и в стрессовых ситуациях. Низкий уровень магния может быть признаком некоторых проблем с пищеварением, недоедания или алкоголизма. Его недостаток возникает при употреблении кофеина и мочегонных лекарств.
Магний против стресса
Магний тормозит процессы возбуждения – этим объясняется его естественное «антистрессовое» воздействие, однако баланс вещества весьма неустойчив.
Наша нервная система чутко реагирует на уровень магния – при эмоциональной нагрузке организм изрядно расходует магний. Отсюда и происходит специфическое название дефицита магния – «болезнь успешных людей».
Еще одна категория подверженных стрессу – это старшие школьники и студенты в период сдачи ЕГЭ или сессий. В это время резко возрастает тревожность, связанная со страхом, который провоцирует стресс.
Дополнительный прием препаратов магния (особенно в сочетании с витамином В6) оказывает нормализующее действие на нервную систему при чрезмерном эмоциональном напряжении.
Некоторые признаки дефицита магния
Один из косвенных симптомов нехватки магния – судороги в икроножных мышцах. Вначале они возникают после ходьбы, бега или плавания, в более запущенных стадиях – и в состоянии покоя.
Иногда из-за дефицита магния появляется чувство онемения конечностей, «ползания мурашек».
Пониженное его содержание может вызвать «беспричинные» головные боли, бессонницу, снижение внимания и памяти. Одним из признаков нехватки магния являются мышечная слабость и повышенная утомляемость, не связанные с недосыпанием, стрессом или физической нагрузкой: «я просто устал».
Учёные связывают недостаточное потребление магния с низкой минеральной плотностью костей, а значит, и риском возникновения остеопороза и переломов костей, хотя многие другие факторы влияют на это.
Еда и биодобавки
Употребление в пищу листовой зелени, овощей, фруктов, злаков и бобовых поможет достичь рекомендуемой суточной нормы. Больше всего магния содержат орехи, особенно миндаль, кедровые орехи и арахис, тыквенные семечки, семена кунжута, шпинат, авокадо.
Другие продукты, содержащие магний: овсяная каша, фасоль, банан и яблоки, рыба, изюм, куриная грудка, говядина, брокколи и морковь.
Основная проблема с магнием состоит в том, что он участвует в огромном количестве обменных реакций. Это может привести к его дефициту даже при достаточном поступлении с продуктами питания. Поэтому большинству людей необходимо дополнительно принимать магний.
Если говорить про добавки, то к числу хорошо абсорбируемых формул магния относятся: цитрат магния, малат магния, таурат магния и глицинат магния. Несомненно, при подборе препаратов следует проконсультироваться с врачом.
О важной роли витамина D для нашего организма читайте в материале ForPost «Витамин D3: пить или не пить?».
Магний, свойства атома, химические и физические свойства
Магний, свойства атома, химические и физические свойства.
24,304-24,307 1s 2 2s 2 2p 6 3s 2
Магний — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 12. Расположен во 2-й группе (по старой классификации — главной подгруппе второй группы), третьем периоде периодической системы.
Физические свойства магния
Атом и молекула магния. Формула магния. Строение магния:
Магний (лат. Magnesium, от др.-греч. βαρύς – «тяжёлый») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Mg и атомным номером 12. Расположен в 2-й группе (по старой классификации — главной подгруппе второй группы), третьем периоде периодической системы.
Магний – щёлочноземельный металл. Относится к группе цветных металлов.
Магний обозначается символом Mg.
Как простое вещество магний при нормальных условиях представляет собой лёгкий, ковкий металл серебристо-белого цвета.
Молекула магния одноатомна.
Химическая формула магния Mg.
Строение атома магния. Атом магния состоит из положительно заряженного ядра (+12), вокруг которого по трем атомным оболочкам движутся 12 электронов. При этом 10 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку магний расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома магния – на 3s-орбитали находится два спаренных электрона. В свою очередь ядро атома магния состоит из 12 протонов и 12 нейтронов. Магний относится к элементам s-семейства.
Радиус атома магния (вычисленный) составляет 145 пм.
Атомная масса атома магния составляет 24,304-24,307 а. е. м.
Изотопы и модификации магния:
Свойства магния (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Магний |
| 102 | Прежнее название | |
| 103 | Латинское название | Magnesium |
| 104 | Английское название | Magnesium |
| 105 | Символ | Mg |
| 106 | Атомный номер (номер в таблице) | 12 |
| 107 | Тип | Металл |
| 108 | Группа | Цветной, щёлочноземельный металл |
| 109 | Открыт | Джозеф Блэк, Шотландия, 1755 г., Хемфри Дэви, Великобритания, 1808 г., Антуан Александр Брутус Бюсси, Франция, 1829 г. |
| 110 | Год открытия | 1755 г. |
| 111 | Внешний вид и пр. | Лёгкий, ковкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 2,9 % |
| 120 | Содержание в морях и океанах (по массе) | 0,13 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,06 % |
| 122 | Содержание в Солнце (по массе) | 0,07 % |
| 123 | Содержание в метеоритах (по массе) | 12 % |
| 124 | Содержание в организме человека (по массе) | 0,027 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 24,304-24,307 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 |
| 203 | Электронная оболочка | K2 L8 M2 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 150 пм |
| 206 | Ковалентный радиус* | 141 пм |
| 207 | Радиус иона (кристаллический) | Mg 2+ 1,584 г/см 3 (при температуре плавления 650 °C и иных стандартных условиях , состояние вещества – жидкость), 1,57 г/см 3 (при 651 °C и иных стандартных условиях , состояние вещества –жидкость) |
| 402 | Температура плавления | 650 °C (923 K, 1202 °F) |
| 403 | Температура кипения | 1090 °C (1363 K, 1994 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 8,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 128 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,983 Дж/г·K (при 25 °C), 1,6 Дж/г·K (при 100 °C), 1,31 Дж/г·K (при 650 °C) |
| 410 | Молярная теплоёмкость* | 24,869 Дж/(K·моль) |
| 411 | Молярный объём | 13,984 см³/моль |
| 412 | Теплопроводность | 156 Вт/(м·К) (при стандартных условиях ), 156 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Гексагональная плотноупакованная |
| 513 | Параметры решётки | a = 3,2029 Å, c = 5,2000 Å |
| 514 | Отношение c/a | 1,624 |
| 515 | Температура Дебая | 318 К |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-95-4 |
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома магния согласно [1] составляет 160 пм.
206* Ковалентный радиус магния согласно [1] и [3] составляет 141±7 пм и 136 пм соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) магния согласно [3] составляет 9,20 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) магния согласно [3] составляет 131,8 кДж/моль.
410* Молярная теплоемкость магния согласно [3] составляет 24,90 Дж/(K·моль).
Физические свойства магния:
Химические свойства магния. Взаимодействие магния. Реакции с магнием:
1. Реакция взаимодействия магния и водорода:
В результате реакции образуются гидрид магния. Реакция протекает при избыточном давлении.
2. Реакция окисления кислородом магния:
2Mg + O2 → 2MgO (t = 600-650 °C).
3. Реакция взаимодействия магния и хлора:
В результате реакции образуются хлорид магния.
4. Реакция взаимодействия магния и кремния:
В результате реакции образуются силицид магния. Реакция протекает при сплавлении реакционной смеси.
5. Реакция взаимодействия магния и азота:
В результате реакции образуются нитрид магния.
6. Реакция взаимодействия магния и фосфора:
В результате реакции образуются фосфид магния.
7. Реакция взаимодействия бора и магния:
В результате реакции образуются борид магния.
8. Реакция взаимодействия висмута и магния:
В результате реакции образуются висмутид магния.
9. Реакция взаимодействия сурьмы и магния:
В результате реакции образуются стибид магния.
10. Реакция взаимодействия магния и воды:
В результате реакции образуются гидроксид магния и водород. В ходе реакции используется горячая вода.
11. Реакция взаимодействия оксида бериллия и магния:
BeO + Mg → MgO + Be (t = 700-800 °C).
В результате реакции образуются оксид магния и бериллий.
12. Реакция взаимодействия оксида азота (I) и магния:
В результате реакции образуются азот и оксид магния.
13. Реакция взаимодействия оксида азота (II) и магния:
2NO + 2Mg → N2 + 2MgO (t ≈ 500 °C).
В результате реакции образуются азот и оксид магния.
14. Реакция взаимодействия магния и тетраоксида диазота:
В результате реакции образуются нитрат магния и оксид азота.
15. Реакция взаимодействия оксида лития и магния:
Li2O + Mg → 2Li + MgO (t = 800 °C).
В результате реакции образуются литий и оксид магния.
Li2O + Mg + H2 → 2LiH + MgO (t = 450-500 °C).
В результате реакции образуются гидрид лития и оксид магния.
17. Реакция взаимодействия оксида бора и магния:
В результате реакции образуются в первом случае – борид магния и оксид магния, во втором – бор и оксид магния.
Вторая реакция представляет собой метод получения аморфного бора. Полученный бор – бор Муассана, чистота 95-98 %.
18. Реакция взаимодействия оксида углерода и магния:
CO2 + 2Mg → 2MgO + C (t ≈ 500 °C).
В результате реакции образуются оксид магния и углерод. В ходе реакции происходит сжигание магния в среде углекислого газа.
19. Реакция взаимодействия оксида кремния и магния:
SiO2 + 2Mg → Si + 2MgO (t ≈ 1000 °C),
SiO2 + 4Mg → Mg2Si + 2MgO (t = 800 °C).
В результате реакции образуются в первом случае – кремний и оксид магния. Первая реакция представляет собой лабораторный метод получения кремния осуществляют следующем образом: смесь сухого песка и измельченного магния зажигают магниевой лентой.
Во втором случае в результате реакции образуются силицид магния и оксид магния. Реакция протекает при температуре не более 800°C в атмосфере водорода.
CaO + H2 + Mg → CaH2 + MgO (t = 800-900 °C).
В результате реакции образуются гидрид кальция и оксид магния.
21. Реакция взаимодействия магния и бромоводорода:
В результате реакции образуются бромид магния и водород. В ходе реакции используется разбавленный раствор бромоводорода.
22. Реакция взаимодействия магния и фтороводорода:
В результате реакции образуются фторид магния и водород. В ходе реакции используется разбавленный раствор фтороводорода.
23. Реакция взаимодействия магния и сероводорода:
В результате реакции образуются сульфид магния и водород.
24. Реакция взаимодействия магния и азотной кислоты:
В результате реакции образуются в первом случае – нитрат магния, азот и вода, во втором – нитрат магния, оксид азота (I) и вода, в третьем – нитрат магния, оксид азота (I), оксид азота (II) и вода. В ходе реакции в первом и втором случае применяется разбавленная азотная кислота, в третьем – 30%-й раствор азотной кислоты.
25. Реакция взаимодействия магния и ортофосфорной кислоты:
В результате реакции образуются ортофосфат магния и водород. При этом в ходе реакции используется разбавленный раствор ортофосфорной кислоты.
Аналогичные реакции проходят и с другими кислотами.
26. Реакция взаимодействия магния и аммиака:
В результате реакции образуются нитрид магния и водород.
27. Реакция взаимодействия фторида бериллия и магния:
BeF2 + Mg → MgF2 + Be (t = 700-750 °C).
В результате реакции образуются фторид магния и бериллий.
28. Реакция взаимодействия фторида кремния и магния:
SiF4 + 2Mg → Si + 2MgF2 (t = 500-600 °C).
В результате реакции образуются кремний и фторид магния. В ходе реакции применяется примесь – силицид магния Mg2Si.
29. Реакция взаимодействия карбоната лития и магния:
30. Реакция взаимодействия магния и карбоната рубидия:
31. Реакция взаимодействия карбида кремния и магния:
2SiC + 5Mg → 2Mg2Si + MgC2 (t ≈ 700°C).
В результате реакции образуются силицида магния и карбида магния.
32. Реакция взаимодействия хлорида олова и магния:
SnCl2 + Mg → MgCl2 + Sn (t = 200-300 °C).
В результате реакции образуются хлорид магния и олово.
33. Реакция взаимодействия хлорида ванадия и магния:
В результате реакции образуются ванадий и хлорид магния.
34. Реакция взаимодействия хлорида железа и магния:
2FeCl3 + 3Mg → 2Fe + 3MgCl2 (t = 300-400 °C).
В результате реакции образуются железо и хлорид магния.
35. Реакция взаимодействия хлорида титана и магния:
TiCl4 + 2Mg → Ti + 2MgCl2 (t = 800-850 °C).
В результате реакции образуются титан и хлорид магния. В ходе реакции используется магний в виде расплава. Реакцию проводят при температуре в отсутствие воздуха в атмосфере аргона.
36. Реакция взаимодействия хлорида гафния и магния:
HfCl4 + 2Mg → Hf + 2MgCl2 (t = 650-700 °C).
В результате реакции образуются гафний и хлорид магния.
37. Реакция взаимодействия хлорида циркония и магния:
ZrCl4 + 2Mg → Zr + 2MgCl2 (t ≈ 700 °C).
В результате реакции образуются цирконий и хлорид магния.
38. Реакция взаимодействия хлорида тантала и магния:
2TaCl5 + 5Mg → 2Ta + 5MgCl2 (t ≈ 750°C).
В результате реакции образуются тантал и хлорид магния.
39. Реакция взаимодействия хлорида ванадия, оксида углерода и магния:
В результате реакции образуются гексакарбонилванадат магния и хлорид магния. Реакция протекает в пиридине при температуре около 135°C и избыточном давлении.
40. Реакция взаимодействия сульфата бериллия, воды и магния:
В результате реакции образуются гидроксосульфат бериллия, сульфат магния и водород.
41. Реакция взаимодействия сульфида титана и магния:
TiS2 + 2Mg → 2MgS + Ti (t ≈ 1000 °C).
В результате реакции образуются сульфид магния и титан. Реакция протекает в атмосфере аргона.
42. Реакция взаимодействия тетрабората натрия и магния:
43. Реакция взаимодействия магния и пентана :
В результате реакции образуются карбид магния и водород. Реакция протекает при нагревании до температуры не более 700°C.
44. Реакция взаимодействия магния и циклопентадиена:
В результате реакции образуются циклопентадиенил магния и водород.
45. Реакция взаимодействия магния и ацетилена:
В результате реакции образуются карбид магния и водород.