Магний является антагонистом кальция что это значит
Первые признаки и последствия дефицита магния
Жили мы себе, не тужили. И тут здоровье пошатнулось. Благодаря активной рекламной кампании лекарственных средств в интернете, по теле- и радиовещанию мы уже знаем, где и как искать ответ на свой вопрос. Итак, набираем: «чем я болею и что нужно принимать».
– Тревога, беспокойство, страх. Пишут, что это лечится успокаивающими, анксиолитиками (противотревожными), даже антидепрессантами. Нужно к неврологу и его рецепт.
– Бессонница – сразу информация про снотворное. Есть безрецептурные, попрошу помощь провизора.
– Повышение артериального давления – сотни антигипертензивных средств в большом разнообразии. Темный лес, надо идти к врачу.
– Нехватка сил, усталость – о, красиво звучит – астеническое состояние, скорее лечиться, пишут, что возможно, это депрессия и понадобятся антидепрессанты.
– Тошнота, проблемы со стулом – это вообще проще простого. Дома все есть, сейчас сам полечу.
– Беспричинное обострение бронхиальной астмы – наверное, врач опять гормоны назначит. А что делать.
– Спазмы мышц, судороги? О, это магний, нужен магний! Это я знаю.
Признаки дефицита магния
Вот что это. Товарищи! Все вышеперечисленное – тоже может быть магний (Mg). А точнее, его нехватка. Не стопроцентная причина, но очень распространенная. Ужасно?
– Да. Лечим симптомы, но причина остается. И что будет дальше? Снова вернутся симптомы?
– Вполне вероятно. Итак.
Почему возникает дефицит магния
По разным данным, от 70 до 90% взрослого населения страдает дефицитом магния.
Магний – основной клеточный компонент, находящийся на втором месте по содержанию в клетке.
до 60% его содержится в костях и зубах – это такое своеобразное депо магния; 20% – в составе мышц и органов; 20% приходится на нервы и мозг.
Причины дефицита магния
Абсолютно разные. Но при недостатке он сразу высвобождается из своего депо, из костей, где его много, а потому даже при появившихся признаках дефицита лабораторные показатели магния крови могут быть в норме.
Как определить дефицит магния в организме
Помимо лабораторных данных анализов крови, диагноз устанавливается на основании симптомов.
Mg крайне важен для здоровья и взрослого человека, и ребенка. Он принимает участие в десятках и сотнях реакций:
Mg поступает в наш организм с едой. Им богаты овощи, злаковые и крупы, бобовые, орехи и семена, рыба и морепродукты, тыква и какао, кисломолочные продукты. Производители минеральной воды обогащают магнием свою продукцию.
Почему в еде его мало?
Нехватка магния причины
Общие факторы:
– Обеднение почв микроэлементами, включая магний, в результате активного земледелия. Соответственно, снижение количества его в крупах, овощах, семенах.
– Загрязнение почв промышленными отходами предприятий также снижает его уровень
– Термическая обработка и рафинирование пищи снижает исходное количество микроэлемента до 80%.
Причины недостатка магния в организме также скрываются в обработке питьевой воды фтором и хлором, связывающими магний
Индивидуальные факторы:
– повышенная потребность в магнии увеличивает риск развития дефицита (беременность, физические нагрузки, инфекции, стресс)
– заболевания желудочно-кишечного тракта, на фоне которых усвоение магния из пищи снижено
– заболевания почек и эндокринной системы также могут стать причиной
– употребление некоторых лекарственных средств
– снижение усвоения Mg из-за приверженности к белковой, жирной пище, алкоголю, кофе
– мода на прием кальция (Са) и кальцийсодержащих продуктов питания. Кальций – антагонист магния, это его противовес в клетке, при превышении допустимой нормы Са уровень Mg сразу снижается.
Симптомы дефицита магния в организме человека
Мышечные клетки составляют скелетную мускулатуру, из них также состоят стенки наших органов и стенки сосудов.
Самая важная мышца нашего организма – сердечная, это миокард, образующий сердце.
Магний отвечает за расслабление мышечной клетки. Когда его не хватает, то сократившись, клетка не в состоянии полноценно расслабиться. Противовес магния – кальций, в это время накапливается в клетке.
Отсюда возникают повышение артериального давления, коронароспазм, нарушение ритма сердца, мышечные судороги, кальцификация артерий и тромбообразование, спазмы сосудов и стенок органов (бронхиальная астма и др.).
Магний препятствует повышению тонуса матки во время беременности.
При снижении его возникает риск невынашивания, преждевременных родов, гипоксии плода и последующей задержке развития ребенка.
Магний способствует внутриутробному формированию костной и соединительной ткани у плода.
При стойкой нехватке возникает риск врожденных пороков развития
Магний выводит лишний кальций из почек. При его нехватке кальций в почках начинает накапливаться.
Отсюда образование камней. При соединении кальция с мочевой, фосфорной и щавелевой кислотами образуются соли ураты, фосфаты, оксалаты. Из них формируются камни.
При дефиците магния он высвобождается из своих запасов – из костей, нарушая их химический состав и стабильность.
Начинается опосредованное разрушение костей и зубов.
Магний входит в состав фермента, понижающего уровень холестерина и триглицеридов. А значит участвует в обмене жиров. При нехватке происходит формирование холестериновых бляшек.
Отсюда возникает атеросклероз. Из-за атеросклеротических бляшек в сосудах идет сужение просвета и нарушение кровообращения. А в перспективе – ишемическая болезнь сердца, стенокардия, ишемия головного мозга с дальнейшим риском развития инфаркта или инсульта.
Способствует выработке инсулина и транспортировке его к клеткам
При снижении Mg увеличивается концентрация глюкозы в крови и может возникнуть сахарный диабет
Отвечает за синтез антител (иммуноглобулинов)
При нехватке – снижение иммунного ответа организма к вирусным и бактериальным агентам
Участвует в энергетическом обмене в клетке
При снижении – беспричинная усталость, даже после сна. Также нехватка сил
Участвует в передаче нервных импульсов
При снижении повышается нервно-мышечная возбудимость с появлением раздражительности, депрессии, мигрени, нарушением сна, бессонницы, ночными кошмарами.
Также магний участвует в синтезе белка и минеральном обмене, регулирует выработку гормонов, деятельность мочеполовой системы, нормализует работу почек.
снижает проявления ПМС, корректирует дисменорею (боли во время месячных), участвует в регуляции гормонального фона, предотвращает ожирение, остеопороз, (к которому больше склонны женщины), снижает неприятные проявления при наступлении климакса, но главное – помогает стать мамой здорового ребенка.
помогает в наращивании мышечной массы, а через снижение уровня молочной кислоты устраняет боли в мышцах, повышает подвижность сперматозоидов, повышает либидо, предотвращает заболевания предстательной железы, стимулирует выработку тестостерона.
помогает расти и преодолевать нагрузки, связанные с учебой и спортом. Улучшает внимание, память, работоспособность, снижает раздражительность, плаксивость. Корректирует симптомы вегето-сосудистой (нейро-циркуляторной) дистонии.
Магний. Общая информация
Mg присутствует во всех тканях организма, более половины его находится в костной ткани. Общее содержание магния в организме человека составляет около 25 г, наибольшую концентрацию иона отмечают в тканях с интенсивным обменом веществ. Ионы магния преимущественно содержатся внутри клетки, где они связаны с белками; присутствуют в ядре, митохондриях, цитоплазматическом ретикуломе; в цитоплазме около 80% магния находится в комплексе с АТФ. Внеклеточный магний (в т. ч. магний плазмы крови) составляет лишь 1% от общего количества, содержащегося в организме.
Магний является облигатным кофактором многих ферментативных реакций: необходим для реакций гликолиза, для образования АТФ при окислительном фосфорилировании в митохондриях. Магний выступает в роли физиологического регулятора клеточного роста, поддерживая адекватный запас пуриновых и пиримидиновых нуклеотидов, необходимых для синтеза ДНК и РНК. Истощение запасов Mg2+ в клетке приводит к снижению синтеза белка; магний необходим на всех этапах синтеза белковой молекулы. Активация и ингибирование системы ц-АМФ, медиатора многих физиологически активных веществ, связаны с магнием: он повышает активность аденилатциклазы и формирование циклического АМФ.
Магний поступает в организм с пищей и водой. Сбалансированная диета содержит 300–350 мг/сут, недостаток магния в пище может быть причиной дефицита элемента в организме. Главным источником магния являются орехи, овес, зелень, мясо. Большая часть магния абсорбируется в тонком кишечнике. Витамин D и его метаболиты повышают абсорбцию Mg, но в меньшей степени, чем Ca. Избыток в пище органических кислот связывает Mg, нарушая его всасывание. При усиленном поступлении Mg с пищей, при парентеральном введении, избыток катиона быстро экскретируется почками, которые являются основным регулятором поддержания постоянной концентрации Mg в организме. При истощении запасов Mg его экскреция снижается или прекращается вообще.
Активное участие Mg в различных физиологических процессах является основой многообразия клинической симптоматики при гипо- и гипермагниемии. Расстройства, связанные с дефицитом магния, имеют сложный характер и обычно сопровождаются множественными нарушениями обмена веществ. Клинические симптомы недостаточности Mg носят преимущественно неврологический характер: сонливость, слабость, раздражительность, тетания, тремор и фасцикуляции (подергивания) мышц, также отмечают тошноту и рвоту. Неврологические симптомы, особенно тетания, коррелируют с развитием гипокальциемии и гипокалиемии.
Недостаток магния в организме человека выявляют при многих ССЗ. Магний оказывает влияние на функциональное состояние эндотелия, участвующего в регуляции сосудистого тонуса, гемостаза, иммунного ответа, миграции клеток крови в сосудистую стенку, синтеза факторов воспаления и их ингибиторов. Неблагоприятные эффекты дефицита магния отмечают в виде повышения тонуса коронарных сосудов, увеличения чувствительности к вазоконстрикторным агентам (серотонин, ангиотензин, норадреналин, ацетилхолин), развития гипертонии и аритмии. У пациентов с ИБС содержание Mg в сыворотке крови часто понижено; резкое падение концентрации Mg в крови может быть одной из причин внезапной смерти. При гипомагниемии отмечают изменения данных ЭКГ: удлинение интервала Q–T и PR(Q); депрессия сегмента ST; инверсия зубца T и др.
Гипомагниемия наблюдается при разнообразной эндокринологической патологии: тиреотоксикоз, первичный гипоальдостеронизм, около 30% больных СД имеют разную степень гипомагниемии. Концентрация магния оказывает влияние на уровень ПТГ: как повышенное, так и пониженное содержание иона в крови угнетает секрецию гормона. При значительном снижении содержания магния в крови часто наблюдают выраженную гипокальциемию, что, по мнению многих исследователей, является следствием развития острого гипопаратиреоза, вызванного торможением секреции ПТГ. Неэффективность лечения гипокальциемии витамином Д в ряде случаев обусловлена именно гипомагниемией; инъекции сульфата магния способствую нормализации уровня кальция.
Физиологически магний выступает как антагонист кальция; его дефицит сопровождается накоплением кальция в сыворотке крови. Гиперкальциемия, понижая реабсорбцию Mg в почечных канальцах, в свою очередь способствует гипомагниемии.
При гипермагниемии наряду с неврологической симптоматикой (параличи, атаксия, сонливость, нарушения сознания) отмечают расстройства функционирования ЖКТ (тошнота и рвота), гипотензию, брадикардию, изменения данных ЭКГ (удлинение интервалов P-R и QT, расширение комплексов QRS). Значительное увеличение концентрации магния может быть причиной комы, остановки сердца и дыхания.
Гипермагниемия может быть вызвана избытком поступления иона, нарушением работы почек, наблюдается также при гипотиреозе, лактацидозе, гепатите, злокачественных новообразованиях.
Магний является антагонистом кальция что это значит
Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, Москва
Введение
В отличие от чужеродных для организма человека лекарственных веществ фармакотерапия, основанная на естественных по своей природе микронутриентах (витамины, минеральные вещества и микроэлементы), обладает характерными особенностями [1]. Физиологический уровень витаминов и минералов в организме не нулевой, поддерживается в узком интервале значений; существуют эндогенные регуляторные механизмы его поддержания – гомеостатические механизмы.
К таким гомеостатическими процессам относятся:
Если минералы и микроэлементы не метаболизируются в организме, то по отношению к лекарствам-ксенобиотикам срабатывает ответная защитная реакция – элиминация «как можно раньше», их нормальный физиологический уровень в плазме крови – «нулевой». Эффективные «машины» элиминация ксенобиотика, как правило, ждут его в двух местах – печени и почках, а задача лекарства-ксенобиотика – избежать их, чтобы найти, прочно связать и заблокировать/активировать свою мишень терапевтического действия (например, кальциевые каналы, β-адренорецепторы, ключевые ферменты синтеза холестерина и др.).
Микронутриенты обычно действуют в организме согласованно. Всасывание в кишечнике и последующий метаболизм определенного питательного вещества в значительной степени зависят от наличия других питательных веществ. Эссенциальный характер микронутриентов предполагает их взаимодействие на всех этапах: абсорбции, распределения, внутриклеточного транспорта, почечной экскреции. Дефицит или избыточное потребление микронутриентов с пищей, прием лекарственных средств и БАДов, содержащих отдельные макроэлементы и витамины, могут изменять физиологический баланс кальций/магний/витамин D, способствуя развитию патологических состояний (нефроуролитиаз, кальциноз артерий и мягких тканей) [3].
Баланс поступления кальция и магния, возможные последствия его нарушения
Хотя о магнии известно многое, внимание к его взаимодействию с кальцием и витамином D было привлечено сравнительно недавно. Толчком к этим исследованиям послужили данные о том, что с 1977 по 2012 г. потребление кальция в популяциях, использующих в пищу современные продукты*, увеличилось в 2–2,5 раза по сравнению с потреблением магния. В результате чего соотношение потребления кальция и магния превысило 3,0 [4].
Изменение баланса потребления кальция и магния в сочетании с приемом препаратов кальция и витамина D на фоне субоптимального поступления магния могут иметь неблагоприятные последствия для здоровья [5].
Повышенные уровни фосфата и кальция в плазме крови соответствуют увеличению риска ишемической болезни сердца (ИБС), инсульта и смертности. Исследование ARIC (Atherosclerosis Risk in Communities), проводившееся в течение более 10 лет и включившее наблюдения за когортой из 15 700 человек, подтвердило, что повышенные уровни кальция (отношение шансов [ОШ] – 1,16, 95% доверительный интервал [ДИ] – 1,07–1,26; р=0,0005) и фосфата (ОШ – 1,11, 95% ДИ – 1,02–1,21; р=0,0219) в плазме крови служат фактором риска этих заболеваний [6].
Избыточное содержание кальция в составе пищевых добавок может приводить к дефициту магния, увеличивая риск кальцификации артерий [5].
Основным элементом, содержащимся в кальцинированной атеросклеротической бляшке (АБ), служит гидроксиапатит кальция, который содержит до 40% кальция, а по своему химическому строению идентичен гидроксиапатиту кальция, содержащемуся в костях. Степень кальциноза коронарных артерий может быть количественно отражена с помощью коронарного кальциевого индекса (ККИ). Показано, что ККИ коррелирует с тяжестью коронарного атеросклероза, наличием гемодинамически значимых стенозов коронарных артерий и риском развития коронарных осложнений [7].
Результаты клинических исследований демонстрируют связь между кальцинозом коронарных артерий и их атеросклеротическим поражением, причем площадь кальциноза составляет примерно 1/5 площади коронарных АБ [8]. Другими словами, хотя количество коронарного кальция тесно соотносится с тотальной массой уязвимых АБ, обызвествление представляет всего лишь вершину айсберга. Определяемый объем обызвествленных АБ составляет 20% их тотальной массы.
Большинство АБ содержит кальцинаты, общая тяжесть атеросклеротического поражения артерий (объем АБ) коррелирует с выраженностью кальциноза, частота обызвествлений нарастает с возрастом [9].
Увеличение риска сердечно-сосудистых осложнений у пациентов с ревматическими заболеваниями также связывают с коронарным кальцинозом [10], который ассоциируется с повышением уровня смертности как от кардиоваскулярных, так и от других причин. Кальцификация сердечных тканей и стенок сосудов – это часто развивающийся при хронической болезни почек (ХБП) процесс, который является одной из основных причин развития сердечно-сосудистых заболеваний (ССЗ) и повышения уровня смертности среди данной категории пациентов. Его распространенность наиболее высока среди пациентов с тяжелой ХБП [11].
Одно из самых частых показаний к назначению кальций-содержащих препаратов – профилактика остеопороза различного генеза. При анализе возрастных и гендерных особенностей атеросклеротического поражения сосудов обращает на себя внимание другой важный аспект – взаимосвязь атерокальциноза и изменений минеральной плотности костной ткани. Никого не удивляет ухудшение состояния костной ткани с возрастом, и объясняется это тесными биологическими и патогенетическими связями атеросклеротической кальцификации и остеогенеза [12]. Доказано достоверное увеличение отложения кальция в коронарных артериях при снижении плотности костной ткани и увеличение риска развития инфаркта миокарда.
Е. Schulz et al. обнаружили, что пациенты с выраженной кальцификацией сосудистой стенки часто имеют низкую плотность костной ткани и что значительная потеря костной массы у таких лиц коррелирует с более быстрым прогрессированием кальцификации брюшной аорты, в то время как низкие значения минеральной плотности костей коррелируют с некальцифицированными АБ [13].
Предполагаемый риск ССЗ, связанный с общим потреблением кальция, может зависеть от источника его поступления. Потребление кальция с пищей, как было показано, не увеличивает риск ССЗ, тогда как прием пищевых добавок с кальцием ассоциирован с повышенным риском инфаркта миокарда. Аналогичным образом потребление кальция, содержащегося в пище, может снижать риск возникновения камней в почках, тогда как добавки с кальцием могут увеличивать риск нефролитиаза [14]. Одно из объяснений этого очевидного парадокса может заключаться в том, что одномоментный прием больших нагрузочных доз в виде добавок кальция могут временно повышать концентрацию кальция в плазме крови [15], что в свою очередь способно приводить к кальцификации сосудов и другим неблагоприятным побочным эффектам. Одним из потенциальных механизмов, лежащих в основе ассоциации между потреблением кальция и риском ССЗ, может стать прогрессирование атеросклероза. Оценка кальциноза коронарных артерий является хорошо зарекомендовавшим себя суррогатным маркером тяжести поражения атеросклерозом и является прогностическим фактором риска ССЗ [16].
Чрезмерное содержание кальция в рационе, особенно чрезмерное потребление пищевых добавок кальция, принимаемых для профилактики или лечения остеопороза, может иметь непредсказуемые последствия для здоровья. Об этом свидетельствуют данные исследования Multi-Ethnic Study of Atherosclerosis (MESA), выполненного экспертами из 8 университетов США, результаты которого опубликованы несколькими независимыми группами. В начале исследования все участники (5448 пациентов в возрасте 45−84 лет без клинических признаков ССЗ) сообщили о своих пищевых привычках, чтобы определить, сколько кальция они употребляют в пищу с молочными продуктами, зеленью и зерновыми культурами, какие лекарственные средства и пищевые добавки принимают. Для определения кальцификации коронарных артерий использовали мультиспиральную компьютерную томографию. Через 10 лет она проведена повторно для оценки риска развития ИБС.
На основе опубликованных в Journal of the American Heart Association данных, авторы пришли к выводу, согласно которому избыточное употребление кальция в составе пищевых добавок на 22% увеличивает риск образования АБ и развития ССЗ в течение 10 лет [17]. При этом пациенты, соблюдавшие здоровую диету с преобладанием богатых кальцием продуктов, имели на 27% более низкую вероятность ССЗ.
Результаты 10-летнего наблюдения в исследовании MESA также демонстрируют, что высокий ККИ увеличивает риск не только ССЗ, но и рака, ХБП и хронической обструктивной болезни легких. Выводы по этой части исследования MESA были опубликованы в Journal of the American College of Cardiology: Cardiovascular Imaging [18]. У 68% из 710 пациентов с диагнозом «рак» ККИ был высоким. После корректировки на другие факторы установлено, что у лиц ККИ >400 относительный риск развития рака повышался на 53% (ОШ – 1,53, 95% ДИ – 1,18–1,99). Частота ХБП у лиц с нулевым ККИ составляла 3%, при ККИ > 400 – 13%.
В то же время результаты другого клинического исследования, выполненного ранее, не поддерживают предположения об увеличении риска ССЗ при использовании пищевых добавок с кальцием [19].
На основе мета-анализа существующих данных другая группа исследователей пришла к выводу, согласно которому БАД с кальцием не повышают риска развития ССЗ по сравнению с плацебо при условии их приема здоровыми людьми в суточных дозах, не превышающих 500–2000 мг [20].
Ключевая роль магния в поддержании кальциевого обмена
Одной из возможных причин развития гиперкальцемии и гиперкальциурии служит дефицит магния. Однако до настоящего времени определение уровня магния в плазме крови не стало нормой в условиях реальной клинической практики, т.к. считается, что этот показатель только косвенно и очень приблизительно отражает его содержание внутри клетки.
Около 60% сывороточного магния находится в ионизированном виде, остальная часть связана с протеинами, фосфатами, цитратами. В плазме крови и эритроцитах содержится менее 1% от общего количества магния. На сердце приходится около 20% всего магния, содержащегося в организме человека, что говорит о его большом значении для нормальной сердечной деятельности [21].
Эпидемиологические исследования связывают низкий уровень магния с более высоким риском метаболического синдрома, сахарного диабета 2 типа, ССЗ, остеопороза, хронической обструктивной болезнию легких и, возможно, некоторых видов рака [4].
Магний является вторым по распространенности внутриклеточным катионом и играет ключевую роль в минерализации костной ткани, влияя на синтез активных метаболитов витамина D.
Согласно современным представлениям, любой эффект магния или кальция зависит от соотношения кальций/магний. По образному выражению специалиста-нутрициолога Carolyn Dean, «магний является ключом к правильной ассимиляции и использованию кальция, а также витамина D. Если мы потребляем слишком много кальция без достаточного количества магния, избыток кальция используется неправильно и может фактически стать токсичным, вызывая такие патологические состояния, как нефролитиаз, некоторые формы артрита, остеопороз и кальциноз артерий. Эффективность и преимущества кальция в отношении здоровья костей и профилактики остеопороза значительно ухудшается при отсутствии адекватного уровня магния в организме» [25].
Эффективным инструментом исправления дисбаланса может служить добавление в рацион магния [26, 27]. Более высокое потребление магния ассоциировано с более низким риском повышения ККИ [28], дополнительный прием магния улучшает функцию эндотелия у пациентов с ИБС [29].
Имеющее место в профессиональной среде убеждение, будто всасывание магния снижается в присутствии кальция, вступает в противоречие с современными представлениями о механизмах поступления кальция и магния в организм [30].
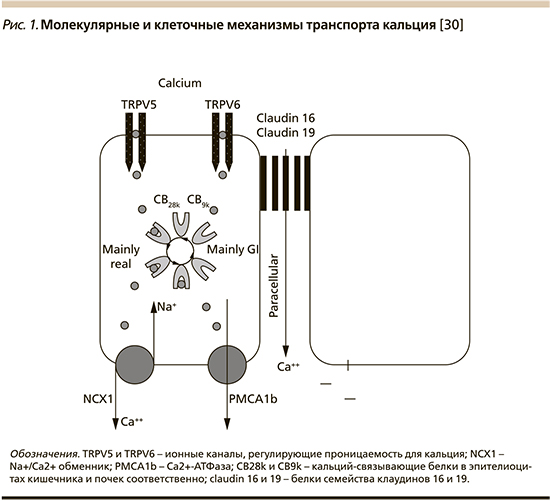
Процессы всасывания кальция в желудочно-кишечном тракте и его реабсорбции в почечных канальцах опосредованы двумя представителями суперсемейства TRP (transient receptor potential channels)** – ионными каналами TRPV5 и TRPV6 (рис. 1).
Выход кальция из энтероцитов обеспечивает натрий-кальциевый обменник, являющийся трансмембранным белком цитоплазматической мембраны, транспортирующим ионы кальция из клетки в обмен на ионы натрия, которые поступают в клетку (механизм антипорта). Обменник использует энергию, накопленную в электрохимическом градиенте натрия, пропуская 3 иона Na+ в клетку по градиенту концентрации и выводя один ион Ca2+ из клетки против градиента концентрации.
В эпителии нефрона за реабсорбцию кальция и его возвращение в системный кровоток отвечает Ca2+-АТФаза (PMCA1b), интегрированная в базальную мембрану эпителиоцитов почки.
Параклеточный перенос ионов кальция зависит от активности белков-клаудинов (claudin) 16 и 19, расположенных в зоне межклеточных контактов. Название «клаудин» происходит от латинского слова claudere («закрыть»), что соответствует барьерной роли этих белков. Клаудины (у человека представлены 24 белками) являются наиболее важным компоненом плотных межклеточных контактов – параклеточного барьера, контролирующего транспорт воды и ионов между клетками эпителия.
Клаудины имеют четыре трансмембранных домена, две внеклеточных и одну внутриклеточную петлю, находящихся в цитоплазме N- и С-концы.
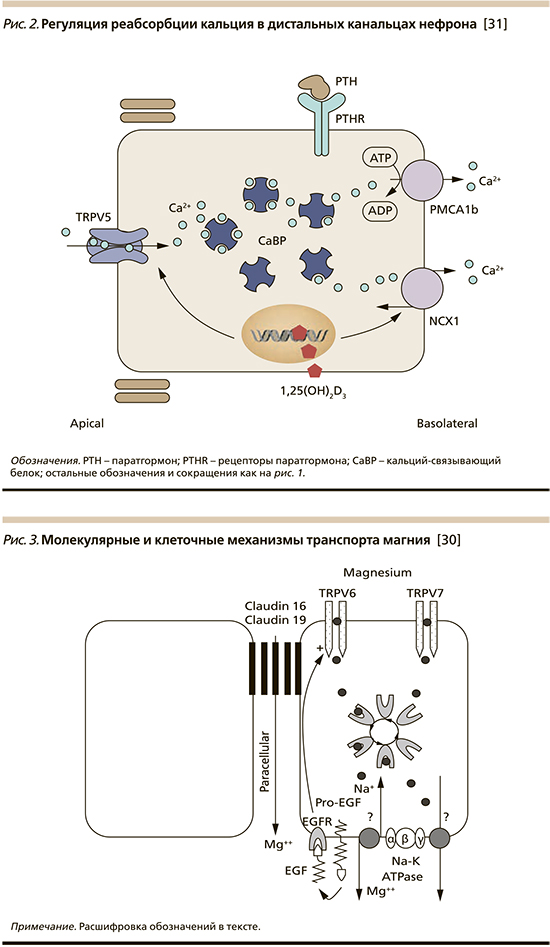
В свою очередь экспрессия ключевых участников трансэпителиального переноса кальция – TRPV5 и PMCA1b – находится под контролем витамина D (рис. 2). Поскольку все витамин D-зависимые реакции напрямую зависят от присутствия магния, следствием взаимодействия между магнием и витамином D является нормокальциемия.
Внутриклеточный транспорт магния в энтероцитах пищеварительного тракта и эпителиоцитах почек осуществляется с помощью каналов подсемейства TRPM – TRPM6 и TRPM7 (рис. 3). Активность этих каналов контролируется эпидермальным фактором роста (EGF), который образуется из предшественника Pro-EGF, локализованного на базолатеральной мембране эпителия. Трансцеллюлярный перенос магния на уровне базальной мембраны регулируется работой Na+/K+-АТФазы.
Магний является кофактором 700–800 ферментных систем в организме человека, среди них – все витамин-D-зависимые процессы/реакции. Активность 3 основных витамин-D-превращающих ферментов и витамин-D-связывающих белков зависит от присутствия магния. К ним относятся 25-гидроксилаза в печени и 1- и 24-гидроксилазы в почках [4]. Таким образом, магний служит кофактором для биосинтеза, транспорта и активации витамина D. В свою очередь 1,25(OH)2D стимулирует всасывание магния в кишечнике [2].
Дефицит магния проявляется на уровне секреции паратгормона и кальцитонина, дополнительный прием магния заметно снижает резистентность к лечению витамина D [33]. Магний снижает уровень паратгормона, работает синергически с витамином D и кальцием, стимулируя специфическую активность кальцитонина [31]. Кальцитонин в свою очередь способствует минерализации костной ткани, снижая плазменные и тканевые уровни кальция, предотвращает развитие остеопороза, кальциевого нефролитиаза и некоторых форм артрита [32].
Кальций-содержащие препараты
В настоящее время фармакологические средства, содержащие кальций, делятся на несколько групп [34]:
Одним из таких препаратов третьего поколения является Остеокеа (Osteocare®) производства компании Витабиотикс (Великобритания). В таблетированной форме Остеокеа является зарегистрированным лекарственным средством, в жидкой форме – биологически активной добавкой и, что важно, единственной жидкой формой кальция. Помимо кальция и витамина D (100 ЕД) препарат содержит магний и цинк (см. таблицу).
Лечение препаратом показано для профилактики и коррекции дефицита минералов и витамина D, профилактики дефицита кальция в периоды жизни, характеризующиеся повышенной потребностью в нем (менопауза, пожилой возраст, период беременности и лактации), а также профилактики системного остеопороза и кариеса. Препарат прошел ряд исследований с успешным результатом, в которых доказано его положительное действие на минеральную плотность кости, кальциевый баланс; было отмечено достоверное снижение костной резорбции и уменьшение болевого синдрома на фоне терапии [41].
Заключение
Обзор литературных данных свидетельствует о возможной ассоциации кальциноза коронарных артерий и повышения риска ССЗ с приемом дополнительного источника кальция в виде БАД к пище. Одним из эффективных инструментов сохранения нормального кальциевого обмена в организме является соблюдение баланса кальций/магний, который может быть достигнут при сочетанном приеме препаратов, содержащих кальций, магний и витамин D. Магний участвует в активации и функционировании витамина D, оказывая нормализующее влияние на гомеостаз кальция в организме. Адекватное поступление кальция и магния является одним из важных условий безопасной профилактики остеопороза и других возраст-ассоциированных заболеваний. Выбирая препарат, следует помнить не только о необходимости сбалансированного сочетания в лекарственном средстве витамина D и соли кальция при его высоком процентном содержанием, но и о дополнительном наличии в таком препарате соединения магния.
Литература
1. Духанин А.С. Критерии ответственного выбора витаминно-минерального комплекса для прегравидарной подготовки, ведения беременности и в период лактации: клинико-фармакологические и фармацевтические аспекты. РМЖ. 2017;2:109–15.
2. Uwitonze A.M., Razzaque M.S. Role of Magnesium in Vitamin D Activation and Function. J. Am. Osteopath. Assoc. 2018;118(3):181–89.
3. Bolland M.J., Grey A., Avenell A., et al. Calcium supplements with or without vitamin D and risk of cardiovascular events: reanalysis of the Women’s Health Initiative limited access dataset and meta-analysis. BMJ. 2011;342:d2040.
4. Rosanoff A., Dai Q., Shapses S.A. Essential Nutrient Interactions: Does Low or Suboptimal Magnesium Status Interact with Vitamin D and/or Calcium Status? Adv. Nutr. 2016;7(1):25–43.
5. DiNicolantonio J.J., O’Keefe J.H., Wilson W. Subclinical magnesium deficiency: a principal driver of cardiovascular disease and a public health crisis. Open Heart. 2018;5(1):e000668.
6. Foley R.N., Collins A.J., Ishani A., Kalra P.A. Calcium-phosphate levels and cardiovascular disease in community-dwelling adults: the Atherosclerosis Risk in Communities (ARIC) Study. Am. Heart J. 2008;156(3):556–63.
7. Liang D.K., Bai X.J., Wu B., et al. Associations between bone mineral density and subclinical atherosclerosis: a cross-sectional study of a Chinese population. J. Clin. Endocrinol. Metab. 2014;99(2):469–77.
8. Симоненко В.Б., Екимовских А.Ю., Долбин И.В. Кальциноз коронарных артерий — современное состояние проблем. Клиническая медицина. 2013;4:11–5.
9. Лутай М.И., Голикова И.П. Кальциноз венечных артерий, аорты, клапанов сердца и ишемическая болезнь сердца: патофизиология, взаимосвязь, прогноз, стратификация риска. Український кардіологічний журнал. 2015;2:99–112.
10. Маркелова Е.И., Новикова Д.С., Коротаева Т.В. и др. Распространенность традиционных кардиоваскулярных факторов риска, субклинического атеросклероза сонных артерий, коронарного кальциноза у пациентов с ранним псориатическим артритом (исследование РЕМАРКА). Научно-практическая ревматология. 2018;56(2):184–88.
11. Wang Z., Jiang A., Wei F., Chen H. Cardiac valve calcification and risk of cardiovascular or all-cause mortality in dialysis patients: a meta-analysis. BMC Cardiovasc. Disord. 2018;18(1):12.
12. Масенко В.Л., Семенов С.Е., Коков А.Н. Атерокальциноз и остеопороз. Связи и условия взаимного влияния. Комплексные проблемы сердечно-сосудистых заболеваний. 2017;2:93–102.
13. Szulc P. Vascular calcification and fracture risk. Review. Clin. Cases Miner. Bone Metab. 2015;12(2):139–41.
14. Curhan G.C., Willett W.C., Speizer F.E., et al. Comparison of dietary calcium with supplemental calcium and other nutrients as factors affecting the risk for kidney stones in women. Ann. Intern. Med. 1997;126:497– 504.
15. Bristow S.M., Gamble G.D., Stewart A., et al. Acute and 3-month effects of microcrystalline hydroxyapatite, calcium citrate and calcium carbonate on serum calcium and markers of bone turnover: a randomised controlled trial in postmenopausal women. Br. J. Nutr. 2014;112:1611–20.
16. Blaha M.J., Blumenthal R.S., Budoff M.J., Nasir K. Understanding the utility of zero coronary calcium as a prognostic test: a Bayesian approach. Circ. Cardiovasc. Qual. Outcomes. 2011;4:253–56.
17. Anderson J.J., Kruszka B., Delaney J.A., et al. Calcium Intake From Diet and Supplements and the Risk of Coronary Artery Calcification and its Progression Among Older Adults: 10‐Year Follow‐up of the Multi‐Ethnic Study of Atherosclerosis (MESA). J. Am. Heart Assoc. 2016;5(10):pii: e003815.
18. Handy C.E., Desai C.S., Dardari Z.A., et al. The Association of Coronary Artery Calcium With Noncardiovascular Disease: The Multi-Ethnic Study of Atherosclerosis. JACC Cardiovasc. Imaging. 2016;9(5):568–76.
19. Paik J.M., Curhan G.C., Sun Q., et al. Calcium Supplement Intake and Risk of Cardiovascular Disease in Women. Osteoporos Int. 2014;25(8):2047–56.
20. Chung M., Tang A.M., Fu Z., et al. Calcium Intake and Cardiovascular Disease Risk: An Updated Systematic Review and Meta-analysis. Ann. Intern. Med. 2016;165(12):856–66.
21. Недогода С.В. Роль препаратов магния в ведении пациентов терапевтического профиля. Лечаший врач. 2009;6:61–6.
22. Costello R.B., Elin R.J., Rosanoff A., et al. Perspective: the case for an evidence-based reference interval for serum magnesium: The time has come. Adv. Nutr. 2016;7:977–93.
23. Wang J.L., Shaw N.S., Yeh H.Y., Kao M.D. Magnesium status and association with diabetes in the Taiwanese elderly. Asia Pac. J. Clin. Nutr. 2005;14:263–69.
24. Malon A., Brockmann C., FijalkowskaMorawska J., et al. Ionized magnesium in erythrocytes-the best magnesium parameter to observe hypo-or hypermagnesemia. Clin. Chim. Acta. 2004;349:67–73.
26. Doyle L., Flynn A., Cashman K. The effect of magnesium supplementation on biochemical markers of bone metabolism or blood pressure in healthy young adult females. Eur. J. Clin. Nutr. 1999;53:255–61.
27. Basso L.E., Ubbink J.B., Delport R., et al. Effect of magnesium supplementation on the fractional intestinal absorption of 45CaCl2 in women with a low erythrocyte magnesium concentration. Metabolism. 2000;49:1092–96.
28. Hruby A., O’Donnell C.J., Jacques P.F., et al. Magnesium intake is inversely associated with coronary artery calcification: the Framingham Heart Study. JACC Cardiovasc. Imaging. 2014;7:59–69.
29. Shechter M., Sharir M., Labrador M.J., et al. Oral magnesium therapy improves endothelial function in patients with coronary artery disease. Circulation. 2000;102:2353–58.
30. Allgrove J. Physiology of Calcium, Phosphate, Magnesium and Vitamin D. Endocr. Dev. 2015;28:7–32.
31. Hoorn E.J., Zietse R. Disorders of calcium and magnesium balance: a physiology-based approach. Pediatr. Nephrol. 2013;28(8):1195–206.
32. Zofková I, Kancheva R.L. The relationship between magnesium and calciotropic hormones. Magnes Res. 1995;8(1):77–84.
33. Swaminathan R. Magnesium metabolism and its disorders. Clin. Biochem. Rev. 2003;24(2):47–66.
34. Марченкова Л.А., Макарова Е.В. Профилактика минерального дефицита и остеопороза: современные возможности. Фарматека. 2017;17:41–45.