Макрофаги что это такое
Макрофаги что это такое
Активация макрофагов сопровождается усилением множества их функций. Важность поглощения и уничтожения таких внутриклеточных патогенных агентов, как Mycobacterium tuberculosis. Listeria, Leishmania, Toxoplasma, и некоторых грибов, очевидна, но макрофаги способны очищать кровь и от внеклеточных патогенных агентов, например Streptococcus pneumoniae.
Уничтожение поглощенных микроорганизмов зависит главным образом от продукции свободных радикалов (например, перекиси водорода) и оксида азота. Активированные макрофаги производят большее количество этих токсических метаболитов.
Противоопухолевая активность мононуклеарных фагоцитов изучена хуже. Она может быть и не связанной с процессом фагоцитоза. По-видимому, макрофаги уничтожают опухолевые клетки, секретируя лизосомные ферменты, оксид азота, метаболиты кислорода, цитолитические протеазы и ФНО-а. Протеолитические ферменты и цитотоксические факторы, присутствующие на мембране моноцитов, могут играть роль в отторжении опухолей.
Защитная функция моноцитов зависит от их способности проникать сквозь эндотелиальную стенку капилляров и мигрировать в очаги микробной инвазии в тканях. Хемотаксическими факторами для моноцитов служат фрагменты компонентов комплемента и хемокины, выделяемые нейтрофилами, лимфоцитами и другими клетками. Последующий фагоцитоз зависит от присутствия опсонинов (антител, комплемента, связывающих маннозу белков и белков сурфактанта), свойств поверхности микроорганизмов или опухолевых клеток и активности макрофагов.
Другие важные функции макрофагов включают уничтожение поврежденных и мертвых клеток, что способствует прекращению иммунных реакций и заживлению ран. Макрофагам, выстилающим синусоиды селезенки, принадлежит особая роль в поглощении изношенных эритроцитов. В очагах воспаления макрофаги распознают изменения фосфатидилсерина на мембране лимфоцитов и нейтрофилов, подвергающихся апоптозу, в результате чего такие клетки уничтожаются раньше, чем выделят свое токсическое содержимое в ткань.
Макрофаги — филогенетически древние клетки и в онтогенезе обнаруживаются уже на ранних стадиях развития плода, когда их функция сводится к уничтожению одних тканей по мере их замене другими. Эти клетки удаляют из организма и неорганические частицы, такие как элементы сигаретного дыма или попадающую в легочные альвеолы пыль.
Макрофаги — необходимые участники процесса индукции и реализации гуморальных и клеточных иммунных реакций. Поглощая чужеродный материал, они разрушают его и представляют на своей поверхности отдельные антигены в.виде пептидов или полисахаридов, связанных с молекулами МНС класса II. Антигенпредставляющей функцией обладают также В-лимфоциты и особенно дендритные клетки, играющие вспомогательную роль в развитии специфического иммунного ответа.
В активированных макрофагах усиливается экспрессия молекул МНС класса II и представление антигенов становится более эффективным.
Повышенная киллерная активность активированных макрофагов отчасти связана, по-видимому, с ускорением синтеза и выделения различных гидролитических ферментов и бактерицидных веществ. Известно примерно 100 различных веществ, секретируемых макрофагами. Столь высокая секреторная активность сближает эти клетки с гепатоцитами. Учитывая воздействие некоторых секретируемых веществ на другие клетки, огромное количество макрофагов и их повсеместное присутствие в тканях, систему мононуклеарных фагоцитов можно считать важнейшим эндокринным органом.
В этом можно убедиться на примере ИЛ-1. Любое воспаление или повреждение тканей стимулирует выделение ИЛ-1, главным образом, моноцитами и макрофагами. Этот интерлейкин, в свою очередь, влияет на температуру тела, сон и секрецию ИЛ-6, который вызывает продукцию белков острой фазы воспаления.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
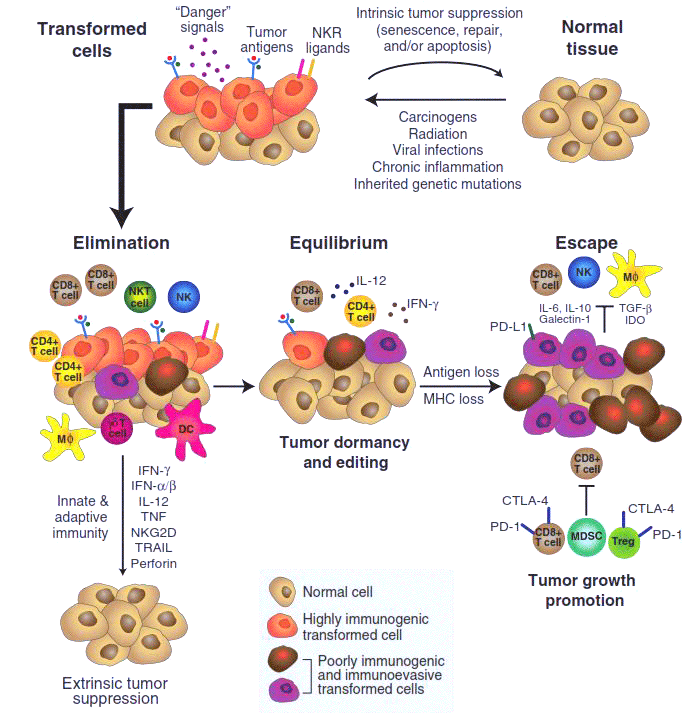
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
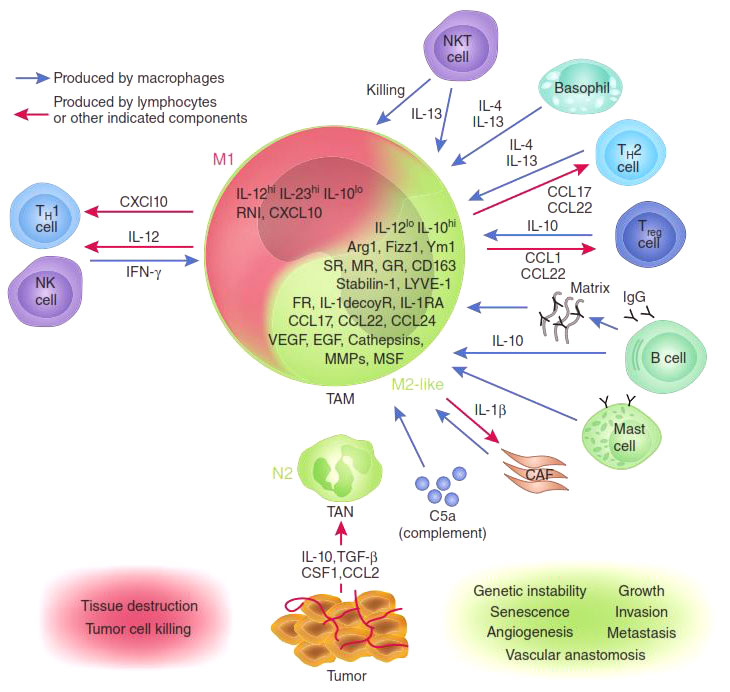
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Макрофаг — столп регенерации
Глубокие обширные раны заживают у млекопитающих долго и тяжело, причем поврежденные ткани никогда не восстанавливаются полностью. На месте мышц и кожи образуются коллагеновые рубцы, остаются шрамы. О том, чтобы вместо отрубленного пальца вырос новый, и речи нет. Между тем аксолотль (Ambystoma mexicanum, способная к размножению личинка амбистомы, близкого родственника настоящих саламандр) легко восстанавливает утраченные конечности. Естественно, этот феномен привлекает внимание ученых: нам бы так!
Заживление раны — сложный и многоступенчатый процесс, в котором участвует множество генов и биологически активных молекул, в том числе факторов роста, ферментов, про- и противовоспалительных сигналов, цитокинов, привлекающих в рану фибробласты и клетки иммунной системы. Все эти факторы и у млекопитающих, и у аксолотля примерно одинаковы. Основное отличие между ними заключается в том, когда они начинают действовать. Так, у аксолотля макрофаги прибывают в рану существенно раньше, чем у млекопитающих. Специалисты Австралийского института регенеративной медицины Университета Монаша и Имперского колледжа Лондона под руководством профессора Нади Розенталь (Nadia A. Rosenthal) установили, что именно благодаря раннему участию макрофагов у аксолотля на месте отрезанной лапки образуется не культя, а новая конечность.
У млекопитающих количество макрофагов в поврежденной ткани возрастает спустя 48–96 часов после травмы. Макрофаги вычищают рану, поедая мертвые клетки, выделяют провоспалительные цитокины (воспаление — необходимый этап заживления), а затем и факторы, которые подавляют воспаление, стимулируют образование сосудов и деление клеток, привлекают в рану фибробласты. Именно они создают среду, благоприятную для восстановления поврежденных тканей. Если у мышей с поврежденными скелетными мышцами создать искусственный дефицит макрофагов, мышечная ткань восстановится плохо, зато в большом количестве образуются фиброзные рубцы.
Влияние макрофагов на регенерацию лапки Аксолотля. Пунктиром показана линия отреза. Левый столбец — контрольные животные, правый — Аксолотли, у которых до ампутации «вывели из игры» макрофаги. На четвертый день у контрольных животных образуется бластема — скопление клеток, пронизанное кровеносными сосудами, а у подопытных — фиброзная ткань. Без макрофагов регенерация не идет, на месте отрезанной конечности образуется культя. Но после повторной ампутации из нее вырастает нормальная конечность. (Рисунок из статьи)
В ране аксолотля макрофаги появляются в первые же сутки после ампутации лапки, достигают пика численности на 4–6-й дни и пребывают в поврежденных тканях и регенерирующей конечности недели две, до завершения ранней стадии регенерации.
Макрофаги в живом организме можно эффективно связать, вводя в вену упакованный в липосомы препарат клодронат. Этот реагент специфически связывает циркулирующие в крови моноциты и находящиеся в тканях макрофаги. Исследователи сделали аксолотлям инъекцию клодроната за сутки до ампутации (контрольным животным вводили липосомы с буфером), в результате первые шесть дней регенерации проходили при остром дефиците макрофагов и нехватке ростовых факторов и других молекул, необходимых для полноценного заживления ран и регенерации конечностей. Спустя неделю количество макрофагов пришло в норму, но конечность все равно выросла куцая.
Если сделать аксолотлю не одну инъекцию, а три, количество макрофагов в ране упадет практически до нуля. В этом случае регенерация конечности заблокирована полностью: рана затягивается, но вместо лапы образуется покрытая шрамами фиброзная культя, как у млекопитающих.
Чтобы выяснить роль макрофагов на поздней стадии регенерации, исследователи вводили аксолотлям клодронат на 10–13-й день после ампутации, когда уже образовалась бластема — скопление однородных неспециализированных клеток, которые формируют ткани отрастающего органа. Толстых волокон коллагена, вызывающих фиброз, бластема не содержит. Оказалось, что отсутствие макрофагов на поздней стадии замедляет регенерацию, но не блокирует ее. Очевидно, самые главные события, определяющие выбор между регенерацией и образованием фиброзной ткани, происходят в начале формирования бластемы.
В случае неудачной регенерации программу можно реактивировать, были бы макрофаги. Ученые вторично ампутировали аксолотлю культю, которая не превратилась в конечность. В этот раз регенерации ничто не препятствовало, макрофаги наличествовали в должном количестве, и аксолотль отрастил нормальную лапу. Восстановление возможно даже на 150-й день после первой ампутации.
Исследователи подчеркивают, что для регенерации конечностей необходимо на самой ранней стадии создать микросреду, благоприятную для восстановления органа. Эту среду создают макрофаги. Исследователи надеются, что, определив роль всех молекул, выделяемых макрофагами, они смогут найти средство, которое поможет предотвратить образование рубцов и поспособствует регенерации тканей млекопитающих.
J. W. Godwin, A. R. Pinto, and N. A. Rosenthal «Macrophages are required for adult salamander limb regeneration», PNAS 2013, 110 (23), 9415–9420, doi: 10.1073/pnas.1300290110
Макрофаги что это такое
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
В соответствии с «М1/М2» парадигмой выделяют два подтипа активированных макрофагов – классически активированные (М1) и альтернативно активированные (М2), которые экспрессируют различные рецепторы, цитокины, хемокины, факторы роста и эффекторные молекулы. Однако данные последних лет указывают на то, что в ответ на изменение сигналов микроокружения, макрофаги могут проявлять уникальные свойства, не позволяющие отнести их ни к одному из этих подтипов.
Макрофаги играют главную роль в реакции организма на имплантируемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты. Макрофаги фагоцитируют частицы износа поверхности суставных протезов, инициируют воспаление в зоне протезирования и остеолиз, управляют процессами образования фиброзной капсулы вокруг инородных тел. Представлен краткий обзор факторов, вызывающих миграцию, адгезию и активацию макрофагов, анализ их функциональных характеристик на различных поверхностях, включая биодеградирующие и не деградирующие материалы in vivo и in vitro.
Введение
Современную медицину в настоящее время невозможно представить без применения имплантируемых изделий, устанавливаемых в организм на различные сроки с целью восстановления анатомии и функции утраченных или пораженных патологическим процессом органов и тканей. Биосовместимость синтетических материалов или тканеинженерных конструкций является основной проблемой, влияющей на результаты таких имплантаций. Реакция на протезирующий материал развивается в следующей последовательности: альтерация тканей, инфильтрация клетками острого, затем хронического воспаления с формированием грануляционной ткани и фиброзной капсулы. Степень выраженности этих реакций определяет биосовместимость имплантируемого изделия. Макрофаги играют главную роль в реакции организма на устанавливаемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты и др.
Морфология макрофагов
Функции макрофагов
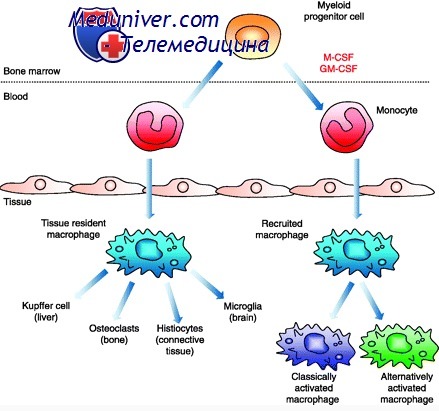
Миграция моноцитов/макрофагов
Тканевые макрофаги происходят преимущественно из моноцитов крови, которые мигрируют в ткани и дифференцируются в различные популяции. Миграция макрофагов направляется хемокинами: ССL2 CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, ССL15, ССL19, CXCL10, CXCL12; факторами роста VEGF, PDGF, TGF-b; фрагментами системы комплемента; гистамином; белками гранул полиморфноядерных лейкоцитов (ПМЯЛ); фосфолипидами и их производными.
Активация макрофагов
Эти исследования наглядно показывают, что формирующиеся в естественных условиях популяции макрофагов значительно отличаются от получаемых in vitro М1 и М2 популяций. Воспринимая множество активирующих сигналов, макрофаг отвечает «по запросу», секретируя медиаторы адекватно изменению окружающей среды, поэтому в каждом конкретном случае формируется свой фенотип, иногда, возможно, даже уникальный.
Реакция макрофагов на чужеродный материал
Адсорбция белков плазмы крови является первой стадией взаимодействия имплантируемых материалов с тканями организма. Химический состав, свободная энергия, полярность поверхностных функциональных групп, степень гидрофильности поверхности определяют количество, состав и конформационные изменения в связываемых белках, являющихся матриксом для последующей адгезии клеток, в том числе макрофагов. Наиболее значимыми в этом плане являются фибриноген, IgG, белки системы комплемента, витронектин, фибронектин и альбумин.
В этой связи существенное значение приобретают изучение клеточных популяций в зоне протезирования, разработка методов и подходов к блокированию чрезмерной воспалительной реакции с исходом в фиброз и стимуляция репаративной регенерации в месте имплантации различных материалов.
Заключение
Макрофаги – полиморфная популяция клеток, фенотип которых определяется сигналами микроокружения. Они играют решающую роль в реакции организма на чужеродный материал, используемый для эндопротезирования, катетеризации, стентирования и др. видов лечения. Характер реакции и степень ее выраженности зависят как от размера имплантируемого материала, так и от его физикохимических свойств и могут иметь как положительное, так и отрицательное значения для организма пациента. Для деградируемых материалов на основе коллагена показана зависимость типа активации макрофагов и скорости регенерации соединительной ткани от способа обработки коллагенового сырья. Это открывает широкие возможности для специалистов, разрабатывающих новые методы децеллюляризации тканей, химической модификации и стерилизации коллагеновых материалов в целях получения имплантатов для регенеративной медицины.
Проблемы, связанные с активацией макрофагов недеградирующими материалами, по-видимому, должны решаться иначе. Макрофаги, фагоцитирующие микрочастицы износа поверхности суставных эндопротезов, и макрофаги, мигрирующие к обширным поверхностям синтетических имплантов, инициируют длительно персистирующее воспаление, остеолиз в первом случае и фиброз во втором. Нивелирование этого эффекта, скорее всего, будет достигнуто путем блокады направленной миграции, адгезии и активации моноцитов/макрофагов, что потребует более глубоких знаний об этих процессах, чем те, которыми мы располагаем в настоящее время.