Макрофаги с гемосидерином в молочной железе что это
Макрофаги с гемосидерином в молочной железе что это
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Макрофаги в молочной и щитовидной железе
Осмотр и пальпация (ощупывание) щитовидной железы 
В молочной и щитовидной железе при этом можно определить уплотнения и другие изменения, которые могут быть признаком растущей опухоли. Однако не всегда узел в тканях говорит о раке. Также это может быть киста, доброкачественное новообразование и т.д. Чтобы сделать предположение о диагнозе и запланировать лечение, делают биопсию желез – добывают кусочек ткани и под микроскопом изучают его клеточный состав. Если речь идет о молочной железе, то женщинам также могут провести исследование выделений из соска. В зависимости от результатов микроскопии устанавливают, что у человека за болезнь и как ее лечить. Наличие определенных клеток во взятой пробе указывает на наличие конкретного заболевания.
В этом посте мы не будем детально описывать разные картины биоптата щитовидной и молочных желез, разберем лишь частный вопрос: присутствие в этих органах клеток-макрофагов.
Макрофаги в молочной железе:

Совершенно правильная логическая цепочка. Если в ткани молочной железы и выделениях из соска много фагоцитов, это говорит о патологии. Так, когда в препарате присутствуют нейтрофилы, макрофаги и гистиоциты (это разновидность макрофагов, находящаяся в норме в соединительной ткани), то это прямо указывает на наличие воспалительного процесса.
Перед лаборантом, изучающим добытый от пациента образец, стоит задача не только обнаружить, но и изучить строение найденных макрофагов. В них всегда немало всякого «мусора», который представляет собой остатки и фрагменты перевариваемых или уже переваренных ими агрессоров. Если удается распознать, что именно находится внутри макрофагов, это помогает понять, против чего боролись эти фагоциты, а значит, сделать вывод, что за болезнь у пациента.
Так, иногда встречаются макрофаги в молочной железе с включениями «обломков» эритроцитов и гемосидерина (гемосидерин – один из конечных продуктов разрушения гемоглобина). Если макрофаги с гемосидерином находят в препарате, это говорит о присутствии в железе полости, внутри которой находится кровь. Последнее встречается при посттравматических изменениях, при некоторых формах мастопатии.
Макрофаги в щитовидной железе:
Макрофаги и нейтрофилы в щитовидной железе также в большом количестве обнаруживаются при заболеваниях. Довольно распространена такая патология этого органа как киста. Сделав пункцию (прокол) кисты, специалисты получают жидкость. В ней мало клеток, среди них преобладают макрофаги с гемосидерином – их еще называют сидерофагами.
Также макрофаги в щитовидной железе могут встречаться при других заболеваниях, например, при воспалительном процессе. Однако при аутоиммунном тиреоидите, который является основным воспалительным заболеванием этого органа, таких фагоцитов в биоптате немного – в железе преобладают лимфоциты, а другие иммунные клетки встречаются реже.
Итак, присутствие большого количества макрофагов в описанных 
Кстати, когда речь идет о выздоровлении, важно не только непосредственно воздействовать на причину болезни (онкологический, воспалительный, дисгормональный процесс), но и уделять внимание поддержке иммунной системы, частью которой являются пресловутые макрофаги. Прием препарата Трансфер Фактор позволяет нормализовать деятельность иммунитета и помочь макрофагам в осуществлении их благого дела – борьбы с возбудителями заболеваний и другими вредоносными факторами.
Регулярная терапия этим средством может помочь выздороветь от большинства заболеваний молочной и щитовидной желез, а при профилактическом приеме предупредить их появление. При устойчивой и слаженной работе всех звеньев иммунитета, что достигается благодаря Трансфер Фактору, риск заболеть аутоиммунными, воспалительными и даже онкологическими процессами этих органов многократно уменьшается.
Одураченные макрофаги, или Несколько слов о том, как злокачественные опухоли обманывают иммунитет
Макрофаг атакует раковую клетку
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Иммунная система — это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания Генотек.
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Опухоль и иммунитет — драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке — то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет. » [1] можно прочесть про особенности ракового метаболизма. — Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
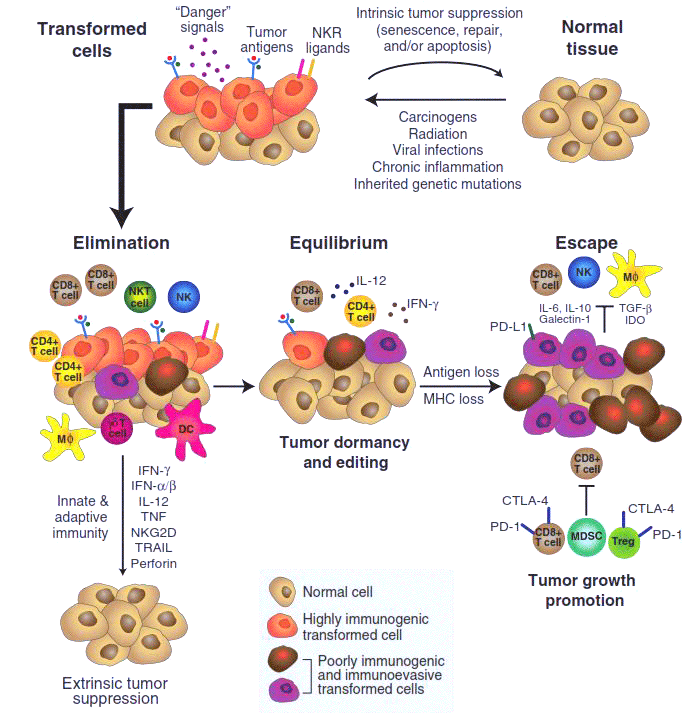
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) — переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting), описывающая основные этапы этого процесса (рис. 1) [2].
Рисунок 1. Иммуноредактирование (immunoediting) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования — процесс устранения (elimination). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» — приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги, натуральные киллеры и Т-клетки. В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность — способность вызывать иммунный ответ — по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны — свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры. Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития — избегания (escape), — на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того — обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными — две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака [2], [3]. В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Переориентирование иммунной системы от борьбы с опухолью на ее защиту возможно благодаря пластичности клеток этой системы. Говоря об иммунном ответе, мы, как правило, используем «воинственные» метафоры — «борьба», «уничтожение», «подавление». Но мало уничтожить врага, будь то вирус, бактерия или другой паразит. Организм должен еще и исправить причиненные им повреждения. Регенерация поврежденных тканей и заживление ран тоже находятся под контролем клеток иммунной системы: она не только «воин», но еще и «целитель». Коварство рака заключается в том, что, будучи по сути «чужеродным агентом» в организме, он выделяет специальные вещества, которые подавляют активный иммунный ответ и побуждают лейкоциты воспринимать опухоль не как врага, требующего уничтожения, а как рану, требующую помощи, защиты и исцеления.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги — «клетки-воины» и «клетки-целители»
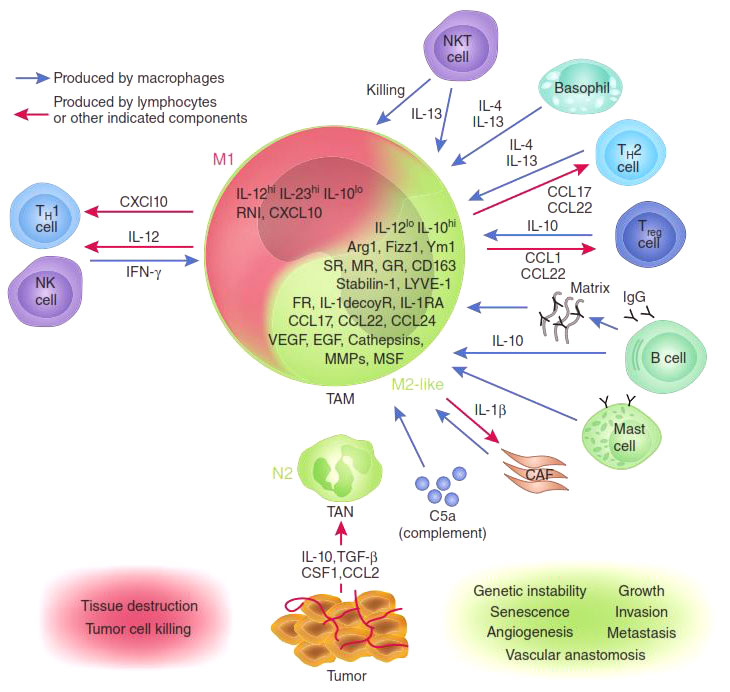
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) — «воины» — отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги — «целители» — ускоряют регенерацию тканей и обеспечивают заживление ран [4], [8].
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост [5], а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы — факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип [6], перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).
Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB [7]. Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства — р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB — р50/р50 — обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 [7]. Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается — растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа — актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы — значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы — это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей [8].
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова [9], — обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга [10]. Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
Биомаркеры [11] и биоинформатический анализ [12] — лишь некоторые из таких методов. — Ред.
Макрофаги с гемосидерином в молочной железе что это
В последние несколько лет зарубежными авторами проводятся цитологические исследования внутрипротокового содержимого молочных желез, полученных с помощью забора наружной вакуумной аспирации и дуктального лаважа, у женщин в группах повышенного риска с целью выявления атипических клеток [10]. Однако до настоящего времени не проводилось исследований, указывающих на применение этих методов у пациенток с хроническим дуктофоритом и СПС. Нет оценки информативности цитологического и бактериологического исследований патологического секрета, полученного с помощью наружной вакуумной аспирации и дуктального лаважа при данной патологии. Между тем данная патология встречается в практической деятельности акушера-гинеколога и маммолога достаточно часто. Хронический дуктофорит (ХД) в структуре синдрома патологической секреции составляет 20-30 %, у 95 % женщин с ХД наблюдается диффузная мастопатия [3]. Несостоятельность диагностики традиционных методов, применяемых для обследования пациенток с СПС, часто подменяется большим количеством неоправданных секторальных резекций [2, 4]. При этом резекция не устраняет фоновой патологии, спровоцировавшей СПС, и является дополнительным фактором риска в виде операционной раны и, как следствие, рубцовой ткани в молочной железе. На сегодняшний день перспективным для оптимизации диагностики внутрипротоковой патологии является развитие двух направлений: цитологической верификации и установления локализации внутрипротоковой патологии. Так как верифицировать диагноз возможно при наличии клеток протокового эпителия, необходимы технологии, при которых возможен забор секрета на протяжении всего протока с достаточным количеством цитологического материала. Также перспективным является совершенствование метода дуктографии в качестве уточняющей диагностики внутрипротоковой патологии.
Целью исследования явилась сравнительная оценка эффективности традиционных и современных методов диагностики для дифференциации внутрипротоковой патологии молочных желез, сопровождающейся синдромом патологической секреции.
Материалы и методы
В клиническое исследование были включены 483 женщины, обратившиеся в краевой маммологический центр с жалобами на патологическую секрецию молочных желез.
Результаты исследования и обсуждение
Информативность УЗИ была выражена по отношению к кистозным полостям в группах сравнения: 36,9 % и 44,7 % (табл. 1). Такой признак как дилатация млечных протоков является косвенным при установлении внутрипротоковой патологии. Дилатация протоков статистически не различалась в группах сравнения: при хроническом дуктофорите (49,5 % и 52,5 % соответственно), при внутрипротоковом папилломатозе (42,6 % и 48,0 %), при внутрипротоковом раке ( 44,0 % и 33,3 %).
Таблица 1 Результаты ультразвукового исследования молочных желез в группах сравнения (%)
Фиброзно-кистозная мастопатия – болезнь цивилизации

Врачи нередко при обращении к ним женщин с жалобами на боли, нагрубание молочных желез ставят диагноз мастопатии. Но далеко не всякий дискомфорт молочных желез является мастопатией.
Для обоснованной постановки данного диагноза женщина должна пройти всестороннее обследование:
Диагноз мастопатии ставят при обнаружении комплекса следующих патологических проявлений.
Классификация мастопатии
Предложено несколько классификаций мастопатии. В практике наиболее часто пользуются клинической классификацией, которая делит мастопатию на 3 формы.
1. Масталгия (мазоплазия, мастодиния). При этой форме преобладающим являются выраженные боли в молочных железах, которые требуют назначения обезболивающих препаратов.
2. Диффузная мастопатия. При этом в тканях молочных желез выявляются диффузные уплотнения и кисты. В свою очередь, диффузная мастопатия делится на 2 подтипа:
а) диффузная фиброзная мастопатия, преобладают фиброзные (соединительнотканные) участки уплотнений;
б) диффузная фиброзно-кистозная мастопатия, на фоне фиброзных уплотнений выявляются кисты.
3. Локализованная мастопатия (локализованный фиброаденоматоз).
При этом в каком-либо квадранте молочной железы выявляется четко отграниченный участок. Данную форму выделяют специально, так как при выявлении отграниченного узла в молочной железе необходимо исключить наличие рака. Поэтому при локализованном фиброаденоматозе обязательно проводят маммографию и исследование клеток или тканей из узла. Иногда природу узла в молочной железе можно выявить только во время операции. В таком случае женщине предлагают операцию, под наркозом проводят секторальную резекцию молочной железы с подозрительным участком, и направляют удаленную ткань на срочное гистологическое исследование.
Лечение мастопатии
Диффузная мастопатия лечится консервативным путем. При мастопатии рекомендуется ограничение в пище животных жиров, молочно-растительная диета, увеличение потребления овощей и фруктов, сои и других бобовых, пищевых волокон с отрубями злаковых; оптимизация веса тела; нормализация режима сна и бодрствования; увеличение двигательной активности и лечебная физкультура. Применяют в лечении мастопатии санаторно-курортное лечение, минеральные воды, физиотерапию, аутотренинг, психотерапию.
Применяемые лекарственные препараты можно разделить на 2 группы:
1. Гормональные средства: препараты на основе женских половых гормонов
2. Негормональные средства: витамины, адаптогены, мочегонные, успокаивающие, улучшающие работу печени, препараты калия, ферменты, обезболивающие, препараты йода. В лечении мастопатии используются фитотерапия и препараты на основе природных биологически активных веществ, биологически активные добавки к пище.
При сопутствующей патологии, вызывающей мастопатию, необходимо дополнительное лечение выявленных заболеваний: лечение гинекологических болезней, лечение заболеваний щитовидной железы, регулирование и стабилизация обменных процессов, лечение заболеваний печени и желчного пузыря, устранение венозного застоя в малом тазу, ликвидация синдрома дисбактериоза толстого кишечника и запоров.
Хирургическое лечение при мастопатии проводится лишь в нескольких случаях.
При наличии крупной кисты с жидким содержимым проводят пункцию кисты, отсасывают содержимое. Иногда для того, чтобы стенки кисты спались, внутрь нее вводят склерозирующие вещества. Подобные операции выполняются, как правило, в амбулаторных условиях. При локализованном фиброаденоматозе, как уже говорилось выше, нередко женщину приходится госпитализировать и с диагностической целью проводить секторальную резекцию молочной железы. При фиброаденоме молочной железы иногда в стационарных условиях проводят оперативное лечение: вылущивание опухоли молочной железы, секторальная резекция молочной железы. В большинстве случаев фиброаденому не удаляют, а проводят за ней динамическое наблюдение.
Занимайтесь самообследованием, запомните: положительный результат возможен лишь при очень аккуратном, последовательном и длительном лечении по схеме, рекомендованной врачом.