Малигнизация что это означает
Чем отличается доброкачественная опухоль от злокачественной
В медицине понятие доброкачественности означает лёгкое течение болезни, хорошие результаты лечения и неопасность для жизни. Под злокачественным процессом подразумевают разрушительное течение, сложность терапии, высокий риск смертности.
Для опухолей такое разделение условно. Тем не менее пациентам и врачам крайне важно определить вид опухоли. От этого зависят тактика лечения и прогноз.
Характеристика доброкачественных и злокачественных опухолей
Существуют чёткие критерии:
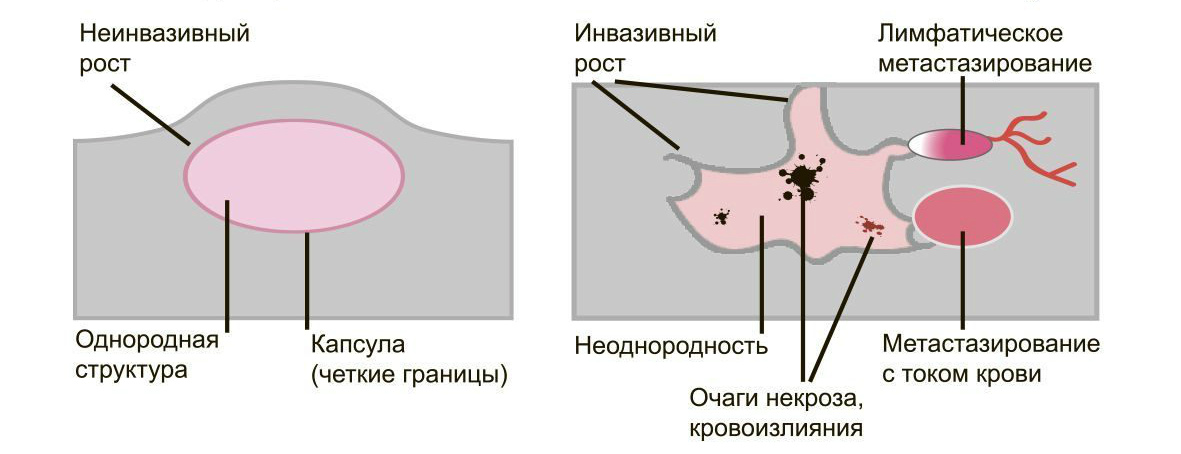
Доброкачественные опухоли чётко отграничены от здоровых тканей, часто имеют капсулу. Рак прорастает окружающие ткани, внедряется в сосуды, его контуры более аморфны.
Большинство доброкачественных опухолей могут расти годами, не проявляя симптомов. Карциномы растут быстро, нарушая функции органов и отравляя организм. Рост сопровождается утомляемостью, слабостью, потерей веса, болью.
Доброкачественные образования “сидят” на одном месте, постепенно растут и раздвигают здоровые ткани, подвижны при прощупывании. Раковые клетки слабо скреплены друг с другом, легко отделяются и разносятся лимфой и кровью по организму. Они оседают в лимфоузлах, костях, внутренних органах, образуя новые опухолевые очаги — метастазы. При пальпации узел спаян с тканями и не сдвигается.
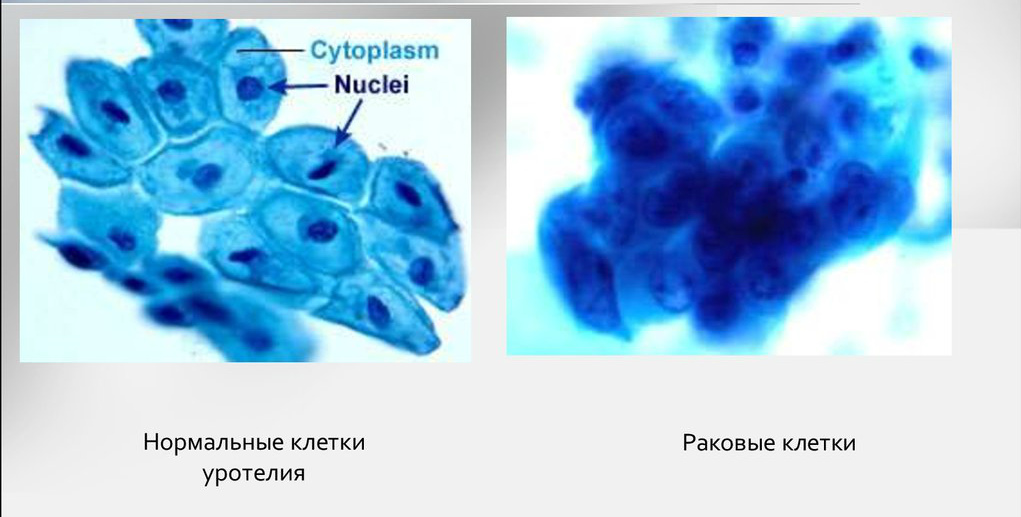
Много информации даёт биопсия. Исследование показывает, что доброкачественные клетки похожи на здоровые, их структура более чёткая. Структура злокачественных клеток сильно изменена из-за выраженных мутаций. Чем меньше клетки напоминают ткань, из которой выросли, тем хуже прогноз для лечения и жизни.
Доброкачественную опухоль, такую как аденома простаты, можно удалить и добиться полного излечения. Если возникнет рецидив, он будет на том же месте, где нашли первичный очаг. Злокачественные образования трудно удалить полностью. Даже одна оставшаяся клетка даст новую опухоль либо на старом месте, либо там, куда она попала по сосудам. Выживаемость больных существенно ниже.
Общие свойства доброкачественных и злокачественных опухолей
Есть моменты, объединяющие оба вида новообразований:
Тяжесть симптомов зависит не только от степени сдавления тканей опухолью, но и от неспособности новообразования выполнять функцию здоровых клеток.
Виды опухолей
Различия не всегда очевидны. Нужна тщательная диагностика для поиска атипичных клеток.
Может ли доброкачественная опухоль стать злокачественной
Любая опухоль способна к малигнизации. Миомы, липомы, фибромы редко переходят в рак. Кисты — крайне редко. Невусы, аденомы, полипы в желудке или кишечнике — очень часто. Многое зависит от условий, в которых находится опухоль, питания, экологии, уровня стресса, гормональных сбоев, наличия предраковых болезней.
В Клинике урологии имени Р. М. Фронштейна доступна современная диагностика опухолей, разработаны эффективные методики лечения. Обращайтесь на консультацию и наши специалисты вам помогут.
Малигнизация
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Малигнизация – отклонение развития клетки организма человека, обусловленное обретением тканевого материала нормальной или патологически преобразованной структуры.
В основе этого явления лежит сбой в процессе реализации генетически обусловленной программы формирования специализированного фенотипа клеток, а так же активизация разрастания ткани организма путем размножения клеток делением.

Причины малигнизации
Несмотря на упорные многолетние исследования, на сегодняшний день лекарства, способного победить рак, не существует. И немалая доля в отсутствии решения приходится на неустановленность причин, по которым происходит дезинтеграция и дедифференцирование здоровых клеток.
Каковы же предполагаемые причины озлокачествления? На сегодняшний день насчитывается множество различных гипотез, но доподлинного подтверждения ни одна из них, пока, не нашла. Ясно только, что наступает определенное сочетание неблагоприятных факторов, которое и запускает процесс перерождения.
Предположительно, причины малигнизации делят по направленности воздействия:
Естественно, это не полный список предполагаемых причин, из-за которых наблюдается озлокачествление клеток, ведущих за собой такие страшные последствия.

Малигнизация клеток
Малигнизация клеток – это автономно прогрессирующий процесс появления в человеческом организме раковых новообразований, путем перерождения в них здоровых клеток, либо уже патологически измененных клеток, но доброкачественного характера. Перестройке подвергается вся структура перерождаемой клетки, она активно начинает разрастаться. На начальном этапе больной не испытывает дискомфорта, даже не догадываясь о своем заболевании. На данном этапе затруднена и диагностика патологии.
В большинстве своем, озлокачествлению подвержены структуры, отягощенные эрозиями, язвенными поражениями, а так же полипами и опухолями доброкачественного генезиса. Процесс злокачественного перерождения клеток является нерегулируемым и необратимым, создавая все новые очаги поражения (метастазы), что способствует стремительному росту процента летальных исходов.
Причина такого сбоя может быть как генетического характера, так и связанная с внешними и внутренними факторами. Купирование ранних стадий заболевания, делает дальнейший жизненный прогноз достаточно благоприятным.

Признаки малигнизации
Во многом, симптоматика заболевания зависит от места локализации патологии. Раковые клетки, поражающие определенный орган, дают симптоматику поражения данного места. Но существуют признаки малигнизации, которые сродни каждой патологии:
Малигнизация полипа
Например, при единичных наростах, диагностируемых в толстой кишке, озлокачествление полипа составляет два – семь процентов. В случае скопления полипов, процесс перерождения встречается гораздо чаще и достигает 95%. Если же диагностирован папилломатоз, являющийся симптоматикой синдрома Тюрко, уровень перерождения – 100%. Исходя из этого, врачами выработана своя тактика лечения, которая и зависит от принадлежности полипов к тому или иному типу.
За редким исключением, полипы всех категорий подлежат иссечению и тщательному гистологическому исследованию. Инновационная эндоскопическая аппаратура дает возможность осуществлять данную процедуру быстро и безболезненно, в условиях поликлиники.
В случае обширного поражения папилломатозом (полипозом) кишечника, когда уровень перерождения обозначается как 100%, медиками назначается классическая полосная операция, предполагающая резекцию части пораженного кишечника с последующей восстановительной пластикой.
Малигнизация язвы желудка
Не редки случаи (от 3 до 15%) перерождения язвенных патологий желудочного тракта в раковые опухоли – этот процесс и называют малигнизация язвы желудка. На сегодняшний день досконально не известны причины, катализирующие развитие рака, но множественные исследования с большой долей вероятности позволяют констатировать неправильное питание, бедное овощами и фруктами, употребление большого количества жареной, копченой пищи, а так же наследственная предрасположенность.
Симптоматика озлокачествления язвы желудка такова:
Диагностируют злокачественное перерождение данного органа теми же методами, что и в случае с язвой желудка.
Малигнизация аденомы
Уже изначально аденому относят к настоящим опухолям. По статистике их раз в 16 реже диагностируют чем, например, констатируют диагноз гиперплазиогенные полипы или фовеолярная гиперплазия. Но озлокачествление аденомы, в зависимости от места ее локализации, встречается в широком процентном диапазоне – от 6 до 75%. Например, у больных, страдающих на рак желудка, озлокачествление аденомы наблюдается в 29 – 59 случаях из ста. Во многом процесс перерождения зависит от размера новообразования.
Наиболее опасными в смысле трансформации являются новообразования диаметром более двух сантиметров. Исходя из этого, можно утверждать, что проведенная эндоскопическая полипэктомия небольших полипов способна снизить процент малигнизированных аденом.
Малигнизация невуса
Родинка на лице может придать шарма ее обладателю, а может обезобразить. Но с медицинской точки зрения, обладатель невусов является потенциальным претендентом на развитие меланомы кожи, пожалуй, самого опасного ракового новообразования. Риск перерождения тем больше, чем значительнее количество родинок на теле человека. Во многом злокачественное перерождение невуса зависит и их формы. Риск перерождения больше у тех новообразований, которые имеют выступающую над поверхностью кожного покрова форму.
Катализатором озлокачествления невуса может стать:
Наиболее подвержены озлокачествлению два типа невусов: врожденные и диспластические. При стечении определенных факторов, малигнизация показывает 100% перерождение клеток в злокачественные опухоли, особенно это касается диспластических невусов.
В связи с тем, что в половине случаев меланома перерождается из невусов – их рассматривают как предраковые новообразования. Поэтому онкологи рекомендуют, по возможности, удалить все выпуклые невусы на теле.
Малигнизация папилломы
На сегодняшний день известно около 70 видов вируса папилломы человека, среди которых наблюдаются и те, которые обладают высокой предрасположенностью к онкологии. Попадая в организм человека, провоцируется малигнизация папилломы. То есть папиллому так же можно назвать предраковым образование, при определенных условиях провоцирующих развитие рака кожи. Хотя онкогенез папилломы и происходит достаточно редко.
Записаться на осмотр к дерматологу должна заставить следующая симптоматика:
Озлокачествление папилломы связывают с ростом активности вируса папилломы человека. Причинами, провоцирующими эту активизацию, называют гормональные сбои в организме, воспалительные процессы хронического характера, подавление иммунитета. Определить причину патологии сможет только врач. Пройдя необходимое обследование, можно выявить признаки раковых преобразований. Только после этого онколог сможет назначить необходимое лечение. Обычно доктор рекомендует в срочном порядке удалить и доброкачественные и малигнизированные папилломы.
Малигнизация узла щитовидной железы
Обнаружение в процессе обследования доброкачественных образований на щитовидной железе побуждает доктора более внимательно относиться к такому пациенту. С этого момента он должен находиться под постоянным медицинским контролем. Ведь такие опухоли могут расти, увеличивая давление на близлежащие органы, что существенно сказывается на их работе. Хоть и незначительна, но существует вероятность озлокачиствления узлов. Озлокачествление узла щитовидной железы выявлена лишь у 5% пациентов, тогда как вообще узлы на щитовидке находят у 95% населения. Но даже такого незначительного процента перерождений достаточно, чтобы не выпускать пациента из поля зрения онкологов, хотя малигнизация узла щитовидной железы большинством оппонентов и отрицается.
Малигнизация миомы
Миома – это уже доброкачественное новообразование, культивирующее на слизистой матки, и состоящее из мышечных волокон или соединительных тканей. Достаточно сильно миома колеблется и в размерах: от нескольких миллиметров до размера кулака взрослого человека. Преимущественно данная патология встречается в лоне матки, меньше на шейке матки. Реже встречаются одиночные миомы (они «любят» соседство себе подобных).
Причиной развития миомы у женщины, гинекологи называют:
Структура миомы неоднородна и их патологичность достигает 75 %, но лишь один процент из них подвергается озлокачествлению.
Малигнизация миомы матки
Миому матки относят к доброкачественным новообразованиям. Данное заболевание составляет треть всех гинекологических заболеваний и обнаруживается в основном у женщин от 30 до 45 лет. Морфологическая неоднородность структур миомы делит ее на три формы:
Малигнизация эпителия эндометрия
Гипертрофия эндометрия (утолщение) развивается за счет увеличения объемов межклеточных структур, количественного и размерного роста клеточного эпителия железистых и соединительных тканей. Гипертрофические изменения и приводят к гиперплазии эндометрия. Наиболее опасным осложнением развития данной патологии является малигнизация эпителия эндометрия, то ест его озлокачествление.
В зависимости от возраста женщины, тяжести ее анамнеза и темпов развития заболевания, озлокачествление эпителия эндометрия проявляется в 1 до 55 случаев из ста.
К гиперплазии эндометрия могут привести:
Малигнизация родинки
Меланома или рак кожи – это результат озлокачествлевания доброкачественного образования (родинки) или малигнизация родинки. Причиной данного процесса считают стремительный неконтролируемый рост меланоцитов в кожных структурах человека. В норме меланоциты производят пигмент меланин, который отвечает за темный оттенок кожи. Под воздействием прямых солнечных лучей выработка этого пигмента усиливается, кожа приобретает темный оттенок (загар). Меланин является защитой организма от солнечного излучения. Превышение меланина в определенном участке кожи и образует родинку.
Раковая меланома – это наиболее тяжелый случай онкологического заболевания кожи. При несвоевременном удалении злокачественной родинки, раковая опухоль начинает очень быстро метастазировать.
Наибольший риск озлокачествления родинки:
Зачастую злокачественная меланома возникает в области родинки (хотя может поразить и любой другой участок кожи). Злокачественное перерождение родинки можно наблюдать и визуально:
Малигнизация эпителия шейки матки
Эндометрий шейки матки – наиболее частая область локализации злокачественных новообразований репродуктивной системы женщины. Малигнизация эпителия шейки матки происходит путем преобразования элементов многослойного плоского эпителия, либо клеток железистой эпителиальной ткани, устилающих полость цервикального канала.
Обычно процессу озлокачествления эпителия шейки матки предшествуют другие болезни органов малого таза:
Все эти заболевания, при сложившихся условиях способны озлокачествливаться, перерождаясь в рак шейки матки.
Диагностика малигнизации
Способы распознания озлокачествления в различных органах человека несколько отличны, но все же существуют какие-то устоявшиеся методики, с помощью которых и ведется диагностика малигнизации.

Подозрение на малигнизацию
Диагностические критерии, вызывающие подозрение на малигнизацию при разной ее локализации несколько разнятся:
К кому обратиться?
Лечение малигнизации
Однозначно описать лечение малигнизации достаточно проблематично в связи с широкой морфологией и «географией» поражения. Ведь человек может долгие годы жить с родинками и папилломами, не чувствуя дискомфорта. В этом случае никакого лечения не требуется, но если есть подозрение или диагностировано озлокачествление образования, его необходимо удалить. Таких современных методик достаточно много. Один из наиболее эффективных методов – это удаление новообразований путем их выжигания (лазерная терапия, криодеструкция, электрокоагуляция и другие).
Магализированные новообразования однозначно подлежат удалению. Лечение малигнизации – это лечение непосредственно того органа, клетки которого начали озлокачествляться. Методы удаления новообразований различны и применяются в зависимости от их большей эффективности в том или ином случае.
Например, протокол лечения в случае озлокачествления язвенной болезни желудка идентичен курсу лечения рака желудка. Даже в случае отсутствия однозначной симптоматики озлокачествления язвенных структур в рак, хирургическое вмешательство все равно показано. В данном случае онкологи пользуются простым медицинским постулатом: чем глубже и обширнее поражение, чем больше возраст больного, чем ниже уровень кислотности желудочного сока, тем меньше времени до эффективного оперативного вмешательства.
Профилактика малигнизации
Для того чтобы избежать или хотя бы диагностировать патологию на ранних сроках развития, необходима профилактика малигнизации.
Придерживаясь этих несложных правил можно, если и не предотвратить озлокачествление здоровых или доброкачественных клеток, то, хотя бы диагностировать ее на ранней стадии перерождения.
Прогноз малигнизации
Применение современных методов диагностики и лечения онкологических заболеваний делает прогноз малигнизации более благоприятным. Важным для его оценки является локализация патологии, степен злокачественности, временной фактор ее обнаружения. Не последнее место в прогнозе на будущее занимает возраст пациента, а так же его общее состояние здоровья.
После своевременного удаления перерожденной папилломы или невуса, человек может долго и счастливо прожить до глубокой старости. В случае же озлокачествления язвы желудка, тут прогноз не менее оптимистичен, но качество жизни страдает. При этом не стоит забывать, что если не провести своевременной диагностики и лечения, результат один – летальный исход.
Путь клетки «из греков в варяги». Малигнизация: причины и следствия
Малигнизация — один из самых загадочных процессов. Что же на самом деле направляет клетку на тернистый путь перерождения?
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Недуг, прозванный чумой XXI века. В наши дни рак является одним из самых страшных заболеваний. В 2010 году более семи миллионов людей по всему свету умерли от рака. В Соединенных Штатах каждая третья женщина и каждый второй мужчина рано или поздно заболеют раком. По прогнозам ВОЗ, число случаев заболевания будет продолжать расти от 14 миллионов в 2012 году до 22 миллионов в следующие десятилетия. Пугающие числа, от которых невольно бросает в дрожь. Однако процесс ракового перерождения, или малигнизации, не только страшен, но и интересен, и в этой статье мы разберемся, почему же некоторые «избранные» клетки решают свернуть не туда и как это влияет на самого «изменника».
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Гончие еще играют во дворе, но дичи не уйти,
как ни мчится она уже сейчас по лесам.
Франц Кафка
На «Биомолекуле» опубликовано немало статей о молекулярных основах канцерогенеза. Но каждая из них, как правило, посвящена какой-то одной стороне этого патологического процесса, в то время как среди наших читателей наверняка есть люди, которые хотели бы, прежде чем углубляться в детали, получить общее представление о раковой клетке. Обзорная статья Анны Батуевой удачно заполняет этот пробел и дает общее представления о ключевых молекулярных механизмах злокачественного перерождения. — Ред.
Под малигнизацией понимают приобретение здоровыми клетками черт злокачественности, которые мы подробно рассмотрим ниже. Процесс злокачественного изменения можно уподобить дичи из цитаты Кафки, ведь клетка, однажды встав на этот путь, не сможет вернуться и получить свое клеточное здоровье обратно. Важную роль в понимании основ перерождения клеток и их дальнейшего функционирования сыграла медицина, а следом за ней и молекулярная биология. Но начнем с истоков истории рака.
Часть 1. Биография рака
Первые упоминания о раке встречаются в папирусе Эдвина Смита, датируемом 16 веком до нашей эры [1]. Там же отмечается, что данное заболевание не поддается лечению.
Во времена Гиппократа, около 400 года до нашей эры, появилось специальное обозначение рака — karkinos. Разросшаяся опухоль напомнила Гиппократу краба, окутывающего все вокруг клешнями. Современное название онкологии произошло от греческого слова onkos, которое греки использовали для описания опухолей. Однако врачи того времени не различали доброкачественные и злокачественные новообразования, и karkinos Гиппократа не имеет ничего общего с истинным раком.
Гиппократ выдвинул гуморальную теорию, суть которой состояла в том, что каждый недуг является следствием переизбытка одного из четырех гуморов: крови, слизи, желтой желчи и черной желчи.
Гален, греческий врач, практиковавший в Риме около 160 года нашей эры, довел теорию Гиппократа до совершенства. Он заявил, что рак образуется из-за переизбытка черной желчи. Гален умер в 199 году нашей эры, но его «черная желчь» еще долго будоражила умы онкологов.
Только спустя пять столетий, в 1538 году, Андреас Везалий опроверг теорию Галена, делая вскрытия в Парижском университете. Окончательно похоронил галенову теорию лондонский анатом Мэтью Бейли, который в 1793 году опубликовал учебник «Патологическая анатомия некоторых наиболее важных частей человеческого тела» [2], в котором представил рисунки и описания раковых опухолей, где не было и следа «черной желчи».
Изобретение микроскопа повлекло за собой первые цитологические исследования рака. В 1801 году французский физиолог Франсуа Биша и в 1838 году Иоганн Мюллер определили, что опухоли имеют клеточную структуру. После этого Жан Крювелье высказал гипотезу «канцероматозной дегенерации», основанную на предположении, что клетка проходит несколько этапов, прежде чем окончательно превратиться в раковую. Немецкий хирург Карл Тирш доказал, что раковая опухоль происходит из эпителиальной ткани, а саркома — из соединительной.
Первая половина XX века породила еще одну теорию канцерогенеза, недалеко ушедшую от истины. В 1911 году Пейтон Раус, работая в Рокфеллеровском университете в Нью-Йорке, открыл вирус, способный вызывать опухоли у кур. Ученые по всему свету бросились искать вирусы, ответственные за рак именно у человека, однако ничего не могли найти. В 1974 году в Medical World News вирус рака у человека ставили в один ряд с НЛО, снежным человеком и лохнесским чудовищем. Вирус СВ-40 и вирус папилломы человека, вызывающие рак у людей, были открыты в 1960 и 1983 годах соответственно.
В 1970 году генетик Говард Темин, работавший в лаборатории Макардла в Висконсине и изучавший вирус саркомы Рауса (ВСР, или VSR), представил свою работу на Десятом Международном онкологическом конгрессе. Он открыл у ВСР обратную транскрипцию — синтез ДНК по РНК — и положил начало изучениям ретровирусов. Позднее он отказался от вирусной теории канцерогенеза, а в 1979 году ученые Майкл Бишоп и Харолд Вармус открыли первый протоонкоген — src (сарк), содержащийся в ВСР. Это положило начало новому этапу в истории онкологии, люди наконец-то поняли, как запускается процесс канцерогенеза. Но этого бы не произошло без изучения раковой клетки и ее странной физиологии.
Часть 2. Что заставляет клетку измениться?
В этой главе мы разберем причины злокачественного перерождения клетки. Первым толчком к началу этого изменения является мутация в ДНК.
Но не всякие повреждения ДНК обязательно приведут к появлению раковой клетки, а лишь те, что затронут определенные гены. Наиболее важную роль в канцерогенезе играют три группы генов: протоонкогены, онкогены и гены — супрессоры опухолей.
Протоонкогены
Протоонкогены — это «здоровые» предшественники онкогенов, которые в результате мутации могут вызвать развитие опухоли. Такими причинами являются различные мутации или суперэкспрессия гена. Как правило, протоонкогены кодируют белки, участвующие в процессах жизненного цикла клетки. В результате мутаций появляются сбои в регуляции клеточного деления и дифференцировки.
Основные изменения, происходящие с протоонкогенами:
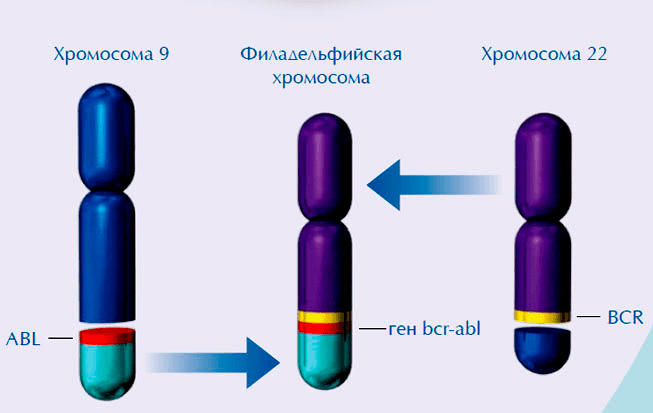
Рисунок 1. Химерный ген BCR-ABL образуется при слиянии участка 9 хромосомы, несущей ген ABL, с участком 22 хромосомы, несущей ген BCR
В некоторых случаях канцерогенез запускается вирусами. Онкогены в геноме вирусов являются ранее захваченными в клетках-хозяевах нормальными генами, которые со временем превратились в злокачественные. Когда такие онкогенные вирусы попадают в клетку, начинается считывание информации с вирусной ДНК или РНК, в цитоплазме накапливаются онкогенные белки и начинается процесс перерождения.
Онкогены
Онкогены — это гены, активность которых стимулирует образование и развитие злокачественной опухоли. Как уже было упомянуто выше, первый вирусный онкоген был открыт в 1979 году.
Биохимические продукты онкогенов
Онкогены кодируют белки с различной структурой и функциями. К основным продуктам деятельности онкогенов относят:
Все вышеперечисленные продукты онкогенов являются сигналами к запуску неконтролируемого клеточного деления. Внешние факторы больше не играют никакой роли в жизни клетки, потому что пролиферацию запускают внутренние сигнальные белки.
Гены и белки — супрессоры
В здоровой клетке существуют защитные механизмы, следящие за процессами и регулирующие клеточный цикл. К таким механизмам относят деятельность белков — супрессоров опухолей: p21, p53, pRb, PTEN и др.
Белок p53 — наиболее изученный белок-супрессор. Он является продуктом гена TP53, мутации которого обнаруживаются в клетках многих опухолей [7]. p53 синтезируется во всех клетках организма, но активируется только при повреждениях ДНК. Этот белок способен остановить клеточный цикл и не допускать дальнейшее деление клетки, пока не произойдет репарация ДНК. При сильных повреждениях он также может запускать процесс апоптоза.
Одной из главных функций p53 является сохранение генетической идентичности всех клеток организма. При неправильной работе этого белка клетка получает возможность делиться даже при поврежденной ДНК, что увеличивает вероятность мутаций и накопления дефектных онкогенов. Важную роль в подавлении p53 играет белок MDM2, который в норме регулирует активность p53. Однако при повышенном синтезе он связывается с p53 и ингибирует его противоопухолевое действие.
Эпигенетические факторы рака
Важными факторами канцерогенеза являются эпигенетические события. Эпигенетика изучает процессы, затрагивающие активность генов, но не изменяющие структуру ДНК. К ним относится изменение метилирования ДНК.
Метилирование — это присоединение метильной группы к нуклеотидам в особых, строго определенных участках генома, называемых CpG-островками. Такое изменение не влияет на структуру молекулы, однако может влиять на экспрессию отдельных генов. В частности, если в участке ДНК много метильных групп, то транскрипция этого участка прекращается.
Особенно активно метилирование проходит в эмбриональный период жизни, а у взрослого человека метилировано около 2% генома. В норме баланс между метилированием и деметилированием строго регулируется и соблюдается, однако в старости начинают преобладать процессы метилирования, что может в итоге привести к канцерогенезу. В процессе онкогенеза происходит гиперметилирование CpG-островков, что приводит к общей геномной нестабильности и накоплению еще большего количества мутаций. В большинстве случаев метилированные участки являются промоторами и влияют на активацию или, наоборот, инактивацию генов, что с виду похоже на действие точечных мутаций.
Однако хотя нарушения в эпигенетической регуляции сопровождают развитие злокачественного перерождения, они, как правило, не являются его первопричиной, а лишь одним из сопутствующих факторов.
По отдельности каждое из вышеперечисленных нарушений не может спровоцировать раковое перерождение. Все они работают совместно и слаженно. Так, онкогенез запускается, только если одновременно активированы онкогены и инактивированы гены-супрессоры в обеих копиях ДНК. Впервые теорию двойного канцерогенеза высказал Альфред Кнудсон, изучавший ретинобластому: «По всей видимости, — писал он, — в возникновении рака у детей ключевую роль играют два типа генов. Первый, онкогены, действует посредством повышенной, аномальной активности. Второй же класс, антионкогены, в онкогенезе рецессивен: рак происходит лишь тогда, когда обе нормальные копии удалены или изменены» [8]. В процессе жизнедеятельности раковая клетка накапливает все большее количество мутаций, поэтому раковый геном часто очень сильно отличается от генома здоровой клетки (рис. 2).
Рисунок 2. Раковый геном. В процессе жизнедеятельности раковая клетка накапливает огромное количество мутаций и нередко характиризуется полиплоидностью.
Часть 3. Физиологические последствия малигнизации
Основное последствие малигнизации — клеточное бессмертие. Оно может поддерживаться несколькими способами: активацией фермента теломеразы, блокировкой регуляторов митохондриального пути апоптоза и в некоторых случаях активацией механизма ALT (alternative lengthening of telomeres, альтернативного удлинения теломер [14]).
Обратная сторона «вечной молодости»
Впервые клеточное бессмертие раковых клеток было продемонстрировано в 1951 году на клеточной линии HeLa, взятой у Генриетты Лакс, вскоре скончавшейся от рака шейки матки (рис. 3) [9].
Рисунок 3. Клеточная линия HeLa — «бессмертная» линия раковых клеток. С 50-х годов прошлого столетия используется для изучения поведения раковых клеток и выявления новых противораковых препаратов.
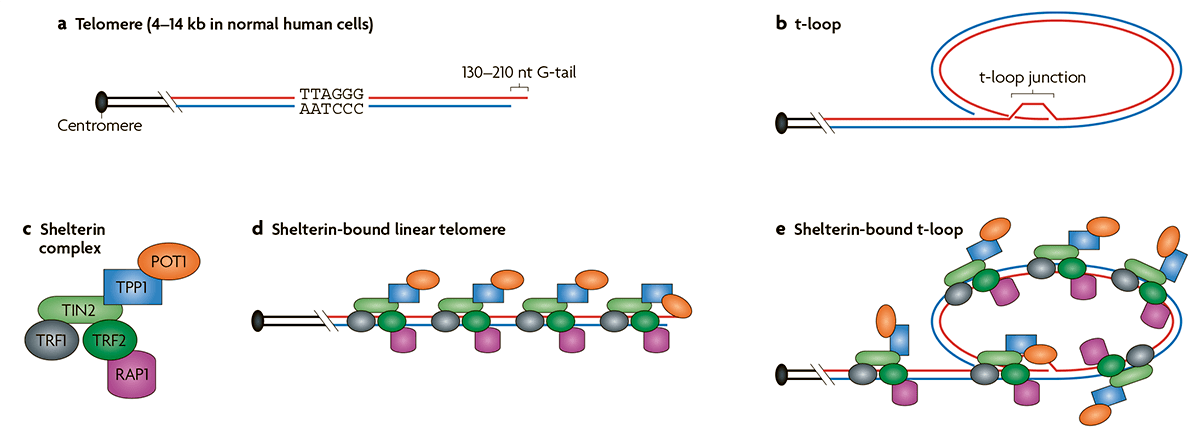
Как правило, малигнизация сопровождается активацией фермента теломеразы. На концах хромосом находятся короткие повторяющиеся участки ДНК, названные теломерами [10]. После каждого деления теломеры укорачиваются, что в итоге приводит к их полному исчезновению и невозможности продолжать деление. Количество возможных делений для клетки названо пределом Хейфлика. Действие теломеразы заключается в восстановлении теломер и превращении клетки в фактически бессмертную, позволяя ей делиться бесконечно долго. Существуют нормальные клетки, в которых также экспрессируется теломераза. Это клетки, которым надо часто делиться: половые, стволовые и клетки эпителия кишечника. Однако теломераза активна в подавляющем большинстве раковых клеток, что играет важную роль в их жизненном цикле.
С другой стороны, в некоторых злокачественных клетках, наравне с активной теломеразой, существует так называемое альтернативное удлинение теломер, или сокращенно ALT [11]. При ALT происходит гомологичная рекомбинация концевых участков хромосом (рис. 4). В норме рекомбинация происходит в процессе мейоза, однако раковые клетки научились достраивать теломеры, используя теломеры другой хромосомы как матрицу [12].
Рисунок 4. Принцип действия ALT, основанный на гомологичном достраивании концов теломер. Такой механизм «бессмертия» является основным для ряда опухолей.
Важно отметить, что раковое бессмертие контролируется не только теломерами, но и ингибированием путей апоптоза, главным из которых является митохондриальный путь. В норме, из митохондрий в цитоплазму выходят митохондриальные белки и образуют апоптотический комплекс — апоптосому, которая и запускает апоптоз. При неправильной работе регуляторных белков, а к ним относятся белки семейства BCL-2, нарушается выход апоптотических белков, что приводит к сбою в процессе апоптоза. В раковых клетках обнаружены нарушения в работе белков BAX и BAK, а также экспрессия ингибиторов клеточной смерти.
Часть 4. Заключение
Ежедневно в нашем организме появляются клетки, вступившие на путь ракового перерождения. Но далеко не все из них дойдут до конца и образуют злокачественную опухоль. С другой стороны, интересно клеточное поведение в процессе малигнизации, когда клетка способна «выключать» отдельные гены, мешающие ее перерождению. Современные исследования в области молекулярной онкологии и раковой геномики дают повод надеяться на окончательное понимание основ малигнизации и физиологии злокачественных клеток. Также в последнее время проводятся разработки новых противораковых препаратов, направленных на исправление дефектных сторон «больных» клеток. Возможно, изучение именно особенностей раковой клетки приведет к созданию лекарства, способного снизить страшные прогнозы Всемирной организации здравоохранения.