Малигнизация что это такое в молочной железе
Рак молочной железы
Рак молочной железы — это злокачественный процесс, во время которого новообразования, замещающие ткани органа, подвергаются малигнизации (озлокачествлению). Патологические изменения происходят на клеточном уровне, в железистой ткани и млечных протоках. Если обратиться в диагностический центр на ранней стадии, можно остановить прогресс заболевания.
Симптомы рака
На первой стадии рак молочной железы протекает без выраженных признаков. Если при самостоятельном осмотре, который должна выполнять каждая женщина после менструального цикла, не реже, чем раз в три месяца, обнаружили уплотнения в груди – обязательно следует записаться на консультацию к маммологу.
На второй стадии уже увеличиваются подмышечные лимфоузлы, новообразование увеличивается, озлокачествляются окружающие ткани. Возможно появление метастазов в регионарных лимфоузлах подмышечных впадин. Появляется боль при неосторожных движениях и прикосновениях.
Третья стадия характеризуется поражением лимфатической системы, молочная железа отекает, краснеет, на коже возникают эрозии, переходящие в язвы, сосок втягивается, иногда появляются выделения.
Летальный исход при обращении в первой стадии сравнительно низкий — 9-11%, а на третьей составляет уже 43-60%. В четвертой стадии метастазы распространяются в окружающие органы, прорастают в близлежащие ткани. На этой стадии вылечить удается 1,5% пациентов. Общие симптомы онкологического процесса: уплотнения в молочных железах и слабость, повышение температуры (при определенных формах заболевания), может развивается депрессия. На поздних стадиях развития болезни возникает болевой синдром.
Возможные причины возникновения рака груди
Точные причины злокачественного перерождения новообразований до сих пор не установлены. Однако выявлены факторы, ускоряющие формирование и рост новообразований:
Установлено, что толчком к развитию рака молочных желез могут стать эндокринные нарушения и физиологические параметры — большая или плотная упругая грудь. Из-за тяжести молочной железы нарушается кровоснабжение. Во втором случае прохождение питательных веществ затруднено из-за индивидуального строения.
Запись на консультацию маммолога по телефону:
Диагностика и лечение
Чем раньше обнаружат малигнизацию новообразований, тем больше шансов на выздоровление. Скрининговая (первичная) диагностика выявляет первичные изменения в молочной железе. В комплекс мероприятий входят осмотр у маммолога, хирурга, онколога и консультация эндокринолога. Специалисты центра помогают выявить опухоль на стадии формирования и предотвратить ухудшение состояния. Как уточняющие обследования используются УЗИ молочных желез, маммография, МРТ, КТ, гистологическое обследование и другие виды диагностических процедур.
Лечение назначают каждому пациенту индивидуально. Могут потребоваться: химиотерапия, радио- и лучевая терапия, хирургическое вмешательство, иммунотерапия и использование гормональных препаратов. Иногда различные методы сочетаются.
Опасность самолечения
Если во время самообследования выявлены уплотнения в молочных железах, необходимо сразу же обращаться к врачу. Народные средства возможно использовать только в комплексе с традиционным лечением, предварительно согласовав расширение терапевтической схемы с лечащим врачом. Домашние методы помогают повысить иммунитет и уменьшить болезненную симптоматику, но остановить малигнизацию и восстановить структуру железистой ткани невозможно. К тому же уходит время, метастазы формируются и врастают в окружающие ткани, состояние утяжеляется.
Рак молочных желез опасное заболевание, нет достоверных данных выздоровления без помощи официальной медицины. Отдельные случаи излечения можно считать чудом. Не следует экспериментировать с собственным здоровьем, слишком высока цена — жизнь.
Что такое новообразование молочной железы? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ивашков В. Ю., маммолога со стажем в 10 лет.
Определение болезни. Причины заболевания
Новообразования груди бывают доброкачественные и злокачественные.
Доброкачественные новообразования, в отличие от злокачественных опухолей:
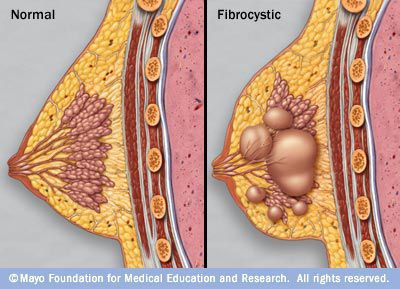
Доброкачественные новообразования могут встречаться как у женщин, так и у мужчин. Существует много типов доброкачественных новообразований молочной железы. Зачастую приходится встречаться с диагнозом фиброзно-кистозная мастопатия, который описывает целую группу доброкачественных новообразований молочной железы.
Доброкачественные новообразования молочных желез встречаются очень часто. Так, в РФ 9 из 10 женщин имеют доброкачественные изменения ткани молочной железы.
Точная причина доброкачественных новообразований молочных желез неизвестна. Известно, что клетки в организме делятся и растут с определенной скоростью. Как правило, организм способен сбалансировать рост и деление клеток. Когда старые или поврежденные клетки умирают, они автоматически заменяются новыми здоровыми клетками. В случае с доброкачественными образованиями скорость деления клеток нарушается, что приводит к локальному росту железистой ткани молочных желез.
Существует множество доброкачественных опухолей, которые развиваются в ткани молочной железы, название опухоли зависит от ткани, которая является источником роста, так, липома молочной железы, например, растет из жировых клеток, а миома — из мышечной ткани.
Аденомы молочных желез образуются в тонком слое ткани, который покрывает железистые дольки молочной железы. Несмотря на разнообразие новообразований молочных желез, наиболее часто встречаются фиброаденомы молочной железы.
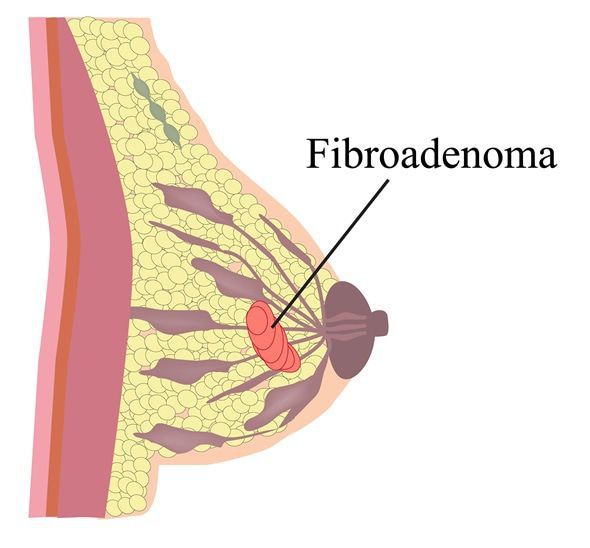
Фиброаденома — это доброкачественная опухоль в груди, которая обычно встречается у женщин в возрасте до 30 лет.
Около 70% женщин в России либо встречались с данным диагнозом, либо не знают о наличии у них фиброаденомы молочной железы. Данная опухоль состоит из так называемой стромальной, или соединительной ткани. Фиброаденомы могут встречаться в одной или обеих молочных железах. Фиброаденома плотная, округлой формы, подвижна под кожей.
На образование фиброаденомы влияет совокупность факторов. Гормоны, такие как эстроген, играют важную роль в росте и развитии фиброаденомы. Существуют данные, что прием оральных контрацептивов в возрасте до 20 лет повышает риск развития фиброаденом. Влияние гормонального фона можно подтвердить тем, что фиброзные новообразования молочных желез могут интенсивно расти во время беременности, а во время менопаузы их размер сокращается.
Существует два типа фиброаденом:
Простые фиброаденомы не повышают риск развития рака молочной железы. Сложные фиброаденомы содержат другие компоненты, такие как кисты, заполненные жидкостью, которые иногда содержат отложения кальция. Сложные фиброаденомы могут незначительно увеличить риск развития рака молочной железы. Американское онкологическое сообщество утверждает, что женщины со сложными фиброаденомами имеют в полтора раза больший риск развития рака молочной железы, чем женщины без таковых.
Рак молочной железы возникает, когда ДНК клетки повреждена, но почему и как эта ДНК повреждается, пока неизвестно. Это может быть генетическое или экологическое воздействие, или в большинстве случаев сочетание обоих факторов. Но большинство пациентов никогда не узнают, что именно вызвало их рак.
Факторы риска, связанные с раком молочной железы:
Если у близких родственников был диагностирован рак молочной железы или яичников, у человека высокий риск развития рака молочной железы в будущем. Риск увеличивается, если родственнику был поставлен диагноз до 50 лет. У женщин с ранней менструацией (до 12 лет), поздней менопаузой (после 55 лет), родивших первого ребенка после 27 лет или никогда не рожавших, риск развития рака молочной железы выше, чем в остальной популяции. Мутации в определенных генах, такие как BRCA1 и BRCA2, могут увеличить риск развития рака молочной железы. Наличие мутаций выясняется с помощью генетического теста, который необходимо выполнить женщинам, у которых есть отягощенный семейный анамнез. Лица с этими мутациями генов могут передавать мутацию гена своим детям.
Другие факторы риска:
Симптомы новообразования молочной железы
Для фиброаденомы характерно наличие плотного округлого образования, которое легко смещается относительно ткани молочной железы. Как правило, безболезненное, однако некоторые пациентки отмечают ощущение болезненности, связанное с менструальным циклом. Если фиброаденома находится близко к поверхности кожи, возможна деформация кожного покрова, что может быть визуально заметно для пациентки.
Кисты молочных желез обычно бессимптомны, если размер кисты зависит от менструального цикла, возможно ощущение набухания молочной железы перед менструациями.
Внутрипротоковая папиллома имеет патогномоничный признак — густые кровянистые выделения из соска. Возможна пальпация самого образования, если оно располагается поверхностно.
Листовидные опухоли и радиальный рубец зачастую проявляют себя только наличием образования в ткани молочной железы, болей нет.
Рак молочной железы имеет некоторые характерные признаки:
1. наличие опухолевого узла в молочной железе;
2. симптом площадки;
4. увеличение подмышечных лимфоузлов;
5. иногда выделения из соска.
Патогенез новообразования молочной железы
Развитие новообразований молочной железы — процесс, который запускается благодаря совокупности различных факторов: гормонального фона, стресса, условий окружающей среды. Особенностью доброкачественных образований — фиброаденом, липом и кист — является тот факт, что в любом случае процесс деления клеток внутри этих образований находится под контролем иммунной системы организма. То есть эти образования никогда не могут разрастись до неконтролируемых размеров или распространиться по лимфатической системе.
Кисты в молочной железе образуются в результате гиперпродукции секрета протоков млечных путей, таким образом происходит формирование мешочков, заполненных содержимым. Фиброаденома — разрастание соединительной ткани. И кисты, и фиброаденомы очень часто сочетаются, поэтому подобное состояние называется фиброзно-кистозная мастопатия.
Что касается злокачественных новообразований молочной железы, то тут механизм немного другой. Поврежденные клетки нашего организма могут размножаться, создавая еще более поврежденные клетки и вызывая рост опухоли. Гормоны нашего организма и химические вещества могут ускорить рост этих мутировавших клеток. Лимфатические и кровеносные сосуды могут переносить рак в другие области тела. Процессы злокачественного роста запускаются после повреждения клеток. Здоровые клетки являются основными строительными блоками всех тканей и органов в организме. Но когда ДНК клетки повреждена, мутировавшие клетки начинают быстро воспроизводиться, не следуя какому-либо плану. Агрессивный рост клеток образует опухоль. Эти аномальные клетки или группы клеток перерастают в болезнь, известную как рак молочной железы, и могут распространяться на другие части тела.
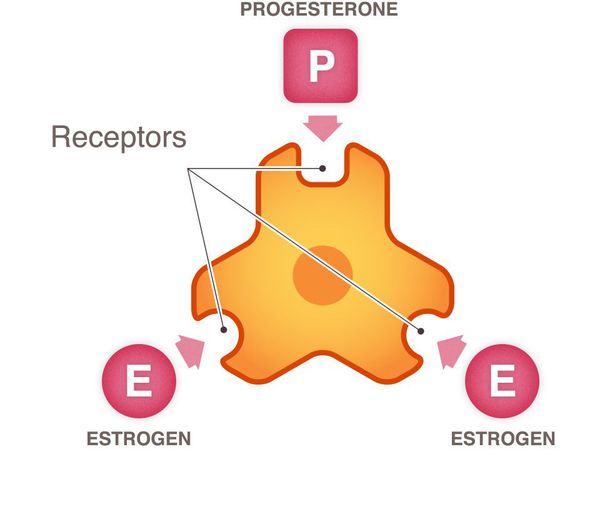
Рост и распространение рака молочной железы подпитывается нормальными химическими веществами организма, такими как эстроген, прогестерон и ген HER2/neu (фактор роста). Каждый из этих трех химических компонентов является важным в норме, однако когда клетка становится раковой, эти химические вещества ускоряют рост клеток рака молочной железы.
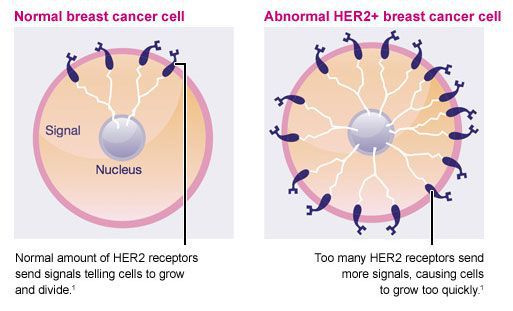
Здоровые рецепторы HER2 — это белки, которые помогают управлять тем, как клетка молочной железы растет, делится и ремонтирует себя. Однако примерно у четверти всех больных раком молочной железы ген HER2 функционирует неправильно. Он создает избыточное количество копий самого себя в процессе, известном как «амплификация гена HER2». Затем эти дополнительные гены инструктируют клетки создавать слишком много рецепторов HER2, что называется «сверхэкспрессией белка HER2». Конечным результатом является то, что клетки молочной железы растут и делятся неконтролируемым образом.
Классификация и стадии развития новообразования молочной железы
Новообразования молочных желез делятся на 2 вида:
Доброкачественные образования:
Гиперплазия — чрезмерный рост (пролиферация) клеток долек или протоков молочной железы. Существует два основных типа гиперплазии — обычный и атипичный. Оба повышают риск рака молочной железы, но атипичная гиперплазия делает это в большей степени. [1]
Кисты представляют собой заполненные жидкостью мешочки, которые почти всегда доброкачественны. Кисты чаще встречаются у женщин в возрасте 35-50 лет.
Внутрипротоковые папилломы — это локальное разрастание стенки млечного протока в груди. Они обычно располагаются близко к соску и могут вызывать боль. Вы можете почувствовать уплотнение вблизи ареолы. Типичным признаком папилломы являются темные кровянистые выделения из соска. Они чаще всего встречаются у женщин в возрасте 35-55 лет. Внутрипротоковые папилломы (ВПП) удаляются хирургическим путем и не требуют дальнейшего лечения. [2] Если у вас одна ВПП, она не увеличивает риск развития рака молочной железы(в случае отсутствия аномальных клеток или клеток протоковой карциномы in situ (DCIS). [3] Наличие 5 или более ВПП может увеличить риск рака молочной железы. [4]
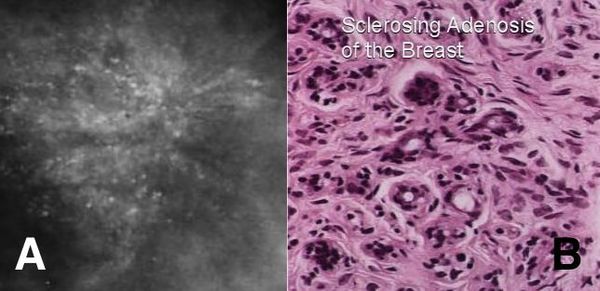
Склерозирующий аденоз состоит из небольших уплотнений, состоящих их увеличенных долек молочной железы. Может вызывать боль, не связанную с менструальным циклом. Склерозирующий аденоз можно увидеть на маммограмме.
Поскольку он имеет неровные контуры, он может быть ошибочно принят за рак молочной железы. Для исключения рака молочной железы может потребоваться биопсия. Склерозирующий аденоз не нуждается в лечении. [5] Некоторые исследования показали, что склерозирующий аденоз несколько увеличивает риск развития рака молочной железы, а другие не обнаружили увеличения риска. [6]
Радиальный рубец (рубец Земба) имеет сердцевину волокон соединительной ткани. Хотя радиальный рубец может выглядеть как рак молочной железы на маммограмме, он не являются раком. Радиальный рубец удаляется хирургическим путем, но не требует дальнейшего лечения. Исследования показали, что радиальный рубец не увеличивает риск развития рака молочной железы. [7]
Листовидная опухоль — это редкая опухоль молочной железы, которая состоит из соединительной (стромальной) ткани. Чаще всего встречаются у женщин в возрасте 40 лет. Женщины с синдромом Ли-Фраумени (редкое наследственное генетическое состояние) имеют повышенный риск развития подобных опухолей. Большинство листовидных опухолей являются доброкачественными (не раковыми), но 1 из 4 из этих опухолей являются злокачественными (рак).
Злокачественные новообразования молочных желез:
Рак молочной железы — заболевание неоднородное. Существует большое количество различных подтипов рака молочной железы, каждый из которых имеет свои особенности диагностики и лечения.
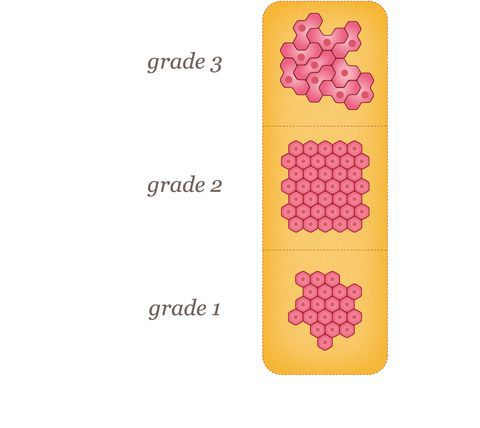
Во-первых, существуют различные типы дифференцировки:
1. низкий класс (1) — хорошо дифференцированный;
2. промежуточный класс (2) — умеренно дифференцированный;
3. высокий класс (3) — плохо дифференцированный.
Высокодифференцированные опухоли больше похожи на нормальную ткань молочной железы под микроскопом. Низкодифференциированные опухоли выглядят менее похожими на нормальную ткань и имеют тенденцию быть более агрессивными. Стадирование рака молочной железы осуществляется по системе TNM, в которой учитывается размер опухоли, состояние региональных лимфоузлов и наличие отдаленных метастазов. Прогноз для пациента очень сильно зависит от стадии рака молочной железы.
Осложнения новообразования молочной железы
В группе доброкачественных новообразований осложнения встречаются относительно редко. Крупные фиброаденомы и листовидные опухоли могут вырастать до крупных размеров, что приводит к изменению формы молочной железы и ее деформации. В случае беременности данная ситуация может осложниться лактостазом и маститом. Крупные кисты молочных желез в некоторых случаях могут инфицироваться, что в дальнейшем приводит к развитию инфекционных осложнений в виде абсцесса или флегмоны молочной железы. Наиболее грозным осложнением новообразований молочных желез является рак молочной железы. Однако злокачественное перерождение происходит достаточно редко, особенно в случае фиброаденомы молочной железы. Относительно чаще злокачественной трансформации подвергается дольковая или протоковая гиперплазия.
В случае обнаружения, развития и последующего лечения рака молочной железы возможно возникновение таких осложнений, как лимфостаз или лимфедема, которые проявляются появлением стойкого отека руки на оперированной стороне. [8] Однако данное состояние эффективно поддается лечению с помощью наложения лимфовенозных анастомозов и пересадки лимфатических узлов. [9]
Диагностика новообразования молочной железы
Существуют различные эффективные методы диагностики новообразований молочных желез. Ключом к постановке правильного диагноза является определение того, является ли опухоль доброкачественной или злокачественной. [10] Только гистологическое исследование может с уверенностью определить эти характеристики опухоли. Самым первым способом диагностики является самообследование молочных желез.
Если вам удалось обнаружить подозрительные образования, необходимо обратиться к специалисту-онкологу для проведения полного обследования молочных желез.
Основные инструментальные методы для диагностики новообразований молочных желез:
3. МРТ молочных желез
Доброкачественные опухоли часто имеют четко выраженные границы, что позволяет диагностировать их как доброкачественные. Также необходимо сдать анализы крови на наличие маркеров рака, например, СА 153. В случаях, когда клиническая картина сомнительна, необходимо провести биопсию опухоли, чтобы определить, является ли она доброкачественной или злокачественной. Биопсия будет более или менее инвазивной в зависимости от местоположения опухоли. Наиболее эффективным методом для биопсии образований молочной железы является кор-биопсия. [11] Суть методики состоит в заборе столбика тканей подозрительного образования с дальнейшим гистологическим исследованием. В случае, если образование злокачественное — необходимо определить рецептурный статус, что позволит начать грамотное и специализированное лечение.
Лечение новообразования молочной железы
Не все доброкачественные опухоли нуждаются в лечении. Если опухоль небольшая и не вызывает никаких симптомов, необходимо осуществлять динамическое наблюдение.
Фиброаденому не обязательно удалять. В зависимости от симптомов, семейной истории, данных УЗИ врач решает: удалить фиброаденому или нет. Фиброаденомы, которые не растут и, безусловно, не являются злокачественными, достаточно контролировать по УЗИ и маммографии.
Показания для удаления фиброаденомы:
1. размер более 5 мм;
2. фиброаденома влияет на естественную форму груди;
3. фиброаденома вызывает боль;
4. обеспокоенность развитием рака;
5. наличие рака в семейной истории;
6. сомнительные результаты биопсии.
После удаления фиброаденомы рекомендовано следующее лечение:
1. Прожестожель 1% 1 р/сут. втирать в каждую железу 3 месяца;
2. Аевит 1 драже 2 р/сут.;
3. Валерианы экстракт 1 таб/3р/сут.;
4. Мастодинон 1 таб 2р/сут. или 30 капель 2р/сут. 3 мес, месяц перерыв, еще 3 месяца;
Основным видом лечения листовидных опухолей является хирургический. [12] Листовидные опухоли могут рецидивировать при недостаточном удалении. По этой причине их необходимо удалять вместе с краем нормальной ткани молочной железы. В некоторых случаях может потребоваться мастэктомия. Злокачественные листовидные опухоли отличаются от рака молочной железы. Они плохо реагируют на гормональную терапию или химиотерапевтические препараты, которые используются для лечения рака молочной железы. Злокачественные листовидные опухоли необходимо лечить по тем же принципам, что и саркомы.
Лечение внутрипротоковой папилломы — хирургическое, удаление новообразования вместе протоком молочной железы. Протоковая, или дольковая гиперплазия, как правило, в лечении не нуждается. Однако если при выполнении пункционной биопсии были получены атипические клетки, необходимо выполнить кор-биопсию молочной железы или секторальную резекцию, чтобы достоверно исключить злокачественное новообразование.
Прогноз. Профилактика
Доброкачественные новообразования молочной железы — это не рак молочной железы. Однако некоторые типы (особенно те, в которых по данным биопсии присутствуют аномальные клетки) повышают риск рака молочной железы. В этом случае стоит осуществлять серьезный контроль за новообразованиями и при необходимости удалять их.
Существуют некоторые факторы, которые могут увеличить риск развития доброкачественных новообразований молочной железы:
1. менопаузальная гормональная терапия (использование постменопаузальной заместительной терапии);
2. семейный рак молочной железы или доброкачественные образования молочных желез у членов одной семьи;
3. употребление алкоголя в подростковом возрасте;
4. нарушения менструального цикла;
5. тиреотоксический зоб;
6. нерегулярная половая жизнь.
Факторы, которые снижают риск возникновения новообразований молочных желез:
1. употребление в пищу продуктов, содержащих каротиноиды, например, дыня, морковь, сладкий картофель, орехи и бобы;
2. грудное вскармливание;
3. регулярная половая жизнь.
Женщинам с атипичной гиперплазией (но не обычной гиперплазией) рекомендуется рассмотреть возможность приема тамоксифена для снижения риска развития рака молочной железы. [13] Тамоксифен снижает риск развития рака молочной железы у женщин с атипичной гиперплазией на 86%.
Путь клетки «из греков в варяги». Малигнизация: причины и следствия
Малигнизация — один из самых загадочных процессов. Что же на самом деле направляет клетку на тернистый путь перерождения?
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Недуг, прозванный чумой XXI века. В наши дни рак является одним из самых страшных заболеваний. В 2010 году более семи миллионов людей по всему свету умерли от рака. В Соединенных Штатах каждая третья женщина и каждый второй мужчина рано или поздно заболеют раком. По прогнозам ВОЗ, число случаев заболевания будет продолжать расти от 14 миллионов в 2012 году до 22 миллионов в следующие десятилетия. Пугающие числа, от которых невольно бросает в дрожь. Однако процесс ракового перерождения, или малигнизации, не только страшен, но и интересен, и в этой статье мы разберемся, почему же некоторые «избранные» клетки решают свернуть не туда и как это влияет на самого «изменника».
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Гончие еще играют во дворе, но дичи не уйти,
как ни мчится она уже сейчас по лесам.
Франц Кафка
На «Биомолекуле» опубликовано немало статей о молекулярных основах канцерогенеза. Но каждая из них, как правило, посвящена какой-то одной стороне этого патологического процесса, в то время как среди наших читателей наверняка есть люди, которые хотели бы, прежде чем углубляться в детали, получить общее представление о раковой клетке. Обзорная статья Анны Батуевой удачно заполняет этот пробел и дает общее представления о ключевых молекулярных механизмах злокачественного перерождения. — Ред.
Под малигнизацией понимают приобретение здоровыми клетками черт злокачественности, которые мы подробно рассмотрим ниже. Процесс злокачественного изменения можно уподобить дичи из цитаты Кафки, ведь клетка, однажды встав на этот путь, не сможет вернуться и получить свое клеточное здоровье обратно. Важную роль в понимании основ перерождения клеток и их дальнейшего функционирования сыграла медицина, а следом за ней и молекулярная биология. Но начнем с истоков истории рака.
Часть 1. Биография рака
Первые упоминания о раке встречаются в папирусе Эдвина Смита, датируемом 16 веком до нашей эры [1]. Там же отмечается, что данное заболевание не поддается лечению.
Во времена Гиппократа, около 400 года до нашей эры, появилось специальное обозначение рака — karkinos. Разросшаяся опухоль напомнила Гиппократу краба, окутывающего все вокруг клешнями. Современное название онкологии произошло от греческого слова onkos, которое греки использовали для описания опухолей. Однако врачи того времени не различали доброкачественные и злокачественные новообразования, и karkinos Гиппократа не имеет ничего общего с истинным раком.
Гиппократ выдвинул гуморальную теорию, суть которой состояла в том, что каждый недуг является следствием переизбытка одного из четырех гуморов: крови, слизи, желтой желчи и черной желчи.
Гален, греческий врач, практиковавший в Риме около 160 года нашей эры, довел теорию Гиппократа до совершенства. Он заявил, что рак образуется из-за переизбытка черной желчи. Гален умер в 199 году нашей эры, но его «черная желчь» еще долго будоражила умы онкологов.
Только спустя пять столетий, в 1538 году, Андреас Везалий опроверг теорию Галена, делая вскрытия в Парижском университете. Окончательно похоронил галенову теорию лондонский анатом Мэтью Бейли, который в 1793 году опубликовал учебник «Патологическая анатомия некоторых наиболее важных частей человеческого тела» [2], в котором представил рисунки и описания раковых опухолей, где не было и следа «черной желчи».
Изобретение микроскопа повлекло за собой первые цитологические исследования рака. В 1801 году французский физиолог Франсуа Биша и в 1838 году Иоганн Мюллер определили, что опухоли имеют клеточную структуру. После этого Жан Крювелье высказал гипотезу «канцероматозной дегенерации», основанную на предположении, что клетка проходит несколько этапов, прежде чем окончательно превратиться в раковую. Немецкий хирург Карл Тирш доказал, что раковая опухоль происходит из эпителиальной ткани, а саркома — из соединительной.
Первая половина XX века породила еще одну теорию канцерогенеза, недалеко ушедшую от истины. В 1911 году Пейтон Раус, работая в Рокфеллеровском университете в Нью-Йорке, открыл вирус, способный вызывать опухоли у кур. Ученые по всему свету бросились искать вирусы, ответственные за рак именно у человека, однако ничего не могли найти. В 1974 году в Medical World News вирус рака у человека ставили в один ряд с НЛО, снежным человеком и лохнесским чудовищем. Вирус СВ-40 и вирус папилломы человека, вызывающие рак у людей, были открыты в 1960 и 1983 годах соответственно.
В 1970 году генетик Говард Темин, работавший в лаборатории Макардла в Висконсине и изучавший вирус саркомы Рауса (ВСР, или VSR), представил свою работу на Десятом Международном онкологическом конгрессе. Он открыл у ВСР обратную транскрипцию — синтез ДНК по РНК — и положил начало изучениям ретровирусов. Позднее он отказался от вирусной теории канцерогенеза, а в 1979 году ученые Майкл Бишоп и Харолд Вармус открыли первый протоонкоген — src (сарк), содержащийся в ВСР. Это положило начало новому этапу в истории онкологии, люди наконец-то поняли, как запускается процесс канцерогенеза. Но этого бы не произошло без изучения раковой клетки и ее странной физиологии.
Часть 2. Что заставляет клетку измениться?
В этой главе мы разберем причины злокачественного перерождения клетки. Первым толчком к началу этого изменения является мутация в ДНК.
Но не всякие повреждения ДНК обязательно приведут к появлению раковой клетки, а лишь те, что затронут определенные гены. Наиболее важную роль в канцерогенезе играют три группы генов: протоонкогены, онкогены и гены — супрессоры опухолей.
Протоонкогены
Протоонкогены — это «здоровые» предшественники онкогенов, которые в результате мутации могут вызвать развитие опухоли. Такими причинами являются различные мутации или суперэкспрессия гена. Как правило, протоонкогены кодируют белки, участвующие в процессах жизненного цикла клетки. В результате мутаций появляются сбои в регуляции клеточного деления и дифференцировки.
Основные изменения, происходящие с протоонкогенами:
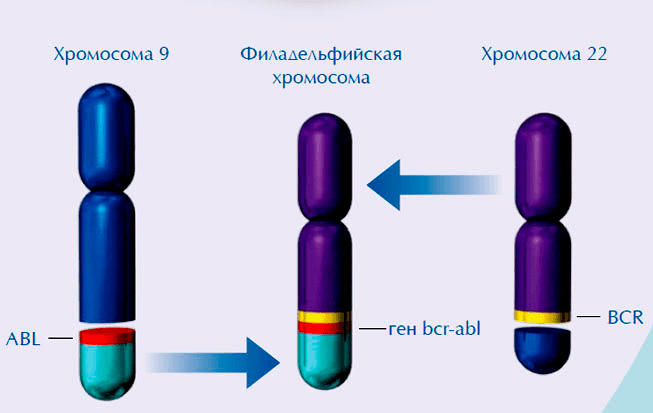
Рисунок 1. Химерный ген BCR-ABL образуется при слиянии участка 9 хромосомы, несущей ген ABL, с участком 22 хромосомы, несущей ген BCR
В некоторых случаях канцерогенез запускается вирусами. Онкогены в геноме вирусов являются ранее захваченными в клетках-хозяевах нормальными генами, которые со временем превратились в злокачественные. Когда такие онкогенные вирусы попадают в клетку, начинается считывание информации с вирусной ДНК или РНК, в цитоплазме накапливаются онкогенные белки и начинается процесс перерождения.
Онкогены
Онкогены — это гены, активность которых стимулирует образование и развитие злокачественной опухоли. Как уже было упомянуто выше, первый вирусный онкоген был открыт в 1979 году.
Биохимические продукты онкогенов
Онкогены кодируют белки с различной структурой и функциями. К основным продуктам деятельности онкогенов относят:
Все вышеперечисленные продукты онкогенов являются сигналами к запуску неконтролируемого клеточного деления. Внешние факторы больше не играют никакой роли в жизни клетки, потому что пролиферацию запускают внутренние сигнальные белки.
Гены и белки — супрессоры
В здоровой клетке существуют защитные механизмы, следящие за процессами и регулирующие клеточный цикл. К таким механизмам относят деятельность белков — супрессоров опухолей: p21, p53, pRb, PTEN и др.
Белок p53 — наиболее изученный белок-супрессор. Он является продуктом гена TP53, мутации которого обнаруживаются в клетках многих опухолей [7]. p53 синтезируется во всех клетках организма, но активируется только при повреждениях ДНК. Этот белок способен остановить клеточный цикл и не допускать дальнейшее деление клетки, пока не произойдет репарация ДНК. При сильных повреждениях он также может запускать процесс апоптоза.
Одной из главных функций p53 является сохранение генетической идентичности всех клеток организма. При неправильной работе этого белка клетка получает возможность делиться даже при поврежденной ДНК, что увеличивает вероятность мутаций и накопления дефектных онкогенов. Важную роль в подавлении p53 играет белок MDM2, который в норме регулирует активность p53. Однако при повышенном синтезе он связывается с p53 и ингибирует его противоопухолевое действие.
Эпигенетические факторы рака
Важными факторами канцерогенеза являются эпигенетические события. Эпигенетика изучает процессы, затрагивающие активность генов, но не изменяющие структуру ДНК. К ним относится изменение метилирования ДНК.
Метилирование — это присоединение метильной группы к нуклеотидам в особых, строго определенных участках генома, называемых CpG-островками. Такое изменение не влияет на структуру молекулы, однако может влиять на экспрессию отдельных генов. В частности, если в участке ДНК много метильных групп, то транскрипция этого участка прекращается.
Особенно активно метилирование проходит в эмбриональный период жизни, а у взрослого человека метилировано около 2% генома. В норме баланс между метилированием и деметилированием строго регулируется и соблюдается, однако в старости начинают преобладать процессы метилирования, что может в итоге привести к канцерогенезу. В процессе онкогенеза происходит гиперметилирование CpG-островков, что приводит к общей геномной нестабильности и накоплению еще большего количества мутаций. В большинстве случаев метилированные участки являются промоторами и влияют на активацию или, наоборот, инактивацию генов, что с виду похоже на действие точечных мутаций.
Однако хотя нарушения в эпигенетической регуляции сопровождают развитие злокачественного перерождения, они, как правило, не являются его первопричиной, а лишь одним из сопутствующих факторов.
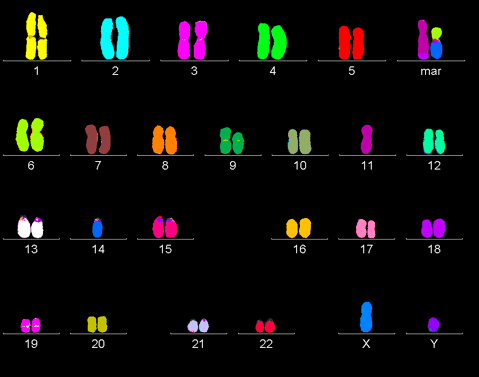
По отдельности каждое из вышеперечисленных нарушений не может спровоцировать раковое перерождение. Все они работают совместно и слаженно. Так, онкогенез запускается, только если одновременно активированы онкогены и инактивированы гены-супрессоры в обеих копиях ДНК. Впервые теорию двойного канцерогенеза высказал Альфред Кнудсон, изучавший ретинобластому: «По всей видимости, — писал он, — в возникновении рака у детей ключевую роль играют два типа генов. Первый, онкогены, действует посредством повышенной, аномальной активности. Второй же класс, антионкогены, в онкогенезе рецессивен: рак происходит лишь тогда, когда обе нормальные копии удалены или изменены» [8]. В процессе жизнедеятельности раковая клетка накапливает все большее количество мутаций, поэтому раковый геном часто очень сильно отличается от генома здоровой клетки (рис. 2).
Рисунок 2. Раковый геном. В процессе жизнедеятельности раковая клетка накапливает огромное количество мутаций и нередко характиризуется полиплоидностью.
Часть 3. Физиологические последствия малигнизации
Основное последствие малигнизации — клеточное бессмертие. Оно может поддерживаться несколькими способами: активацией фермента теломеразы, блокировкой регуляторов митохондриального пути апоптоза и в некоторых случаях активацией механизма ALT (alternative lengthening of telomeres, альтернативного удлинения теломер [14]).
Обратная сторона «вечной молодости»
Впервые клеточное бессмертие раковых клеток было продемонстрировано в 1951 году на клеточной линии HeLa, взятой у Генриетты Лакс, вскоре скончавшейся от рака шейки матки (рис. 3) [9].
Рисунок 3. Клеточная линия HeLa — «бессмертная» линия раковых клеток. С 50-х годов прошлого столетия используется для изучения поведения раковых клеток и выявления новых противораковых препаратов.
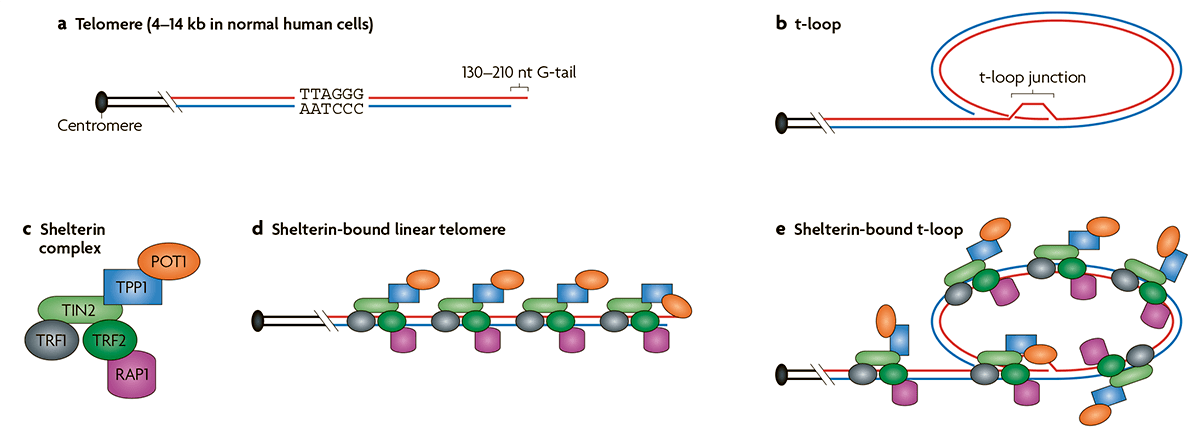
Как правило, малигнизация сопровождается активацией фермента теломеразы. На концах хромосом находятся короткие повторяющиеся участки ДНК, названные теломерами [10]. После каждого деления теломеры укорачиваются, что в итоге приводит к их полному исчезновению и невозможности продолжать деление. Количество возможных делений для клетки названо пределом Хейфлика. Действие теломеразы заключается в восстановлении теломер и превращении клетки в фактически бессмертную, позволяя ей делиться бесконечно долго. Существуют нормальные клетки, в которых также экспрессируется теломераза. Это клетки, которым надо часто делиться: половые, стволовые и клетки эпителия кишечника. Однако теломераза активна в подавляющем большинстве раковых клеток, что играет важную роль в их жизненном цикле.
С другой стороны, в некоторых злокачественных клетках, наравне с активной теломеразой, существует так называемое альтернативное удлинение теломер, или сокращенно ALT [11]. При ALT происходит гомологичная рекомбинация концевых участков хромосом (рис. 4). В норме рекомбинация происходит в процессе мейоза, однако раковые клетки научились достраивать теломеры, используя теломеры другой хромосомы как матрицу [12].
Рисунок 4. Принцип действия ALT, основанный на гомологичном достраивании концов теломер. Такой механизм «бессмертия» является основным для ряда опухолей.
Важно отметить, что раковое бессмертие контролируется не только теломерами, но и ингибированием путей апоптоза, главным из которых является митохондриальный путь. В норме, из митохондрий в цитоплазму выходят митохондриальные белки и образуют апоптотический комплекс — апоптосому, которая и запускает апоптоз. При неправильной работе регуляторных белков, а к ним относятся белки семейства BCL-2, нарушается выход апоптотических белков, что приводит к сбою в процессе апоптоза. В раковых клетках обнаружены нарушения в работе белков BAX и BAK, а также экспрессия ингибиторов клеточной смерти.
Часть 4. Заключение
Ежедневно в нашем организме появляются клетки, вступившие на путь ракового перерождения. Но далеко не все из них дойдут до конца и образуют злокачественную опухоль. С другой стороны, интересно клеточное поведение в процессе малигнизации, когда клетка способна «выключать» отдельные гены, мешающие ее перерождению. Современные исследования в области молекулярной онкологии и раковой геномики дают повод надеяться на окончательное понимание основ малигнизации и физиологии злокачественных клеток. Также в последнее время проводятся разработки новых противораковых препаратов, направленных на исправление дефектных сторон «больных» клеток. Возможно, изучение именно особенностей раковой клетки приведет к созданию лекарства, способного снизить страшные прогнозы Всемирной организации здравоохранения.