Малодифференцированные клетки это что
Иммуногистохимическое определение дифференцировки и гистогенеза опухоли
Описание
Иммуногистохимическое определение дифференцировки и гистогенеза опухоли — исследование биоптата ткани, меченого антителами, под микроскопом. Анализ выполняется для определения тканевого происхождения опухоли и степени дифференцировки. Чем выше степень дифференцировки, тем ниже уровень злокачественности.
ИГХ-исследования проводят после выполнения гистологического исследования.
Иммуногистохимическое исследование
Вид морфологического исследования тканей, полученных в ходе биопсии, и меченых специфическими антителами. В основе метода лежит принцип взаимодействия «антиген-антитело». Ткань, в которой происходит патологический процесс, экспрессирует антигены. При нанесении на образец ткани антител, образуется комплекс «антиген-антитело». Благодаря меткам, он становится доступным для визуализации. Врач-патоморфолог изучает количество клеток, окрашенных маркёром. Он определяет в исследуемой ткани локализацию клеток, гормонов и их рецепторов, ферментов, иммуноглобулинов, компонентов клеток и отдельных генов.
Гистогенез опухоли
Гистогенез опухоли — это тканевое происхождение опухоли. Выявление гистогенеза позволяет определить морфологию опухоли и подобрать лечение. Ведь от происхождения опухоли зависит её чувствительность к процедурам химической или лучевой терапии.
Гистогенез опухоли устанавливается посредством изучения морфологии клеток и их сравнения с различными этапами онтогенетического развития клеток органа и ткани, в которых развилась данная опухоль.
Степень дифференцировки
Степень дифференцировки показывает насколько опухолевая клетка отличается от нормальной по строению и функциям.
Дифференцированные новообразования, как правило, относят к доброкачественным.
В рамках исследования используется панель из 5 антител. При необходимости подбираются дополнительные антитела.
При проведении гистологического исследования в сторонней лаборатории необходимо обязательно предоставить протокол гистологического исследования.
Интерпретация результатов
Ответ выдается в виде описания микропрепарата, применяемых красителей и заключения. Заключение может интерпретировать только врач, направивший на проведение исследования.
Малодифференцированные клетки это что
Дифференцированные и недифференцированные клетки
Дифференцированные и недифференцированные клетки
Опухоль первой стадии содержит раковые клетки, которые близко напоминают своих здоровых «коллег», и тогда ее называют хорошо дифференцированной. Опухолевые образования третьей и четвертой стадии наименее дифференцированы и имеют мало общего с здоровой тканью. В целом, опухоли, которые состоят из плохо дифференцированных клеток, как правило, быстрее растут и более агрессивны, чем опухоли, состоящие в основном из хорошо дифференцированных раковых клеток.
Клетки, напоминающие здоровые, называют высоко дифференцированными. Недифференцированные клетки полностью отличаются от здоровых.
Опухоли 1 степени – хорошо диффернцированные. Клетки таких опухолей являются относительно нормальными.
Опухолевые образования 2 степени называются умеренно дифференцированными.
Малодифференцированные – опухоли 3 степени. Такие опухоли, как мы говорили выше, агрессивны и стремительно растут.
Патологи, изучающие клетки, также помогают диагностировать рак крови, также называемый гематологическим раком. Эти виды рака включают лейкемии, лимфомы и множественные миеломы.
Диагностика этих злокачественных новообразований включает исследование мазков крови и часто биопсию тканей под микроскопом, а также молекулярное тестирование на изменение хромосом, на генные мутации.
Определение стадии для лимфомы и множественной миеломы требует знания степени присутствия болезни в организме. Лейкозы, как острые, так и хронические, происходят из клеток костного мозга и поражают кровь. На момент постановки диагноза лейкоз считается широко распространенным системным заболеванием.
Лимфомы обычно начинаются в лимфатических узлах. Установление стадии заболевания основано на том, распространилась ли лимфома вне лимфатических узлов, есть ли связанные симптомы лихорадки, потери веса или ночного пота, есть ли поражение селезенки.
Диагноз «множественная миелома» ставится на основании нескольких клинических лабораторных анализов крови и рентгенологических результатов.
Записаться в Онкологическую больницу «Европейская клиника»:
Малодифференцированные клетки это что
Регенерация тканей является предметом изучения исследователей теоретических и клинических дисциплин, которые внесли значительный вклад в понимание механизмов восстановления тканей после повреждения. Большой вклад в изучение проблемы регенерации тканей с гистогенетических позиций внесли профессора А.А. Заварзин, Н.Г. Хлопин, С.И. Щелкунов, А.А. Клишов и другие.
Фундаментальные работы профессоров Н.Н. Аничкова, И.В. Давыдовского, С.С. Гирголава, Д.С. Саркисова, И.А. Ерюхина, Ю.Г. Шапошникова и других являются настольными книгами для исследователей, занимающихся проблемами регенерации тканей.
Несмотря на имеющиеся достижения, остаются недостаточно изученными теоретические вопросы посттравматического гистогенеза тканей кожи при различных видах механического повреждения, в том числе и огнестрельном ранении [1].
Огнестрельное повреждение включает разные факторы воздействия: механическое, термическое, химическое действие пороховых газов, микробное обсеменение и др. Каждый из этих факторов вносит свой вклад в общую картину огнестрельного повреждения тканей [1].
При этом представляет интерес исследование влияния каждого из перечисленных факторов в отдельности, в последние годы большое внимание уделяется кинетической составляющей повреждающего агента. Это связано с тем, что при огнестрельном ранении кинетическая составляющая формирует зону «молекулярного сотрясения».
Особенность гистологической картины в зоне «молекулярного сотрясения» заключается в индивидуальном характере клеточных и тканевых реакций, возникновении различных форм гибели клеток, которые наблюдаются даже при заживлении ран, резкие расстройства гемомикроциркуляции, изменение клеточного состава в процессе заживления ран вследствие формирования органо-тканевого комплекса – грануляционной ткани.
Диагностика распространения зоны «молекулярного сотрясения» необходима для выбора методов хирургической обработки и предотвращения отсроченной гибели тканевых элементов, приводящей к осложнению в раневом процессе.
Цель исследования: выявить морфофункциональные свойства клеток и тканей на этапах заживления кожной раны в зоне «молекулярного сотрясения» с позиции концепции о функциональных гистионах.
Материалы и методы исследования
На первом этапе исследования была разработана экспериментальная модель повреждения, стандартизированная по исполнению для получения репрезентативных данных. Это необходимо для количественной оценки гистологических изменений в тканевых элементах [1–3].
В 1-й серии экспериментов были использованы белые мыши массой 20–30 граммов. В межлопаточную область спины животным наносили сквозное ранение кожи пробойником диаметром 3 мм. Кинетическая энергия, прикладываемая к нему, соответствовала энергии, возникающей при выстреле из пневматической винтовки.
Во 2-й серии экспериментов были использованы белые беспородные крысы массой 200–300 граммов. Для нанесения механической травмы была использована установка по передаче кинетической энергии окружающим раневой канал тканям. Подопытным животным в область голени наносили механическую травму, эквивалентную по энергии удару пули калибром 5,6 мм.
Материалом для исследования регенерационных процессов явились ткани различного генеза кожи крыс и мышей. Сроки фиксации были выбраны с учетом ранее изученных гистологических изменений при нанесении различных видов повреждений подопытным животным (через 6 часов, 24 часа, на 3, 6, 15 и 25-е сутки после повреждения).
Для характеристики реактивных изменений клеток и тканей был использован следующий комплекс гистологических исследований: световая и электронная микроскопии; процессы пролиферации регистрировали методом одноволновой цитоспектрофотометрии с помощью прибора, созданного на кафедре. Процессы дифференциации и синтеза биологически активных веществ выявляли цитохимическими методами. Иммуногистохимически выявляли антиген ядерной пролиферации, позволяющий идентифицировать клетки в синтетическом периоде митотического цикла. Морфометрическими методами регистрировали количественные и качественные изменения гистологических элементов, проводили статистическую обработку результатов, а также применяли математическое моделирование для описания индивидуального характера течения клеточных реакций в процессе заживления ран [1].
Гистогенетический подход предполагает изучение состояния тканей в норме, т.е. до нанесения повреждения, считая это «нулевой» фазой регенерации [1].
Указанный комплекс гистологических исследований для изучения каждой фазы регенерации тканей кожи позволит оценить гетероморфию клеточных элементов: внутридифферонную и междифферонную. Междифферонная гетероморфия определяется на межтканевом уровне взаимодействии при регенерации органа, формируется т.н. функциональный гистион [1].
Результаты исследования и их обсуждение
Оценка фазности течения регенерационного процесса и характеристика реактивных изменений клеток и тканей в раневом процессе основывались на установленных гистогенетических закономерностях «нулевой» фазы регенерации.
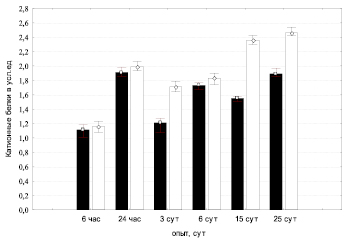
После нанесения повреждения кожи, в 1-е сутки, отмечаются изменения в нейтрофильных лейкоцитах периферической крови в количественном и качественном эквиваленте. Данные изменения наблюдаются в процессах дифференциации и синтеза биологически активных веществ – неферментативных катионных белков. Это свидетельствует о фазе воспалительной реакции в разворачивающемся регенерационном процессе (рис. 1).
К концу первых суток эксперимента устанавливается гетероморфия в популяции нейтрофилов по активности катионных белков. Отмечается повышение количества нейтрофилов периферической крови с высокой активностью катионных белков и понижение числа клеток со слабой и умеренной активностью катионных белков. Отмечается снижение концентрации катионных белков в нейтрофильных гранулоцитах к 3-м суткам опыта и дальнейшее нарастание концентрации катионного белка к 25-м суткам регенерации, что отражает снижение внутридифферонной гетероморфии.
У экспериментальных животных после нанесения механической травмы с передачей кинетической энергии, эквивалентной огнестрельному ранению, формировалась «зона молекулярного сотрясения». Особенность гистологической картины в зоне «молекулярного сотрясения» заключается в индивидуальном характере клеточных и тканевых реакций, возникновении различных форм гибели клеток, которые наблюдаются даже при заживлении ран, в резких расстройствах гемомикроциркуляции, изменении клеточного состава в процессе заживления раны вследствие формирования органо-тканевого комплекса – грануляционной ткани.
К 3-м суткам эксперимента появляются реактивные изменения в виде мгновенной и ранней отсроченной гибели клеток практически всех тканевых элементов кожи, что обуславливает снижение внутри- и междифферонной гетероморфии. Это сигнализирует о начале фазы ранних посттравматических изменений.
Рис. 1. Профиль катионных белков периферической крови в нейтрофильных лейкоцитах. Обозначения: белый – палочкоядерные нейтрофилы; черный – сегментоядерные нейтрофилы
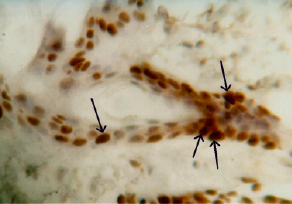
Рис. 2. Реакция на PCNA в ядрах эпителиоцитов волосяного фолликула. 3-и сутки. X 252
Миграция гематогенных клеточных элементов (лейкоцитов, тканевых базофилов, макрофагов) в «зону молекулярного сотрясения» как следствие начала формирования лейкоцитарного вала и постепенного увеличения междифферонной гетероморфии. Однако с междифферонной гетероморфией можно наблюдать и внутридифферонную гетероморфию при формировании функционального гистиона воспаления, представляющего собой кооперацию эндотелиоцитов, нейтрофильных лейкоцитов, тканевых базофилов. Появление макрофагов является дальнейшим развитием грануляционной ткани.
Гистологическим маркером перехода от фазы воспаления к фазе регенерации является увеличение клеток, экспрессирующих ген ядерной пролиферации (PCNA). Ведущими гистологическими элементами с 3-х суток эксперимента становятся клетки, вступающие в митотический цикл. В эпителиальной ткани кожи это не только кератиноциты росткового слоя эпидермиса, но и кератиноциты наружных волосяных влагалищ, сохранивших жизнеспособность (рис. 2).
Иммуногистохимически выявлен антиген ядерной пролиферации в составе эпителиального регенерата. В соединительных тканях кожи активация пролиферации отмечается в: периваскулярных клетках, фибробластах дермы и эндомизии подкожной мышцы.
Индекс пролиферации с 3-х по 15-е сутки в «зоне молекулярного сотрясения» снижается, что доказывается изменением количественного содержания ДНК в ядрах фибробластов при исследовании методом цитоспектрофотометрии.
В фазе дифференцировки тканевых элементов происходит постепенное образование регенерата, являющегося очередной фазой регенерационного гистогенеза. Гистологическим критерием этой фазы является формирование особой органо-тканевой структуры – грануляционной ткани. Отмечается увеличение степени междифферонной гетероморфии, с преобладанием клеточных элементов рыхлой волокнистой соединительной ткани и дифферона эндотелиоцитов.
Гистологическим показателем фазы дифференцировки является возрастание внутридифферонной и междифферонной гетероморфии тканевых элементов в соединительных тканях кожи. В регенерационном гистионе ведущими гистологическими элементами являются фибробласты, эндотелиоциты и макрофаги.
К 25-м суткам эксперимента междифферонная гетероморфия регенерата снижается медленно и длительное время остается на достаточно высоком уровне. В гистионе адаптивной фазы регенерационного гистогенеза гистологическими ведущими элементами являются фиброциты.
Характеристика изменения клеточного состава функциональных гистионов служит надежным диагностическим критерием и является показателем последовательности течения регенерационного процесса. На основе гистологического исследования клеточного состава функциональных гистионов с целью математического моделирования формирования функциональных гистионов грануляционной ткани были включены клетки пяти клеточных дифферонов: нейтрофильные лейкоциты, тканевые базофилы, макрофаги, клетки фибробластического дифферона и эндотелиоциты. Выстроенная математическая модель регенерационного процесса тканей кожи выявляет временные особенности индивидуального изменения клеточного состава функциональных гистионов регенерата.
Реактивные изменения клеток и тканей в раневом процессе базируются на закономерностях эмбрионального и постэмбрионального гистогенеза. Эти характеристики включают активацию и пролиферацию малодифференцированных клеток, их дифференциацию и взаимодействие с последующей адаптивной перестройкой регенерата [4; 5]. Для каждой фазы регенерации тканей кожи характерна гетероморфия клеточных элементов: внутридифферонная и междифферонная. Междифферонная гетероморфия определяется на межтканевом уровне взаимодействии при регенерации органа, формируется т.н. функциональный гистион. На основе гистологического исследования клеточного состава функциональных гистионов с целью математического моделирования формирования функциональных гистионов грануляционной ткани были включены клетки пяти клеточных дифферонов: нейтрофильные лейкоциты, тканевые базофилы, макрофаги, клетки фибробластического дифферона и эндотелиоциы [5]. Диагностика распространения зоны «молекулярного сотрясения» необходима для выбора методов хирургической обработки и предотвращения отсроченной гибели тканевых элементов, приводящей к осложнению в раневом процессе [1; 2; 5].
Малодифференцированные клетки это что
Периферическая кровь является чрезвычайно реактогенной системой, для которой характерны динамические изменения количественного и качественного состава форменных элементов в ответ на действие физиологических и патологических раздражителей.
Самой многочисленной популяцией клеток периферической крови являются эритроциты, суммарный объем которых превышает во много раз объем лейкоцитов и тромбоцитов.
В цикле лекций даны классификация, патогенезе и гематологическая характеристика типовых нарушений со стороны красной крови различной этиологии.
Общая характеристика эритроцитозов и анемий
В условиях патологии возможны количественные и качественные изменения со стороны элементов красной крови, что приводит к выраженному нарушению их функциональной активности.
Среднее содержание эритроцитов в норме в крови у женщин варьирует в диапазоне от 3,7 до 4,7·1012/л, а у мужчин – от 4,5 до 5,5·1012/л. Количественные изменения эритроцитов могут проявляться в виде увеличения их содержания – эритроцитоза или уменьшения – эритропении (анемии). Изменение количества эритроцитов в периферической крови, как правило, является следствием комплексного воздействия ряда патогенетических факторов: нарушения нервной, гормональной, гуморальной регуляции эритропоэза, усиления распада эритроцитов в периферической крови или в мононуклеарно-фагоцитирующей системе, усиления процессов физиологического или патологического депонирования крови, а также следствием кровопотери.
Качественные изменения состава эр итроцитов периферической крови могут проявляться в виде изменения формы эритроцитов, их размеров, появлением незрелых, малодифференцированных форм эритроцитарного ряда. Как известно, в условиях нормы у человека преобладают в периферической кров и, двояковогнутые, или дисковидные (дискоциты), эритроциты, имеющие в среднем размер 7,2–7,5 мкм (нормоциты).
Качественные изменения эритроцитов периферической крови, подобно количественным сдвигам, могут явиться отражением дегенеративных изменений со стороны крови на фоне действия различных патогенных факторов или нарушений регенераторной активности костного мозга, могут быть признаками нарушений проце ссов кроветворения в костном мозге, кровопотери, гемолиза эритроцитов врожденной или приобретенной пр ироды.
Патологическое состояние, характеризующееся выраженными изменениями размеров эритроцитов периферической крови, получило название анизоцитоза. Различают микроцитоз, когда размеры эритроцитов становятся менее 7–6 мкм, макроцитоз – при увеличении размеров свыше 8–9 мкм, мегалоцитоз, когда в периферической крови появляются гигантские эритроциты размерами 14–16 мкм и более. Одной из разновидностей анизоцитоза являются карликовые эритроциты, имеющие диаметр размером 2–2,2 мкм. Размеры эрит роцит ов являют ся одним из вспомогательных признаков, п озволяю щих дать дифференциальную диагностику заболеваний.
Состояние, характе ризующееся изменением формы эритроцитов, – пойкилоцитоз. Подобно анизоцитозу, пойкилоцитоз отражает характер и интенсивность дегенеративных сдвигов со стороны элементов периферической крови. Изменения формы эр итроцитов при различных видах патологии весьма разнообразны. Различают сфероцитоз, овалоцитоз акантоцитоз, стоматоцитоз, шизоци тоз, аннулоцитоз. В ряде случаев патологии в периферической крови появляются мишеневидные эритроциты, серповидноклеточные эритроциты, что неред ко является признаком врожденных аномалий структуры гемоглобина.
В ответ на действие разнообразных патогенных факторов инфекционной и неинфекционной природы костный мозг может реагировать угнетением костномозгового кроветворения, когда в периферической крови снижается содержание ретикулоцитов и становится резко выраженным преобладание дегенеративных форм эритроцитов. В случае активации костномо згового кроветворения как одной из реакций адаптации, компенсации в ответ на действие альтерирующего фактора в периферический кровоток начинают в избытке поступать из костного мозга регенераторные, недостаточно зрелые элементы эритроцитарного ряда – ретикулоциты, а также нормоциты различной степен и зрелости. Лишь при тяжелых формах патологии красной крови опухолевой природы в системный кровоток поступают малодифференцированные клетки костного мозга эритробласты.
Разнообразн ые сдвиги со стороны красной крови симптоматического характера, отражающие развитие патологических процессов или заболеваний, можно объединить в две основные группы:
Группа анемий нередко включает в себя и эритропении.
Эритроцитозы: классификация, этиология, механизмы развития
Эритроцитозы – состояния, характеризующиеся увеличением количества эритроцитов в единице объема крови свыше 4,7 ·1012 /л у женщин и 5,5·1012 /л – у мужчин.
В зависимости от этиологических факторов различают пер вичные эритроцитозы наследственной и приобретенной природы, включающие в себя, в частности, истинную полицитемию, или болезнь Вакеза, а также вторичные эритроцитозы, являющиеся симптомами разнообразных заболеваний или патологических состояний.
В зависимости от механизмов развития выделяют абсолютные эритроцитозы – состояния, характеризующиеся увеличением содержания эритроцитов в периферической крови в связи с активацией эритропоэза в костном мозге, а также относительные эритроцитозы, в основе которых лежит феномен сгущения крови при обычной интенсивности эритропоэза.
Первичные эритроцитозы. Наследственный семейный эритроцитоз – генетически обусловленная форма патологии, характеризующаяся увелич ением содержания в периферической крови гемоглобина, эритроцитов, повышением вязкости крови, расстройствами микроциркуляции. Наследственный эритроцитоз включает группу заболеваний, в осно ве которых могут лежать различные патогенетические механизмы:
1. Образование аномальных гемоглобинов с повыш енным сродством к кислороду; в настоящее время оп исано около 30 таких гемоглобинов.
2. Дефицит фермента дифосфоглицератмутазы и, соответственно, 2,3-дифосфоглицерата, что приводит к повышению сродства гемоглобина к кислороду, уменьшению отдачи его тканям, развитию гипоксии.
Аномальные гемоглобины с повышенным сродством к кислороду наследуются по аутосомно-доминантному типу. Повышенное сродство гемоглобина к кислороду связывают с заменой лишь одного аминокислотного остатка в молекуле гемоглобина.
При всех разновидностях наследственного эритроцитоза возникает выраженная гипоксия тканей, стимулирующая увеличение продукции эритропоэтина и активацию эритропоэза.
Выраженность клинических симптомов наследственного эритроцитоза варьирует и зависит от типа наследования. При аутосомно-доминантном типе наследования, характеризующемся повышением концентрации АТФ в эритроцитах, заболевание, как правило, протекает бессимптомно. Клинические проявления наиболее выражены при аутосомно-рецессивном типе наследования дефицита фермента дифосфоглицератмутазы, приводящего к дефициту 2,3-ДФГ и резкому увеличению степени сродства гемоглобина к кислороду. Симптоматика заболевания обусловлена развитием гипоксии, повышением вязкости крови, нарушением свертываемости крови. Наиболее частыми осложнениями являются тромбозы сосудов головного мозга и капиллярная кровоточивость. Больные жалуются на головную боль, утомляемость, боль в нижних конечностях, области сердца. В периферической крови выявляются эритроцитоз, увеличение содержания эритроцитов, повышение гематокрита, резкое замедление СОЭ.
Эритремия (истинная полицитемия, болезнь Вакеза) относится к числу хронических лейкозов, самостоятельная нозологическая форма патологии, не исключается возможность наследственной предрасположенности к данному заболеванию, поскольку описаны случаи болезни у родственников. Причинами эритремий, как и других заболеваний опухолевой природы, могут быть патогенные факторы физического, химического, биологического происхождения. В основе развития эритреми й лежат неограниченная пролиферация клеток-предшественниц миелопоэза, усиление миелопролиферативного процесса в костном мозге, селезенке, а также в других органах и тканях. При этом име ет место активация эритропоэза, лейкопоэза, тромбоцитопоэза, что приводит к развитию полицитемии. Характерной особенностью эритреми й является снижение уровня эритропоэтина в крови.
В периферической крови отмечаются эритроцитоз, ретикулоцитоз, нейтрофильный лейкоцитоз со сдвигом влево, базофилия, моноцитоз, тромбоцитоз, увеличение содержания гемоглобина до 200 г/л, снижение цветового показателя в связи с отставанием процессов синтеза гемоглобина от интенсивности эритропоэза. В терминальной стадии патологии возникает подавление костномозгового кроветворения, что приводит к развитию панцитопении.
Клинические проявления эритреми й обусловлены в основном увеличением вязкости крови, объема циркулирующей крови, расстройствами коагуляционного гемостаза. У больных отмечаются развитие гипертензии, переполнение кровью внутренних органов (плетора), нарушения микроциркуляции в виде замедления кровотока, стаза, турбулентного кровотока, тромбоза сосудов, геморрагий.
Вторичные эритроцитозы. Вторичные эритроцитозы не являются самостоятельными нозологическими формами патологии, это сим птомы различных патологических процессов и заболеваний.
Как указывалось выше, различают абсолютные и относительные вторичные эритроцитозы.
Абсолютные эритроцитозы связаны с активацией эритропоэза в костном мозге под влиянием различных гормональных и гуморальных стимулирующих воздействий. Важнейшим стимулятором эритропоэза является эритропоэтин – гормон гликопротеиновой природы, стимулирующий пролиферацию и дифференцировку эритропоэтинчувствительной клетки в морфологически распознаваемые элементы.
Считают, что в норме печень не является местом синтеза эритропоэтина, однако в условиях патологии почек (при удалении почки, нарушении ее эндокринной функции) печень становится эритропоэтинсинтезирующим органом.
Следует отметить и возможность синтеза эритропоэтина в тканевых макрофагах, моноцитах крови.
Данные литературы убедительно свидетельствуют о возможности интенсификации синтеза эритропоэтина не только при разнообразных гипоксических состояниях, но и при опухолевом поражении печени и почек, что, естественно, может сопровождаться развитием симптоматического эритроцитоза.
Касаясь механизмов развития вторичных эритроцитозов, необходимо остановиться и на других гормональных стимуляторах эритропоэза, которыми являются гормоны аденогипофиза (АКТГ, ТТГ, ГТГ, СТТ).
Стимулирующим воздействием на эритропоэз обладают гипофизарный и плацентарный пролактин, тиреоидные гормоны, андрогены, причем усиление эритропоэза под влиянием указанных гормонов возникает опосредованно за счет стимуляции продукции эритропоэтина. Тем не менее, очевидна возможность развития эритроцитоза при разнообразных эндокринопатиях, особенно при опухолевом поражении эндокринных желез, сопровождающемся усилением продукции гормонов – стимуляторов образования эритропоэтина почками.
Вторичные абсолютные эритроцитозы в зависимости от их значимости и патогенетических механизмов развития могут быть представлены как гипоксемические, или компенсаторные, и негипоксемические.
Гипоксемические эритроцитозы могут возникать при экзогенных гипоксических состояниях, а также при эндогенной гипоксии циркуляторного, гемического, тканевого характера. Компенсаторные гипоксемические эритроцитозы отмечаются при длительном пребывании в высокогорной местности, при хронической сердечной, легочной недостаточности, при метгемоглобинемии, карбоксигемоглобинемии. Эритроцитоз при гипоксических состояниях обеспечивает адаптацию организма к действию патогенного фактора, поэтому он и получил название компенсаторного.
Абсолютный негипоксемический эритроцитоз не имеет компенсаторной функции, обусловлен повышенной продукцией эритропоэтина при поражении почек: раке, поликистозе, стенозе почечной артерии, гидронефрозе, после операции пересадки почки. Вторичные негипоксемические эритроцитозы могут иметь место при опухолевом поражении печени, селезенки, болезни и синдроме Иценко – Кушинга, когда возникает стабильная гиперпродукция гормонов АКТГ и глюкокортикоидов.
Клинические проявления вторичных абсолютных эритроцитозов разнообразны, в значительной мере обусловлены особенностями этиологических ф акторов и основного заболевания. Тем не менее, общими признак ами эритроцитозов являются умеренная полицитемическая гиперволемия, увеличение вязкости крови и гематокрита, повышение артериального давления, развитие гипертрофии миокарда, расстройства микроциркуляции, наличие микротромбоза.
В периферической крови отмечаются эритроцитоз, ретикулоцитоз, в отличие от эритремии отсутствуют тромбоцитоз и лейкоцитоз.
Вторичные относительные эритроцитозы не связаны с активацией эритропоэза, возникают вследствие двух основных патогенетических факторов:
1. Сгущения крови (гемоконцентрации) при потере организмом жидкости (диарея, рвота, плазмопотеря при ожогах).
2. Выброса депонированной крови при стресс-реакциях, острой гипоксии.
В ряде случаев относительные эритроцитозы наблюдаются при артериальной гипертензии у лиц, злоупотребляющих алкоголем, у курильщиков.
Клинические проявления относительных эритроцитозов также в значительной мере определяются характером основного заболевания, особенностями этиологического фактора. При любых формах патологии не исключена возможность увеличения гематокрита в связи с нормо- или гиповолемической полицитемией, а также развитием гипертензивных состояний.