Мальтофер или ферлатум что лучше пить
Лучшие статьи 2018: Вернись, гемоглобин!
Поделиться:
Термин «анемия» пришел из древнегреческого языка — это слово означает «недостаток крови». В русском языке есть схожее название, которое великолепно отражает суть состояния, — малокровие. Действительно, при анемии число красных кровяных телец (эритроцитов) или белка гемоглобина, который связывается с кислородом и переносит жизненно важный газ, становится слишком мало.
Малокровие имеет «строгие рамки»: диагноз устанавливают при падении уровня гемоглобина менее 120 г/л у женщин и 130 г/л у мужчин.
Причины анемии
Анемия чрезвычайно распространена: с ней сталкивается не менее 30 % популяции. Малокровию больше подвержены женщины, чем мужчины, что вполне понятно: дамы регулярно теряют кровь, а с ней и гемоглобин, во время критических дней, а кровопотери относятся к числу частых причин анемии. К факторам, связанным с ее развитием, также относятся:
В числе других факторов — некоторые инфекции, заболевания крови, аутоиммунные заболевания, алкоголизм, интоксикация, прием некоторых препаратов и т. д.
Разные виды анемии
Наряду с богатством причин и факторов риска малокровие характеризуется и довольно широким «видовым разнообразием». Выделяют несколько типов анемий, в том числе:
Однако все эти и еще более редкие типы малокровия (например, талассемия) имеют ряд общих признаков.
Когда заподозрить дефицит гемоглобина?
Анемия коварна. Она долгое время может не давать о себе знать: вы чувствуете себя совершенно здоровым, а органы и ткани в это время страдают от дефицита кислорода. Как правило, подобная ситуация может развиваться, когда малокровие имеет легкую степень (уровень гемоглобина выше 90 г/л). Анемия средней (гемоглобин выше 70 г/л) и, тем более, тяжелой степени (гемоглобин менее 70 г/л) уже имеет более или менее выраженные симптомы.
Чаще всего малокровие проявляется слабостью и усталостью, иногда — снижением концентрации внимания. Еще один распространенный признак связан с ухудшением снабжения тканей кислородом. Организм, пытаясь компенсировать кислородную недостаточность, увеличивает сердечный выброс, что проявляется сердцебиением, одышкой.
Можно заметить и внешние признаки малокровия: анемичный человек порой выглядит бледным и вялым, однако этот симптом нельзя отнести к надежным, в отличие от сердечных. В любом случае, при появлении слабости и учащенного сердцебиения нужно сдать анализ крови и выяснить уровень гемоглобина.
Если он окажется ниже нормы, доктор может назначить дополнительные исследования, чтобы выяснить причину. Однако, учитывая, что чаще всего анемия связана с дефицитом железа, распространенной тактикой является назначение препаратов железа в качестве средств «скорой помощи».
Железо в пилюлях
Современные препараты железа выпускаются в комбинациях с компонентами, которые необходимы для выработки гемоглобина (с витаминами В9, В12 — Гино-Тардиферон, Мальтофер Фол) или для улучшения всасывания железа (с витамином С — Сорбифер Дурулес, с серином — Актиферрин). Некоторые средства содержат микроэлементы, участвующие в синтезе ферментов, например, медь, марганец (Тотема).
Важным условием эффективности препаратов этой группы считается валентность соли железа, входящего в состав: известно, что биодоступность двухвалентного железа в 3–4 раза выше, чем трехвалентного.
Соли двухвалентного железа:
И тем не менее едва ли можно сказать, что один препарат железа «сильнее», чем другой. Результат лечения больше зависит от соблюдения режима терапии, чем от выбора конкретного средства.
Лечение анемии должно быть длительным: препараты необходимо принимать не менее 3 месяцев, а при беременности — вплоть до родов.
Результаты анализов, которые будут сданы повторно через 2 недели после начала приема лекарств, могут оказаться не очень утешительными, и это вовсе не означает, что терапия неэффективна. Просто эритроциты не накапливают новый гемоглобин, а лишь переносят уже имеющиеся (и при анемии весьма скудные) запасы на протяжении всего срока жизни. А он составляет как раз те самые 3 месяца, или 120 дней. Поэтому-то оценить результат лечения малокровия можно только тогда, когда отжившие свое эритроциты погибнут, а молодые, полные сил и живительного гемоглобина, начнут циркулировать в крови.
И напоследок добавим, что все препараты железа имеют высокий профиль безопасности. Они продаются без рецепта и в большинстве случаев разрешены к применению у детей и беременных женщин. Самые распространенные побочные эффекты, им свойственные, — это запоры, которые можно регулировать, корректируя рацион.
Товары по теме: [product strict=» Мальтофер»](Мальтофер Фол), [product strict=» Сорбифер «](Сорбифер Дурулес), [product strict=» Фенюльс «](Фенюльс), [product strict=» Актиферрин»](Актиферрин), [product strict=» Тотема»](Тотема), [product strict=» Ферретаб»](Ферретаб)
Сравнительная эффективность и переносимость различных железосодержащих препаратов у больных железодефицитной анемией
Верткин А.Л., Городецкий В.В., Годулян О.В. МГМСУ им. Н.А. Семашко
50 ГКБ Департамента здравоохранения Правительства Москвы
Железодефицитная анемия является самым распространенным анемическим синдромом и составляет приблизительно 80% всех анемий (ВОЗ, 1970). Дефицит железа той или иной степени имеется почти у 30% населения планеты (ВОЗ, 1998), причем скрытый его дефицит встречается в два раза чаще, чем железодефицитная анемия.
Основой патогенетической терапии железодефицитной анемии является применение препаратов железа внутрь. При этом необходимо, чтобы суточная доза двухвалентного железа составляла 100-300 мг (Charlton R.W., 1964; Идельсон Л.И., 1985). В связи с этим при выборе препарата железа и определении его суточной дозировки следует ориентироваться не только на общее содержание в нем соли железа, но и на количество элементарного железа, содержащегося в данном препарате (Geisser Р. 1997, Дворецкий Л.И., 1998).
Целью настоящего исследования явилась объективизация выбора ферросодержащих препаратов на основе сравнительного изучения их эффективности и переносимости у больных железодефицитной анемией.
Критериями включения в группу наблюдения служили: снижение гемоглобина (Hb р>0,05).
Таблица 4. Динамика уровня гемоглобина (г/л) на фоне терапии ферропрепаратами
Количество эритроцитов, достигнутое во время лечения, удерживалось на полученном уровне в течение месяца после отмены лечения у пациентов, получавших Ферро-Фольгамму и Сорбифер дурулес, а в других группах оно достоверно снизилось.
На фоне приема всех изучавшихся железосодержащих препаратов степень прироста гемоглобина была почти одинаковой (табл. 6), что обусловлено дизайном исследования. Лишь при использовании Ферро-Фольгаммы имелась тенденция к большему приросту гемоглобина, чем на фоне Актиферрина и Ферроплекса (0,05 0,1 для всех пар).
В период приема любого препарата отмечалось достоверное увеличение уровня сывороточного железа в каждой группе. Наиболее выраженное и практически одинаковое (р>0,1) его возрастание было достигнуто на фоне приема Актиферрина композитум и Ферро-Фольгаммы. При этом прирост, полученный у пациентов, принимавших Актиферрин композитум, достоверно превышал динамику, наблюдавшуюся на фоне приема Сорбифера дурулес и Ферроплекса (р 0,1).
Близкое рассуждение можно применить и к объяснению динамики ферритина. Существенный прирост его уровня наблюдался только на фоне препаратов, обеспечивающих наименьшую скорость прироста гемоглобина. Средства же, при использовании которых за время, ограниченное дизайном исследования, достигались более высокие скорости прироста гемоглобина, не создавали существенных депо, что и отражалось отсутствием изменений в уровне ферритина. Так, при оценке депо железа по уровню ферритина сыворотки крови оказалось, что запасы железа существенно возросли только при применении Актиферрина. Прирост уровня ферритина сыворотки крови в этой группе имел тенденцию к превышению такового на фоне Актиферрина композитум, Ферро-Фольгаммы и Сорбифера дурулес (0,05 0,1), и только в группе пациентов, получивших Ферроплекс, отмечалось, хоть и небольшое, но достоверное снижение уровня железа сыворотки крови (p p>0,05), это снижение было достоверным. Наибольшая динамика (-20,9±4,2 ммоль/л; p
Коррекция дефицита железа у детей
Целью терапии железодефицитной анемии (ЖДА) является устранение дефицита железа и восстановление его запасов в организме. Добиться этого можно только при ликвидации причины, лежащей в основе ЖДА в организме.

Основные принципы лечения ЖДА сформулированы Л. И. Идельсоном в 1981 г.:
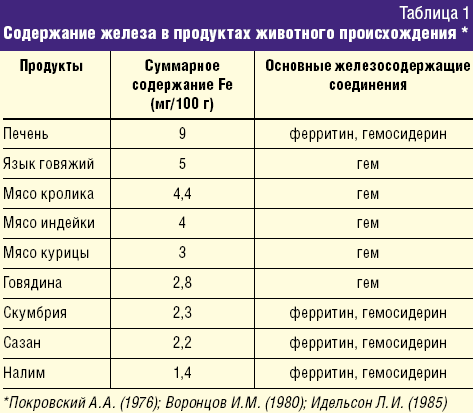
Ранее существовало мнение, что дефицит железа можно устранить назначением диеты, содержащей яблоки, гречневую крупу, гранаты и другие продукты растительного происхождения, содержащие железо. Однако в 60-е гг. ХХ века исследователями было доказано, что железо, содержащееся в продуктах в виде гема (мясо, печень, рыба), лучше усваивается в организме, чем из других соединений. Около 90% железа всасывается в 12-перстной кишке, остальное – в верхнем отделе тощей кишки. При железодефицитных состояниях абсорбционная поверхность тонкого кишечника увеличивается. Железо всасывается в 2-х формах:
Количество железа, поступающее в течение суток с пищей, содержит около 10–12 мг железа (гемовое + негемовое), но только 1–1,2 мг микроэлемента из этого количества абсорбируется. Установлено, что биодоступность гемового железа в пищевых продуктах более высокая, чем из негемовых соединений, и составляет 25–30%.
Большая часть поступающего с пищей железа представлена негемовой формой. Биодоступность железа из злаковых, бобовых, клубневых, овощей и фруктов значительно ниже, чем из гемовых соединений, и во многом зависит от преобладания в рационе факторов, ингибирующих либо потенцирующих кишечную ферроабсорбцию (табл. 3).
Несмотря на высокое содержание железа в части продуктов растительного происхождения, они не в состоянии обеспечить им организм ребенка. Присутствующие в продуктах питания растительного происхождения вещества (танины, фитины, фосфаты) образуют с Fe (III) нерастворимые соединения и выводятся с калом. Имеются также сведения о неблагоприятном влиянии на абсорбцию железа пищевых волокон, которыми богаты крупы, свежие овощи, фрукты. В кишечнике пищевые волокна практически не перевариваются, железо фиксируется на их поверхности и выводится с калом. Напротив, повышают биодоступность железа аскорбиновая кислота, животный белок (мясо, рыба), которые увеличивают абсорбцию микроэлемента. Необходимо отметить также, что продукты из мяса, печени, рыбы, в свою очередь, увеличивают всасывание железа из овощей и фруктов при одновременном их применении.
Полноценная и сбалансированная по основным ингредиентам диета позволяет лишь «покрыть» физиологическую потребность организма в железе, но не устранить его дефицит.
Естественной профилактикой ЖДА у детей первых месяцев жизни является исключительно грудное вскармливание до 4–6 мес. Известно, что концентрация железа в женском молоке составляет всего 0,2–0,4 мг/л, однако абсорбция железа из него достигает 50%, что обеспечивает потребность ребенка первых 4–6 мес. К моменту удвоения массы тела ребенка (5–6 мес) антенатальные запасы железа в его организме истощаются.
С целью профилактики ЖДА при искусственном вскармливании целесообразно у детей, относящихся к группе риска по развитию ЖДА, использовать смеси, обогащенные железом. Они назначаются доношенным детям, относящимся к группе риска (из двойни, тройни, имеющих большую прибавку в массе), начиная с 3–5 мес жизни, а недоношенным – с 1,5–2 мес. Содержание железа в смесях для искусственного вскармливания детей первого полугодия жизни составляет 3–5–8 мг/л смеси, а для детей второго полугодия – 10–14 мг/л.
Включение в питание детей продуктов прикорма, обогащенных железом (фруктовые соки, фруктовые и овощные пюре, инстантные каши), заметно повышает количество железа, поступающего с пищей в организм ребенка.
Детям в возрасте 4–6 мес, находящимся на грудном вскармливании, и младенцам после 6 мес жизни, не получающим обогащенное железом питание, целесообразно назначать препараты железа в профилактической дозе 1–2 мг/кг/день до 12–18 мес жизни.
ЖДА у детей раннего возраста связывают с ранним использованием в пищу коровьего или козьего молока, содержащего высокий уровень белка. Следует отметить, что развитие ЖДА у этих детей связано не только с низким уровнем железа в коровьем молоке, плохим его усвоением, но и потерей железа за счет микродиапедезных кишечных кровотечений. Многочисленными исследованиями отмечена взаимосвязь между количеством употребляемого неадаптированного продукта (молока, кефира) и степенью выраженности микродиапедезных кишечных кровопотерь у младенцев. Отмечено, что чувствительность к неадаптированным продуктам уменьшается с возрастом и после 2-х лет жизни микродиапедезных кишечных кровотечений на фоне приема коровьего молока не отмечается. Механизм, лежащий в основе повышенной экскреции гемоглобина с калом на фоне приема неадаптированных молочных продуктов, у детей раннего возраста точно не известен. Часть авторов связывают микродиапедезные кишечные кровотечения с непереносимостью белков коровьего молока.
Выбору препарата для коррекции ЖДА придается особое значение, поскольку длительность лечения может составлять от нескольких недель до нескольких месяцев. При этом важны не только эффективность, но и отсутствие побочных эффектов и осложнений, приверженность к проводимой терапии, особенно в педиатрической практике.
В настоящее время все препараты железа разделяют на две группы (табл. 4):
Терапия железодефицитных состояний должна быть направлена на устранение причины и одновременное восполнение дефицита железа лекарственными Fe-содержащими препаратами.
Терапия железодефицитных состояний должна проводиться преимущественно препаратами железа для приема внутрь.
Пероральный прием препаратов Fe:
Парентеральное введение препаратов железа показано лишь по специальным показаниям (синдром нарушенного кишечного всасывания, состояние после обширной резекции тонкого кишечника).
Требования к препаратам железа для приема внутрь, применяемым в детской практике:
Детям раннего возраста предпочтительно назначение железосодержащих препаратов, выпускаемых в форме капель, сиропа. Хороши для детей этой возрастной группы Актиферрин (капли, сироп), Мальтофер (капли, сироп), Феррум Лек (сироп), Гемофер (капли) (табл. 5).
Для детей подросткового возраста лучше всего назначать препараты железа типа Феррум Лека (жевательные таблетки) или Тардиферона и Ферроградумента, которые медленно всасываются, обеспечивая пролонгированную и равномерную абсорбцию медикаментозного железа в кишечнике. Как правило, эти препараты хорошо переносятся больными.
После выбора железосодержащего препарата и способа его применения необходимо определить ежедневную суточную дозу лекарственного средства и кратность приема (табл. 6).
Рекомендуемые дозы двухвалентного железа рассчитаны на основе данных, свидетельствующих, что лишь 10–15% поступающего в организм железа всасывается.
Препараты железа (III) – ГПК используются у детей с ЖДА разного возраста в терапевтической дозе 5 мг/кг/сут.
При латентном дефиците железа все препараты железа используются в половинной терапевтической дозе.
Профилактические дозы препаратов железа:
Известно, что лечение солевыми препаратами может сопровождаться расстройствами стула, в связи с чем терапию препаратами двухвалентного железа необходимо начинать с дозы, равной 1/4–1/2 от расчетной терапевтической, с последующим постепенным достижением полной дозы в течение 7–14 дней. Темп «постепенного наращивания» дозы до терапевтической зависит как от выраженности дефицита железа, так и от состояния желудочно-кишечного тракта и индивидуальной переносимости препарата. Данная методика позволяет подобрать индивидуальную дозу в зависимости от переносимости и снизить риск побочных эффектов терапии солевыми препаратами железа.
Хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, затрудняя абсорбцию железа. В связи с этим солевые препараты железа рекомендуют назначать за 1 ч до приема пищи. Назначение препаратов Fe (III) – ГПК не требует применения методики постепенного наращивания дозы. Препараты этой группы назначаются сразу в полной дозе вне зависимости от еды, поскольку пища не влияет на их абсорбцию.
Терапевтический эффект при пероральном приеме железа появляется постепенно. Вначале отмечается клиническое улучшение и лишь спустя некоторое время происходит нормализация гемоглобина. Первым положительным клиническим признаком, появляющимся при лечении препаратами железа, является исчезновение или уменьшение мышечной слабости. Последнее обусловлено тем, что железо входит в состав ферментов, участвующих в сокращении миофибрилл. На 10–12 день от начала лечения повышается содержание ретикулоцитов в периферической крови. Повышение гемоглобина может быть постепенным либо скачкообразным. Чаще всего начало подъема уровня гемоглобина происходит на 3–4 нед от начала терапии. Как показали многочисленные исследования, исчезновение клинических проявлений заболевания отмечается к 1–2 мес терапии, а исчезновение тканевой сидеропении наступает на 3–6 мес лечения. Суточная доза элементарного железа после нормализации уровня гемоглобина должна соответствовать 1/2 терапевтической дозы (табл. 7). Раннее прекращение лечения препаратами железа, как правило, приводит к рецидивам ЖДА. Длительность основного курса лечения препаратами железа составляет 6–10 нед в зависимости от степени тяжести выявленной железодефицитной анемии. Продолжительность профилактического курса препаратами железа с целью создания депо железа в организме составляет:
Критерии эффективности лечения препаратами железа:
Рефрактерность железодефицитной анемии обусловлена неадекватностью назначаемой терапии или анемией, не связанной с дефицитом железа!
Парентеральные препараты при лечении железодефицитной анемии должны использоваться только по строгим показаниям!
Показания к парентеральному введению препаратов железа:
Парентеральные препараты лучше использовать не ежедневно, а с интервалом в 1–2 дня. При этом в первые 1–3 введения можно использовать половинную дозу.
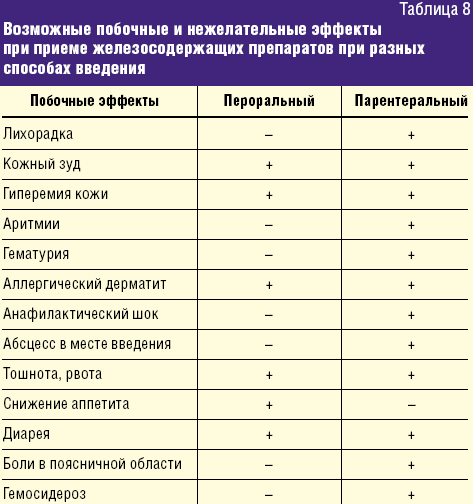
Учитывая длительность проведения ферротерапии, выбор препаратов для коррекции ЖДА у детей раннего возраста требует особого внимания. Как солевые препараты железа, так и препараты Fe(III) — ГПК полимальтозного комплекса являются эффективными при терапии ЖДС. Побочные и нежелательные явления при пероральной ферротерапии ЖДА в основном связаны с превышением рекомендуемых доз и чаще проявляются диспепсией. Побочные реакции и нежелательные эффекты, которые могут развиться при ферротерапии у детей, суммированы в таблице 8.
Парентеральные препараты железа должны применяться только строго по специальным показаниям.
Переливания крови или эритроцитарной массы при ЖДА проводятся крайне редко и строго по жизненным показаниям. Критериями для гемотрансфузии является снижение гемоглобина ниже критического уровня в сочетании с признаками нарушения центральной гемодинамики, геморрагического шока, анемической прекомы, гипоксического синдрома (табл. 9). Гемотрансфузия может проводиться и при значениях гемоглобина и гематокрита выше критических, если имеет место массивная острая кровопотеря.
Эффект от гемотрансфузий при ЖДА кратковременный. Отмечено отрицательное влияние гемотрансфузий на эритропоэз. К тому же сохраняется высокий риск трансфузионного инфицирования реципиента. При наличии витальных показаний для заместительной гемотрансфузии предпочтение отдается эритроцитарной массе или отмытым эритроцитам из расчета 10–15 мл/кг массы. Детям старшего возраста обычно переливают от 150 до 250 мл. Цельную кровь в последние годы в педиатрической практике не используют.
Профилактика ЖДА у детей включает:
1. Антенатальную профилактику:
2. Постнатальную профилактику:
Вакцинация детей с ЖДА проводится после нормализации уровня гемоглобина.
Снятие с диспансерного учета осуществляется через год.
И. Н. Захарова, доктор медицинских наук, профессор
Н. А. Коровина, доктор медицинских наук, профессор
А. Л. Заплатников, доктор медицинских наук, профессор
Н. Е. Малова, кандидат медицинских наук
РМАПО, Москва
Новое поколение препаратов железа – бисглицинат (хелат) железа
Распространенность анемии
Значимость анемии как проблемы современного мира не вызывает сомнений. Несмотря на все достижения цивилизации, дефицит железа является основным и наиболее распространенным нарушением питания в мире. Дефицит железа, от которого страдают многие дети и женщины в развивающихся странах, является единственным видом недостаточности питательных веществ, который также в значительных масштабах распространен в экономически развитых странах. Уровни его распространенности поражают: 2 миллиарда человек, то есть более 30% населения мира, страдают от анемии. 1
Среди анемий ведущими являются железодефицитные, составляя в структуре у женщин до 90% и среди мужчин — до 80%. Важным является высокая распространенность среди населения латентного дефицита железа, которая колеблется от 19,5% до 30%, кроме того, от 50% до 86% женщин имеют факторы риска развития анемии.
Железодефицитная анемия (ЖДА) — заболевание системы крови, обусловленное дефицитом железа в организме, сопровождаетcя изменениями параметров его метаболизма, уменьшением концентрации гемоглобина в эритроцитах, количественными и качественными их изменениями и клинически выражается анемической гипоксией и сидеропенией.
Сидеропения и развивающаяся в последующем тканевая и гемическая гипоксия приводят к расстройствам сердечно-сосудистой (миокардиодистрофия и нарушение кровообращения различной степени), нервной системы (вегетативно-сосудистые, вестибулярные нарушения, астенический синдром), снижению детородной функции женщин, а также развитие осложнений во время беременности и родов, изменению интеллекта и поведенческих настроений, хронизацию различных заболеваний и как следствие снижение работоспособности и ухудшение качества жизни. 4
Эволюция синтетических лекарственных средств терапии железодефицитной анемии
Фармакотерапия ЖДА базируется на введение в организм железа из состава железосодержащих лекарственных средств. Выбору препарата для коррекции сидеропении придается особое значение, так как важна не только эффективность, но и отсутствие побочных реакций и осложнений при их применении.
Существует условное деление препаратов железа на двух- и трёхвалентные. Однако, сама по себе валентность железа не представляет какой-либо ценности.
Известно, что всасывание железа в кишечнике возможно лишь тогда, когда микроэлемент находится в двухвалентной форме, которая способна проходить через клеточную мембрану слизистой оболочки кишечника. Низкое значение рН желудочного содержимого способствует растворению алиментарного железа и переходу трехвалентного железа (окисное) в двухвалентную форму (закисное). 17
При поступлении желудочного содержимого в кишечник рН пищевого комка повышается и в отличие от ферро-иона (Fe2+), ферри-ион (Fe3+) образует нерастворимые соли. В этих условиях только муцин, хелатируя железо, способен поддержать ферри-ион в растворимом состоянии. 4
Таким образом, соединения железа в составе препаратов должны обладать хорошей растворимостью, высокой биодоступностью, достаточным содержанием элементарного железа и малой токсичностью. Рассмотрим особенности абсорбции каждой из трёх известных групп препаратов железа.
Первое поколение препаратов железа
Одной из первых групп препаратов железа стали применять ионные соли двухвалентного железа. Эта группа характеризуется довольно быстрым наступлением эффекта в плане повышения гемоглобина и улучшения гемодинамических показателей в периферической крови.
Тем не менее, лечение ионными препаратами железа, в частности сульфатом железа, вызывает побочные реакции у 44,7% пациентов. Чаще всего страдает желудочно-кишечный тракт (ЖКТ). Симптомы дисфункции его верхних отделов обычно проявляются в течение часа после приема лекарства и могут протекать как в легкой (тошнота, дискомфорт в эпигастрии), так и в тяжелой форме — с болью в животе и/ или рвотой. Кроме того, ферротерапия солевыми препаратами железа нередко сопровождается появлением металлического привкуса в течение первых дней лечения, потемнением зубной эмали и десен, возможны также диарея или запор. хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, затрудняя абсорбцию в том числе и железа. В связи с этим, их рекомендуют назначать за 1 час до приема пищи, однако это усиливает повреждающее действие соединений Fe2+ на слизистую кишечника, вплоть до развития ее некроза. 5
Причиной возникновения данных побочных явлений является гидролиз солей железа в желудке. Под действием желудочного сока ионные соли железа подвергаются гидролизу(диссоциации) в желудке, в результате чего свободные молекулы железа негативно воздействуют на слизистую оболочку ЖКТ и провоцируют возникновение побочных эффектов: тошнота, боль в животе, металлический привкус во рту, диарея/запор.
Второе поколение препаратов железа
Абсорбция железа в виде гидроксид-полимальтозного комплекса (ГПК) железа-III имеет принципиально иную схему по сравнению с его ионными соединениями и осуществляется путем активного всасывания при конкурентном обмене лигандами, уровень которых определяет скорость абсорбции железа Fe3+. Неионная структура, обеспечивающая стабильность комплекса и перенос железа с помощью транспортного белка, предотвращает в организме свободную диффузию ионов железа, то есть прооксидантные реакции. Однако биодоступность полимальтозного комплекса железа-III самая низкая среди всех препаратов железа, всего 10–15%.
В связи с большим размером молекулы (55 kDa), ее пассивная диффузия примерно в 40 раз медленнее, чем у ионов железа. 6 Такую низкую биодоступность приходится компенсировать большими суточными дозами ГПК.
Новое поколение препаратов железа — новое решение проблемы анемии
С конца 90-х начала 2000-х годов начали активно внедрять применение хелатных комплексов железа для терапии дефицита железа и анемии у людей. Хотя данная группа препаратов появилась гораздо раньше, и использовалась изначально в качестве пищевых добавок и в ветеринарии.
В 1893 году Альфред Вернер выдвинул постулат о новой молекулярной структуре, характеризующей эти стабильные молекулы. Спустя несколько лет, в 1920 году Морган и Дрю применили термин «хелат» к молекулярной структуре, постулированной Вернером. 7
Хелаты металлов представляют собой комплексные соединения металла с аминокислотой.
В отличие от солей металлов, лиганд в хелатном комплексе отдает электроны катиону, делая тем самым молекулу ионно-нейтральной, устойчивой к разным факторам, действующим в желудочно-кишечном тракте (рН, пища), а низкая молекулярная масса способствует максимальному усвоению железа при пероральном приеме. 8
Хелатные комплексы легче проникают через стенку кишечника и лучше усваиваются, не нарушая ионный и минеральный баланс клетки. 10
Бисглицинат железа состоит из одной молекулы железа, которая соединена с карбоксильными группами двух молекул глицина при помощи ковалентных связей.
Соотношение железа к лиганду 1:2 нейтрализует валентность железа, что обеспечивает его стойкость к разным факторам, действующим в желудочно-кишечном тракте (рН, пища). Поэтому соединение хелата не поддается гидролизации в желудке, полностью абсорбируется в тонком кишечнике и в неизмененном виде попадает внутрь энтероцитов, где и происходит высвобождение молекулы железа. 8
Бисглицинат железа — это источник негемированного железа. После перорального применения соединение в неизмененном виде попадает в энтероциты, где гидролизируется на железо и глицин. Стабильность соединения бисглицината железа объясняется тем, что оно не гидролизируется при разных значениях рН, а низкая молекулярная масса (204 г/моль) способствует максимальному усвоению железа при пероральном приеме. 8
В составе Multizan ® Феррум бисглицинат железа представлен запатентованным комплексом Ferrochel ® компании Albion Minerals — мировым лидером и новатором в области минерального аминокислотного хелатного питания.
Уникальная гамма хелатных минералов Albion ® :
Даже с повышенной биодоступностью бисглицинат железа безопасен. Всасывание контролируется запасами железа в организме, при этом большие количества обычно усваиваются людьми с более низким статусом железа. Организм, страдающий железодефицитной анемией, может потреблять 90% железа, в то время как организм, не страдающий железодефицитной анемией, может потреблять всего 10%, или ровно столько, сколько необходимо организму для компенсации потерь в метаболизме. Было обнаружено, что бисглицинат железа Ferrochel ® в 2,6 раза безопаснее, чем сульфат железа, и безопаснее, чем обычное неорганическое железо, содержащееся в пищевых продуктах и пищевых добавках. 13
Сравнительная таблица доз LD50 (cредняя доза вещества, вызывающая гибель половины членов испытуемой группы) различных препаратов железа при пероральном введении белым мышам. 14, 15, 16