Маркерный рецидив что это
Маркерный рецидив что это
Злокачественные эпителиальные новообразования яичников — бессимптомные, быстро растущие опухоли с поздним возникновением клинических проявлений, поэтому для выявления ранних рецидивов необходимо тщательное наблюдение. Во многих отделах брюшной полости могут скрываться крупные метастазы, которые невозможно обнаружить при физикальном исследовании и с помощью методов лучевой диагностики.
При наблюдении за пациентками после лечения рака яичника (РЯ) не всегда целесообразно использовать такие сложные методы, как КТ. Некоторые считают, что для контроля распространенности заболевания необходимо периодически определять содержание СА-125 и широко применять хирургические методы — лапароскопию и лапаротомию. Возможно, в будущем скрытые формы болезни можно будет диагностировать с помощью ПЭТ.
Оптимальная стратегия наблюдения за больными без клинических проявлений заболевания после первичного лечения поздних стадий рака яичника (РЯ) не определена. Существует активный и пассивный подход. Данных о пользе терапии второй линии нет; эти методы лечения дорогие, порой сопровождаются тяжелыми осложнениями и причиняют существенный дискомфорт больным. Во время повторной контрольной лапаротомии можно сделать достаточно точный прогноз о дальнейшем течении заболевания, что позволит пациенткам планировать свою жизнь.
В настоящее время нет данных о том, что интенсивное наблюдение за больными с клиническими проявлениями заболевания положительно влияет на общую бессимптомную выживаемость или качество жизни. Поэтому схему наблюдения следует разрабатывать индивидуально, в соответствии с потребностями каждой больной. Проведено много исследований XT второй линии, в которых показано, что ранние диагностика и лечение рецидивов улучшают исход, но это еще предстоит доказать.
Мы проводим физикальное исследование и определение уровня СА-125 через регулярные промежутки времени, снижая частоту наблюдения с увеличением безрецидивного интервала. Методы визуализации используем по индивидуальным показаниям. Такая практика не имеет хорошего научно-методического обоснования, поскольку, как сказано ранее, оптимальная стратегия неизвестна.
Когда истекает 2 года и рецидивы не выявлены, число визитов уменьшается до 1 раза в полгода. У больных, которым не проводилась лапаротомия «second-look», в первые 2 года частота посещений составляет 1 раз в 3—4 мес. Многие женщины настаивают на более частом наблюдении, чтобы удостовериться в отсутствии прогрессирования заболевания.
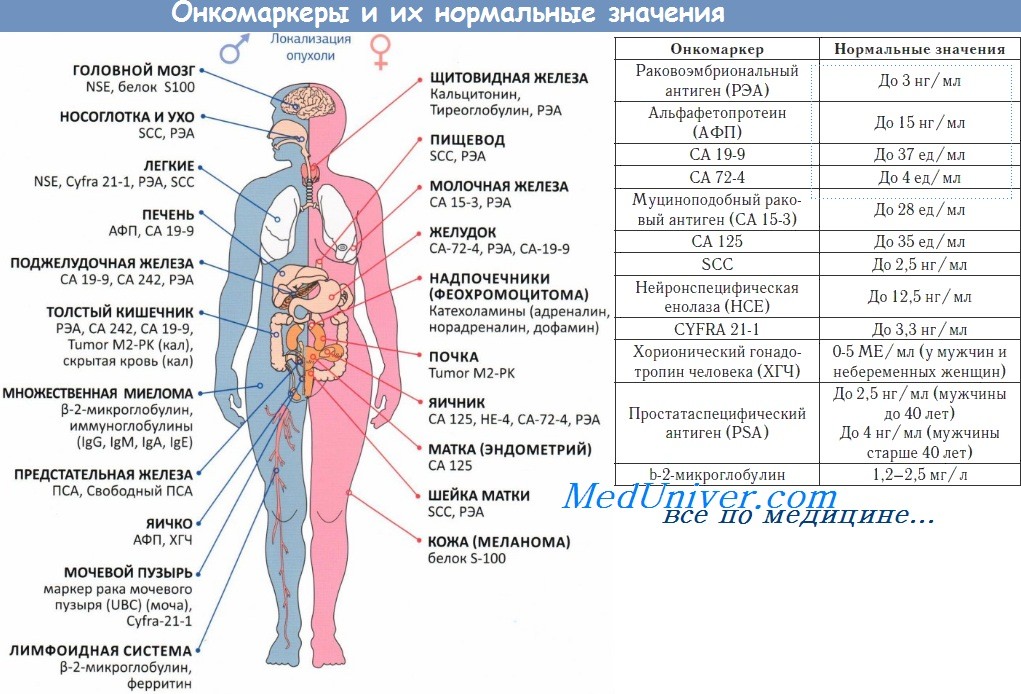
СА-125 — антиген, выделенный Bast с помощью моноклональных антител ОС-125, которые были получены от мышей, иммунизированных эпителиальными злокачественными клетками яичника. Антигенные детерминанты СА-125 представляют собой муциноподобные гликопротеиды с молекулярной массой более 200 000 Да. Небольшое количество антигена экспрессируется во взрослых тканях, происходящих из целомического эпителия, включая мезотелиальные клетки, выстилающие плевру, перикард и брюшину.
Этот антиген также определяют в эпителиальном компоненте маточных труб, эндометрия и эндоцервикса. СА-125 не обнаружен в яичниках плода и взрослых женщин. Однако СА-125 экспрессируется более чем 80 % немуцинозных эпителиальных злокачественных опухолей яичников.
Bast разработал радиоиммунный анализ для определения уровня СА-125 в сыворотке и других биологических жидкостях. Обычный коэффициент вариабельности анализа (в разные дни) примерно 15 %. В связи с этим только удвоение или половинное уменьшение концентрации антигена считают существенным изменением. При верхней границе нормы 35 ед./мл повышенное содержание СА-125 отмечают у 1 % здоровых доноров, у 6 % пациенток с доброкачественными заболеваниями, у 28 % — с негинекологическими злокачественными новообразованиями и у 82 % — с верифицированным РЯ. Niloff и соавт. сообщили об увеличении уровня СА-125 при поздних стадиях аденокарциномы маточной трубы, эндометрия и эндоцервикса.
Более чем в 90 % случаев рака яичника (РЯ) повышение или падение уровня СА-125 коррелируют с прогрессированием или регрессированием заболевания. По данным Niloff, при СА-125
Levin сообщил, что практически у всех пациенток с отрицательными находками во время лапаротомии «second-look» уровень СА-125 сохранялся в переделах нормы в течение 3 мес. после первичной циторедуктивной операции. Buller и соавт. показали, что выраженное падение уровня СА-125 после циторедуктивной операции и начала XT — показатель благоприятного исхода. Эти исследователи доказали, что у больных с резким падением содержания СА-125 до уровня нормы к началу третьего цикла XT после операции выживаемость значительно лучше по сравнению с теми, у кого перед четвертым циклом показатель маркера остается повышенным.
Buller описал S-образную кривую регрессии уровня СА-125 и предложил применять альтернативную XT у больных с отсроченной кривой, или регрессией повышенного значения. Hogberg и Kagedal сообщили, что у 23 пациенток с периодом полураспада СА-125 менее 16 дней во время индукционной XT расчетная выживаемость после лапаротомии «second-look» в течение 59 мес. составила 68 %. У 49 женщин с периодом полураспада СА-125 более 16 дней этот показатель был равен 18 %.
Всех пациенток, успешно завершивших лечение по поводу рака яичника (РЯ), наблюдают с периодичностью по крайней мере 1 раз в 3 мес; уровень СА-125 определяют при каждом посещении. При нормальных данных клинического обследования и допустимом уровне СА-125 риск рецидива низкий, при выраженном повышении — высокий. Положительный цитологический анализ жидкости, полученной во время лапароцентеза, подтверждает подозрение на рецидив. При увеличении содержания СА-125 с последующей стабилизацией показателей на уровне плато и отсутствии клинических проявлений заболевания показано тщательное наблюдение (особенно при минимальном повышении, например, до менее 100 ед.) до подтверждения рецидива или изменения кривой концентрации опухолевого маркера.
Сопутствующие заболевания печени, сердца, артрит и другие могут быть причиной стойкого повышения СА-125. Первоначальный уровень этого показателя у женщин с поздними стадиями заболевания, ответивших на лечение, не всегда коррелирует с выживаемостью. Latimer и соавт. провели многофакторный анализ и показали, что уровень СА-125 не был прогностическим фактором выживаемости, независимым от стадии заболевания. Другими словами, при возникновении объективного ответа на лечение выживаемость не зависит от того, было содержание СА-125 до лечения высоким или низким.
Повышение уровня СА-125 после лечения, в период наблюдения, обычно указывает на рецидив, даже если он клинически не проявляется. Большинству таких больных показана повторная химиотерапия (XT). К сожалению, сейчас федеральные контролирующие органы не считают повышение уровня опухолевого маркера индикатором рецидива, что затрудняет интерпретацию результатов рандомизированных клинических исследований, направленных на возможную регистрацию лекарственных средств. Однако, по данным Rustin и соавт., «прогрессия СА-125» — эквивалент прогрессирования заболевания, доказанного стандартными клиническими или визуализирующими методами диагностики.
Существуют другие причины повышения содержания СА-125, гинекологические и экстрагенитальные: острые воспалительные процессы в области таза и в любой другой части тела, острый гепатит или панкреатит, хронические заболевания печени, колит, сердечная недостаточность, дивертикулит, артрит, пневмония и др.
Видео онкомаркеры в норме и при раке
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Маркерный рецидив что это
Московский научно-исследовательский онкологический институт им. П.А. Герцена
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Причины, диагностика и лечение рецидивов рака яичников. Обзор литературы и анализ собственных данных
Журнал: Онкология. Журнал им. П.А. Герцена. 2015;4(3): 59-67
Новикова Е. Г., Московская Е. Ю. Причины, диагностика и лечение рецидивов рака яичников. Обзор литературы и анализ собственных данных. Онкология. Журнал им. П.А. Герцена. 2015;4(3):59-67.
Novikova E G, Moskovskaja E Ju. The causes, diagnosis, and treatment of recurrent ovarian cancer. A literature review and analysis of the authors’ data. P.A. Herzen Journal of Oncology. 2015;4(3):59-67.
https://doi.org/10.17116/onkolog20154359-67
Московский научно-исследовательский онкологический институт им. П.А. Герцена
Обсуждаются причины возникновения рецидивов рака яичников, методы диагностики и необходимость комплексного подхода к ведению данной когорты пациенток. Рассмотрена роль хирургического и химиотерапевтического компонента комбинированного лечения. Оценено место лучевой терапии при распространенном раке яичников.
Московский научно-исследовательский онкологический институт им. П.А. Герцена
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Известно, что рак яичников на ранних стадиях протекает асимптомно. В связи с этим, а также отсутствием эффективных скрининговых программ, более чем у 70% больных выявляется распространенный процесс (III—IV стадия) [1]. После завершения первичного комбинированного лечения у 80% больных с распространенным процессом развивается рецидив. В то же время даже при ранних стадиях заболевания с наличием неблагоприятных факторов прогноза очень часто возникают рецидивы [2, 3].
Совокупность ряда причин является предпосылкой к тому, что рецидивный рак яичников встречается у 50% больных и характеризуется возвратом заболевания после достижения полной ремиссии и при ее сохранении длительное время [4, 5].
К причинам возникновения рецидивов рака яичников относятся: выявление заболевания в распространенной форме, гистотип опухоли, прогностически неблагоприятные факторы, неадекватное первичное лечение, ошибки в наблюдении за больными в процессе и после окончания первичного лечения [6, 7].
На вероятность возникновения рецидива заболевания влияет интраоперационное выявление макроскопических изменений: прорастание опухоли в капсулу кистомы или наличие опухолевых клеток в асците, нарушение целостности капсулы опухоли при хирургических манипуляциях, массивные сращения и спайки опухоли с окружающими тканями [8, 9].
К неблагоприятным факторам прогноза относят гистотип опухоли (в частности, светлоклеточную аденокарциному), низкую дифференцировку, невыраженность лекарственного патоморфоза (в случае неоадъювантного лекарственного лечения). Отмечено существование влияния степени лекарственного патоморфоза на частоту возникновения рецидивов рака яичников и, следовательно, на выработку дальнейшего лечения. Таким образом, лекарственный патоморфоз является одним из предикторных факторов развития рецидива. Чем выше градация изменений в опухоли после проведенного лечения, тем более длительным предполагается безрецидивный промежуток [10].
Возникновение рецидива рака яичников зависит не только от стадии процесса, но и от адекватности первичного лечения. По данным Американской коллегии хирургов, почти в 75% первичные хирургические вмешательства по поводу опухолей яичников проводятся без участия онкогинеколога, что часто приводит к выбору неадекватного оперативного доступа, объема вмешательства, неправильной оценке стадии заболевания, соответственно значительно ухудшает прогноз [11, 12].
В 2007 г. В. Goff и соавт. [13], анализируя результаты мультицентрового исследования, получили данные, подтверждающие, что специалисты онкогинекологи почти в 2 раза чаще выполняют полноценные хирургические вмешательства, чем акушеры-гинекологи и общие хирурги (табл. 1).

Для большинства пациенток с карциномой яичников хирургическое лечение не является окончательным из-за распространения опухолевых клеток в различные отделы брюшной полости, в связи с чем прогноз заболевания зависит от дополнительной терапии [14].
При проведении химиотерапии специалистами могут быть допущены ошибки, связанные с нарушением определения дозы химиопрепаратов. Расчет необходимо проводить для каждого курса химиотерапии на основании изменения массы тела, роста, возраста и креатинина сыворотки крови пациентки. Однако зачастую дозировка препарата рассчитывается однократно перед началом лечения и не подлежит пересчету при последующих курсах терапии. Обращает на себя внимание несоблюдение сроков проведения курсов лечения, неаргументированная и несвоевременная смена схем, в том числе при прогрессировании заболевания на фоне лечения [15].
Диагностика рецидивов рака яичников
Рецидив, характеризующийся изолированным подъемом уровня СА125, без клинических проявлений заболевания, называется «маркерным». По данным G. Rustin и соавт. [18], рост уровня СА125 — эквивалент прогрессирования заболевания, доказанного стандартными клиническими или визуализирующими методами диагностики.
В каждом клиническом случае имеется индивидуальный базовый уровень маркера, зафиксированный после окончания лечения, изменения которого для конкретной больной используются как для оценки эффективности проводимого лечения, так и для определения сроков выявления рецидива. При отсутствии клинических данных, свидетельствующих о прогрессировании заболевания и низком уровне CA125, риск рецидива низкий, при выраженном повышении маркера значительно увеличивается возможность возврата заболевания.
Современный стандарт клинической трактовки маркера сводится к следующему: если после комбинированного лечения уровень СА125 ниже дискретного, а в процессе последующего наблюдения повышается, то необходимо углубленное обследование для выявления локализации и распространенности заболевания. Рекомендации GOG (Gynecologic Oncology Group Study), сформулированные в 2001 г., подчеркивали необходимость лечения больных раком яичников даже при бессимптомном стойком повышении уровня СА125 выше 100 Ед/мл [16, 17].
Однако имеется мнение и о том, что при выявлении повышения уровня маркера без выраженной клинической картины нет выигрыша в отдаленных результатах лечения. Это было подтверждено данными проспективного рандомизированного исследования (MRC OV05/EORTC 55955), в котором пациенток с повышением уровня маркера без признаков рецидива при физикальном или инструментальном обследовании оставляли под наблюдение до появления объективных признаков рецидива (263 пациентки). В другой группе начинали терапию второй линии немедленно, после 2-кратного повышения уровня СА125 (264 больные). При наблюдении в течение 49 мес от рандомизации различий в медиане выживаемости в группах не было зафиксировано [18]. Следует отметить, что в группе пациенток, где лечение начинали по результатам повышения уровня СА125, происходило это в среднем на 5 мес раньше, чем в группе с отложенным проведением химиотерапии.
В отделении гинекологии отдела опухолей репродуктивных и мочевыводящих органов ФГБУ «ФМИЦ им. П.А. Герцена» наблюдалась пациентка Ф. 1960 г. р. по поводу маркерного рецидива рака яичников IIIС стадии (T3сN0M0).
Первичное лечение было проведено в 2009 г.: выполнена экстирпация матки с придатками, резекция большого сальника, с последующим проведением 6 курсов ПХТ (доцетаксел + карбоплатин), лечение закончено в феврале 2009 г. Первый безрецидивный интервал составил 2 года. В феврале 2011 г. при комплексном обследовании (СА125, УЗИ, МРТ) выявлен маркерный рецидив. Проведено 6 курсов ПХТ по схеме ТС с хорошим клиническим эффектом, заключавшимся в выраженном снижении уровня СА125. Пациентка оставалась под строгим динамическим наблюдением. Через 8 мес выявлен рост уровня СА125 до 90 Ед/мл, другой очаговой патологии не выявлено. Пациентка обратилась в ФГБУ «ФМИЦ им. П.А. Герцена», где с учетом стадии и распространенности опухолевого процесса, длительности бесплатинового интервала сочли целесообразным провести 6 курсов МХТ топотеканом. На фоне противорецидивного лечения была отмечена тенденция к снижению уровня СА125 до 50 Ед/мл (рис. 1). Через 1 мес после окончания противорецидивного лечения выполнено комплексное обследование: отмечен рост уровня СА125 до 91,3 Ед/мл; УЗ- и МР-картина рецидива в полости малого таза (рис. 2, 3).



Учитывая прогрессирование заболевания, солитарный характер поражения, объем проведенного лечения, решено было выполнить оперативное вмешательство типа second-look и удаление рецидивной опухоли из полости малого таза. В ноябре 2013 г. выполнена ревизионная лапаротомия, подвздошно-обтураторная лимфаденэктомия слева. По вскрытии брюшной полости свободной жидкости в брюшной полости и полости малого таза не выявлено. При ревизии органов брюшной полости без видимой патологии, печень и диафрагмальная поверхность над печенью, селезенка и диафрагмальная поверхность над ней — без диссеминации, парааортальные лимфатические узлы незначительно увеличены. При ревизии малого таза культя влагалища не изменена. Сигмовидная кишка находится в спайках с левым латеральным каналом. В подвздошной области слева определяется невыраженный инфильтрат протяженностью до 1 см, расположенный над подвздошной веной. Широко раскрыт левый параметрий, произведено удаление клетчатки из области над и под наружными подвздошными сосудами и из обтураторной ямки, с удалением вышеописанного инфильтрата с участком брюшины малого таза.
При гистологическом исследовании в удаленных лимфатических узлах метастазов не обнаружено.
Принимая во внимание данные комплексного обследования, несмотря на рост уровня СА125, данные интраоперационной ревизии и гистологического исследования, в настоящее время клинических проявлений (гистологически верифицированных) рака яичников нет. В связи с объемом противорецидивного лечения (6 курсов МХТ топотеканом + оперативное вмешательство в объеме подвздошно-обтураторной лимфаденэктомии слева), проводить профилактическую химиотерапию не представляется целесообразным. Решено оставить пациентку под динамическим наблюдением. В случае возникновения клинических проявлений заболевания будет решен вопрос о возможности возобновления и характере цитостатической терапии.
До настоящего времени пациентка находится под строгим динамическим наблюдением без признаков рецидива, маркер СА125 за время наблюдения не превышал 100 Ед/мл.
Таким образом, в настоящее время не существует однозначной позиции в отношении сроков начала химиотерапии второй линии. Неоспоримым остается, что эффективность лекарственного воздействия тем выше, чем меньше объем опухоли, однако более раннее начало терапии (лечение маркерного рецидива) достоверно не улучшает выживаемость больных.
Физические методы диагностики
В стандарт комплексного обследования пациенток с рецидивом рака яичников входит оценка динамики уровня опухолевого маркера СА125, УЗИ, рентгенография, КТ и МРТ, в редких случаях используется ПЭТ-КТ [19].
Целью наблюдения за пациентами является возможность достоверно и объективно определять степень ответа существующих опухолевых поражений на проводимую терапию и своевременно выявлять появление новых очагов опухоли.
Ультрасонография в серой шкале и с использованием допплеровского сканирования в настоящее время является одним из самых распространенных методов лучевой диагностики. УЗИ является субъективным методом, что не всегда позволяет провести измерение опухолевого очага в одних и тех же проекциях перед началом лечения, в мониторинге или при контрольном исследовании. Ультрасонография обладает рядом преимуществ: простотой, быстротой исследования, безвредностью для пациентки и врача, возможностью многократного применения не только в госпитальных, но и в амбулаторных условиях, поэтому этот метод целесообразно применять при мониторинге. В случае возникновения рецидива заболевания для детализации опухолевых очагов целесообразно использовать КТ и МРТ [20].
Оценка ответа опухоли на лечение по критериям RESICT
Для оценки эффективности проводимой терапии и объективного сравнения полученных результатов в различных клиниках недостаточно было унификации диагностических мероприятий, требовалось создание единой терминологии. В конце 70-х годов Международным противораковым союзом (International Union Against Cancer) и ВОЗ (World Health Organization) были введены, а с 1994 г., после многочисленных переработок, приняты и используются онкологами всего мира специальные критерии для оценки ответа на лечение и определения прогрессии солидных опухолей. Впоследствии они получили название критериев RECIST (Responce Evaluation Criteria in Solid Tumors) [21]. Данная система периодически пересматривается и обновляется специалистами из Responce Evaluation Criteria in Solid Tumors Groups на основании данных, получаемых в результате многоцентровых рандомизированных исследований.
В настоящее время к использованию приняты критерии RECIST 1.1. Основу классификации составляет измерение размера опухоли при помощи методов лучевой диагностики (рентгенография, КТ, МРТ, УЗИ) и эндоскопических методов. В соответствии с критериями RECIST опухолевые очаги подразделяются на два типа: измеряемые — объемное образование, выявляемое и составляющее по наибольшему диаметру при шаговом КТ ≥20 мм, а при СКТ ≥10 мм; не измеряемые — объемное образование, выявляемое и составляющее по наибольшему диаметру при шаговом КТ 
Чем дольше период после первичного лечения до прогрессирования заболевания, и чем меньше остаточная опухоль после первичной операции и химиотерапии, тем больше вероятность успеха повторной циторедуктивной операции.
В ряде случаев при распространенных опухолях возможны только паллиативные вмешательства (эвакуация асцита или жидкости из плевральной полости, наложение кишечных анастомозов из-за кишечной непроходимости и т. д.), цель которых заключается в улучшении качества жизни больных, даже если ее ожидаемая продолжительность невелика.
Лучевая терапия
Несмотря на длительный период использования лучевой терапии для лечения карциномы яичников, мнения об ее эффективности весьма неоднозначны. Вероятнее всего, противоречивость взглядов связана с небольшим количеством исследований, невысокой чувствительностью опухоли к лучевой терапии и, соответственно, с невозможностью адекватной оценки накопленных данных при сравнении режимов облучения с химиотерапией. Сходное отношение к радиотерапии в составе современных химиотерапевтических протоколов прослеживается и применительно к паллиативной терапии при неэффективности химиотерапии рака яичников.
R. Hepp и соавт. [31] провели оценку адъювантной терапии у пациенток после оперативного лечения. В исследование были включены 60 пациенток, 5-летняя выживаемость которых составляла 55%, а средний период наблюдения — 96,5 мес. В группе, где выполнялась лучевая терапия, выживаемость оказалась сравнимой с таковой при химиотерапевтическом лечении.
Кафедрой акушерства и гинекологии медицинского колледжа Университета Ульсан был выполнен ретроспективный анализ (с 1997 по 2007 г.) историй болезни 38 пациенток с рецидивирующим раком яичников, получавших в плане комбинированного лечения лучевую терапию. У большинства пациенток был впервые выявлен рак яичников III стадии (27 пациенток). Преобладающий гистотип в исследованной группе был представлен серозной аденокарциномой (n=26). Все пациентки получили не менее одной линии химиотерапии по поводу рецидива, при этом у 24 возникший рецидив рака яичников относился к платиночувствительному типу. Наиболее распространенным объектом облучения были лимфатических узлы. Ответ на терапию составил 65%. Медиана выживаемости без прогрессирования — 7,2 мес. Выраженной гематологической и диспепсической токсичности не наблюдалось [32].
Следует отметить, что проведение лучевой терапии оправдано только в случае локального характера и небольшого размера рецидива, отсутствия диссеминации и отдаленных метастазов [33].
Принимая во внимание вышеизложенное можно считать, что лучевая терапия в индивидуальных случаях имеет ряд преимуществ, в частности при терапии рецидивов рака яичников: гомогенность радиационной дозы, прицельное воздействие на тазовые, парааортальные или лимфатические узлы надключичной зоны. Однако в настоящее время лучевая терапия остается скорее методом исключения при исчерпывании резервов других методов лечения рецидива рака яичников.
Лекарственное лечение
Эффективность противорецидивного лекарственного лечения в значительной мере зависит от гистотипа и степени дифференцировки, объема остаточной опухоли, характера неоадъювантного лечения, сроках констатации рецидива.
Согласно современным представлениям GOG, «оптимальной» считается циторедукция, после которой максимальный размер каждой остаточной опухоли не превышает 1 см. Субоптимальной циторедукции соответствует размер оставшейся опухоли 1—2 см. При размерах оставшихся опухолевых масс более 2 см объем операции считается неоптимальным.
R. Bristow и соавт. [34] провели метаанализ 81 исследования, включающего 6885 пациенток, и продемонстрировали, что увеличение числа пациенток (которым была выполнена максимальная циторедукция) на каждые 10% коррелировало с удлинением медианы продолжительности жизни на 5,5%.
Зависимость медианы общей выживаемости от объема резидуальной опухоли нашла отражение и в другом исследовании, выполненном четырьмя годами позже. D. Chi в 2006 г. продемонстрировала, что при оптимальном объеме операции более высока вероятность достижения полной ремиссии после химиотерапии, а результаты общей и безрецидивной выживаемости выше как в случае первичного, так и противорецидивного лечения (табл. 3).

В 2012 г. S. Chang и R. Bristow [35] опубликовали обзор исследований, посвященных значению максимальной циторедукции, и вновь подтвердили ведущую роль оптимального объема оперативного вмешательства для общей выживаемости пациенток с рецидивирующим раком яичников.
В случае если на первом этапе противорецидивного комбинированного лечения выполнение оптимальной или субоптимальной циторедуктивной операции маловероятно, следует начинать лечение с химиотерапии.
В настоящее время стандартом лекарственного лечения является использование комбинации таксанов и платиновых производных в первой линии химиотерапии. Такой подход привел к увеличению частоты ответа на лечение (по сравнению со схемами САР и СР) и, в конечном итоге, к пролонгации как безрецидивной, так и общей выживаемости.
Однако, несмотря на появление новых химиопрепаратов и схем, а также существенные разногласия в тактике лечения больных с рецидивами рака яичников, следует констатировать весьма скромные показатели эффективности последующей противорецидивной терапии — от 14 до 22%. При этом частота ответа на последующее лечение находится в прямой зависимости от длительности безрецидивного и бесплатинового интервала [37].
На основании накопленных данных в последние годы наметилась тенденция к изменению традиционного алгоритма лечения рецидивов рака яичников, что нашло отражение в новой классификации. Если ранее все пациенты делились на две большие группы: с рецидивом, выявленным более 6 мес после первой линии терапии, — платиночувствительные или поздние, и платинорезистентные, с интервалом менее 6 мес, которые относились к ранним рецидивам, то в настоящее время используется более детальная характеристика. В последние 5 лет, в зависимости от времени констатации рецидива, различают: платиночувствительные, потенциально (частично) платиночувствительные, платинорезистентные и рефрактерные формы заболевания (табл. 4).

Доказательством влияния длительности бесплатинового промежутка на общую и безрецидивную выживаемость явился мультивариантный анализ результатов лечения рецидивов у 92 пациенток с предшествующим платиновым режимом. Продемонстрировано, что в 10% случаев ответ на лечение был отмечен при безрецидивном промежутке менее 6 мес, у 29% — в интервале от 6 до 12 мес и 84% составила группа пациенток, у которых время без прогрессирования было более 12 мес [16].
Е. Pujade-Lauraine и соавт. [38], изучая результаты терапии 583 больных с распространенными стадиями рака яичников, показали, что независимыми предикторными факторами при терапии рецидивов являются длительность безрецидивного промежутка и ответ на терапию первой линии. Уровень ответа у пациенток со стабилизацией заболевания и безрецидивным интервалом менее 12 мес колебался от 24 до 35%. При интервале более 12 мес ответ на лечение был у 52—62% пациенток.
Ретроспективный анализ 178 историй болезни женщин с рецидивами рака яичников продемонстрировал высокие цифры ответа на лечение (55—75%) в тех случаях, когда бесплатиновый интервал составлял от 12 до 17 мес, в то же время для промежутка менее 12 мес он не превышал 33% [39].
Таким образом, деление рецидивов в зависимости от длительности бесплатинового интервала полностью оправдано и является ориентиром для выбора противорецидивной терапии.
При развитии рецидива опухоль чаще всего уже резистентна к использованным ранее химиопрепаратам, а больная страдает от проявлений разных видов токсичности после перенесенной ранее терапии. В связи с этим, для достижения объективного ответа следует использовать моноагенты или комбинации с учетом разных механизмов действия, профилей токсичности полученного первичного и предполагаемого противорецидивного лечения, а также соматического статуса пациентки. Своевременный переход с одной линии терапии на другую, вследствие низкой эффективности или неэффективности проводимого лечения из-за приобретенной резистентности, является основным из факторов, влияющих на показатели общей выживаемости.
Следует отметить, что когорта пациенток с платиночувствительной формой рака яичников всегда имеет более благоприятный прогноз для химиотерапевтического лечения. При терапии пациенток с платинорезистентным и рефрактерным раком яичников, а также больных с платиночувствительной формой заболевания, у которых рецидив констатирован менее чем через 12 мес после окончания предыдущего лечения, основной задачей терапии является разработка путей удлинения бесплатинового интервала с целью последующей платиновой реиндукции.
При лечении платинорезистентных форм необходимо использовать цитостатики, активные в отношении резистентного заболевания, отдавать предпочтение монотерапии, продолжать лечение до прогрессирования или неприемлемой токсичности. Следует помнить, что профиль токсичности применяемого режима должен отличаться от токсичности предыдущей терапии, на что указывают большинство исследователей.
Среди большого количества препаратов, использующихся в клинической практике в качестве второй линии терапии резистентного рака яичников, в настоящее время активно изучаются пегилированный липосомальный доксорубицин, пероральный этопозид, винорельбин, гемцитабин, доцетаксел, топотекан, в том числе большой спектр препаратов таргетной терапии.
Одним из наиболее перспективных препаратов второй линии в лечении рецидивов рака яичников является топотекан. Его механизм заключается в цитотоксическом действии. Топотекан связывается с комплексом топоизомераза I-ДНК и предотвращает повторное сшивание нитей ДНК. Полагают, что цитотоксичность топотекана обусловлена повреждением удвоенной нити ДНК, образующейся в процессе ее синтеза. При этом ферменты, участвующие в репликации, взаимодействуют с тройным комплексом, сформированным топотеканом, топоизомеразой I и ДНК опухолевой клетки [40, 41].
В отделении гинекологии отдела опухолей репродуктивных и мочевыводящих органов ФГБУ «ФМИЦ им. П.А. Герцена» с целью изучения целесообразности использования топотекана в качестве агента для пролонгации бесплатинового интервала были проанализированы результаты проведенной монохимиотерапии топотеканом в еженедельном режиме и мониторинга 63 пациенток с рецидивом рака яичников. Топотекан был использован в еженедельной схеме введения по 4 мг/м 2 в 1, 8 и 15-й дни с длительностью курса 28 дней.
Всем пациенткам перед началом лечения рецидива проводилось комплексное обследование в том же объеме, что и перед началом первичного лечения. У 60 (95%) пациенток факт развития рецидива был верифицирован морфологически, у 3 (5%) лечение топотеканом начато по поводу маркерного рецидива.
Средний возраст больных составил 55 лет при колебаниях от 32 до 74 лет. Оцениваемая группа в 92% (58 случаев) состояла из пациенток в III—IV стадии заболевания и более чем 50% (33 пациентки) относились к группе платинорезистентного и платинорефрактерного рака яичников, что определяло неблагоприятный прогноз заболевания и низкую эффективность противорецидивной терапии.
В качестве второй линии терапии топотекан использовался у 77,7% (49 пациенток), третьей и четвертой — у 17,5% (11 больных) и у 3,22% (2 случая) соответственно. У одной пациентки (1,58%) топотекан применялся в качестве шестой линии лечения. У 63 пациенток было проведено 257 курсов, медиана составила 4 курса.
В зависимости от результатов проведенного комплексного обследования оценивались эффективность и токсичность проведенного лечения, а также принималось решение о возможности и целесообразности дальнейшей терапии топотеканом.
Оценка эффективности по критериям RECIST проводилась в межкурсовых интервалах каждые 2 курса химиотерапии и через 4 нед после окончания противорецидивного лечения.
Общий ответ (сумма полного и частичного ответов) был достигнут в 23,8% (в 15 из 63) случаев для всей исследуемой группы больных, в то время как для платинорезистентных — 12,1% (4/33), для потенциально платиночувствительных (безрецидивный интервал 6—12 мес) — в 31,7% (7/22), для чувствительных (более 12 мес) — в 50% (4/8) (табл. 5).

При анализе длительности времени до прогрессирования оказалось, что в группах платинорезистентного и потенциально платиночувствительного рака яичников показатели средних значений различаются на 3 нед (16,7 и 13,7 нед соответственно, в то время как для группы больных с первым безрецидивным интервалом более 12 мес этот показатель составил 58,8 нед. Полученные данные еще раз доказывают, что на прогноз заболевания, а также эффективность последующих линий терапии, существенное влияние оказывает продолжительность первого безрецидивного интервала.
Более чем у половины (40 больных, 63,5%) на фоне проводимого лечения или сразу после его окончания было отмечено прогрессирование заболевания, однако у 23 (57,5%) пациенток, учитывая достаточную пролонгацию бесплатинового интервала (12 мес и более), появилась возможность платиновой реиндукции, что нашло отражение в показателях общей выживаемости.
У 9 (14,3%) пациенток прогрессирование заболевания было отмечено на фоне лечения топотеканом (после 2-го курса), у 3 (4,8%) — при первом комплексном обследовании после окончания противорецидивного лечения. Однако у большинства — 51 (80,9%) пациентка, была достигнута ремиссия, позволяющая при дальнейшем прогрессировании заболевания осуществить платиновую реиндукцию.
Именно когорта пациенток с распространенным раком яичников, вынужденная получать неоднократное лечение и находиться в паритетных отношениях с лечащим врачом, требует пристального внимания. Только при должном внимании к больной, не только в момент введения цитостатика, но и в межкурсовых интервалах, тщательном анализе анамнестических данных и особенностей течения заболевания у конкретной женщины возможно персонализировать противорецидивную терапию и добиться более высоких результатов выживаемости.
Заключение
Таким образом, проведение данного исследования позволило установить неоспоримые преимущества применения топотекана: возможность удлинения бесплатинового интервала с целью последующей платиновой реиндукции и увеличение общей выживаемости за счет чередования платиновых и бесплатиновых режимов.
В ведении клиницистом пациентки с рецидивом распространенного рака яичников есть следующие особенности: врач не может быть до конца убежден, что больная получит 6—8 курсов запланированной терапии (в отличие от стандарта первичного лечения). Также нельзя исключать тот факт, что проведение более 6 курсов химиотерапии одним цитостатиком приведет к возникновению вторичной резистентности и окажет скорее отрицательное, нежели иное воздействие на результаты лечения. При терапии рецидивов ориентируются на результаты обследования после каждых 2 курсов терапии, чтобы вовремя определить ответ опухоли на лечение, а в случае его отсутствия осуществить замену схемы лечения.
Несмотря на длительный период изучения проблемы диссеминированных процессов в яичниках и очевидные достижения в лечении данной патологии, по-прежнему невысокими остаются показатели общей выживаемости у таких больных. К сожалению, рецидивы при данной патологии неизбежны. И, несмотря на появление новых химиопрепаратов и схем, эффективность последующей противорецидивной терапии невелика.