Масса атома и массовое число в чем разница
Что такое массовое число атомного ядра
Что такое массовое число атомного ядра? Массовое число численно равно сумме нейтронов и протонов ядра. Его обозначают буквой А. Понятие «массовое число» появилось в связи с тем, что масса ядра обусловлена числом ядерных частиц. Как связаны между собой масса ядра и количество частиц? Давайте выяснять.
Строение атома
Строение ядра

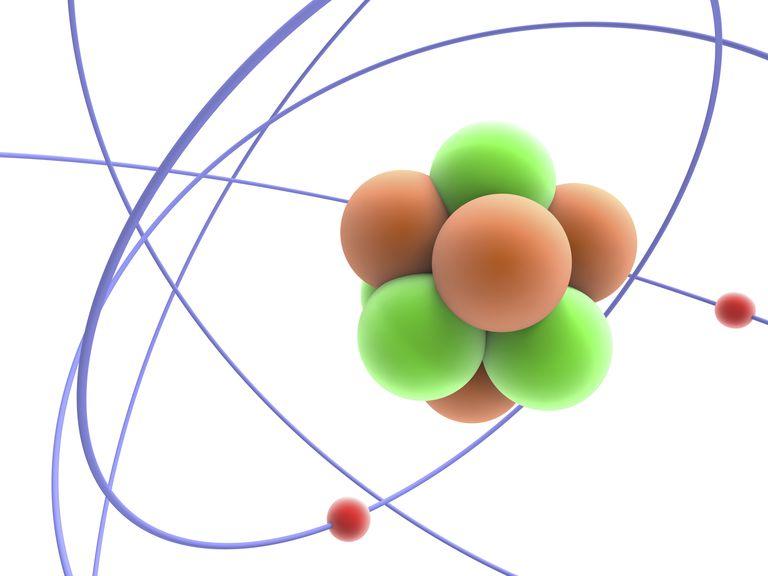
Ядро состоит из двух видов частиц – протонов и нейтронов. Протоны заряжены положительно, нейтроны не имеют заряда. Таким образом, заряд ядру дают протоны. Заряд каждого протона принят за +1. То есть, сколько протонов содержится в ядре, такой и будет заряд всего ядра. К примеру, в ядре углерода 6 протонов, заряд ядра +6.
В периодической системе элементов Менделеева все элементы расположены в порядке увеличения именно заряда ядра. У водорода заряд ядра +1, он расположен первым; у гелия +2, он второй в таблице; у лития +3, он третий и так далее. То есть заряд ядра соответствует порядковому (атомному) номеру элемента в таблице.
В целом любой атом электронейтрален. Это значит, что количество электронов равно заряду ядра, то есть количеству протонов. А поскольку количество протонов определяет атомный номер элемента, то зная этот атомный номер, мы, таким образом, знаем и количество электронов, и количество протонов, и заряд ядра.
Масса атома
Когда нужно знать массовое число?
Зная массовое число (A) и атомный номер элемента в периодической системе (Z), можно определить число нейтронов. Для этого нужно вычесть из массового числа протоны.
Зная массовое число, можно вычислить массу ядра или всего атома. Поскольку масса ядра обусловлена массой частиц, входящих в его состав, то она равна произведению количества этих частиц и массы этих частиц, то есть произведению массы нейтрона и массового числа. Масса нейтрона равна массе протона, в целом их обозначают как масса нуклона (ядерная частица).
К примеру, рассчитаем массу атома алюминия. Как видно из периодической системы элементов Менделеева, относительная атомная масса алюминия равна 26,992. Округлив, получаем массовое число ядра алюминия 27. То есть его ядро состоит из 27 частиц. Масса одной частицы – постоянная величина, равная 1,67 ∙ 10-24 г. Тогда, масса ядра алюминия равна: 27 ∙ 1,67 ∙ 10-24 г = 4,5 ∙ 10-23 г.
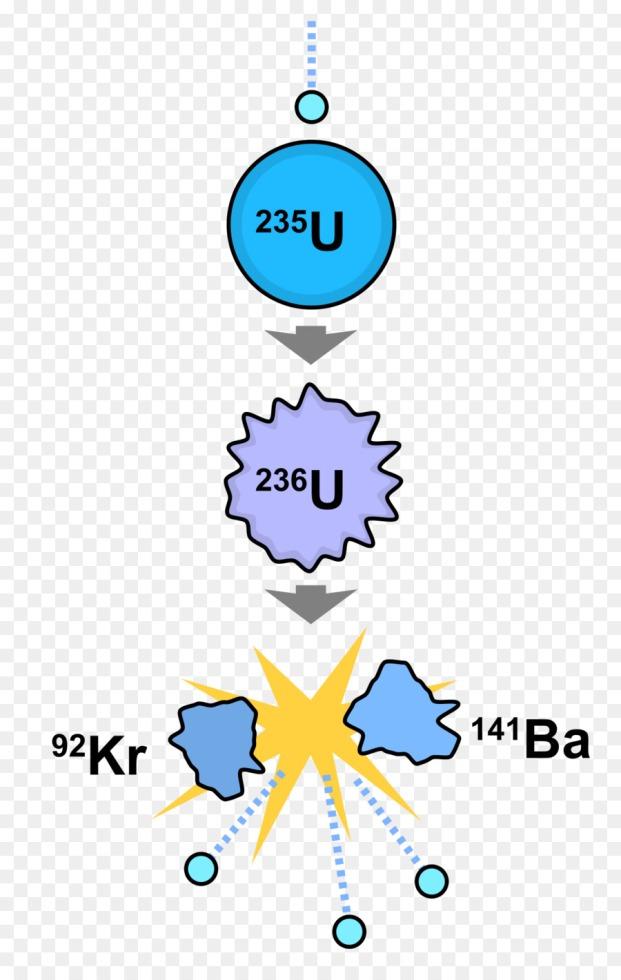
Что такое массовое число ядер элементов нужно знать при составлении реакций радиоактивного распада или ядерных реакций. Например, при делении ядра урана 235U, захватившего один нейтрон 1n, образуются ядра бария 141Ba и криптона 92Kr, а также три свободных нейтрона 1n. При составлении таких реакций пользуются правилом: сумма массовых чисел в правой и левой частях уравнения не меняется. 235+1 = 92+141+3.
Разница между атомным номером и массовым числом
Текущая периодическая таблица составлена таким образом, что все элементы имеют увеличивающийся атомный номер и, следовательно, увеличивающееся массовое число. Но знаем ли мы, что такое массовое число или даже атомный номер? Как мы знаем, атом состоит из электронов, протонов и нейтронов. Число электронов во внешних оболочках дает нам валентность атома. Таким же образом количество протонов и нейтронов связано с атомным номером и массовым числом атома.
Атомный номер, атомная масса и относительная атомная масса
Атомы каждого элемента состоят из определенного количества протонов. Фактически, количество протонов определяет, на какой атом мы смотрим (например, все атомы с 6 протонами являются атомами углерода). Атомный номер — это количество протонов в атоме. С другой стороны, количество нейтронов для данного элемента может отличаться. Вместе количество протонов и количество нейтронов определяет массовое число элемента.
Массовое число = количество протонов + количество нейтронов
Если вы хотите рассчитать количество нейтронов в атоме, вы можете просто вычесть количество протонов или атомный номер из массового числа.
Свойство, тесно связанное с массовым числом атома, — это его атомная масса. Атомная масса отдельного атома — это в основном его общая масса и обычно выражается в атомных единицах массы или AMU. По определению, атом углерода с 6 нейтронами, углерод-12, имеет атомную массу 12 а.е.м. В общем, атомная масса атома будет очень близка к его массовому числу, но будет иметь некоторую разницу в десятичных разрядах.
Изотоп элемента — это вариант того конкретного элемента, который состоит из нейтронов, различающихся по количеству нейтронов и, кроме того, по количеству нуклонов. Все изотопы определенного элемента имеют одинаковое количество протонов, но опять же различаются только количеством нейтронов в каждом атоме. Поскольку изотоп элемента различается по атомной массе, ученые могут также установить относительную атомную массу, иногда называемую атомным весом элемента. Относительная атомная масса — это среднее значение всех атомных масс различных изотопов в данном образце с вкладом каждого изотопа в среднее значение.
Относительные атомные массы, указанные в записях периодической таблицы — например, водорода — рассчитываются для всех встречающихся в природе изотопов каждого элемента, взвешенные по количеству этих изотопов на Земле. Объекты, такие как астероиды или метеоры, могут иметь очень разное количество изотопов.
Атомный номер
Атомный номер (выраженный буквой Z) элемента — это количество протонов в ядре каждого атома этого элемента. Атом можно классифицировать как элемент исключительно на основании его атомного номера. Например, атом с порядковым номером восемь (его ядро содержит 8 протонов) является атомом кислорода, а атом с другим числом протонов будет другим элементом. Таблица Менделеева установлена в порядке возрастания атомного номера.
Поскольку атомы нейтральны, количество протонов в атоме равно количеству электронов. Атомы водорода имеют 1 электрон, занимающий пространство за пределами ядра. Гелий, состоящий из 2 протонов, будет иметь 2 электрона из-за нейтрального состояния. В химической классификации количество протонов всегда будет равно атомному номеру атома, и это значение не будет подвергаться никаким изменениям, если только ядро не подвергнется распаду, в результате чего атом потеряет свою энергию; также называется радиоактивным распадом.
Важность атомных номеров
Помогает идентифицировать выбранный элемент атома.
Расположение элементов основано на атомном номере. Элементы устанавливаются в порядке возрастания атомных номеров элементов.
Помогает в открытии свойств любого элемента. Однако валентный электрон определяет поведение химической связи элемента.
Примеры атомных номеров
Неважно, сколько протонов и электронов присутствует в атоме. Атомный номер всегда рассчитывается по количеству протонов. Например,
Если у атома 1 протон, то атомный номер равен 1, а элемент — водород.
У каждого атома углерода будет шесть протонов, а атомный номер углерода равен 6.
Каждый атом цезия состоит из 55 протонов, следовательно, его атомный номер равен 55.
Масса атома
Массовое число. Массовое число-это суммарное число протонов и нейтронов в ядре атома. Оно обозначается символом А.
Говоря о конкретном атомном ядре, обычно употребляют термин нуклид, а ядерные частицы протоны и нейтроны-в совокупности называют нуклонами.
Атомный номер. Атомный номер элемента совпадает с числом протонов в ядре его атома. Он обозначается символом Z. Атомный номер связан с массовым числом следующим соотношением:
где N-число нейтронов в ядре атома.
Каждый химический элемент характеризуется определенным атомным номером. Другими словами, никакие два элемента не могут иметь одинаковый атомный номер. Атомный номер равен не только числу протонов в ядре атомов данного элемента, но также равен числу электронов, окружающих ядро атома. Это объясняется тем, что атом в целом представляет собой электрически нейтральную частицу. Таким образом, число протонов в ядре атома равно числу электронов, окружающих ядро. Это утверждение не относится к ионам, которые, разумеется, представляют собой заряженные частицы.
Первое экспериментальное обоснование атомных номеров элементов* получил в 1913 г. Генри Мозли, работавший в Оксфорде. Он бомбардировал твердые металлические мишени катодными лучами. (В 1909 г. Баркла и Кайи уже показали, что любой твердый элемент при бомбардировке быстрым пучком катодных лучей испускает рентгеновские лучи, характеристические для данного элемента.) Мозли анализировал характеристическое рентгеновское излучение, пользуясь фотографической методикой регистрации. Он обнаружил, что длина волны характеристического рентгеновского излучения увеличивается с возрастанием атомного веса (массы) металла и показал, что квадратный корень из частоты этого рентгеновского излучения прямо пропорционален некоторому целому числу, которое он обозначил символом Z.
Мозли установил, что это число приблизительно совпадает с половиной значения атомной массы. Он пришел к выводу, что это число-атомный номер элемента-является фундаментальным свойством его атомов. Оно оказалось равно числу протонов в атоме данного элемента. Таким образом, Мозли связал частоту характеристического рентгеновского излучения с порядковым номером излучающего элемента (закон Мозли). Этот закон имел большое значение для утверждения периодического закона химических элементов и установления физического смысла атомного номера элементов.
Исследование Мозли позволило ему предсказать существование трех недоста-вавших к тому времени в периодической таблице элементов с атомными номерами 43, 61 и 75. Эти элементы были обнаружены позже и получили названия технеций, прометий и рений соответственно.
Символы нуклидов. Массовое число нуклида принято указывать в виде верхнего индекса, а атомный номер-в виде нижнего индекса слева от символа элемента. Например, запись 1IC означает, что этот нуклид углерода (как и все другие нуклиды углерода) имеет атомный номер 6. Данный конкретный нуклид имеет массовое число 12. Другому нуклиду углерода отвечает символ 14C Поскольку все нуклиды углерода имеют атомный номер 6, указанный нуклид часто записывают просто как 14C или углерод-14.
Изотопы. Изотопами называются различные по свойствам атомные разновидности одного элемента. Они различаются числом нейтронов в их ядре. Таким образом, изотопы одного элемента имеют одинаковый атомный номер, но разные массовые числа. В табл. 1.1 приведены значения массового числа А, атомного номера Z и числа нейтронов N в ядре атомов каждого из трех изотопов углерода.
Молекулярная физика. Атомная единица массы. Атомная масса.
Атомная единица массы.
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 12 С:
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества Mr, в единицу массы СИ (кг), пользуются формулой:

Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы:

где Mr — относительная молекулярная (атомная) масса; m0 — масса молекулы (атома), выраженная в единицах СИ (кг); m0С — масса молекулы изотопа углерода 12 С, выраженная в тех же единицах, что и m0.

Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов.
Атомные массы всех химических элементов точно измерены.
Атомная масса и атомное число.
Если мы заглянем в справочник, то увидим, что атомная масса гелия равна не ровно 4, а 4,002602. Атомная масса – это совсем не то же самое, что и атомное (или зарядовое) число – это принципиально разные вещи. Атомное число показывает – сколько протонов в ядре, а атомная масса говорит о том – какова совокупная масса нуклонов. А массовое число показывает – сколько всего нуклонов в ядре.
Когда мы говорим о времени или массе или длине, мы оперируем теми или иными единицами измерения – секунда или килограмм или ангстрем. Конечно, было бы чрезвычайно неудобно измерять массу атомного ядра в килограммах – получилось бы крайне длиннющее и неудобное для работы число, да еще и в придачу с кучей нулей после запятой. Это неудобно. Поэтому оставим килограммы и граммы для бытовой жизни, а для атомного мира воспользуемся другой единицей измерения.
В атомной физике единицей атомной массы принято считать одну двенадцатую массы нейтрального (то есть не имеющего электрического заряда, то есть имеющего одинаковое количество протонов и электронов) атома наиболее распространенного изотопа углерода, имеющего в своем ядре 6 протонов и 6 нейтронов. Отсюда ясно, что атомная масса 12 C равна двенадцати – ведь если мы решили 1 /12 от его массы считать равной единице, то это и значит, что вся его масса равна 12. Для обозначения атомной единицы массы принято использовать сокращение «а.е.м.». Естественно, любые единицы массы можно перевести друг в друга. Так, например, мы можем измерять массу в килограммах, а можем в граммах, и при этом мы знаем, что один килограмм – это тысяча граммов. Аналогично, можно выразить одну а.е.м. через грамм:
Атомная масса других элементов не будет целой, но чтобы понять это более ясно, сделаем небольшое отступление.
Это справедливо не только для микромира, не подумай. Эта формула универсальна, она годится для любых масс!
Кроме того, при вычислении атомной массы мы пользуемся статистическими методами. Мы берем, к примеру, миллион атомов и измеряем среднее арифметическое от полученной массы. Но мы знаем, что у разных атомов существует разное количество разных стабильных изотопов, то есть некоторые атомы – допустим, два на миллион, будут содержать не то же число нейтронов в ядре, чем у остальных, а это значит, что среднее арифметическое опять немного изменится. Именно поэтому, глядя в таблицу Менделеева, мы видим, что массовое число и атомное число у каждого элемента, естественно, представлены целыми числами и они не могут быть иными, поскольку определяются количеством нуклонов. А атомная масса представлена дробными числами, в том числе и у углерода, так как и у углерода встречаются разные стабильные изотопы, например 13 C.
Разность между атомной массой изотопа и его массовым числом (то есть разность между числом, выражающим массу нуклонов ядра в условных единицах массы, и числом, выражающим количество этих нуклонов) называется избытком массы, и опять таки этот термин неудачен, потому что на самом деле «избыток массы» у некоторых элементов положителен, то есть это в самом деле «избыток» в бытовом понимании этого слова, зато у других атомов он отрицателен, то есть в этих случаях «избыток массы» является «недостачей» в бытовом понимании. Но очень многие термины, будучи устоявшимися, уже в будущем не меняются, иногда даже несмотря на крайнюю их неудачность – это нередкая ситуация в любой науке, не только в физике.