Матрикс это в медицине что
Матрикс это в медицине что
• Межклеточные контакты представляют собой специализированные белковые комплексы благодаря которым соседние клетки вступают во взаимный контакт и сообщаются друг с другом
• Внеклеточный матрикс представляет собой плотную сеть, состоящую из белков, которая расположена между клетками и образована ими самими
• Клетки экспрессируют рецепторы для белков внеклеточного матрикса
• Белки внеклеточного матрикса и межклеточные контакты контролируют трехмерную организацию клеток в ткани, а также их рост, подвижность, форму и дифференцировку
Одним из наиболее важных событий в эволюции живых существ было появление многоклеточных организмов. Когда клетки выработали способ группироваться вместе, они приобрели способность образовывать сообщества, в которых различные клетки специализированы по функциям. Если, например, два одноклеточных организма «объединяют усилия», можно представить себе, что каждый из них будет специализироваться на выполнении определенных функций, необходимых для успешного роста и размножения, а остальные оставит своему партнеру.
Для образования простого многоклеточного организма или ткани более сложного организма клетки должны надежно прикрепляться друг к другу. Как показано на рисунке ниже, для клеток животных это прикрепление может достигаться тремя путями. Во-первых, клетки непосредственно прикрепляются друг к другу посредством образования межклеточных контактов, которые представляют собой специальные модификации клеточной поверхности соседних клеток. Эти контакты видны в электронном микроскопе. Во-вторых, клетки могут взаимодействовать между собой без формирования контактов, используя белки, которые не образуют такие специализированные области. В-третьих, клетки соединяются между собой непрямым образом, прикрепляясь к сети внеклеточного матрикса (ВКМ), который содержит молекулы, расположенные в межклеточной среде.
Прикрепление клеток происходит за счет образования контактов их поверхности с внеклеточным матриксом.
Однако формирование многоклеточного организма представляет собой не такую простую задачу, как скрепление нескольких клеток друг с другом. Правильное функционирование таких сообществ клеток обеспечивается их эффективным взаимодействием и разделением труда между ними. Межклеточные контакты представляют собой высокоспециализированные области, в которых клетки соединяются между собой посредством белковых комплексов, связанных с мембранами. Известно несколько различных типов межклеточных контактов, каждый из которых выполняет специфическую роль в сообщении клеток между собой.
Белки, образующие щелевые контакты, дают возможность клеткам непосредственно сообщаться друг с другом, образуя каналы, через которые происходит обмен малыми цитоплазматическими молекулами. Белки, формирующие плотные контакты, служат селективным барьером, который регулирует прохождение молекул через слой клеток и препятствует диффузии белков в плазматической мембране. Адгезивные контакты и десмосомы формируют механическую устойчивость, связывая цитоскелет контактирующих клеток, в результате чего слой клеток может функционировать как единое целое. Эти контакты могут служить передатчиками сигналов, переводя изменения клеточной поверхности в биохимические сигналы, которые распространяются по клетке.
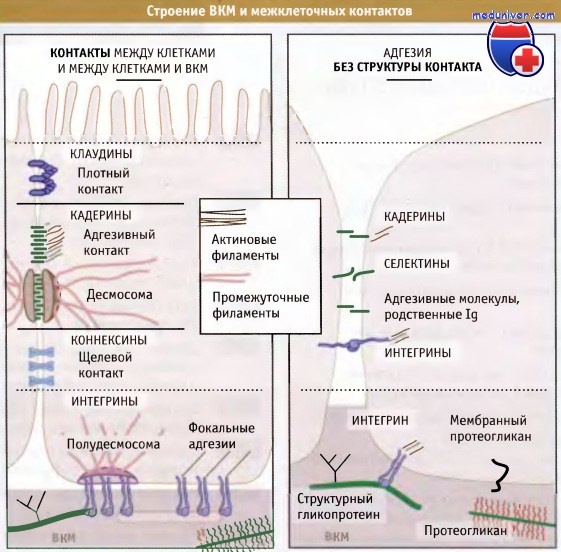
контактных адгезивных комплексов клеток неэпителиального происхождения (справа) и комплексов клеток с внеклеточным матриксом (внизу).
Показаны также основные классы компонентов внеклеточного матрикса (ВКМ).
Известны также различные типы белков, которые участвуют в бесконтактном взаимодействии клеток. К таким белкам относятся интегрины, кадерины, селектины и родственные иммуноглобулинам молекулы, обеспечивающие адгезию клеток.
Все клетки, даже самые примитивные одноклеточные организмы, обладают функциями узнавания внешнего окружения и взаимодействия с ним. Даже до появления клеточных сообществ клетки должны были прикрепляться к поверхности и перемещаться по ней. Таким образом, адгезивные структуры клеточного матрикса сформировались рано в эволюции. Как показано на рисунке ниже, у многоклеточных организмов пространство между клетками заполнено плотной структурой, состоящей из белков и сахаров, которая называется внеклеточным матриксом. Внеклеточный матрикс организован в виде волокон, слоев и пленочных структур.
В некоторых тканях внеклеточный матрикс находится в виде сложных слоев, которые называются базальной ламиной и непосредственно контактируют с клетками. Белки, входящие в состав внеклеточного матрикса, бывают двух типов: структурные гликопротеины, например коллаген и эластин, и протеогликаны. Эти белки придают тканям прочность и эластичность, а также служат селективным фильтром, контролирующим поток нерастворимых компонентов между клетками. Протеогликаны проявляют гидрофильные свойства и поддерживают между клетками водное окружение. Когда клетки мигрируют, внеклеточный матрикс функционирует как опорная структура, обеспечивающая их передвижение.
Клетки секретируют компоненты внеклеточного матрикса. Они сами образуют эту наружную опорную систему, и при необходимости могут изменять ее форму за счет деградации и замены окружающих участков матрикса. В настоящий момент вопросы контроля сборки и деградации внеклеточного матрикса представляют существенный интерес, поскольку они играют важную роль в развитии многоклеточных организмов, в заживлении ран, а также в образовании злокачественных опухолей.
Контакты клеток с внеклеточным матриксом образуются за счет рецепторных белков клеточной поверхности, которые, собираясь вместе, формируют на поверхности клеток структуры типа островков (patch) и которые связывают внеклеточный матрикс, расположенный с наружной стороны плазматической мембраны с цитоскелетом со стороны цитозоля. Так же как в случае некоторых межклеточных контактов, некоторые из этих белков образуют упорядоченные комплексы, соединяющие клеточную поверхность с цитоскелетом. Эти белки обладают гораздо более широкими функциями, чем просто «клеточные присоски»; они также участвуют во многих процессах передачи сигналов и обеспечивают клеткам возможность сообщаться друг с другом.
Различные клетки вместе со своим внеклеточным матриксом формируют ткани, для которых характерна высокая степень специализации. Хрящевая, костная и другие виды соединительной ткани могут противостоять сильной механической нагрузке, в то время как другие, например ткань, формирующая легкие, не отличаются прочностью, однако являются высокоэластичными. Баланс между прочностью, эластичностью и трехмерной структурой тщательно регулируется, и компоненты каждой ткани выполняют свои функции во взаимодействии друг с другом. Таким образом, организация и состав ткани соответствуют функции, выполняемой органом; например, мышцы совершенно отличаются от кожи, и слава Богу!
Межклеточные контакты и прикрепление клеток к матриксу не ограничены только клеточной поверхностью. Во многих случаях белки должны быть заякорены в мембране достаточно сильно для того, чтобы противостоять механическим усилиям. Для этого требуется их связывание с цитоскелетом, что в основном обеспечивает клетке структурную поддержку. Наличие цитоскелета также предотвращает латеральное смещение рецепторов в плоскости мембраны, «удерживая» их на своих местах. Наряду с этим, процессы передачи сигнала регулируют сборку межклеточных контактов и поддерживают их. Цитоскелет и сигнальные механизмы играют существенную роль в клеточной адгезии.
Последующие статьи на сайте подразделяется на темы, которые посвящаются рассмотрению основных классов молекул внеклеточного матрикса, таких представителей группы его рецепторов, как интегрины, роли этих рецепторов в процессах развития, а также структуре и функциям наиболее распространенных типов клеточных контактов.
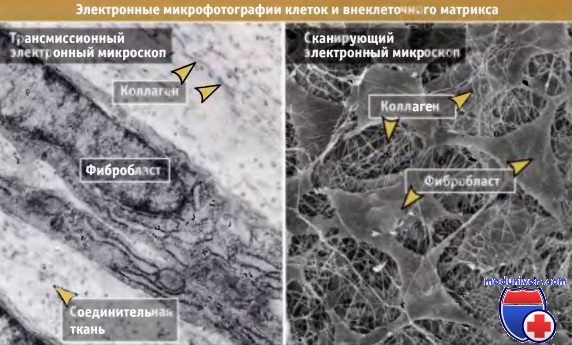
На фотографиях видны коллагеновые фиблиллы в межклеточном пространстве между фибробластами в соединительной ткани (слева) и в роговице глаза (справа).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Тканевая инженерия — окно в современную медицину
Тканевая инженерия — окно в современную медицину
В перспективе тканевая инженерия, если и не приведет к бессмертию, то уж точно сделает решение многих современных проблем медицины более чем реальным.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Петр I мечтал «прорубить окно в Европу», а ученые нашего времени — окно в современную медицину. Сочетание «медицина + биотехнология» нашло свое отражение в тканевой инженерии — технологии, открывающей возможность восстановления утраченных органов без трансплантации. Методы и результаты тканевой инженерии поражают: это получение живых (а не искусственных!) органов и тканей; регенерация тканей; печать кровеносных сосудов на 3D-принтере; использование «тающих» в организме хирургических шовных нитей и многое другое.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
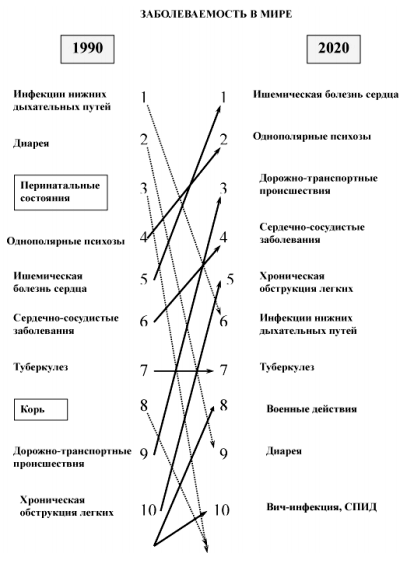
В последние десятилетия стали отчетливо проявляться тревожные тенденции старения населения, роста количества заболеваний и инвалидизации людей трудоспособного возраста, что настоятельно требует освоения и внедрения в клиническую практику новых, более эффективных и доступных методов восстановительного лечения больных. На рисунке 1 показано, как изменяется структура заболеваний в настоящее время.
Рисунок 1. Мировая динамика частоты заболеваний.
На сегодняшний день наука и техника предлагает несколько альтернативных путей восстановления или замены поврежденных или пораженных патологией тканей и органов:
В рамках данной статьи мы подробнее остановимся на возможностях и перспективах тканевой инженерии.
Тканевая инженерия — современная инновационная технология
Принципиально новый подход — клеточная и тканевая инженерия — является последним достижением в области молекулярной и клеточной биологии. Этот подход открыл широкие перспективы для создания эффективных биомедицинских технологий, с помощью которых становится возможным восстановление поврежденных тканей и органов и лечение ряда тяжелых метаболических заболеваний человека.
Цель тканевой инженерии — конструирование и выращивание вне организма человека живых, функциональных тканей или органов для последующей трансплантации пациенту с целью замены или стимуляции регенерации поврежденных органа или ткани. Иными словами, на месте дефекта должна быть восстановлена трехмерная структура ткани.
Важно отметить, что обычные имплантаты из инертных материалов могут устранить только физические и механические недостатки поврежденных тканей, — в отличие от тканей, полученных методом инженерии, которые восстанавливают, в том числе, и биологические (метаболические) функции. То есть, происходит регенерация ткани, а не простое замещение ее синтетическим материалом.
Однако для развития и совершенствования методов реконструктивной медицины на базе тканевой инженерии необходимо освоение новых высокофункциональных материалов. Эти материалы, применяемые для создания биоимплантатов, должны придавать тканеинженерным конструкциям характеристики, присущие живым тканям:
Клетки и матриксы — основа основ для тканевой инженерии
Наиболее важным элементом успеха является наличие необходимого количества функционально активных клеток, способных дифференцироваться, поддерживать соответствующий фенотип и выполнять конкретные биологические функции. Источником клеток могут быть ткани организма и внутренние органы. Возможно использование соответствующих клеток от пациента, нуждающегося в реконструктивной терапии, или от близкого родственника (аутогенных клеток). Могут быть использованы клетки различного происхождения, в том числе первичные (рис. 2) и стволовые клетки (рис. 3).
Рисунок 2. Первичная клетка человека.
библиотека Федерации Киокушинкай г. Южноуральска
Рисунок 3. Стволовая клетка человека.
Первичные клетки — это зрелые клетки определенной ткани, которые могут быть взяты непосредственно от организма-донора (ex vivo) хирургическим путем. Если первичные клетки взяты у определенного организма-донора, и впоследствии необходимо имплантировать эти клетки ему же в качестве реципиента, то вероятность отторжения имплантированной ткани исключается, поскольку присутствует максимально возможная иммунологическая совместимость первичных клеток и реципиента. Однако первичные клетки, как правило, не способны делиться — их потенциал к размножению и росту низок. При культивировании таких клеток in vitro (посредством тканевой инженерии) для некоторых типов клеток возможна дедифференцировка, то есть потеря специфических, индивидуальных свойств. Так, например, хондроциты, вводимые в культуру вне организма, часто продуцируют фиброзный, а не прозрачный хрящ.
Поскольку первичные клетки не способны делиться и могут потерять свои специфичные свойства, возникла необходимость альтернативных источников клеток для развития технологий клеточной инженерии. Таковой альтернативой стали стволовые клетки.
Рисунок 4. Биокерамические изделия из ортофосфатов кальция.
Стволовые клетки — недифференцированные клетки, которые имеют способность к делению, самообновлению и дифференцировке в различные типы специализированных клеток под воздействием конкретных биологических стимулов (см.: «Была клетка простая, стала стволовая» [3]). Стволовые клетки подразделяются на «взрослые» [2] и «эмбриональные». Эмбриональные стволовые клетки образуются из внутренней клеточной массы развития зародыша на ранней стадии, а взрослые — из тканей взрослого организма, пуповины или даже плодных тканей. Однако существует этическая проблема, связанная с неизбежным разрушением человеческого эмбриона при получении эмбриональных стволовых клеток [4]. Поэтому предпочтительнее «добыча» клеток из тканей взрослого организма. Так, например, в 2007 году Шинью Яманакой (Shinya Yamanaka) из Киотского университета Японии были открыты индуцированные плюрипотентные стволовые клетки (ИПСК), получаемые из покровных тканей человека (в основном, из кожи). ИПСК открывают поистине невиданные возможности для регенеративной медицины, хотя, прежде чем они всерьез войдут в медицинскую практику, предстоит решить еще немало проблем (см.: «Снежный ком проблем с плюрипотентностью» [5]).
Для направления организации, поддержания роста и дифференцировки клеток в процессе реконструкции поврежденной ткани необходим специальный носитель клеток — матрикс, представляющий из себя трехмерную сеть, похожую на губку или пемзу (рис. 4). Для их создания применяют биологически инертные синтетические материалы, материалы на основе природных полимеров (хитозан, альгинат, коллаген) и биокомпозиты. Так, например, эквиваленты костной ткани получают путем направленной дифференцировки стволовых клеток костного мозга, пуповинной крови или жировой ткани в остеобласты, которые затем наносят на различные материалы, поддерживающие их деление (например, донорскую кость, коллагеновые матрицы и др.).
«Фирменная» стратегия тканевой инженерии
На сегодняшний день одна из стратегий тканевой инженерии такова:
Матриксы через некоторое время после имплантации в организм хозяина полностью исчезают (в зависимости от скорости роста ткани), а в месте дефекта останется только новая ткань. Также возможно внедрение матрикса с уже частично сформированной новой тканью («биокомпозит»). Безусловно, после имплантации тканеинженерная конструкция должна сохранить свои структуру и функции в течение периода времени, достаточного для восстановления нормально функционирующей ткани в месте дефекта, и интегрироваться с окружающими тканями. Но, к сожалению, идеальные матриксы, удовлетворяющие всем необходимым условиям, пока не созданы.
Кровеносные сосуды из принтера
Перспективные тканеинженерные технологии открыли возможность лабораторного создания живых тканей и органов, но перед созданием сложных органов наука пока бессильна. Однако сравнительно недавно ученые под руководством доктора Гунтера Товара (Gunter Tovar) из Общества Фраунгофера в Германии сделали огромнейший прорыв в сфере тканевой инженерии — они разработали технологию создания кровеносных сосудов. А ведь казалось, что капиллярные структуры создать искусственно невозможно, поскольку они должны быть гибкими, эластичными, малой формы и при этом взаимодействовать с естественными тканями. Как ни странно, но на помощь пришли производственные технологии — метод быстрого прототипирования (другими словами, 3D-печать). Подразумевается, что сложная трехмерная модель (в нашем случае кровеносный сосуд) печатается на трехмерном струйном принтере с использованием специальных «чернил» (рис. 5).
Рисунок 5. Технология «печати» искусственного кровеносного сосуда.
Принтер наносит материал послойно, и в определенных местах слои соединяются химически. Однако заметим, что для мельчайших капилляров трехмерные принтеры пока недостаточно точны. В связи с этим был применен метод многофотонной полимеризации, используемый в полимерной промышленности. Короткие интенсивные лазерные импульсы, обрабатывающие материал, так сильно возбуждают молекулы, что они взаимодействуют друг с другом, соединяясь в длинные цепочки. Таким образом, материал полимеризуется и становится твердым, но эластичным, как естественные материалы. Эти реакции настолько управляемы, что с их помощью можно создавать мельчайшие структуры по трехмерному «чертежу».
А для того, чтобы созданные кровеносные сосуды могли состыковаться с клетками организма, при изготовлении сосудов в них интегрируют модифицированные биологические структуры (например, гепарин) и «якорные» белки. На следующем этапе в системе созданных «трубочек» закрепляются клетки эндотелия (однослойный пласт плоских клеток, выстилающий внутреннюю поверхность кровеносных сосудов) — для того, чтобы компоненты крови не приклеивались к стенкам сосудистой системы, а свободно транспортировались по ней.
Однако прежде чем действительно можно будет имплантировать выращенные в лаборатории органы с собственными кровеносными сосудами, пройдет еще какое-то время.
Давай, Россия, давай вперед!
Без ложной скромности скажем, что и в России создана научная основа для практического применения биомедицинских материалов нового поколения. Интересную разработку предложила молодой учёный из Красноярска Екатерина Игоревна Шишацкая (рис. 6) — растворимый биосовместимый полимер биопластотан [7]. Суть своей разработки она объясняет просто: «в настоящее время практические медики испытывают большой дефицит материалов, способных заменить сегменты человеческого организма. Нам удалось синтезировать уникальный материал, который в состоянии заменить элементы органов и тканей человека». Разработка Екатерины Игоревны найдет применение, прежде всего, в хирургии. «Самое простое — это, например, шовные нити, сделанные из нашего полимера, которые растворяются после того, как зарастает рана, — говорит Шишацкая. — Также можно делать специальные вставки в сосуды — стенты. Это маленькие полые трубки, которые используют, чтобы расширить сосуд. Через некоторое время после операции сосуд восстанавливается, а полимерный заменитель растворяется» [8].
Рисунок 6. Лауреат премии Президента РФ Екатерина Игоревна Шишацкая.
Первый опыт трансплантации тканеинженерной конструкции в клинике
Рисунок 7. Паоло Маккиарини, мастер-класс которого «Клеточные технологии для тканевой инженерии и выращивания органов» прошел в Москве в 2010 году.
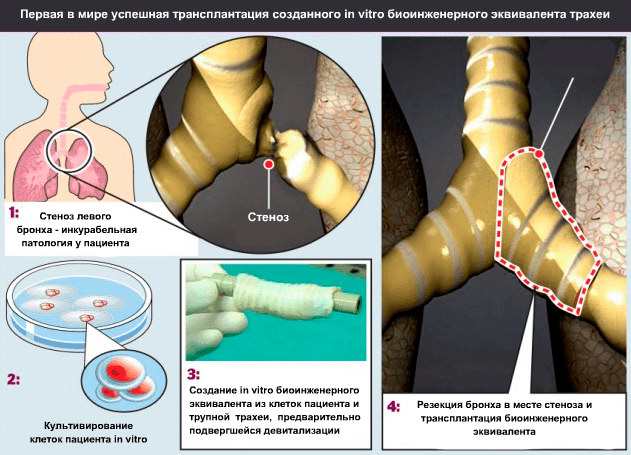
Осенью 2008 года руководитель клиники Университета Барселоны (Испания) и Медицинской школы Ганновера (Германия) профессор Паоло Маккиарини (Paolo Macchiarini; рис. 7) провел первую успешную операцию по трансплантации биоинженерного эквивалента трахеи пациентке со стенозом главного левого бронха на протяжении 3 см (рис. 8) [11].
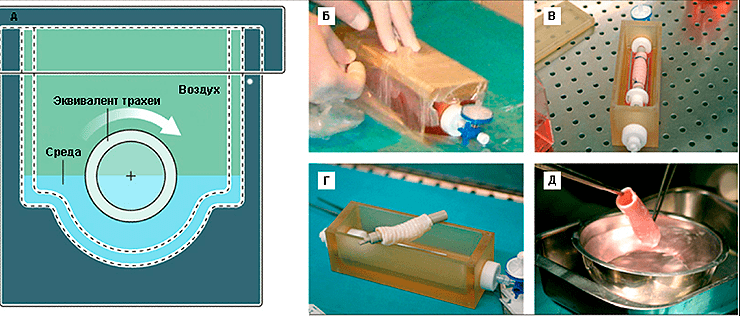
В качестве матрикса будущего трансплантата был взят сегмент трупной трахеи длиной 7 см. Чтобы получить природную матрицу, по свойствам превосходящую все то, что можно сделать из полимерных трубок, трахею очистили от окружающей соединительной ткани, клеток донора и антигенов гистосовместимости. Очищение заключалось в 25 циклах девитализации с применением 4%-деоксихолата натрия и дезоксирибонуклеазы I (процесс занял 6 недель). После каждого цикла девитализации проводили гистологическое исследование ткани для выявления количества оставшихся ядросодержащих клеток, а также иммуногистохимическое исследование на наличие в ткани антигенов гистосовместимости HLA-ABC, HLA-DR, HLA-DP и HLA-DQ. Благодаря биореактору собственной разработки (рис. 9) ученые на поверхность медленно вращающегося отрезка трахеи равномерно нанесли шприцем суспензию клеток. Затем трансплантат, наполовину погруженный в среду для культивирования, вращался вокруг своей оси с целью попеременного контакта клеток со средой и воздухом.
Рисунок 8. Операция по пересадке пациентке трахеи.
Рисунок 9. Биореактор для создания тканеинженерного эквивалента трахеи. А — схема биореактора, вид с боку. Б — герметизация биореактора. В — биореактор с тканеинженерным эквивалентом трахеи in situ. Г — биореактор после удаления эквивалента трахеи. Д — вид эквивалента трахеи непосредственно перед операцией.
Эквивалент трахеи находился в биореакторе 96 часов; затем его трансплантировали пациентке. При операции был полностью удален главный левый бронх и участок трахеи, к которому он примыкал. В образовавшийся промежуток вшили трансплантат, а некоторое несоответствие диаметров просветов тканеинженерного эквивалента и бронха реципиента было преодолено благодаря эластичности донорской ткани.
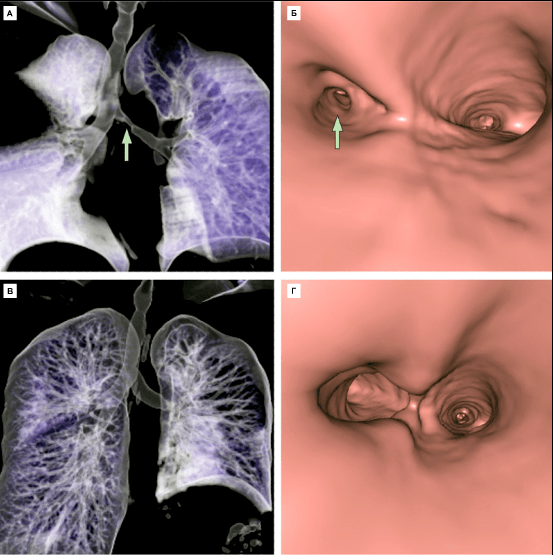
По истечении десяти суток после операции пациентка была выписана из клиники без признаков дыхательной недостаточности и иммунной реакции отторжения трансплантата. По данным компьютерной томографии, с помощью которых была сделана виртуальная 3D реконструкция дыхательных путей, тканеинженерный эквивалент был практически неотличим от собственных бронхов пациентки (рис. 10).
Рисунок 10. Виртуальная 3D-реконструкция дыхательных путей по данным компьютерной томографии и бронхоскопии перед операцией (А, Б) и через 1 месяц и после замены стенозного участка левого главного бронха тканеинженерным эквивалентом (В, Г). Стрелкой указан стеноз.
Матрикс это в медицине что
Внеклеточный матрикс — комплекс белков и полисахаридов, составляющих основу любой ткани [1]. Длительное время внеклеточный матрикс рассматривался исключительно с позиции его ведущей роли в поддержании структуры, «каркаса» ткани. Однако сравнительно новые данные об участии молекул внеклеточного матрикса в процессах передачи сигнала, регуляции роста клеток и дифференцировки, апоптоза изменили представление о функциональной значимости его компонентов и позволяют расценивать его составляющие как возможные терапевтические мишени для коррекции различных патологических процессов и состояний. Состав компонентов внеклеточного матрикса специфичен в отдельной ткани. В коже он представлен гликозаминогликанами, а также белками коллагеном, эластином, фибронектином, ламинином [2]. Все компоненты внеклеточного матрикса разделяют на две большие группы: образующие волокна (коллаген и эластин) и не формирующие волокона (протеогликаны и гликопротеины) [3].
Основные компоненты межклеточного матрикса
Одним из основных компонентов межклеточного матрикса является коллаген. В настоящее время выделяют 27 типов коллагенов, из которых в коже обнаружено 9 типов [4]. Наиболее распространенным является коллаген I типа. Данный тип коллагена представлен плотно упакованными толстыми волокнами, основной его функцией является препятствие растяжению. Коллаген II типа образует рыхлую сеть коллагеновых волокон, его основная функция — сохранение устойчивости кожи к перепадам давления. Коллаген III типа образует рыхлую сеть тонких волокон, функция которых — поддержка структуры крупных органов. Кроме того, данный тип коллагена вносит свой вклад в стабильность сосудистой стенки, поскольку мутации генов, кодирующих эти молекулы, приводят к разрывам сосудов в процессе эмбрионального развития [2]. Коллаген IV типа составляет основную часть базальной мембраны эпидермодермальной зоны, сосудов и придатков кожи. Ингибирование синтеза коллагена при нарушениях сборки его фибрилл тормозит развитие микрососудов [3]. Коллаген V типа располагается преимущественно в сосочковом слое дермы и вокруг базальных мембран сосудов, нервов и придаточных образований кожи, а также в пограничной эпидермодермальной зоне. Коллаген VI типа пронизывает всю дерму в виде сети [4]. Коллаген VII типа формирует прикрепляющие фибриллы сосочкового слоя дермы. Коллаген VIII типа является главным компонентом десцеметовых мембран эндотелия роговицы. Коллагены IX и XII типов являются фибрилл-связывающими коллагенами, эти коллагены прикрепляются к поверхности фибрилл на определенном расстоянии друг от друга и взаимодействуют как с фибриллами, так и с другими компонентами межклеточного матрикса; эти соединения делают структуру коллагена более прочной. Помимо коллагена в межклеточном матриксе располагаются и другие белковые молекулы (см. таблицу). Наиболее многочисленную популяцию клеток дермы представляют фибробласты. Они контролируют массу и целостность внеклеточного матрикса путем регулируемого по принципу обратной связи синтеза коллагена и эластина, синтеза основного вещества, а также путем участия в разрушении вышеуказанных элементов [5]. Ультраструктурные изменения компонентов внеклеточного матрикса интенсивно происходят на этапе формирования тканей во время эмбриогенеза, при раневом процессе, в ответ на воздействие инфекционных агентов, а также при различных патологических состояниях. Данный процесс во внеклеточном матриксе осуществляется опосредованно через белки интегрины, а также синдеканы — протеогликаны внеклеточного матрикса или же посредством белков-ферментов, обладающих способностью модифицировать ферменты внеклеточного матрикса — матриксные металлопротеиназы [1]. Внеклеточный матрикс принимает участие в формировании так называемых ниш для стволовых клеток — пространства со специфичным микроокружением, поддерживаемым для сохранения пула стволовых клеток [6]. На сегодняшний день известно, что подобные «ниши» есть во всех органах у взрослых людей. Одним из компонентов этих образований является гликозаминогликан гепарансульфат, а молекулы интегринов играют важную роль в передаче сигналов к стволовым клеткам, регулируя их пролиферацию и способность мигрировать из «ниши» [7]. Известно, что молекулы внеклеточного матрикса взаимодействуют с ростовыми факторами. В частности, фактор роста фибробластов и фактор роста сосудистого эндотелия связываются с гепарансульфатом, который, таким образом, выступает в качестве «резервуара» для данных молекул и посредника в процессах передачи сигнала. Взаимодействие фактора роста сосудистого эндотелия с белками межклеточного матрикса играет важную роль в процессе «ангиогенного переключения» при опухолевом росте [8]. В целом можно отметить, что факторы роста вместе с матриксными металлопротеиназами регулируют состояние внеклеточного матрикса: факторы роста индуцируют локальную продукцию компонентов внеклеточного матрикса, в то время как матриксные металлопротеиназы осуществляют их деградацию и изменение его структуры, обеспечивая существование внеклеточного матрикса в качестве динамичной среды для существования и передвижения клеток [9].
Изменения межклеточного матрикса при старении
Процесс старения представляет собой динамичное явление, влияющее на все системы. В коже признаки старения проявляются в виде морщин и птоза в результате структурных изменений на молекулярном уровне, в первую очередь касающихся состояния межклеточного матрикса [10]. Старение кожи связано с изменением коллагеновых и эластических волокон. В частности, с возрастом уменьшается коллагеновая сеть в коже, что является результатом повышенной активности коллагеназ. В это же время происходит снижение уровня синтеза коллагена, что, таким образом, резко ограничивает репаративные механизмы в отношении коллагеновых волокон, которые начинают также характеризоваться неупорядоченностью. Изменения претерпевают эластические волокна, что приводит к снижению эластичности и упругости кожи. Фибробласт, являясь основной коллагенобразующей клеткой, обеспечивает процесс обновления дермы. Ограничение пролиферативной способности дермальных фибробластов при старении свидетельствует о нарушении их функциональных свойств: угнетении продукции углеводно-белковых комплексов основного вещества и волокон дермы, снижении синтеза многочисленных факторов роста клеток, а также преждевременной деградации компонентов внеклеточного матрикса. Все это неизбежно приводит к нарушению регенерации дермы и формированию признаков старения кожи [11]. Важно отметить, что старение кожи является результатом двух процессов — хроностарения, характеризуемого изменениями в коже, подобными тем, что происходят во внутренних органах, а также фотостарения, свойственного только коже. Два вышеуказанных процесса изменяют эластические свойства кожи различными путями. Возрастное старение кожи связано с потерей эластических волокон в результате протеолитической деградации, ассоциированной со снижением синтеза эластина в увядающей коже. При фотостарении в средних отделах дермы определяются массивные депозиты эластина, потерявшего свои функциональные характеристики. Таким образом, на участках кожи, подверженной в большей степени воздействию УФ-излучения, признаки старения являются выражением как «эндогенного», так и «экзогенного» механизмов увядания кожи [12]. На основании данных фактов сформированы современные концепции коррекции возрастных изменений кожи: стимуляция продукции коллагена ретиноевой и аскорбиновой кислотами. Предпринимались попытки вводить в кожу ингибиторы эластазы, разрушающей эластин, но их клиническая эффективность оказалась незначительной [13]. Столь же дискутабельными являются эффекты внутридермального введения гиалуроновой кислоты — компонента межклеточного матрикса, регулирующего гидратирование дермы посредством способности данного соединения связываться с водой [12]. При патологических процессах, происходящих в коже, компоненты межклеточного матрикса претерпевают существенные изменения, которые захватывают как волокнистые структуры, так и основное вещество.
Раневой процесс и межклеточный матрикс
У здоровых людей процесс заживления раны начинается сразу же после действия повреждающего фактора: тромбоциты из периферического кровотока мигрируют в зону раневого дефекта и начинают активно взаимодействовать с коллагеном и другими компонентами внеклеточного матрикса. Это приводит к повышению функциональной активности тромбоцитов, продукции и выделению тромбогенных и ростовых факторов, а также цитокинов, что вызывает формирование временного фибринового тромба, миграцию нейтрофилов, фагоцитирующих чужеродные микроорганизмы, фрагменты поврежденных и мертвых клеток. Позднее в очаге раны появляются макрофаги, которые также обладают фагоцитарной активностью, но помимо этого они продуцируют медиаторы воспаления, индуцирующие процессы пролиферации посредством активации фибробластов, синтезирующих компоненты внеклеточного матрикса [14]. Фактором, индуцирующим развитие «респираторного взрыва» в коже при ее повреждении, является повреждение коллагена I типа, вследствие чего увеличивается продукция цитокинов лейкоцитами, что обеспечивает хемотаксис необходимых типов клеток в очаг поражения. Фибронектин посредством интегринов связывает клетки, обеспечивая их депонирование в области раны. Помимо этого молекулы фибронектина, полимеризуясь, меняют свою конформацию, что сопряжено с потерей экспрессии интегринов, а также других молекул, опосредующих регуляторную активность фибронектина в отношении формирования клеточно-матриксных адгезионных контактов, передачи сигнала клеткам [15]. Ламинин участвует в неоангиогенезе, ламинин-5 восстанавливает целостность базальной мембраны в области дермо-эпидермального соединения [16]. Гиалуроновая кислота способствует удержанию воды во внеклеточном матриксе, а также вместе с другими гликозаминогликанами функционирует как сигнальная молекула, регулируя синтез и секрецию фибробластами и эндотелиальными клетками необходимых для дальнейшего восстановления ткани факторов роста и цитокинов [17]. Ростовые факторы, депонируемые во внеклеточном матриксе, функционируют в качестве постоянного источника цитокинов, которые регулируют начальные стадии воспаления и процесса заживления раны, индуцируют миграцию клеток — участников воспаления и обеспечивают их направленную активность. Длительно незаживающие раны характеризуются высоким уровнем ферментов, вызывающих деградацию внеклеточного матрикса, нарушениями синтеза цитокинов и наличием стареющих фибробластов со сниженной функциональной активностью [18]. Помимо этого фибробласты в таких раневых дефектах не экспрессируют на своей поверхности рецепторы к молекулам интегринов, что необходимо для их связывания с фибронектином и обеспечения процесса перемещения кератиноцитов от базального слоя эпидермиса в его вышележащие слои [19]. С учетом особенностей функционирования внеклеточного матрикса при хронических ранах терапевтические подходы в данном случае должны включать: локальное использование факторов роста, которые могут стимулировать заживление раны; применение компонентов внеклеточного матрикса, полученных биотехнологическим путем для закрытия раневого дефекта и восстановления архитектоники ткани в пораженной области, а также для индукции синтеза собственных факторов роста; нанесение синтетических материалов, богатых коллагеном, для абсорбции матриксных металлопротеиназ, в избытке присутствующих в ране [14].
Внеклеточный матрикс и формирование рубцовой ткани
Неразрывно связан с нарушением соотношения компонентов межклеточного матрикса, и в первую очередь коллагена, процесс формирования патологических рубцов. Считается, что ведущую роль в патологическом образовании соединительной ткани играют нарушения во взаимоотношениях между фибробластами и макрофагами [20]. Патологические рубцы являются примером заболевания, в основе которого лежит повышенная пролиферативная активность фибробластов, индуцируемая такими цитокинами, как трансформирующий фактор роста-β, инсулиноподобный фактор роста 1, интерлейкин (ИЛ)-1 [21]. Сами же фибробласты синтезируют протеазы (коллагеназу, гиалуронидазу, эластазу), тромбоцитарный фактор роста, эпидермальный фактор роста, коллаген, эластин. Повышение уровня функционально активных фибробластов в месте патологического процесса, а также недостаток макрофагов, активно синтезирующих коллагеназу, обусловливают предпосылки для накопления коллагена, что и определяет характер дальнейших изменений рубцовой ткани. В гипертрофических и келоидных рубцах образование коллагена преобладает над его распадом из-за недостатка коллагеназы — фермента, расщепляющего коллаген, вследствие чего развивается мощный фиброз. Предполагается, что размер рубца, который остается на коже после заживления раны, зависит главным образом от активности колагеназы [22]. В настоящее время уже достаточно хорошо установлены основные причины спонтанного регресса рубцов. Одной из причин регресса рубца является уменьшение количества в рубцах так называемых раневых фибробластов (миофибробластов), которые оказались в данной зоне в ходе репарации поврежденной ткани. Именно эта популяция клеток «короткоживущих фибробластов» играет основную роль в репаративных процессах. Она же отвечает за отложение в зоне повреждения избыточного количества компонентов внеклеточного матрикса. Другой причиной регресса рубцов является включение в процесс деструкции избыточного матрикса (прежде всего коллагена) матриксных металлопротеиназ, которые секретируются макрофагами, кератиноцитами, эндотелиальными клетками и самими фибробластами [6]. Уменьшение количества миофибробластов и активность матриксных металлопротеиназ являются причиной перехода рубца из категории «гипертрофических» в «гипо- и атрофические». Отмечено, что трансформирующий фактор роста-β3, широко представленный в эмбриональной коже, обладает способностью к восстановлению раневых дефектов без формирования рубцов. В связи с этим проводятся испытания рекомбинантного трансформирующего фактора роста-β3 для терапии рубцов у взрослых людей.
Воспалительные заболевания кожи и внеклеточный матрикс
Наследственная патология, связанная с изменениями межклеточного матрикса
Синдром Элерса — Данлоса — наследственное заболевание, характеризующееся гиперэластичностью кожи, при котором различают шесть подтипов [27]. При I, «классическом», подтипе синдрома синтезируется патологический коллаген V типа, что приводит к повышенной растяжимости кожи, склонности к образованию рубцов, гиперподвижности суставов. При синдроме Элерса — Данлоса VI типа наблюдается дефицит фермента лизилоксидазы. При этом не происходит гидроксилирования лизина, нарушается процесс сшивок между полипептидными цепями, и молекула коллагена характеризуется необычно высокой растворимостью. Кроме того, у таких пациентов резко повышается содержание гиалуроновой кислоты, уменьшается количество коллагеновых волокон и относительно увеличивается число эластических волокон. Все эти патоморфологические изменения обеспечивают клинические проявления данного подтипа синдрома: повышенную подвижность суставов, мышечную гипотонию в детском возрасте, сколиоз. Синдром Марфана — наследственное заболевание с полиорганными патологическими изменениями. Изменения кожи характеризуются ее легкой растяжимостью и образованием стрий растяжения, повышенной ранимостью, недоразвитием подкожной жировой клетчатки. В основе развития синдрома лежит мутация гена, кодирующего фибриллин-1, который является обязательной составляющей микрофибрилл — основного структурного и регуляторного компонента внеклеточного матрикса. Фибриллин-1, взаимодействуя с интегринами, принимает участие в осуществлении межклеточной адгезии. Дефектный фибриллин, синтезируемый в результате мутации гена, приводит к функциональной несостоятельности внеклеточного матрикса, что обеспечивает появление клинических признаков заболевания, в частности дилатации аорты. Более того, на сегодняшний день известно, что фибриллин-1 регулирует активацию фактора трансформирующего роста-β, который принимает участие в развитии реакций воспаления, фиброза, а также активации матриксных металлопротеиназ [28]. При сutis laxa (синдром вялой кожи) изменения внеклеточного матрикса связаны с потерей эластических волокон в коже. Вследствие потери эластичности кожа становится вялой, появляется складчатость, легко растягивается с замедленным возвращением к исходному состоянию, становится избыточной, что способствует образованию крупных провисающих складок. При синдроме Гренблад — Страндберга изменения внеклеточного матрикса связаны с увеличением содержания в коже гиалуроновой кислоты, а также хондроитинсульфатов. Развитию данного процесса способствует недостаток нескольких ферментов лизосом. В результате гликозаминогликаны накапливаются в клетке. Одним из проявлений заболевания служит повышенная ломкость и разрушение кровеносных сосудов, которое связано с поражением эластических волокон сосудов. У таких пациентов в дерме обнаруживают скопление измененных эластических волокон, уменьшение количества коллагеновых волокон, их утолщение и расщепление.
Атрофии кожи и межклеточный матрикс
Достаточно выраженные изменения со стороны внеклеточного матрикса наблюдаются при атрофиях кожи: при старческой, пятнистой, червеобразной, идиопатической атрофодермии Пазини — Пьерини, стероидной, полосовидной атрофии. При всех видах данных нарушений изменения со стороны внеклеточного матрикса связаны главным образом с дистрофическими изменениями коллагеновых волокон, дегенерацией эластических волокон. При стероидной атрофии наблюдается резорбция основного вещества, при этом расстояние между коллагеновыми волокнами увеличивается, наблюдаются их перераспределение и изменения в фиброзной сети. Полосовидная атрофия кожи характеризуется значительными изменениями микроциркуляторного русла и волокнистого каркаса межклеточного вещества. Отмечается снижение количества фибробластов [11].
Изменение межклеточного матрикса при некоторых инфекционных заболеваниях
Нарушения компонентных составляющих межклеточного матрикса наблюдаются и при таких инфекционных заболеваниях, как лепра, боррелиоз, имеющих дерматологические проявления. Патогномоничным для боррелиоза является генерализованное поражение кожи в виде хронического атрофического акродерматита Герксгеймера [29]. При этом кожа становится сухой, морщинистой, теряет эластичность и истончается, напоминая по внешнему виду папиросную бумагу (или печеное яблоко) — симптом Поспелова. Сквозь истонченную кожу просвечивают сосуды [29]. При боррелиозе в коже происходит отек сосочкового слоя дермы, пучки коллагеновых волокон ориентированы параллельно эпидермису и варьируют от нескольких пучков до большого скопления. Внутри инфильтрата наблюдаются фрагменты коллагеновых волокон и отсутствие эластических волокон под инфильтратом, наблюдается дезорганизация и деструкция коллагеновых волокон. На поздних стадиях заболевания происходит полное разрушение коллагеновых и эластических волокон. Выраженные морфологические изменения компонентов межклеточного матрикса сопровождают развитие лепроматозного процесса. В пораженной коже наблюдаются изменения структуры коллагеновых волокон и резкое уменьшение количества эластических волокон [30]. На молекулярном уровне при лепре определяются матриксные металлопротеиназы в центральных отделах гранулем, где также преобладают макрофаги и эпителиоидные клетки. При этом сравнительно редко выявляемые признаки некроза в пораженной ткани свидетельствуют о балансе между продукцией матриксных металлопротеиназ при данном заболевании и регуляцией их активности. Напротив, при туберкулезном поражении кожи повышенный уровень матриксных металлопротеиназ коррелирует со степенью деструктивных изменений в очаге поражения [31]. Помимо этого показано, что M. leprae обладают способностью связываться с ламинином-2, что позволяет микроорганизму инфицировать шванновские клетки, обусловливая в дальнейшем появление неврологической симптоматики у больных лепрой. Известно, что неврологические изменения, возникающие при данном заболевании, не поддаются обратному развитию или коррекции. Поэтому блокирование взаимодействия между белками межклеточного матрикса и патогенным микроорганизмом может являться новым терапевтическим подходом для предотвращения поражения нервной системы при лепре [30].
Изменение внеклеточного матрикса при развитии опухолевого процесса
Формирование злокачественных новообразований и опухолевая прогрессия неразрывно связаны с процессом ремоделирования ткани, при котором нормальная ткань замещается малигнизированной. При этом большое значение имеет протеолитическая деградация внеклеточного матрикса [32]. Изменение структуры внеклеточного матрикса необходимо для выживания опухолевых клеток, роста опухолевого узла, экстра- и интравазии и формирования вторичных очагов опухолевого роста. Изменения в продукции и деградации компонентов внеклеточного матрикса наблюдаются при широком спектре опухолей различной локализации [33]. Продукция и секреция протеиназ, участвующих в деградации компонентов внеклеточного матрикса, осуществляется как самими опухолевыми клетками, так и стромальными клетками микроокружения. Многие протеолитические ферменты, такие как катепсины, сериновые протеазы, способны лизировать отдельные компоненты внеклеточного матрикса in vitro, однако разрушать все структуры внеклеточного матрикса могут только матриксные металлопротеиназы [34]. Многие опухоли демонстрируют локальное увеличение уровня матриксных металлопротеиназ — ферментов, способных разрушать любой белок матрикса, что позволяет связывать их с инвазивным фенотипом опухоли. Коллаген играет существенную роль в развитии злокачественных новообразований кожи. Именно коллаген служит главным препятствием инвазивному росту, и для распространения опухолевых клеток он должен быть разрушен. Матриксные металлопротеиназы являются представителями семейства протеаз, данные ферменты способны разрушать коллагены различного типа. Они инициируют инвазивные процессы, так как базальные мембраны состоят из коллагена IV, а внеклеточный матрикс представлен в основном фибриллярными коллагенами I—III типа. Кроме того, матриксные металлопротеиназы играют критическую роль в процессе неоангиогенеза и инициируют образование сосудов в начальной стадии васкуляризации опухоли [35]. В процессе внеклеточного протеолиза происходит высвобождение ангиогенных ростовых факторов, формируются проангиогенные центры связывания интегрина и активные факторы клеточной миграции, что играет ведущую роль в неоангиогенезе растущей опухоли [36]. Опухоли, достигая размера 2—3 мм, далее не могут расти без кровоснабжения растущей ткани. По вновь образованным сосудам доставляется кислород, питательные вещества и удаляются продукты обмена. Рост опухолей строго зависит от неоангиогенеза, а блокирование образования новых сосудов может его подавлять [37]. Опухоли, для которых характерна одновременная продукция различных ангиогенных факторов, чаще метастазируют. Неоангиогенез является одним из определяющих факторов опухолевой прогрессии и играет ключевую роль в поддержании роста злокачественных новообразований и их метастатического потенциала. Охарактеризован ряд эндогенных антиангиогенных факторов, которые являются фрагментами внеклеточного матрикса и протеинов базальной мембраны или ферментов, участвующих в их протеолизе. Наиболее распространенные из них ангиостатин, эндостатин, арестен и тумстатин. Ангиостатин может индуцировать апоптоз или остановку митотического цикла эндотелиальных клеток и ингибировать их миграцию. Опухоль претерпевает постоянные процессы изменения: происходит прогрессия, как правило, в сторону повышения ее злокачественности, которая проявляется как инвазивный рост и развитие метастазов. Стадия инвазивной опухоли характеризуется возникновением инфильтрирующего роста. В опухоли появляется развитая сосудистая сеть и формируется строма, выраженная в различной степени. Границы с прилежащей неопухолевой тканью отсутствуют из-за прорастания в нее опухолевых клеток. Инвазия опухоли протекает в три фазы и обеспечивается определенными генетическими перестройками. Первая фаза инвазии опухоли характеризуется ослаблением контактов между клетками эндотелия и межклеточного матрикса, о чем свидетельствуют уменьшение количества межклеточных контактов, снижение экспрессии некоторых адгезивных молекул из семейства CD44 на поверхности клеток и других и, наоборот, усиление экспрессии прочих адгезивных молекул, обеспечивающих мобильность опухолевых клеток и их контакт с внеклеточным матриксом. На клеточной поверхности снижается концентрация ионов кальция, что приводит к повышению отрицательного заряда опухолевых клеток. Усиливается экспрессия интегриновых рецепторов, обеспечивающих прикрепление клетки к компонентам внеклеточного матрикса — ламинину, фибронектину, коллагенам. Во второй фазе опухолевая клетка секретирует протеолитические ферменты и их активаторы, которые обеспечивают деградацию внеклеточного матрикса, освобождая тем самым путь для инвазии. В то же время продукты деградации фибронектина и ламинина являются хемоаттрактантами для опухолевых клеток, которые мигрируют в зону деградации в ходе третьей фазы инвазии, затем процесс повторяется в новой области. Способность к метастазированию является отличительной особенностью злокачественных опухолей и основным способом их распространения. Процесс метастазирования связан с распространением опухолевых клеток из первичной опухоли в другие органы по лимфатическим и кровеносным сосудам, периневрально, имплантационно, что стало основой выделения видов метастазирования. Процесс метастазирования начинается с возникновения метастатического субклона опухолевых клеток с измененной плазмолеммой, в результате чего теряются межклеточные контакты и появляется способность к передвижению. Затем опухолевые клетки мигрируют через внеклеточный матрикс, прикрепляясь интегриновыми рецепторами к ламинину, фибронектину, коллагеновым молекулам базальной мембраны сосуда, осуществляют ее протеолиз за счет выделения коллагеназ, катепсина, эластазы, гликозаминогидролазы, плазмина и др. Это позволяет опухолевым клеткам проникать через базальную мембрану сосуда и прикрепляться к его эндотелию. Затем клетка изменяет свои адгезивные свойства посредством супрессии адгезивных молекул семейства и отделяется как от опухолевого пласта, так и от эндотелия сосуда. На следующем этапе формируются опухолевые эмболы, которые могут состоять только из опухолевых клеток или же из опухолевых клеток в сочетании с тромбоцитами и лимфоцитами. Фибриновое покрытие таких эмболов может защищать опухолевые клетки от элиминации клетками иммунной системы и действия неспецифических факторов защиты. Предпринимаются попытки использовать молекулы внеклеточного матрикса в противоопухолевой терапии. В частности, существуют данные, указывающие, что олигомеры гиалуроновой кислоты посредством связывания с CD44 индуцируют активацию внутриклеточных механизмов передачи сигнала, в конечном итоге приводя к индукции апоптоза опухолевых клеток [30]. В качестве другой мишени для противоопухолевой терапии, в том числе метастазирующей меланомы кожи, рассматривается α5 β1 интегрин, который связывается с фибронектином, экспрессируемым на эндотелиальных клетках. Таким образом, предполагается, что антитела к α5 β1 интегрину могут служить ингибиторами неоангиогенеза, необходимого для прогрессирования опухоли.
Заключение
Развитие многих заболеваний кожи связано с изменениями межклеточного матрикса, заключающимися в его аномальном синтезе или распаде. Это может проявляться накоплением его компонентов в дерме, а также множественными морфофункциональными изменениями. Внеклеточный матрикс является динамичной средой для существования и передвижения клеток. Функциональная роль внеклеточного матрикса выходит далеко за рамки только осуществления механической поддержки ткани. Является доказанной роль межклеточного матрикса в создании «ниш» для стволовых клеток, передаче сигнала, а также в развитии злокачественных новообразований и ряда заболеваний соединительной ткани. Лечение последних с воздействием на компоненты внеклеточного матрикса на сегодняшний день представляет большую проблему в условиях отсутствия адекватной терапии генных заболеваний, а также из-за проблем с использованием стволовых клеток. Однако регуляция функциональной активности некоторых молекул внеклеточного матрикса, например, посредством влияния на ростовые факторы, может иметь прикладной характер и быть эффективным направлением терапии заболеваний, ассоциированных с патологией внеклеточного матрикса.
Литература
1. Watt F.M., Fujiwara H. Cell-extracellular matrix interactions in normal and diseased skin. Cold Spring Harb Perspect Biol 2011; 3 (4): a005124.
2. Faller D.M., Shilds D. Molekuljarnaja biologijakletki. Rukovodstvo dlja vrachej. M: BINOM-Press; 2003; 272 str. [Фаллер Д.М., Шилдс Д. Молекулярная биология клетки. Руководство для врачей. М: БИНОМ-Пресс 2003; 272.]
3. Järveläinen H., Sainio A., Koulu M. et al. Extracellular matrix molecules: potential targets in pharmacotherapy. Pharmacol Rev 2009; 61 (2): 198—223.
4. Pataridis S., Eckhardt A., Mikulikova K. et al. Identification of collagen types in tissues using HPLC-MS/MS. J Sep Sci 2008; 31: 3483—3488.
5. Sorrell J.M., Caplan A.I. Fibroblast heterogeneity: more than skin deep. J Cell Sci 2004; 117: 667—675.
6. Singer A.J., Clark R.A.N. Cutaneous wound healing. N Engl J Med 1999; 341: 738—746.
7. Stupack D.G., Cheresh D.A. Get a ligand, get a life: integrins, signaling and cell survival. J Cell Sci 2002; 115 (Pt 19): 3729—3738.
8. Chen T.T., Luque A., Lee S. et al. Anchorage of VEGF to the extracellular matrix conveys differential signaling responses to endothelial cells. J Cell Biol 2010; 188: 595—609.
9. Poltorak Z., Cohen T., Sivan R. et al. VEGF145, a secreted vascular endothelial growth factor isoform that binds to extracellular matrix.J Biol Chem 1997; 272: 7151—7158.
10. Röck K., Fischer J.W. Role of the extracellular matrix in extrinsicskin aging. Hautarzt 2011; 62 (8): 591—597.
11. Lever’s Histopathology of the skin. Ed.D.Elder.-9th Ed.- Philadelphia, 2005: 597—600.
12. Fisher G.J., Kang S., Varani J. et al. Mechanisms of photoaging and chronologicalskin aging. Arch Dermatol Res 2002; 138: 1462—1470.
13. Muto J., Kuroda K., Wachi H. et al. Accumulation of elafin in actinic elastosis of sun-damaged skin: elafin binds to elastin and prevents electrolytic degradation. J Invest Dermatol 2007; 127 (6): 1286—1287.
14. Scadden D.T. The stem-cell niche as an entity of action. Nature 2006; 441: 1075—1079.
15. Sottile J., Hocking D.C. Fibronectin polymerization regulates the composition and stability of extracellular matrix fibrils and cell-matrix adhesions. Mol Biol Cell 2002; 13: 3546—3559.
16. Hodde P., Johnson C.E. Extracellular matrixasastrategy for treating chronic wounds. Am J Clin Dermatol 2007; 8 (2): 61—66.
17. Brown M.B., Jones S.A. Hyaluronic acid: a unique topical vehicle for the localized delivery of drugs to the skin. J Eur Acad Dermatol Venereol 2005; 19: 308—318.
18. Sephel G.C., Kennedy R., Kudravi S. Expression of capillary basement membrane components during sequential phases of wound angiogenesis. Matrix Biol 1996; 15 (4): 263—279.
19. Hodde J. P., Johnson C.E. Extracellular matrix as a strategy for treating chronic wounds. Am J Clin Dermatol 2007; 8 (2): 61—66.
20. Vande Berg J.S., Robson M.C. Arresting cell cycles and the effect on wound healing. Surg Clin North Am 2003; 83 (3): 509—520.
21. Satish L., Kathju S. Cellular and molecular characteristics of scarless versus fibrotic wound healing. Dermatol Res Pract 2010; 14: 1—11.
22. Page-McCaw A.P., Ewald A.J., Werb Z. Matrix metalloproteinases and the regulation of tissue remodeling. Nat Rev Mol Cell Biol 2007; 8: 221—233.
23. Fertin C. Nicolas JF., Gillery P. et al. IL-4 stimulate collagen synthesis by normaland sclerodermafibroblastsin dermal equivalents. Cell Mol Biol 1991; 37: 823—829.
24. Badea I., Taylor B.M, Rosenberg A. Foldvari M. Pathogenesis and therapeutic approaches for improved topical treatment in localized scleroderma and systemic sclerosis. Rheumatology (Oxford) 2009; 48: 213—221
25. Amital E., Rewald Y., Levy Y. et al. Fibrosis regression induced by intravenous gammaglobin treatment. Ann Rheum Dis 2003; 62: 175—177
26. Yokozeki H., Takagawa S, Yamamoto T. et al. Hepatocyte growth factor both prevents and ameliorates the symptoms of dermal sclerosis in a mouse model of scleroderma. Gene Ther 2004; 11 (2): 170—180.
27. Bravo J.F. Síndrome de Ehlers-Danlos tipo III, llamado también Síndrome de Hiperlaxitud Articular (SHA): Epidemiología y manifestaciones clínicas. Rev Chil Reumatol 2010; 26 (2): 194—202.
28. Keane M., Pyeritz R. Medical management of Marfan syndrome. Curr Probl Cardiol 1982; 7: 1—48.
29. Lyubeznova O.N., Bondarenko A.L. Lyme borreliosis: expectations and prognosis. Palliative Medicine and Rehabilitation 2012; 4: 47—50. [Любезнова О.Н., Бондаренко А.Л. Лайм-боррелиоз: ожидания и прогнозы. Паллиативная медицина и реабилитация 2012; 4: 47—50.]
30. Antunes S.L. Gallo M.E. Dermal extracellular matrix in cutaneous leprosy lessions. Int J Lepr Other Mycobact Dis 1999; 67 (1): 24—35.
31. Salgame P. MMPs in tuberculosis: granuloma creators and tissue destroyers. J Clin Invest 2011; 121(5): 1686—1688.
32. Klishko E.V., Kondakova I.V., Choynzonov E.L. Matriksnye metalloproteinazy v onkogeneze. Siberian Journal of Oncology 2003; (2): 62—70. [Клишко Е.В., Кондакова И.В., Чойнзонов Е.Л. Матриксные металлопротеиназы в онкогенезе. Сибирский онкологический журнал 2003; (2): 62—70.]
33. Cockett M.I., Murphy G., Birch M.L. at al. Matrix metalloproteinases and metastic cancer. Biochem Soc Symp 1998; 63: 295—313.
34. Rundhaug J.E. Matrix metalloproteinases and angiogenesis. J Cell Mol Med 2005; 9: 267—285.
35. Johansson N., Ahonen M., Kähäri V. Matrix metalloproteinasesin tumor invasion. Cell Mol Life Sci 2000; 57: 5—15.
36. Kalluri R. Basement membranes: Structure, assembly and role in tumor angiogenesis. Nat Rev Cancer 2003; 3: 422—433.
37. Folkman J. Angiogenesis and apoptosis. Semin Cancer Biol 2003; 13: 159— 167.
Авторы
Т.Г. Рукша, М.Б. Аксененко, Г.М. Климина, Л.В. Новикова