Мдлп что это расшифровка
МДЛП: для кого и зачем?
МДЛП: для кого и зачем?
Закон о маркировке движения лекарственных препаратов (МДЛП) вступает в силу с 01.01.2020. В данной статье мы рассмотрим, в каких программах 1С будет поддерживаться МДЛП и для кого этот сервис предназначен.
Приложение (МДЛП) предусмотрено для учреждений с медицинским направлением деятельности, которые ведут свой учёт в программах 1С, отличных от 1С:Медицина. Больничная аптека. Стоит обратить внимание, что оно не предназначается для ведения количественного и суммового учёта лекарственных средств на складах медицинской организации.
Новое приложение будет актуально для:
В рамках закона предполагается маркировать лекарственные препараты с помощью двухмерного штрих-кода (Data Matrix Code), содержащего данные о производителе, импортёре, дате выпуска и дающего возможность отследить путь от производителя до розничного покупателя. Данные сведения будут отражаться в системе (ИС МДЛП), разработанной ФНС. В конце 2018 года проект по маркировке лекарственных препаратов перешёл от ФНС к основному оператору маркировки – Центру развития перспективных технологий (Честный знак).
Что необходимо делать аптекам и медицинским учреждениям:
С помощью специального мобильного приложения каждый житель страны сможет получить информацию о легальности купленного им препарата и всю информацию по нему.
Рассмотрим на примере несколько форм созданий уведомлений в сервисе МДЛП.
Перед обменом с ИС МДЛП организация должна обсудить с поставщиками лекарственных средств, какая схема акцептования будет использоваться при обмене данными с ИС МДЛП: прямая или обратная.
Прямая схема работает следующим образом: поставщик передаёт сведения об отгруженных лекарственных препаратах для организации (покупателя). А она, в свою очередь, получая данные по отгруженным товарам из ИС МДЛП, подтверждает их или отказывается от приёма.
Обратная схема акцептования реализована так: организация отправляет уведомления о приёмке лекарственных средств в ИС МДЛП. А поставщик, получая данные о принятых товарах, либо подтверждает, либо отказывается от подтверждения этих данных.
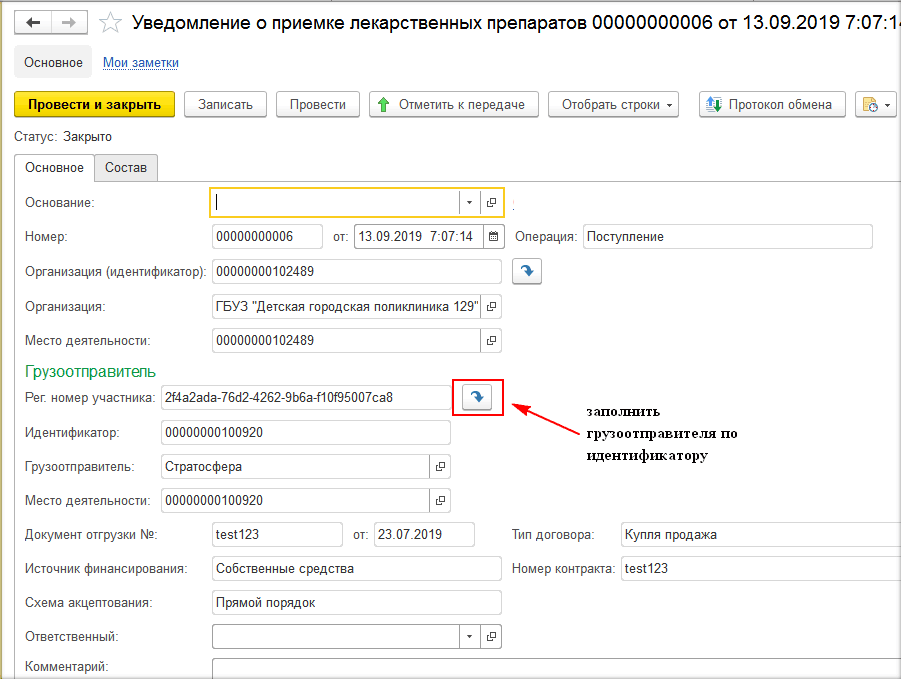
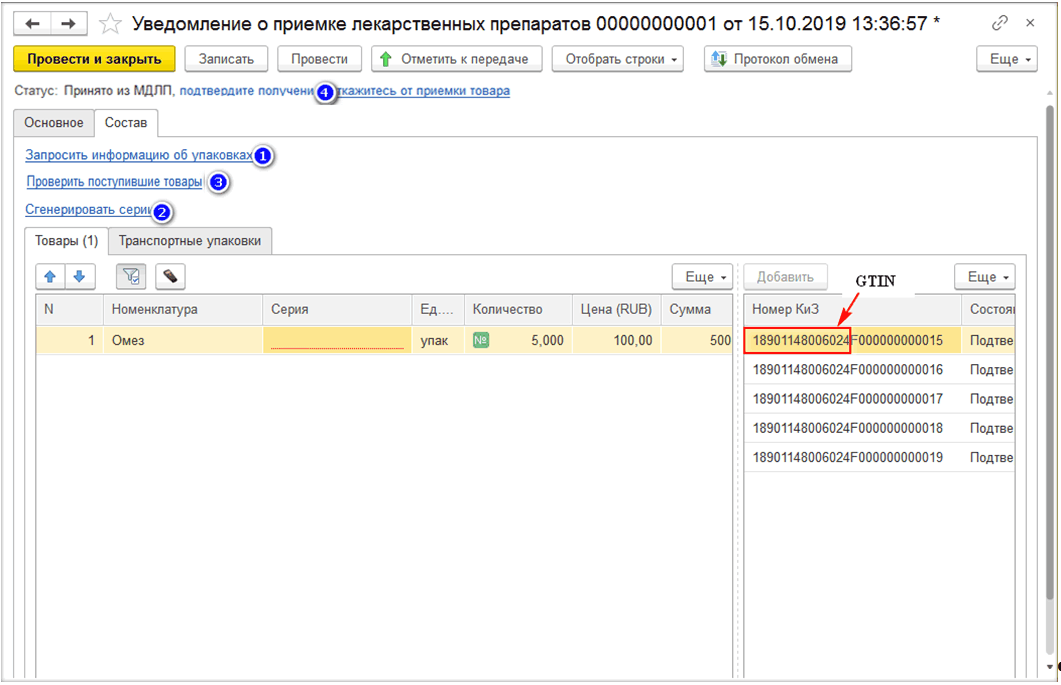
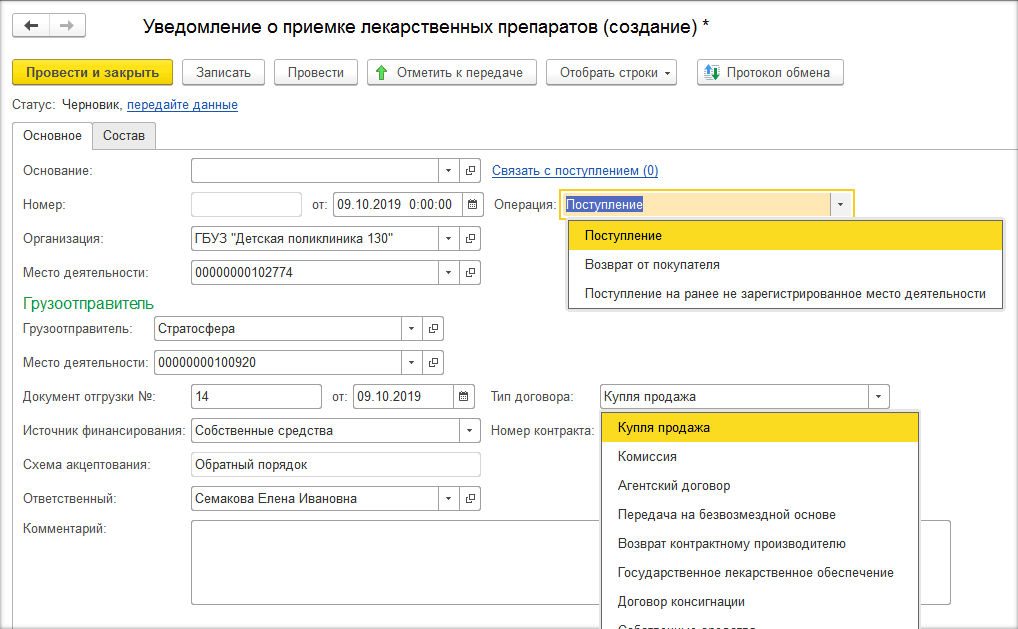
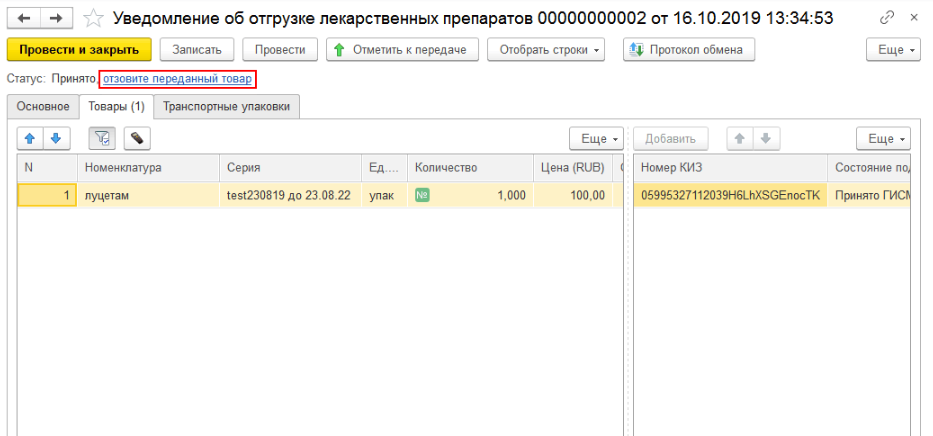
В программе при прямом порядке организация получает уведомление от ИС МДЛП, а при обратном – создаёт уведомление сама по кнопке «Создать» на рабочем месте МДЛП (рис. 1, 2, 3).
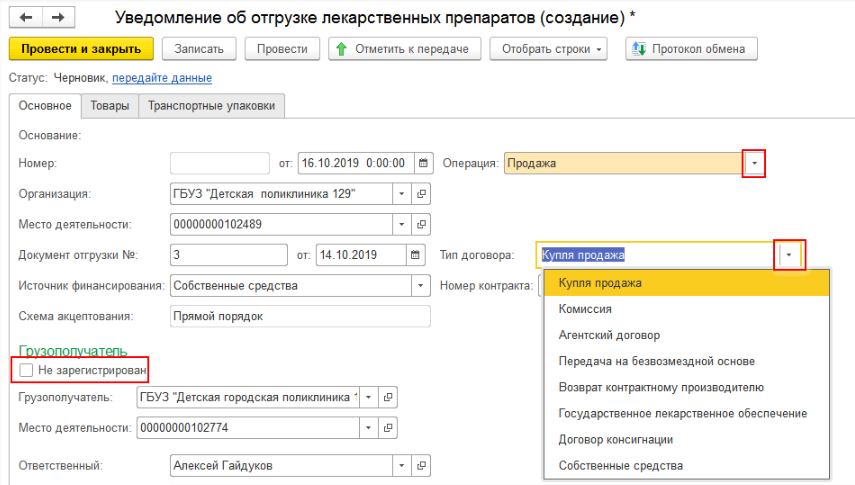
При отгрузке лекарственных средств (при создании уведомления об отгрузке товаров) необходимо на закладке «Основное» заполнить данные отправителя и получателя. Если товар передаётся контрагенту, который не зарегистрирован в системе МДЛП, то необходимо поставить необходимую галочку и выбрать необходимую информацию во вкладках «Операция» и «Тип договора» (рис. 4, 5).
На вкладке «Товары» необходимо просканировать отгружаемые упаковки, либо загрузить номера КиЗ из ТСД, либо ввести вручную по кнопке «Добавить» и передать данные в ИС МДЛП. После произведённого обмена с системой до подтверждения получателем информации об отгрузке можно отозвать переданные товары. Если отгружается транспортная упаковка, то её код вносится на закладке «Транспортные упаковки».
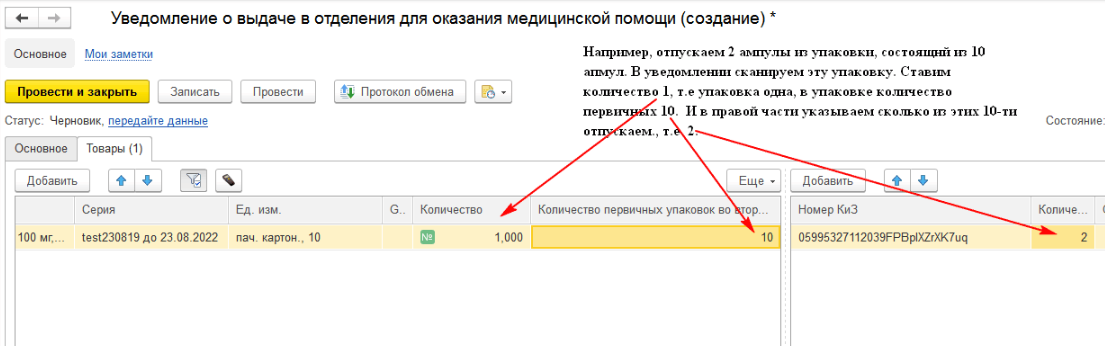
Для того, чтобы лекарственные препараты могли быть перемещены в отделение организации, необходимо создать уведомление о выдаче в отделение для оказания медицинской помощи. На закладке «Основное» заполняем все необходимые сведения. Если в 1С подключён регистратор выбытия, то необходимо поставить галочку «Использовать РВ». Уведомления о выдаче для оказания медицинской помощи будут передаваться в ИС МДЛП через РВ.
На закладке «Товары» вносим информацию о штрих-коде. Отсканировать или загрузить его в данном уведомлении нет возможности, добавляем штрих-код вручную. Также есть возможность указать количество израсходованных лекарственных средств (если была потрачена не вся упаковка) – рис. 6.
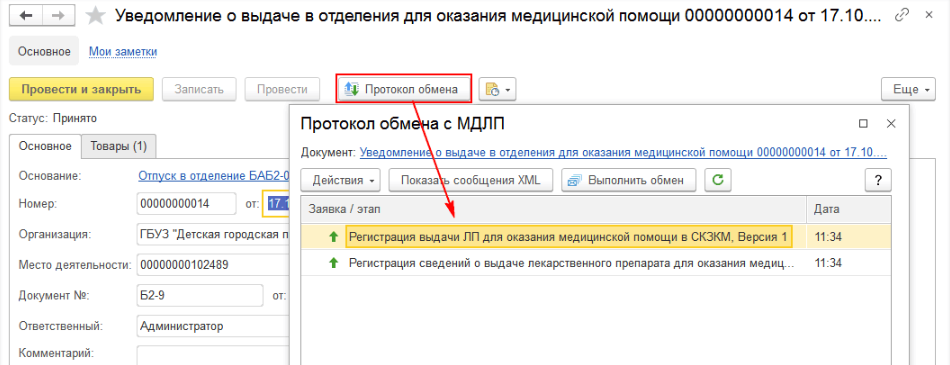
После успешной отправки уведомления можно просмотреть «Протокол уведомлений» (рис. 7).
В данной статье мы ответили на основные вопросы, с которыми может столкнуться пользователь на начальном этапе работы с сервисом МДЛП. Если у вас возникнут сложности с настройкой сервиса, то вы можете обратиться к нашим специалистам, которые выполнят настройки программы 1С с учётом ваших пожеланий. Настройка программ 1С доступна в рамках тарифов сопровождения 1С и как отдельная услуга.
Мониторинг движения лекарственных препаратов (МДЛП)
С 1 июля 2020 года маркировка лекарств станет обязательной, мы расскажем, что такое система МДЛП и как она работает.
Единый комплекс мер по учету служит для защиты покупателей от контрафактных медицинских препаратов и обеспечивает возможность для физических лиц и организаций оперативно верифицировать лекарственное средство.
Кроме того, система отслеживает и собирает подробную информацию о пути следования товара, а также сведения, которые впоследствии могут запретить его дальнейшее обращение (в случае, если поступили данные о том, что товар был реализован или изъят из оборота по другим основаниям).
Основная задача ‒ исключить из оборота контрафактные препараты.
Цели внедрения маркировки и системы МДЛП?
Для государственных органов:
Кому в обязательном порядке необходимо работать в МДЛП?
Штрафы за нарушения фиксации данных в систему МДЛП
Статья 6.34. КоАП РФ «Несвоевременное внесение данных в систему мониторинга движения лекарственных препаратов для медицинского применения либо внесение в нее недостоверных данных».
Нарушение этой статьи влечет за собой административный штраф для должностных лиц в размере от 5 до 10 тысяч рублей; для юридических лиц размер штрафа составляет от 50 до 100 тысяч рублей. Граждане, занимающиеся предпринимательской деятельностью без учреждения юридического лица, в случае нарушения положений кодекса об административных правонарушениях, будут нести такую же ответственность, как и юридические лица.
1 июля 2020 года заканчивается действие упрощенного режима. Необходимо уделить внимание этому вопросу как можно быстрее.
Мдлп что это расшифровка
Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу выдаются удостоверения установленного образца.
Программа разработана совместно с АО «Сбербанк-АСТ». Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.

Приказ Министерства здравоохранения РФ от 30 ноября 2015 г. N 866 «Об утверждении Концепции создания Федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки»
Во исполнение пункта 5 перечня поручений Президента Российской Федерации от 20 февраля 2015 г. N Пр-285 по итогам совещания с членами Правительства Российской Федерации 4 февраля 2015 г. приказываю:
Утвердить прилагаемую Концепцию создания Федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки.
| Министр | В.И. Скворцова |
Концепция
создания Федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки
(ФГИС МДЛП)
(утв. приказом Министерства здравоохранения РФ от 30 ноября 2015 г. N 866)
1. Общие сведения
1.1. Наименование системы
1.2. Обоснование разработки ФГИС МДЛП
Пункт 5 Поручения Президента Российской Федерации Пр-285 от 20 февраля 2015 г.: «Министерству здравоохранения Российской Федерации обеспечить разработку и поэтапное внедрение автоматизированной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки (кодификации) и идентификации упаковок лекарственных препаратов в целях обеспечения эффективного контроля качества лекарственных препаратов, находящихся в обращении, и борьбы с их фальсификацией».
1.3. Нормативно-правовое обеспечение ФГИС МДЛП
Решение Комиссии Таможенного союза от 16 августа 2011 г. N 769 «О принятии технического регламента Таможенного союза «О безопасности упаковки».
от 26 декабря 2008 г. N 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»;
от 6 апреля 2011 г. N 63-ФЗ «Об электронной подписи».
Постановления Правительства Российской Федерации:
от 6 июля 2012 г. N 686 «Об утверждении Положения о лицензировании производства лекарственных средств»;
от 3 сентября 2010 г. N 674 «Об утверждении Правил уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств»;
от 15 октября 2012 г. N 1043 «Об утверждении Положения о федеральном государственном надзоре в сфере обращения лекарственных средств»;
от 22 декабря 2011 г. N 1081 «О лицензировании фармацевтической деятельности».
Приказ Министерства здравоохранения Российской Федерации от 13 февраля 2013 г. N 66 «Об утверждении Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года и плана ее реализации».
Приказы Министерства здравоохранения и социального развития Российской Федерации:
от 29 сентября 2011 г. N 1090н «Об утверждении Административного регламента Федеральной службы по надзору в сфере здравоохранения и социального развития по исполнению государственной функции по контролю за уничтожением лекарственных средств» (зарегистрировано в Минюсте России 18 января 2012 г. N 22945);
от 26 августа 2010 г. N 757н «Об утверждении порядка осуществления мониторинга безопасности лекарственных препаратов для медицинского применения, регистрации побочных действий, серьезных нежелательных реакций, непредвиденных нежелательных реакций при применении лекарственных препаратов для медицинского применения» (зарегистрировано в Минюсте России 31 августа 2010 г. N 18324).
Приказ Федеральной службы по надзору в сфере здравоохранения от 7 августа 2015 г. N 5539 «Об утверждении Порядка осуществления выборочного контроля качества лекарственных средств для медицинского применения» (зарегистрировано в Минюсте России 9 октября 2015 г. N 39263).
Приказ Министерства промышленности и торговли Российской Федерации от 4 октября 2013 г. N 1607 «Об утверждении Административного регламента исполнения Министерством промышленности и торговли Российской Федерации государственной функции по осуществлению лицензионного контроля деятельности по производству лекарственных средств для медицинского применения» (Зарегистрировано в Минюсте России 3 марта 2014 г. N 31483).
2. Перечень употребляемых сокращений, терминов и определений
2.1. Перечень употребляемых сокращений
| ФГИС МДЛП | Федеральная государственная информационная система мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки |
|---|---|
| ГК | Групповой код транспортной тары лекарственного препарата |
| ЕСИА | Единая система идентификации и аутентификации |
| ЖНВЛП | Жизненно необходимые и важнейшие лекарственные препараты |
| ИК | Индивидуальный код упаковки лекарственного препарата |
| ИС | Информационная система |
| ЛП | Лекарственный препарат |
| МНН | Международное непатентованное наименование лекарственного средства |
| ЛС | Лекарственное средство |
| СМЭВ | Система межведомственного электронного взаимодействия |
| ЭП | Электронная подпись |
| ГРЛС | Государственный реестр лекарственных средств |
| НСИ | Нормативно-справочная информация |
| ЕСНСИ | Единая система нормативно-справочной информации |
| АРМ | Автоматизированное рабочее место |
2.2. Перечень употребляемых терминов и определений
3. Назначение и цели создания ФГИС МДЛП
3.1. Цель создания ФГИС МДЛП
3.2. Назначение ФГИС МДЛП
ФГИС МДЛП предназначена для организации непрерывного мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием индивидуальной и групповой кодированной маркировки (сериализация и агрегация) и идентификации упаковок лекарственных препаратов в целях обеспечения эффективного контроля качества лекарственных препаратов, находящихся в обращении, и борьбы с их фальсификацией.
Основными задачами, решаемыми с использованием ФГИС МДЛП, являются:
— Повышение лекарственной безопасности населения Российской Федерации.
— Снижение угрозы жизни и здоровью населения Российской Федерации, вызываемой поступлением в оборот фальсифицированных, контрафактных и недоброкачественных лекарственных препаратов.
— Формирование системы отслеживания лекарственных препаратов на всех этапах движения от производителя до конечного потребителя и создание механизмов постоянного оперативного мониторинга рынка лекарственных препаратов и его отдельных сегментов (объем, продажи, запасы и т.д.)
— Мониторинг наличия и движения товарных запасов ЛП в медицинских организациях, в том числе закупаемых за счет федерального бюджета Российской Федерации.
— Информационная поддержка органов исполнительной власти Российской Федерации в их деятельности по противодействию обращения фальсифицированных, незарегистрированных, недоброкачественных ЛП.
— Привлечение населения Российской Федерации к противодействию обороту фальсифицированных, незарегистрированных, недоброкачественных ЛП.
— Повышение эффективности федерального государственного надзора в сфере обращения лекарственных средств.
ФГИС МДЛП должна обеспечивать выполнение следующих функций:
— Мониторинг сроков годности ЛП, находящихся в обращении.
— Мониторинг изъятия из обращения недоброкачественных, фальсифицированных и незарегистрированных ЛП.
— Блокирование процесса обращения фальсифицированных, незарегистрированных, и недоброкачественных ЛП, в отношении которых уполномоченным федеральным органом исполнительной власти принято решение о приостановке обращения, либо подлежащих изъятию из оборота и уничтожению.
— Мониторинг процесса уничтожения ЛП, с целью предотвращения поступления в обращение ЛП, подлежащих уничтожению.
— Предоставление возможности участникам Системы получения различных отчетов и аналитических срезов в рамках своих полномочий.
4. Характеристика объекта автоматизации
4.1. Описание основных участников информационного взаимодействия и их функции
Участниками информационного взаимодействия в рамках ФГИС МДЛП являются:
1. Министерство здравоохранения Российской Федерации.
2. Производители ЛП.
4. Организации розничной торговли лекарственными препаратами на территории Российской Федерации/Аптечные организации.
5. Организации, осуществляющие уничтожение ЛП.
6. Медицинские организации.
7. Потребители ЛП (Пациенты).
8. Федеральная служба по надзору в сфере здравоохранения.
9. Министерство промышленности и торговли Российской Федерации.
4.2. Организационная диаграмма информационного взаимодействия участников Системы
4.3. Основные функции участников информационного взаимодействия в рамках функционирования Системы
5. Требования к ФГИС МДЛП
5.1. Требования к системе в целом
ФГИС МДЛП должна обеспечивать реализацию двух основных сценариев функционирования:
— Мониторинг движения ЛП, произведенных на территории Российской Федерации и ввезенных в Российскую Федерацию, в целях осуществления гражданского оборота.
— Мониторинг уничтожения ЛП.
5.1.1. Требования к структуре и функционированию системы
В рамках создания ФГИС МДЛП следует различать функциональные и инфраструктурные подсистемы.
К функциональным подсистемам относятся:
1. Подсистема предоставления информации. Портал ФГИС МДЛП.
2. Платформа мобильного приложения.
3. Подсистема регистрации выпуска ЛП, формирования ИК и ГК.
4. Подсистема управления обращения ЛП.
5. Подсистема регистрации обращений потребителей.
6. Подсистема планирования государственных закупок ЖНВЛП.
7. Подсистема управления НСИ.
8. Подсистема обработки информации и построения отчетности.
9. Подсистема обеспечения информационного взаимодействия с внешними ИС.
10. Подсистема администрирования.
11. Подсистема информационной безопасности.
К инфраструктурным подсистемам относятся:
1. Подсистема инфраструктурного обеспечения.
2. Подсистема мониторинга и управления Информационной инфраструктурой.
3. Комплекс технических средств.
4. Удостоверяющий центр.
При неустойчивом интернет-соединении ФГИС МДЛП должна обеспечивать сбор, обработку, хранение и передачу данных в отложенном (offline) режиме в соответствии с регламентом.
5.1.2. Функциональная схема ФГИС МДЛП
5.1.3. Перечень основных сервисов, предоставляемых ФГИС МДЛС
Информационный обмен между компонентами ФГИС МДЛП осуществляется посредством стандартных протоколов и интерфейсов электронного взаимодействия. Управление компонентами ФГИС МДЛП осуществляется с использованием специализированных АРМ управления.
ФГИС МДЛП должна обеспечивать предоставление информации, аккумулированной в ней. Объем предоставляемой информации (включая открытые источники) регулируется соответствующим уровнем полномочий и прав доступа к ФГИС МДЛП.
5.2. Организация информационного взаимодействия с внешними информационными системами
В состав внешних систем, осуществляющих информационное взаимодействие с компонентами ФГИС МДЛП, входят:
— информационные системы федеральных органов исполнительной власти Российской Федерации;
— информационные системы производителей ЛП;
— информационные системы организаций, осуществляющих оптовую торговлю ЛП;
— информационные системы аптечных организаций;
— информационные системы медицинских организаций;
— информационные системы организаций, осуществляющих уничтожение ЛП.
5.2.1. Взаимодействие с информационными системами федеральных органов исполнительной власти Российской Федерации (с использованием СМЭВ):
Выгрузка из ФГИС МДЛП актуальной информации о текущем состоянии ЛП (произведен, перемещен на склад оптовой организации, отпущен потребителю, уничтожен, изъят из оборота и др.).
Выгрузка из ФГИС МДЛП детальной информации о движении партий ЛП.
— Товарные остатки ЛП.
Выгрузка из ФГИС МДЛП сведений по товарным остаткам ЛП на дату в соответствии с запрашиваемыми условиями поиска.
Выгрузка из ФГИС МДЛП соответствующих зарегистрированных обращений Потребителей ЛП, а также загрузка в ФГИС МДЛП статусов обработки обращений сотрудниками органов государственной власти.
5.2.2. Взаимодействие с информационными системами Производителей лекарственных препаратов:
— Индивидуальные и групповые коды на упаковки и транспортную упаковку ЛП.
Загрузка в ФГИС МДЛП сведений о произведенных сериях ЛП (сообщение о регистрации ИК и ГК).
— Движение лекарственных препаратов.
Загрузка в ФГИС МДЛП информации об отгрузках, списаниях, возвратах произведенных лекарственных препаратов.
— Статус состояния ЛП по ИК и ГК.
Получение из ФГИС МДЛП актуальной информации о текущем состоянии и местонахождении индивидуальных упаковок ЛП.
5.2.3. Взаимодействие с информационными системами Организаций, осуществляющих импорт лекарственных препаратов:
— ГК на транспортную упаковку ЛП.
Загрузка в ФГИС МДЛП сведений о сформированных ГК (регистрация ГК).
Загрузка в ФГИС МДЛП информации о поступлении, отгрузке, возврате, списании и передачи на уничтожение партий ЛП.
— Статус состояния ЛП по ИК и ГК.
Выгрузка из ФГИС МДЛП актуальной информации о ЛП, в том числе изъятых из оборота.
5.2.4. Взаимодействие с информационными системами Организаций, осуществляющих оптовую торговлю лекарственными препаратами:
— Групповые коды на транспортную упаковку ЛП.
Загрузка в ФГИС МДЛП сведений о сформированных ГК (регистрация ГК).
Выгрузка из ФГИС МДЛП актуальной информации о ЛП, в том числе изъятых из оборота.
— Загрузка в ФГИС МДЛП информации о поступлении, отгрузке, возврате, списании и передаче на уничтожение партий лекарственных препаратов.
5.2.5. Взаимодействие с информационными системами Аптечных организаций:
— ГК на транспортную упаковку ЛП.
Загрузка в ФГИС МДЛП сведений о сформированных ГК (регистрация ГК).
Выгрузка из ФГИС МДЛП актуальной информации о ЛП, в том числе изъятых из оборота.
Загрузка в ФГИС МДЛП информации о поступлении, отгрузке, возврате, списании и передаче на уничтожение партий лекарственных препаратов.
5.2.6. Взаимодействие с внешними информационными системами Медицинских организаций:
Выгрузка из ФГИС МДЛП актуальной информации о ЛП, в том числе изъятых из обращения.
— Движение лекарственных препаратов.
Загрузка в ФГИС МДЛП информации о поступлении, отгрузке, возврате, списании и передачи на уничтожение партий ЛП.
5.2.7. Взаимодействие с информационными системами Организаций, осуществляющих уничтожение лекарственных препаратов:
Загрузка из ФГИС МДЛП актуальной информации по аннулированным ИК и ГК уничтоженных ЛП.
Загрузка в ФГИС МДЛП информации о поступлении и уничтожении партий ЛП.
5.3. Требования к индивидуальной и групповой маркировке упаковок и товарной тары ЛП
Техническую основу автоматизированных систем мониторинга движения ЛП составляет нанесение на первичную (при отсутствии вторичной упаковки), вторичную (потребительскую) упаковку и транспортную тару ЛП специальной маркировки*, позволяющей в автоматическом режиме с помощью технических средств отслеживать движение ЛП по товаропроводящей цепочке вплоть до конечного потребителя.
Требования к индивидуальной и групповой маркировке определяются Правительством Российской Федерации. Способ нанесения маркировки на упаковку (включая защиту от вскрытия упаковки) и товарную тару ЛП определяются субъектами обращения ЛП в соответствии с установленными Правительством Российской Федерации требованиями.
6. Этапы реализации настоящей Концепции
Реализация настоящей Концепции будет проходить в несколько этапов.
На первом этапе (до 15 декабря 2015 года) предполагается согласовать Концепцию создания ФГИС МДЛП, определить объем, источники и порядок финансирования, принять дорожную карту («план мероприятий») по созданию и вводу в эксплуатацию Системы.
На втором этапе разработать и согласовать технический проект по созданию Системы. Кроме того, предполагается разработать, внести изменения и затем в соответствии с установленным порядком принять законодательные и иные нормативные правовые акты Российской Федерации, направленные на достижение целей и выполнение задач ФГИС МДЛП, в том числе:
— Федеральный закон «О внесении изменений в отдельные законодательные акты Российской Федерации». Целью данного нормативного правового акта является внесение соответствующих изменений в Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств» и в Кодекс Российской Федерации об административных правонарушениях;
— постановление Правительства Российской Федерации «Об утверждении порядка и объема маркировки лекарственных препаратов для медицинского применения». Целью данного нормативного правового акта является утверждение порядка нанесения маркировки на упаковку лекарственных препаратов для медицинского применения, а также содержание такой маркировки;
— постановление Правительства Российской Федерации «Об утверждении Порядка внесения данных в федеральную государственную информационную систему мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки и получения доступа к ним». Целью данного нормативного правового акта является утверждение порядка внесения юридическими лицами и индивидуальными предпринимателями, осуществляющими производство, изготовление, хранение, перевозку, ввоз в Российскую Федерацию, вывоз из Российской Федерации, отпуск, реализацию, передачу, применение и уничтожение лекарственных препаратов для медицинского применения, данные в федеральную государственную информационную систему мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки;
— постановление Правительства Российской Федерации «О внесении изменений в Положение о лицензировании фармацевтической деятельности утвержденное постановлением Правительства Российской Федерации N 1081 от 22 декабря 2011 г.» Целью данного нормативного правового акта является дополнение обязательных лицензионных требований наличием доступа к системе Интернет и в ФГИС МДЛС).
На третьем этапе (до 31 октября 2016 года) предполагается разработать минимально необходимый функционал ФГИС МДЛП и осуществить пилотное внедрение ФГИС МДЛП. Границы пилота:
— Участники пилотного взаимодействия:
— Министерство здравоохранения Российской Федерации.
— Производители ЛП: не менее, чем по 1 (одному) производителю ЛП, зарегистрированному на территории Российской Федерации и на территории третьих стран.
— Функционал ФГИС МДЛП в рамках пилота:
— Кодирование и маркировка ИК и ГК ЛП (кодификация и сериализация).
— Учет движения ЛП (с учетом агрегации) между участниками проекта.
— Проверка статусов ЛП по ИК и ГК.
— Регистрация продаж ЛП.
На четвертом этапе (с 1 января 2017 года) предполагается начать эксплуатацию ФГИС МДЛП для лекарственных препаратов входящих в перечень 7 ВЗН.
— Министерство здравоохранения Российской Федерации.
— Медицинские организации осуществляющей лечение больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, лиц после трансплантации органов и (или) тканей.
— Функционал ФГИС МДЛП:
— Кодирование и маркировка ИК и ГК ЛП (кодификация и сериализация).
— Учет движения ЛП (с учетом агрегации) между участниками проекта.
— Проверка статусов ЛП по ИК и ГК.
— Регистрация продаж ЛП.
На пятом этапе (с 1 января 2018 года) предполагается дополнительно включить в систему мониторинга лекарственные препараты для медицинского применения, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов.
— Министерство здравоохранения Российской Федерации.
— Функционал ФГИС МДЛП:
— Кодирование и маркировка ИК и ГК ЛП (кодификация и сериализация).
— Учет движения ЛП (с учетом агрегации) между участниками проекта.
— Проверка статусов ЛП по ИК и ГК.
— Регистрация продаж ЛП.
На шестом этапе (с 1 января 2019 года) предполагается приступить к полнофункциональной эксплуатации ФГИС МДЛП с поэтапным последовательным внедрением.
На любом этапе реализации концепции Производитель ЛП вправе переходить на использование ИК, ГК в добровольном порядке.
7. Основные критерии эффективности реализации настоящей Концепции
Основными критериями эффективности реализации настоящей Концепции являются:
Степень достижения требуемых результатов внедрения ФГИС МДЛП в отношении:
— субъектов обращения ЛП;
— ЛП подлежащих мониторингу движения.
Отчетные (к установленным срокам и нарастающим итогом) показатели функционирования ФГИС МДЛП по каждому из заданных параметров в соответствии с основными возможностями ФГИС МДЛП.
8. Результаты, ожидаемые от создания ФГИС МДЛП
Создание ФГИС МДЛП должно привести к следующим результатам:
1. Снижение угрозы жизни и здоровью населения Российской Федерации, вызываемой поступлением в оборот фальсифицированных, контрафактных и недоброкачественных ЛП.
2. Формирование системы отслеживания ЛП на всех этапах движения от производителя до конечного потребителя и создание механизмов постоянного оперативного контроля за рынком и его отдельными сегментами (объем, продажи, запасы и т.д.).
3. Создание механизмов мониторинга адресности движения ЛП, информации по местонахождению определенных ЛП.
4. Создание механизмов оперативного регулирования и мониторинга наличия ЛП в медицинских организациях.
5. Создание механизмов оперативного отзыва Росздравнадзором ЛП из обращения на всей территории Российской Федерации.
6. Повышение эффективности федерального государственного надзора в сфере обращения лекарственных средств.
* Тип специальной маркировки должен быть определен на этапе технического проектирования.
Оснащение рабочих мест участников взаимодействия в целях подключения и обеспечения работы с ФГИС МДЛП
1. Производители лекарственных препаратов
Производитель лекарственных препаратов каждую технологическую линию должен обеспечить соответствующим оборудованием для маркировки выпускаемых упаковок ЛП, в связи с чем потребуется приобретение нового или дооснащение существующего оборудования для маркировки упаковок.
В соответствии с функциями, отраженными в настоящей Концепции, Производитель ЛП должен оснастить производственные и рабочие места соответствующим оборудованием:
— оборудованием для формирования и нанесения специальной маркировки;
— устройствами считывания специальной маркировки;
— потоковым сканером (для полностью автоматизированных производственных линий, на которых отсутствует ручной труд при упаковке ЛП);
— терминалом сбора данных (беспроводное устройство для считывания информации со специальной маркировки, зачастую используемое на производственных складах и в местах, удаленных от стационарных рабочих мест);
— каналом связи с устойчивым скоростным подключением к информационно-телекоммуникационной сети «Интернет».
Кроме того, представляется необходимым доработка существующих производственных систем для обеспечения интеграции с ФГИС МДЛП, а также приобретение соответствующих ключей ЭП.
2. Участники, осуществляющие регулирующие и контрольно-надзорные функции (Минздрав России, Росздравнадзор, Минпромторг России)
В соответствии с функциями, отраженными в настоящей Концепции, участники, осуществляющие регулирующие и контрольно-надзорные функции, должны быть оснащены соответствующими персональными компьютерами, иметь ключи ЭП и должны быть подключены по устойчивому скоростному каналу связи к информационно-телекоммуникационной сети «Интернет». При этом специализированные системы данных участников должны быть адаптированы для интеграции с ФГИС МДЛП с использованием СМЭВ.
Кроме того, следует предусмотреть возможность оснащения выездных бригад и сотрудников, осуществляющих проверки на местах отпуска, реализации ЛП, а также при отборе образцов, соответствующими терминалами сбора данных (беспроводными устройствами для считывания специальной маркировки ЛП).
3. Организации оптовой торговли лекарственными препаратами, в том числе Импортер ЛП
Для участников данного типа в целях подключения к ФГИС МДЛП и обеспечения работы предполагается оснащение следующими видами оборудования:
— устройство для формирования и нанесения специальной маркировки;
— устройства считывания специальной маркировки;
— терминал сбора данных;
— каналом связи с устойчивым скоростным подключением к информационно-телекоммуникационной сети «Интернет».
Кроме того, представляется необходимым доработка соответствующих систем управления складом и логистикой, для обеспечения интеграций с ФГИС МДЛП, а также приобретение соответствующих ключей ЭП.
4. Аптечные и медицинские организации
Согласно настоящей Концепции аптечные и медицинские организации в целях подключения и взаимодействия с ФГИС МДЛП должны иметь рабочие места, оснащенные персональными компьютерами, устройствами считывания специальной маркировки, а также иметь ключи ЭП. Для оперативного взаимодействия с ФГИС МДЛП должно быть обеспечено подключение к информационно-телекоммуникационной сети «Интернет». В случае отсутствия такой возможности сбор, обработка, хранение и передача данных осуществляется в отложенном (offline) режиме.
Кроме того, потребуется доработать информационные системы аптечных и медицинских организаций в целях интеграции с ФГИС МДЛП для организации контроля на местах приобретения, получения, отпуска, реализации ЛП.
5. Организации, осуществляющие уничтожение лекарственных препаратов
Организации, осуществляющие уничтожение ЛП, необходимо оснастить персональными компьютерами, ручными сканерами и ключами ЭП. Для оперативного взаимодействия с ФГИС МДЛП должно быть обеспечено подключение к информационно-телекоммуникационной сети «Интернет». В случае отсутствия такой возможности сбор, обработка, хранение и передача данных осуществляется в отложенном (offline) режиме. Если данные участники имеют собственные информационные системы для организации учета поступления и уничтожения ЛП, то потребуется их адаптация для обеспечения взаимодействия с ФГИС МДЛП.
Обзор документа
Разработана концепция создания Федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки (ФГИС МДЛП).
Система создается, чтобы обеспечить гарантированные поставки потребителям качественных, эффективных и безопасных лекарственных препаратов. Она предполагает организацию непрерывного мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием индивидуальной и групповой кодированной маркировки и идентификации упаковок лекарственных препаратов.
ФГИС МДЛП позволит отследить движение конкретного препарата (конкретной серии или упаковки лекарства); обеспечит мониторинг сроков годности лекарственных средств и изъятия из обращения недоброкачественных, фальсифицированных и незарегистрированных препаратов.
Установлены требования к системе. Определены этапы ее создания. К полнофункциональной эксплуатации ФГИС МДЛП с поэтапным последовательным внедрением планируется приступить с 1 января 2019 г.
(1).jpg)
