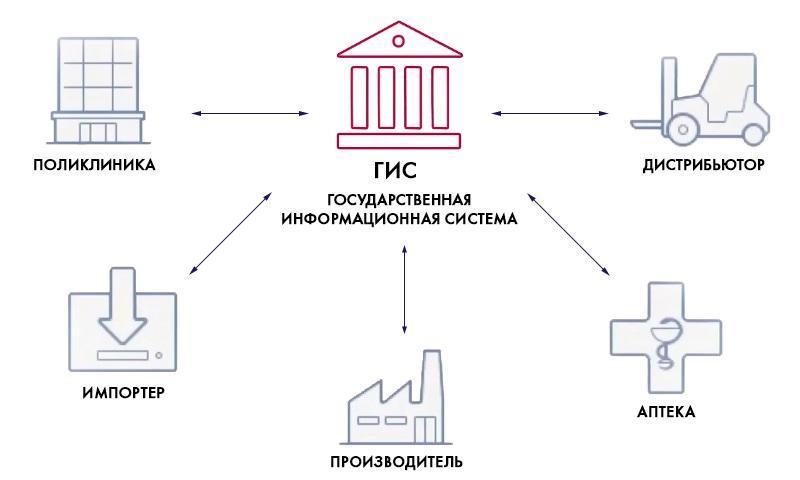
Мдлп лекарственные препараты что это
Что нужно знать о маркировке лекарств
С 1 июля маркировка лекарств станет обязательной. Это повлияет на работу производителей и поставщиков, изменит процессы в розничной продаже и в услугах с применением лекарств. Рассказываем, что важно знать и к чему готовиться.
Почему маркировка лекарств обязательна
Маркировка — эта система прослеживаемости товаров с помощью кодов формата Data Matrix. В разных товарных категориях свои сроки старта обязательной маркировки и свои требования. Для лекарственных препаратов старт — 1 июля 2020 года.
Вот какие нормативные акты регулируют маркировку лекарств:
Регулирует маркировку лекарств Минздрав РФ.
Кто участвует в маркировке лекарств
Организации, в которых лекарства используются для лечения или не продаются по другим причинам, должны использовать регистратор выбытия (РВ). Это устройство для вывода маркированных лекарств из оборота не через онлайн-кассу. РВ бесплатно поставляет ЦРПТ по соответствующему заявлению через сайт Честного ЗНАКа.
Как работает маркировка лекарств
Основа маркировки — передача данных о движении маркируемого товара в систему Честный ЗНАК (ЦРПТ). Для лекарств создана подсистема «Мониторинг движения лекарственных препаратов» (МДЛП).
Маркировка других товарных категорий построена на работе системы электронного документооборота (ЭДО). В маркировке лекарств ЭДО не является обязательным. При этом каждый участник оборота должен самостоятельно сообщать в МДЛП о своих действиях с маркированными лекарствами.
Так, в систему МДЛП должны поступать данные о следующих действиях:
Что нужно для маркировки лекарств
Для работы с маркировкой вам потребуется:
Обязательная маркировка лекарств в 2020 году: руководство для участников оборота
Для маркировки лекарств используется система автоматизированного учёта и мониторинга движения лекарственных препаратов медицинского назначения (МДЛП). Она дополняет государственную регистрацию и экспертизу лекарств, позволяя отслеживать все этапы их оборота — от производителя до конечного потребителя. Основная цель внедрения системы — борьба с контрафактной продукцией.
МДЛП создавалась и развивалась в несколько этапов:
Какие нормативно-правовые акты регулируют маркировку лекарств
Поскольку проект по маркировке лекарственных препаратов реализуется на протяжении уже нескольких лет, нормативная база создавалась постепенно. На сегодняшний день она представлена:
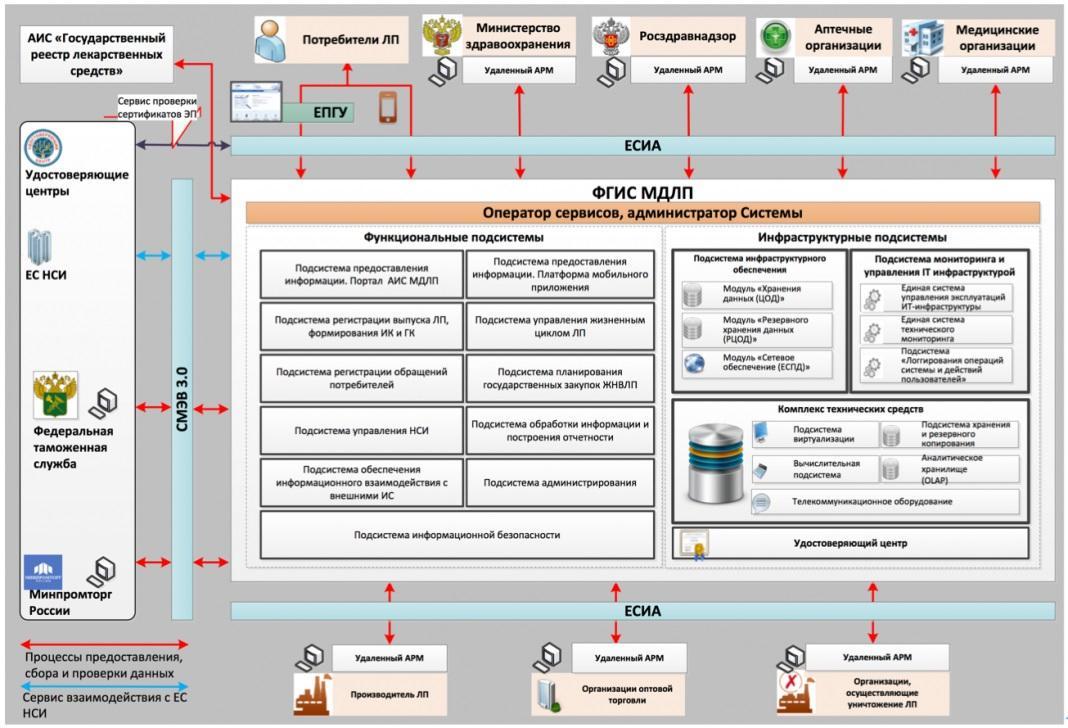
Как работает ФГИС МДЛП
В системе регистрируются участники оборота лекарственных препаратов медицинского назначения:
До 1 июля 2020 года любой из участников рынка мог добровольно зарегистрироваться в системе и принять участие в эксперименте по маркировке. При этом все основные расходы покрывались оператором системы, участники могли постепенно тестировать новые бизнес-процессы и внедрять их в свою деятельность.
С 1 июля 2020 года обязанность по маркировке лекарственных препаратов распространится на все лекарства и всех участников оборота.
Оборот немаркированных лекарств с 1 июля 2020 года будет запрещён, за исключением:
Указанные выше лекарства можно реализовывать, хранить и применять до истечения срока годности.
Для каждого участника в системе МДЛП создаётся свой личный кабинет и предусмотрен свой набор действий по регистрации, направлению сведений в систему и информационному взаимодействию.
Общая схема работы в системе МДЛП:
Каким требованиям должны отвечать участники оборота лекарственных препаратов
Маркировка не отменяет обязанностей участников оборота, связанных с экспертизой и государственной регистрацией лекарственных препаратов, как и в целом требований, предъявляемых к участникам рынка в соответствии с №61-ФЗ «Об обращении лекарственных средств». Однако в связи с внедрением обязательной маркировки появился ряд новых требований — они обеспечивают возможность работы в системе МДЛП и предусматривают:
Производители (фармацевтические компании) должны быть оснащены регистратором эмиссии — промышленным программно-аппаратным комплексом для генерации ключа и проверочного кода, а также хранения кодов маркировки. Для его получения нужно подать заявку Оператору-ЦРПТ. С производителем заключаются договоры по предоставлению регистратора эмиссии и оказанию услуг по предоставлению кодов маркировки.
Медицинские организации и аптеки, осуществляющие бесплатную реализацию маркированных лекарственных препаратов, должны быть оснащены регистраторами выбытия по количеству мест ведения деятельности. Регистратор — это аналог онлайн-кассы, только для фиксации бесплатного отпуска лекарств. Устройства поставляются Оператором-ЦРПТ, который также обеспечивает их обслуживание.
Не требуется оснащать регистратором выбытия:
Аптеки, которые занимаются розничной продажей лекарственных препаратов, могут ограничиться имеющимся оборудованием — онлайн-кассой и присоединённым сканером для считывания кода (2D сканер штрихкода). Если розничной продаже сопутствует выдача лекарств по льготным рецептам, нужно дополнительно оснастить аптеку регистратором выбытия.
Зарегистрированные дистрибьюторы используют имеющиеся программно-технические средства, но их обязательно необходимо интегрировать с системой МДЛП (в составе системы Честный ЗНАК).
Порядок регистрации в системе маркировки лекарств
С 1 июля 2020 года регистрацию должны пройти участники оборота лекарств, которые:
Для каждого из участников оборота (производитель, дистрибьютор, аптека, медучреждение) предусмотрен специфический набор действий по регистрации в системе и внедрению процессов в свою деятельность.
Все участники предварительно должны:
Медицинские организации должны:
Подключаемся к системе мониторинга оборота лекарственных препаратов
Автор: Тарасова Е. А., эксперт журнала
О системе мониторинга движения лекарственных препаратов для медицинского применения и необходимости подключения к ней участников оборота этих препаратов, а также о принимаемых мерах по созданию данной системы мы неоднократно писали на страницах нашего журнала. Теперь пора переходить от теории к практике. И поможет в этом аптекам и аптечным сетям Инструкция по подключению к ИС МДЛП, опубликованная Росздравнадзором в Письме от 20.05.2019 № 01и-1269/19.
Обязанность участия в системе мониторинга.
Юридические лица и ИП, осуществляющие производство, хранение, ввоз в РФ, отпуск, реализацию, передачу, применение и уничтожение лекарственных препаратов для медицинского применения, должны обеспечить внесение информации о лекарственных препаратах для медицинского применения в информационную систему движения мониторинг лекарственных препаратов (ИС МДЛП) с 1 января 2020 года. Напомним: эта обязанность обусловлена положениями Федерального закона от 28.12.2017 № 425-ФЗ[1] и ч. 7 ст. 67 Закона № 61-ФЗ[2].
Организации и ИП, не подключившиеся к ИС МДЛП, с 1 января 2020 года не смогут осуществлять обращение лекарственных препаратов, имеющих маркировку контрольными (идентификационными) знаками DataMatrix.
Порядок внесения информации о лекарственных препаратах в ИС МДЛП субъектами обращения лекарственных средств и ее состав регламентирован Положением о ИС МДЛП (утверждено Постановлением Правительства РФ от 14.12.2018 № 1556)[3]. А инструкция, определяющая порядок действий субъектов обращения лекарственных средств при подключении к ИС МДЛП, приведена в вышеупомянутом Письме Росздравнадзора № 01и-1269/19.
Итак, организации и ИП, имеющие намерение осуществлять оборот лекарственных препаратов для медицинского применения, до 1 января 2020 года обязаны (Письмо Росздравнадзора № 01и-1269/19)[4]:
пройти регистрацию в ИС МДЛП для медицинского применения;
иметь личный кабинет субъекта обращения лекарственных средств с целью внесения информации о лекарственных препаратах в систему мониторинга.
Ответственность субъектов обращения лекарственных средств.
За производство или продажу лекарственных препаратов для медицинского применения без нанесения средств идентификации, с нарушением установленного порядка их нанесения, а также за несвоевременное внесение данных в ИС МДЛП для медицинского применения или внесение в нее недостоверных данных организации и ИП несут ответственность в соответствии с действующим законодательством.
Так, несвоевременное внесение данных в ИС МДЛП для медицинского применения либо внесение в нее недостоверных данных согласно ст. 6.34 КоАП РФ (действует с 1 января 2020 года[5]) влечет штраф:
для должностных лиц – в размере от 5 до 10 тыс. руб.;
для юридических лиц (и ИП) – в размере от 50 до 100 тыс. руб.
Кроме того, согласно ч. 2 ст. 15.12 КоАП РФ продажа товаров и продукции без маркировки и (или) нанесения информации, предусмотренной законодательством РФ, в случае если такая маркировка и (или) нанесение такой информации обязательны, а также хранение, перевозка либо приобретение таких товаров и продукции в целях сбыта, за исключением продукции, указанной в ч. 4 названной статьи, влечет наложение штрафа:
на должностных лиц – в размере от 5 до 10 тыс. руб. с конфискацией предметов административного правонарушения;
на юридических лиц – в размере от 50 до 300 тыс. руб. с конфискацией предметов административного правонарушения.
Алгоритм подключения к ИС МДЛП.
Для начала работы с ИС МДЛП аптекам и аптечным сетям необходимо выполнить следующие действия (причем некоторые из них могут выполняться параллельно – для ускорения процесса подключения к системе).
Этап
Описание
Определите круг лиц (пользователей), которые будут регистрировать те или иные действия с лекарственными препаратами в ИС МДЛП, а также то, как они будут это делать и в какой момент
Справка. Какие именно действия должны регистрироваться в ИС МДЛП, описано в документе «Паспорта процессов». Он размещен в разделе «Маркировка лекарств» на сайте https://честныйзнак.рф в подразделе «Документы», блок «Основные действия участников МДЛП»
Получите для руководителя организации и каждого пользователя усиленную квалифицированную электронную подпись (УКЭП) в аккредитованном Минкомсвязи удостоверяющем центре (УЦ).
При получении УКЭП руководителя необходимо обратить внимание на точное соответствие данных сертификата данным ЕГРЮЛ. В случае их несоответствия доступ в ИС МДЛП с использованием такого сертификата будет невозможен
Справка. Список центров размещен по адресу https://digital.gov.ru/ru/activity/govservices/2
Установите средство криптографической защиты информации (СКЗИ), содержащее криптопровайдер (CSP), с поддержкой ГОСТ Р 34.10-2012** на компьютер, с которого предполагается регистрировать ответственных пользователей, работающих с ИС МДЛП
Справка. Процесс установки СКЗИ и сертификата УКЭП детально описан в «Руководстве пользователя личного кабинета субъекта обращения лекарственных препаратов» в разд. 2.1 «Установка ПО и сертификатов» и приложении Б «Инструкции по установке криптографического ПО». Документ расположен в разделе «Маркировка лекарств» на сайте https://честныйзнак.рф в подразделе «Документы», блок «Основные действия участников МДЛП».
При возникновении сложностей с выполнением этого и последующих шагов можно обратиться в службу технической поддержки оператора системы по адресу support@crpt.ru или через форму обратной связи на сайте https://честныйзнак.рф
С этого компьютера, используя полученную УКЭП руководителя, зарегистрируйте субъект обращения мониторинг лекарственных препаратов в ИС МДЛП.
О факте регистрации субъекта в ИС МДЛП необходимо проинформировать территориальный орган Росздравнадзора, орган управления здравоохранением субъекта РФ и центр компетенции в соответствующем субъекте РФ
Справка. Для этого нужно воспользоваться ссылкой https://mdlp.crpt.ru или кнопкой «Вход в систему» в разделе «Маркировка лекарств» на сайте https://честныйзнак.рф. Данный шаг подробно описан в «Руководстве пользователя личного кабинета…» в разд. 2.2 «Регистрация Личного кабинета Участника в ИС «Маркировка»
Получите УКЭП пользователей (определенных на шаге 1), если они не были получены на шаге 2, а затем зарегистрируйте этих пользователей в ИС МДЛП (используя средства личного кабинета ИС МДЛП, УКЭП руководителя и установленное СКЗИ). Установите СКЗИ и сертификаты УКЭП данных пользователей на их рабочие места
Справка. Подробно данный шаг описан в разд. 4.11 «Добавить запись пользователя в ЛК Участника (Администрирование)» «Руководства пользователя личного кабинета…»
Закрепите (при необходимости) определенный на шаге 1 порядок действий сотрудников по регистрации действий с лекарственными препаратами во внутренних организационно-распорядительных документах организации
Закажите (при необходимости) доработку используемых информационных систем для автоматизации разработанных бизнес-процессов в соответствии с порядком действий, определенном на шаге 1.
Кроме того, необходимо зарегистрировать в ИС МДЛП используемую субъектом обращения информационную систему, с помощью которой предполагается выполнять обмен данными с ИС МДЛП
Справка. Список разработчиков информационных систем, активно сотрудничающих с Оператором системы, можно найти в подразд. «Партнеры» по ссылке https://честныйзнак.рф/business/projects/21/#87.
Порядок регистрации информационной системы подробно описан в разд. 4.12 «Добавить, удалить учетную систему в ЛК Участника (Администрирование)» «Руководства пользователя личного кабинета…»
– порядок отзыва (при увольнении и изменении должностных обязанностей) ключей электронной подписи пользователей и закрепите его (при необходимости) во внутренних организационно-распорядительных документах;
– иные действия, необходимые для снижения риска компрометации ключей электронной подписи
Составьте перечень мест хранения лекарственных препаратов и мест их выбытия, проверьте его соответствие лицензиям. Опишите в личном кабинете список мест осуществления деятельности в соответствии с составленным перечнем
Справка. Эти действия подробнее описаны в разд. 4.5 «Добавить место деятельности Участника в ЛК Участника» «Руководства пользователя личного кабинета…»
При наличии у субъекта договорных отношений с другими участниками оборота, в соответствии с которыми субъект выполняет действия с лекарственными препаратам в местах осуществления деятельности другими участниками, эти места необходимо указать в соответствии с разд. 4.6 «Добавить место ответственного хранения в ЛК Участника» «Руководства пользователя личного кабинета…»***
Определите порядок действий пользователей при отказе ИС МДЛП зарегистрировать действие с лекарственным препаратом
Справка. Перечень возможных причин отказа приведен в документе «Описание XSD» для каждой регистрируемой в ИС МДЛП операции
В «песочнице» ИС МДЛП (https://sb.mdlp.crpt.ru) с помощью технической поддержки оператора системы (support@crpt.ru) зарегистрируйте тестовые коды маркировки лекарственных препаратов и уведомление об их отгрузке в адрес субъекта-получателя
Справка. Максимальное количество выдаваемых службой технической поддержки в рамках одного обращения кодов маркировки вторичных упаковок для использования в «песочнице» составляет не более 5 штук
Проверьте работоспособность разработанных бизнес-процессов и обученность пользователей (их готовность к реализации этих процессов), используя в качестве исходных данных для прохождения контрольных примеров зарегистрированные на предыдущем шаге в «песочнице» МДЛП коды маркировки лекарственных препаратов
Проверьте (при необходимости) подключение к рабочему контуру ИС МДЛП и работоспособность заказанных доработок информационных систем (шаг 7) во взаимодействии с организацией, обслуживающей данные информационные системы
* Шаги 1 и 2 – 5 могут выполняться параллельно.
***Следует учесть, что реализацию и вывод из оборота для медицинского применения в местах ответственного хранения зарегистрировать невозможно.
[1] «О внесении изменений в Федеральный закон «Об обращении лекарственных средств».
[2] Федеральный закон от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств».
[3] Утверждено Постановлением Правительства РФ от 14.12.2018 № 1556.
[4] Дополнительно информацию по данному вопросу можно получить на официальном сайте Росздравнадзора (http://roszdravnadzor.ru) в разделе «Система маркировки лекарственных препаратов (пилотный проект)» и на официальном сайте оператора системы ООО «Оператор-ЦРПТ» по ссылке https://честныйзнак.рф/business/projects/21.
[5] Федеральный закон от 15.04.2019 № 58-ФЗ «О внесении изменений в Кодекс Российской Федерации об административных правонарушениях».
Мониторинг движения лекарственных препаратов (МДЛП)
С 1 июля 2020 года маркировка лекарств станет обязательной, мы расскажем, что такое система МДЛП и как она работает.
Единый комплекс мер по учету служит для защиты покупателей от контрафактных медицинских препаратов и обеспечивает возможность для физических лиц и организаций оперативно верифицировать лекарственное средство.
Кроме того, система отслеживает и собирает подробную информацию о пути следования товара, а также сведения, которые впоследствии могут запретить его дальнейшее обращение (в случае, если поступили данные о том, что товар был реализован или изъят из оборота по другим основаниям).
Основная задача ‒ исключить из оборота контрафактные препараты.
Цели внедрения маркировки и системы МДЛП?
Для государственных органов:
Кому в обязательном порядке необходимо работать в МДЛП?
Штрафы за нарушения фиксации данных в систему МДЛП
Статья 6.34. КоАП РФ «Несвоевременное внесение данных в систему мониторинга движения лекарственных препаратов для медицинского применения либо внесение в нее недостоверных данных».
Нарушение этой статьи влечет за собой административный штраф для должностных лиц в размере от 5 до 10 тысяч рублей; для юридических лиц размер штрафа составляет от 50 до 100 тысяч рублей. Граждане, занимающиеся предпринимательской деятельностью без учреждения юридического лица, в случае нарушения положений кодекса об административных правонарушениях, будут нести такую же ответственность, как и юридические лица.
1 июля 2020 года заканчивается действие упрощенного режима. Необходимо уделить внимание этому вопросу как можно быстрее.
Честный знак: мониторинг движения лекарственных препаратов (МДЛП) – что ждать от внедрения системы участникам рынка?
За последние годы проблема контрафакта лекарственных препаратов в России достигла такого уровня, что вынудила правительство к принятию кардинальных мер. С 1-го января 2020 года все организации, имеющие лицензии на фармацевтическую и медицинскую деятельность, будут обязаны передавать данные в Федеральную государственную информационную систему «Мониторинг движения лекарственных препаратов» (ФГИС МДЛП или ИС «Честный знак»). Для этого всем пользователям необходимо будет внедрить специальный электронный документооборот. Что ждать от данного нововведения клиникам, производителям и компаниям-дистрибьюторам? Очередных проблем и поборов или, все-таки на этот раз, есть шанс не только упорядочить свою работу с ЛП, но и даже получить прибыль. Попробуем разобраться.
Мониторинг движения лекарственных препаратов (далее ФГИС МДЛП или ИС МДЛП) – является частью общенациональной системы маркировки и отслеживания продукции под названием «Честный знак» по направлению «Лекарственные препараты». Специальный цифровой код (Data Matrix, штрих-код) гарантирует подлинность и качество товара. Основная задача данной системы – повышение уровня безопасности потребителей, борьба с контрафактом и некачественными аналогами.
Причины внедрения ИС МДЛП
По данным Минпромторга, только за 2018 год в обороте было выявлено свыше 6 миллионов единиц контрафактной продукции. Эта проблема наиболее серьезно отражается на конечных потребителях, которые за свои же собственные деньги рискуют здоровьем, и, зачастую, жизнью. Что касается производителей лекарственных препаратов и клиник, то здесь контрафакт грозит не только серьезными репутационными и финансовыми убытками, но и возможной уголовной ответственностью для должностных лиц.
Наличие цифровой маркировки позволяет получить полную информацию о товаре: название предприятия-изготовителя, место, дату и время производства и продажи, срок годности, артикул и номер стандарта. Данные хранятся в государственной информационной системе. Маркировка направлена на снижение распространения всех видов нелегальной продукции: контрафакта, фальсификата, контрабанды и т.д.
История принятия закона
Решение о создании федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки принято 4 февраля 2015 г. на совещании Президента РФ с членами правительства. 20 февраля 2015 г. было подписано поручение, на основании которого Министерству Здравоохранения РФ поручалось обеспечить разработку и поэтапное внедрение системы. 30.11.2015 г. издан приказ №866 «Об утверждении концепции создания федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки», утвердивший общую концепцию создания системы, ее цели и задачи, основные требования, а также перечень функциональных возможностей и сервисов.
Сроки внедрения и ответственный оператор
Внедрение информационной системы «Честный знак» (далее – ИС «Честный знак») планируется проводить поэтапно до 2024 года. Предполагается, что, начиная с этой даты, все виды товаров, производимых и/или реализуемых на территории РФ, должны иметь индивидуальную цифровую маркировку (штрих-код), позволяющий отследить их происхождение, логистику и использование в России.
1 января 2020 года стартует запуск информационной системы мониторинга движения лекарственных препаратов. Система МДЛП создана для защиты потребителей всех уровней от нелегальных лекарственных средств и призвана предоставить гражданам и организациям возможность оперативной проверки их легальности. Внедрение системы мониторинга движения лекарственных препаратов позволит получать детальные сведения о перемещении упаковки препарата, а также информацию, которая препятствует ее нелегальному обращению (например, при наличии данных о том, что лекарство было ранее продано или выведено из обращения по какой-либо причине).
Разработчиком и оператором системы назначена Федеральная налоговая служба (ФНС). На официальном сайте ведомства создан специализированный раздел, посвященный системе маркировки лекарственных препаратов. Дополнительно подробная информация о ходе реализации проекта публикуется на сайте Росздравнадзора. Кроме этого участниками со стороны государства, помимо Минздрава и ФНС, являются министерство финансов Российской Федерации, министерство промышленности и торговли и Федеральная таможенная служба.
Кто обязан использовать ФГИС МДЛП?
Непосредственными пользователями системы станут все участники рынка обращения лекарственных препаратов (ЛП):
Что будет, если проигнорировать данное нововведение?
Как и любое другое законодательное решение, введение системы МДЛП требует его исполнения. Однако на практике, особенно если следование букве закона на начальном этапе требует материальных расходов, многие продолжают работать по старинке, не обращая внимания на изменения условий. Так к чему нужно быть готовым руководителям клиник, игнорирующим систему МДЛП?
Согласно статье 6.34 КоАП РФ:
Несвоевременное внесение данных в систему МДЛП либо внесение в нее недостоверных данных влечет наложение административного штрафа
Примечание. За административные правонарушения, предусмотренные настоящей статьей, лица, осуществляющие предпринимательскую деятельность без образования юридического лица (ИП), несут административную ответственность как юридические лица.
*Статья 6.34 вступает в силу с 1 января 2020 года
Что касается частных врачей, работающих как ИП, то согласно ст. 323-ФЗ, индивидуальный предприниматель с медицинской лицензией законодательно приравнивается к статусу медицинской организации. Таким образом, на него в полной мере распространяются все требования законов, касающихся медицинской деятельности.
К 1 января 2020 года все участники рынка медицинских и фармацевтических услуг обязаны быть зарегистрированы в системе и обладать для работы в ней всей необходимой техникой и программами.
Как повлияет внедрение системы мониторинга движения лекарственных средств на ее участников (клиники, производители, дистрибьюторы)?
Клиники
С наступлением нового года всем медицинским организациям, работающим на территории РФ, придется передавать информацию о каждой поставке ЛП от поставщика, их перемещении между отделениями клиники, отпуске препаратов для медицинского применения, уничтожении или выводе их из оборота. Если во время приемки препарата информация со штрих-кода (маркировка) на упаковке и в системе мониторинга не совпадет, лекарство необходимо будет вернуть поставщику. Закупать и применять ЛП, данные о которых не внесены в систему, запрещается.
Перемещение препаратов должно быть отражено в системе в течение 5 рабочих дней. На данный момент есть неподтвержденная информация о том, что после запуска системы в эксплуатацию срок может быть сокращен до 1 рабочего дня.
Для работы в системе клиникам необходимо подготовиться: закупить нужное оборудование (сканеры), выделить ПК, бесперебойно подключенный к Интернет, установить программу для работы с системой мониторинга, а также обучить работе с системой ответственных лиц.
Что касается производителей и дистрибьюторов, то их ожидают куда более серьезные затраты. Это отнюдь не дешевое оборудование по нанесению маркировки препаратов, а также формирование дополнительных отделов сотрудников и оснащения рабочих мест.
Сотрудники редакции «Клуба стоматологов» задали этот вопрос разным представителям стоматологического рынка и получили довольно неожиданные ответы. Общее настроение участников опроса можно охарактеризовать, скорее, как пессимистичное. Итак, тема опроса: как повлияет внедрение системы мониторинга движения лекарственных средств на ее участников? И полученные нами отзывы о ИС МДЛП:
— Мария Таскина, директор и главный врач клиники «Ваш стоматолог» (г. Севастополь)
Плюсов введения системы не вижу. Ответственные руководители всегда старались купить оригинальную продукцию, а приобрести подделку подешевле все равно можно будет при желании.
С нелегальными препаратами я сама не сталкивалась, т.к. мы тщательно выбираем поставщиков. А вот предложения купить китайские подделки материалов поступают регулярно. По этой причине не приобретаю никаких материалов на выставках, только у проверенных поставщиков.
На мой взгляд, внедряемая государством система мониторинга приведёт к удорожанию препаратов, и, как следствие, удорожанию услуг и усложнению работы. Проблем она не решит- всегда будут желающие купить дешевле, а спрос, как известно, рождает предложение. ЕГАИС ведь не избавил нас от контрафактного алкоголя. Как торговали паленкой из под полы, так и торгуют.
Тем не менее, мы не собираемся игнорировать законодательство и систему контроля уже начали внедрять: купили ключи и зарегистрировались.
— Ольга Агальцова, руководитель стоматологической клиники «Идеалдент» (г. Таруса)
Я думаю, что кроме разовых затрат на покупку оборудования, получения ЭЦП и выделения дополнительной функции старшей медсестре, внедрение системы контроля больше никак не отразится на работе нашей небольшой клиники. На первом этапе предполагаю также сложности в закупке лекарственных средств, так как система вводится одномоментно по всей стране, и, скорее всего, будут накладки и перебои с поставками. Кроме того, оборудование может сломаться, программа – зависнуть, а техподдержка будет перегружена. Но в конечном итоге, все «утрясется», как утряслось внедрение онлайн касс, например, или номенклатурного прейскуранта.
Что касается возможности использования различных схем обхода данной системы, то, на мой взгляд, в каких-то масштабных проектах, крупных аптечных сетях и складах, возможно и есть шанс придумать и реализовывать какие-либо серые схемы. Хотя сразу оговорюсь: я в таких делах не эксперт, это просто предположение. Ожидаю, что нас, мелких потребителей, контролировать будут достаточно жестко (уже идут предупреждения и напоминания о внедрении системы из контролирующих органов), несмотря на то, что мы не занимаемся реализацией лекарственных препаратов.
Внедрять систему МДЛП в своей клинике конечно же мы планируем, хотя мне не верится, что с 1 января она заработает без перебоев. Цены на услуги будем повышать в плановом порядке.
— Мария Ардинцева, заместитель директора «Дент Арт» (г. Армавир)
Безусловно, внедрение системы МДЛП для клиники приведет к увеличению зарплатного фонда (минимально (!) от 5000 рублей в месяц) и затрат на оборудование дополнительного рабочего пространства (минимально от 50 000 рублей единовременно: на дополнительный стационарный компьютер (порядка 30-40 000 руб. с хорошими характеристиками), изготовление УКЭП (1100 руб.) на защищенном носителе (1200 руб.), приобретение Криптопро с бессрочной лицензией (2700 руб. ) и сканера поступления ЛП (пока под вопросом – от 3000 руб. ). И это в том случае, если не понадобится ещё и спецоценка дополнительного рабочего места. Но можно взглянуть на эту ситуацию и с другой стороны: если раньше кому-то из сотрудников приходилось отслеживать данные из информационных писем РЗН с целью выявления отзыва МИ и ЛС из обращения, то теперь это действие будет производиться автоматически путём сканирования при поступлении ЛП от поставщика. Таким образом, задача, которая решалась в организациях времене- и энергозатратным способом – упрощается и автоматизируется.
К сожалению, я уверена, что на первоначальном этапе система не заработает корректно. По опыту применения он-лайн кассы могу предположить, что технические заминки на местах (при отлаженной работе «Честного знака») будут возникать ещё в течение как минимум двух лет. Именно поэтому сегодня важно сделать «запасы» ЛП без маркировки и с большим сроком годности. В своей клинике мы начали работу по внедрению системы МДЛП, однако процедура регистрации на портале «Честный знак» говорит о затруднениях в работе всего нововведения. Сделав всё необходимое, мы пока не можем в установленные сроки получить подтверждение регистрации. Надеемся, что повторные запросы в службу тех поддержки позволят оказаться в реестре зарегистрированных организаций до 01.01.2020г. и избежать первоначальных штрафов.
Тем не менее среди участников опроса все-таки нашлись и сторонники системы.
— Сергей Кузнецов, президент РОО «Стоматологи столицы», совладелец и руководитель сети клиник ГК «Центр эстетической стоматологии», доктором медицинских наук, профессором (г. Москва)
Лично я вижу от внедрения системы только плюсы! Чем больше контроля со стороны государства, особенно в такой сфере как фармацевтика, тем лучше! Конечно, контрафакт сохранится, но его количество сократиться в разы. Что касается сбоев в работе системы на первоначальном этапе, то они у нас в стране возможны всегда и во всём!
Дистрибьютор ЛП
— Ольга Машкина, директор департамента продаж компании «Рокада Мед» (г. Казань)
Допускаю, что внедрение системы контроля способствует прекращению нелегального оборота ЛС на рынке России, который негативно влияет на здоровье пациентов и юридическую безопасность клиник. В компании «Рокада Мед» поставка ЛС осуществляется напрямую от изготовителя, что полностью исключает нелегальную продукцию. Минусом является повышение стоимости ЛС и соответственно услуг клиник из-за затрат на внедрение системы на всех этапах прохождения ЛС. Сегодня государство заинтересовано навести порядок и ликвидировать контрафакт, поэтому мы рассчитываем, что 90% оборота будут составлять маркированные ЛС. Клиники и торгующие компании, которые не внедрят систему, окажутся на «черном ранке». На начальном этапе возможны проблемы с работой системы, поэтому мы, как компания-импортер, создали большой запас ЛС для обеспечения спроса на переходный период. К внедрению ИС «Честный знак» наша компания полностью готова. Система протестирована, но реальные поставки еще не проводились в связи с отсутствием маркированных ЛС, зарегистрированных в системе.
Есть ли выгоды от внедрения ИС МДЛП для участников медицинского рынка?
Предполагается, что внедрение системы МДЛП и маркировка позволит бизнесу повысить производительность, усовершенствовать логистические схемы, нарастить долю рынка и в конечном счете увеличить выручку:
Что касается клиник, то самая главная и неоспоримая для них выгода – это хорошая репутация и полная уверенность в том, что используемые ЛП являются легальными, а значит не нанесут ущерб здоровью пациента. Кроме этого, систематизируется документооборот, появиться возможность максимально оптимизировать поставки и контроль за складскими запасами.
Как организована работа системы мониторинга движения лекарственных препаратов?
Простые вопросы о системе МДЛП, ответы на которые должен знать руководитель клиники.
1. Какие препараты должны быть занесены в систему мониторинга?
Все препараты медицинского назначения, которые зарегистрированы в РФ именно как лекарственные средства. Проверить препарат можно по государственному реестру лекарственных средств.
2. Кто обязан наносить маркировку?
Это делает производитель или поставщик ЛП.
3. Каким образом проводится проверка подлинности препаратов в условиях клиники?
Проверку подлинности лекарственных средств при получении их от поставщика проводят путем сканирования маркировки (штрих-кода) специальным сканером, подключенным к системе учета ЛП через компьютер. При приемке препарата от поставщика ответственный сотрудник обязан отсканировать код на упаковке и либо принять препарат на баланс в клинику, либо забраковать его, если система покажет несоответствие информации на упаковке и в системе.
4. Что нужно сделать руководителю клиники для использования ИС МДЛС (пошаговая инструкция):
Как получить электронную цифровую подпись (ЭЦП)?
В соответствии с положениями Федерального закона от 6 апреля 2011 г.№ 63-ФЗ «Об электронной подписи» средства электронной подписи и квалифицированные сертификаты ключей проверки электронных подписей выдаются аккредитованными удостоверяющими центрами. Для получения электронной подписи необходимо обратиться в такой центр по месту нахождения организации. Ст. 5 № 63-ФЗ определяет следующие виды электронной подписи: простая электронная подпись и усиленная электронная подпись. Различаются усиленная неквалифицированная электронная подпись и усиленная квалифицированная электронная подпись. Таким образом, перед обращением в удостоверяющий центр для получения электронной подписи, заявителю следует определить вид электронной подписи, который необходим для осуществления различных правоотношений в электронном виде. Для работы с ФГИС МДЛП рекомендуется усиленная электронная подпись.
Выбор сканера: модели, отличия, цены
В данной статье мы приведем примеры наиболее популярных и уже проверенных моделей, но, ни в коем случае, не будем утверждать, что они идеальны. Право выбора всегда остается за самими пользователями.
Штрих-коды DataMatrix, которые с 1 января следующего года будут наноситься на упаковки всех ЛП, представляют собой двумерный матричный код. Для распознавания такого вида кодировки нужен специальный 2D сканер штрих-кода. Другая, более простая линейная модель (1D) не сможет распознать установленный код. Конечно, двумерные сканеры стоят дороже линейных, но, как правило, такие приборы считывают как двумерные (2D), так и линейные (1D) кодировки. Для предотвращения фальсификата идентификатор на упаковках лекарственных препаратов будет отличаться особой сложностью для сканирования. Это и картонные пачки, и блистерные упаковки с блестящим и матовым покрытием. Сканер для считывания таких маленьких, иногда трудночитаемых штрих-кодов должен быть высокочувствительным.
Цена – от 4 000 руб.
Цена – от 4 500 руб.
Недорогой сканер от АТОЛ. Легко справляется с поврежденными штрихкодами, считывает штрихкоды с любых поверхностей. Успешное считывание подтверждается звуковой и визуальной индикацией. Подключается через USB-интерфейс. Для начала работы нужно подключить сканер к компьютеру, драйвер установится сам. Имеет удобную рукоятку и малый вес — всего 125 г. Низкая цена.
Цена – от 3 800 руб.
Цена – от 3 900 руб.
CRM, готовые к работе с ФГИС МДЛП на данный момент
Решение от 1С
Решение от Клуба стоматологов
StomX – программа для стоматологических клиник (расписание, амбулаторные карты, отчеты, CRM и многое другое). Взаимодействие с ИС МДЛП поддерживает и приемку и выбытие лекарственных препаратов с поддержкой и без сканера штрихкодов, а также регистратора выбытия. (перейти на сайт программы).
Решение от Первый БИТ
БИТ.Управление медицинским центром — программа для управления клиникой на базе 1С. Регистратура. Аналитика и финансы. Медицинский учет и ЭМК. Склад. Маркетинг и СRM, МДЛП;
БИТ.Стоматология — программа для управления стоматологической клиникой на базе 1С. Регистратура. Аналитика и финансы. Медицинский учет и Зубная карта. Склад. Маркетинг и СRM, МДЛП.
Бизнес-процесс по приёму и выбытию лекарственного препарата в медицинском учреждении на примере Национального медико-хирургического Центра имени Н.И. Пирогова
Обновления
12 декабря 2019г.
Госдума приняла закон, который переносит на полгода срок вступления в силу положений законодательства об обязательной маркировке лекарственных средств. Вместо 1 января обязательная маркировка стартует 1 июля 2020 года.
10 января 2020г.
Правительство РФ установило особенности внедрения системы цифровой маркировки и прослеживания лекарств. С учетом успешного опыта по запуску маркировки препаратов группы 7ВЗН с 1 октября 2019 г., 31 декабря 2019 г. было подписано Постановление Правительства РФ №1954 определяющее оптимальный режим подготовки всех участников оборота к дате обязательной маркировки всех препаратов.
Основные этапы подключения к системе:
За последние годы проблема контрафакта лекарственных препаратов в России достигла такого уровня, что вынудила правительство к принятию кардинальных мер. С 1-го января 2020 года все организации, имеющие лицензии на фармацевтическую и медицинскую деятельность, будут обязаны передавать данные в Федеральную государственную информационную систему «Мониторинг движения лекарственных препаратов» (ФГИС МДЛП или ИС «Честный знак»). Для этого всем пользователям необходимо будет внедрить специальный электронный документооборот. Что ждать от данного нововведения клиникам, производителям и компаниям-дистрибьюторам? Очередных проблем и поборов или, все-таки на этот раз, есть шанс не только упорядочить свою работу с ЛП, но и даже получить прибыль. Попробуем разобраться.
Мониторинг движения лекарственных препаратов (далее ФГИС МДЛП или ИС МДЛП) – является частью общенациональной системы маркировки и отслеживания продукции под названием «Честный знак» по направлению «Лекарственные препараты». Специальный цифровой код (Data Matrix, штрих-код) гарантирует подлинность и качество товара. Основная задача данной системы – повышение уровня безопасности потребителей, борьба с контрафактом и некачественными аналогами.
Причины внедрения ИС МДЛП
По данным Минпромторга, только за 2018 год в обороте было выявлено свыше 6 миллионов единиц контрафактной продукции. Эта проблема наиболее серьезно отражается на конечных потребителях, которые за свои же собственные деньги рискуют здоровьем, и, зачастую, жизнью. Что касается производителей лекарственных препаратов и клиник, то здесь контрафакт грозит не только серьезными репутационными и финансовыми убытками, но и возможной уголовной ответственностью для должностных лиц.
Наличие цифровой маркировки позволяет получить полную информацию о товаре: название предприятия-изготовителя, место, дату и время производства и продажи, срок годности, артикул и номер стандарта. Данные хранятся в государственной информационной системе. Маркировка направлена на снижение распространения всех видов нелегальной продукции: контрафакта, фальсификата, контрабанды и т.д.
История принятия закона
Решение о создании федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки принято 4 февраля 2015 г. на совещании Президента РФ с членами правительства. 20 февраля 2015 г. было подписано поручение, на основании которого Министерству Здравоохранения РФ поручалось обеспечить разработку и поэтапное внедрение системы. 30.11.2015 г. издан приказ №866 «Об утверждении концепции создания федеральной государственной информационной системы мониторинга движения лекарственных препаратов от производителя до конечного потребителя с использованием маркировки», утвердивший общую концепцию создания системы, ее цели и задачи, основные требования, а также перечень функциональных возможностей и сервисов.
Сроки внедрения и ответственный оператор
Внедрение информационной системы «Честный знак» (далее – ИС «Честный знак») планируется проводить поэтапно до 2024 года. Предполагается, что, начиная с этой даты, все виды товаров, производимых и/или реализуемых на территории РФ, должны иметь индивидуальную цифровую маркировку (штрих-код), позволяющий отследить их происхождение, логистику и использование в России.
1 января 2020 года стартует запуск информационной системы мониторинга движения лекарственных препаратов. Система МДЛП создана для защиты потребителей всех уровней от нелегальных лекарственных средств и призвана предоставить гражданам и организациям возможность оперативной проверки их легальности. Внедрение системы мониторинга движения лекарственных препаратов позволит получать детальные сведения о перемещении упаковки препарата, а также информацию, которая препятствует ее нелегальному обращению (например, при наличии данных о том, что лекарство было ранее продано или выведено из обращения по какой-либо причине).
Разработчиком и оператором системы назначена Федеральная налоговая служба (ФНС). На официальном сайте ведомства создан специализированный раздел, посвященный системе маркировки лекарственных препаратов. Дополнительно подробная информация о ходе реализации проекта публикуется на сайте Росздравнадзора. Кроме этого участниками со стороны государства, помимо Минздрава и ФНС, являются министерство финансов Российской Федерации, министерство промышленности и торговли и Федеральная таможенная служба.
Кто обязан использовать ФГИС МДЛП?
Непосредственными пользователями системы станут все участники рынка обращения лекарственных препаратов (ЛП):
Что будет, если проигнорировать данное нововведение?
Как и любое другое законодательное решение, введение системы МДЛП требует его исполнения. Однако на практике, особенно если следование букве закона на начальном этапе требует материальных расходов, многие продолжают работать по старинке, не обращая внимания на изменения условий. Так к чему нужно быть готовым руководителям клиник, игнорирующим систему МДЛП?
Согласно статье 6.34 КоАП РФ:
Несвоевременное внесение данных в систему МДЛП либо внесение в нее недостоверных данных влечет наложение административного штрафа
Примечание. За административные правонарушения, предусмотренные настоящей статьей, лица, осуществляющие предпринимательскую деятельность без образования юридического лица (ИП), несут административную ответственность как юридические лица.
*Статья 6.34 вступает в силу с 1 января 2020 года
Что касается частных врачей, работающих как ИП, то согласно ст. 323-ФЗ, индивидуальный предприниматель с медицинской лицензией законодательно приравнивается к статусу медицинской организации. Таким образом, на него в полной мере распространяются все требования законов, касающихся медицинской деятельности.
К 1 января 2020 года все участники рынка медицинских и фармацевтических услуг обязаны быть зарегистрированы в системе и обладать для работы в ней всей необходимой техникой и программами.
Как повлияет внедрение системы мониторинга движения лекарственных средств на ее участников (клиники, производители, дистрибьюторы)?
Клиники
С наступлением нового года всем медицинским организациям, работающим на территории РФ, придется передавать информацию о каждой поставке ЛП от поставщика, их перемещении между отделениями клиники, отпуске препаратов для медицинского применения, уничтожении или выводе их из оборота. Если во время приемки препарата информация со штрих-кода (маркировка) на упаковке и в системе мониторинга не совпадет, лекарство необходимо будет вернуть поставщику. Закупать и применять ЛП, данные о которых не внесены в систему, запрещается.
Перемещение препаратов должно быть отражено в системе в течение 5 рабочих дней. На данный момент есть неподтвержденная информация о том, что после запуска системы в эксплуатацию срок может быть сокращен до 1 рабочего дня.
Для работы в системе клиникам необходимо подготовиться: закупить нужное оборудование (сканеры), выделить ПК, бесперебойно подключенный к Интернет, установить программу для работы с системой мониторинга, а также обучить работе с системой ответственных лиц.
Что касается производителей и дистрибьюторов, то их ожидают куда более серьезные затраты. Это отнюдь не дешевое оборудование по нанесению маркировки препаратов, а также формирование дополнительных отделов сотрудников и оснащения рабочих мест.
Сотрудники редакции «Клуба стоматологов» задали этот вопрос разным представителям стоматологического рынка и получили довольно неожиданные ответы. Общее настроение участников опроса можно охарактеризовать, скорее, как пессимистичное. Итак, тема опроса: как повлияет внедрение системы мониторинга движения лекарственных средств на ее участников? И полученные нами отзывы о ИС МДЛП:
— Мария Таскина, директор и главный врач клиники «Ваш стоматолог» (г. Севастополь)
Плюсов введения системы не вижу. Ответственные руководители всегда старались купить оригинальную продукцию, а приобрести подделку подешевле все равно можно будет при желании.
С нелегальными препаратами я сама не сталкивалась, т.к. мы тщательно выбираем поставщиков. А вот предложения купить китайские подделки материалов поступают регулярно. По этой причине не приобретаю никаких материалов на выставках, только у проверенных поставщиков.
На мой взгляд, внедряемая государством система мониторинга приведёт к удорожанию препаратов, и, как следствие, удорожанию услуг и усложнению работы. Проблем она не решит- всегда будут желающие купить дешевле, а спрос, как известно, рождает предложение. ЕГАИС ведь не избавил нас от контрафактного алкоголя. Как торговали паленкой из под полы, так и торгуют.
Тем не менее, мы не собираемся игнорировать законодательство и систему контроля уже начали внедрять: купили ключи и зарегистрировались.
— Ольга Агальцова, руководитель стоматологической клиники «Идеалдент» (г. Таруса)
Я думаю, что кроме разовых затрат на покупку оборудования, получения ЭЦП и выделения дополнительной функции старшей медсестре, внедрение системы контроля больше никак не отразится на работе нашей небольшой клиники. На первом этапе предполагаю также сложности в закупке лекарственных средств, так как система вводится одномоментно по всей стране, и, скорее всего, будут накладки и перебои с поставками. Кроме того, оборудование может сломаться, программа – зависнуть, а техподдержка будет перегружена. Но в конечном итоге, все «утрясется», как утряслось внедрение онлайн касс, например, или номенклатурного прейскуранта.
Что касается возможности использования различных схем обхода данной системы, то, на мой взгляд, в каких-то масштабных проектах, крупных аптечных сетях и складах, возможно и есть шанс придумать и реализовывать какие-либо серые схемы. Хотя сразу оговорюсь: я в таких делах не эксперт, это просто предположение. Ожидаю, что нас, мелких потребителей, контролировать будут достаточно жестко (уже идут предупреждения и напоминания о внедрении системы из контролирующих органов), несмотря на то, что мы не занимаемся реализацией лекарственных препаратов.
Внедрять систему МДЛП в своей клинике конечно же мы планируем, хотя мне не верится, что с 1 января она заработает без перебоев. Цены на услуги будем повышать в плановом порядке.
— Мария Ардинцева, заместитель директора «Дент Арт» (г. Армавир)
Безусловно, внедрение системы МДЛП для клиники приведет к увеличению зарплатного фонда (минимально (!) от 5000 рублей в месяц) и затрат на оборудование дополнительного рабочего пространства (минимально от 50 000 рублей единовременно: на дополнительный стационарный компьютер (порядка 30-40 000 руб. с хорошими характеристиками), изготовление УКЭП (1100 руб.) на защищенном носителе (1200 руб.), приобретение Криптопро с бессрочной лицензией (2700 руб. ) и сканера поступления ЛП (пока под вопросом – от 3000 руб. ). И это в том случае, если не понадобится ещё и спецоценка дополнительного рабочего места. Но можно взглянуть на эту ситуацию и с другой стороны: если раньше кому-то из сотрудников приходилось отслеживать данные из информационных писем РЗН с целью выявления отзыва МИ и ЛС из обращения, то теперь это действие будет производиться автоматически путём сканирования при поступлении ЛП от поставщика. Таким образом, задача, которая решалась в организациях времене- и энергозатратным способом – упрощается и автоматизируется.
К сожалению, я уверена, что на первоначальном этапе система не заработает корректно. По опыту применения он-лайн кассы могу предположить, что технические заминки на местах (при отлаженной работе «Честного знака») будут возникать ещё в течение как минимум двух лет. Именно поэтому сегодня важно сделать «запасы» ЛП без маркировки и с большим сроком годности. В своей клинике мы начали работу по внедрению системы МДЛП, однако процедура регистрации на портале «Честный знак» говорит о затруднениях в работе всего нововведения. Сделав всё необходимое, мы пока не можем в установленные сроки получить подтверждение регистрации. Надеемся, что повторные запросы в службу тех поддержки позволят оказаться в реестре зарегистрированных организаций до 01.01.2020г. и избежать первоначальных штрафов.
Тем не менее среди участников опроса все-таки нашлись и сторонники системы.
— Сергей Кузнецов, президент РОО «Стоматологи столицы», совладелец и руководитель сети клиник ГК «Центр эстетической стоматологии», доктором медицинских наук, профессором (г. Москва)
Лично я вижу от внедрения системы только плюсы! Чем больше контроля со стороны государства, особенно в такой сфере как фармацевтика, тем лучше! Конечно, контрафакт сохранится, но его количество сократиться в разы. Что касается сбоев в работе системы на первоначальном этапе, то они у нас в стране возможны всегда и во всём!
Дистрибьютор ЛП
— Ольга Машкина, директор департамента продаж компании «Рокада Мед» (г. Казань)
Допускаю, что внедрение системы контроля способствует прекращению нелегального оборота ЛС на рынке России, который негативно влияет на здоровье пациентов и юридическую безопасность клиник. В компании «Рокада Мед» поставка ЛС осуществляется напрямую от изготовителя, что полностью исключает нелегальную продукцию. Минусом является повышение стоимости ЛС и соответственно услуг клиник из-за затрат на внедрение системы на всех этапах прохождения ЛС. Сегодня государство заинтересовано навести порядок и ликвидировать контрафакт, поэтому мы рассчитываем, что 90% оборота будут составлять маркированные ЛС. Клиники и торгующие компании, которые не внедрят систему, окажутся на «черном ранке». На начальном этапе возможны проблемы с работой системы, поэтому мы, как компания-импортер, создали большой запас ЛС для обеспечения спроса на переходный период. К внедрению ИС «Честный знак» наша компания полностью готова. Система протестирована, но реальные поставки еще не проводились в связи с отсутствием маркированных ЛС, зарегистрированных в системе.
Есть ли выгоды от внедрения ИС МДЛП для участников медицинского рынка?
Предполагается, что внедрение системы МДЛП и маркировка позволит бизнесу повысить производительность, усовершенствовать логистические схемы, нарастить долю рынка и в конечном счете увеличить выручку:
Что касается клиник, то самая главная и неоспоримая для них выгода – это хорошая репутация и полная уверенность в том, что используемые ЛП являются легальными, а значит не нанесут ущерб здоровью пациента. Кроме этого, систематизируется документооборот, появиться возможность максимально оптимизировать поставки и контроль за складскими запасами.
Как организована работа системы мониторинга движения лекарственных препаратов?

Простые вопросы о системе МДЛП, ответы на которые должен знать руководитель клиники.
1. Какие препараты должны быть занесены в систему мониторинга?
Все препараты медицинского назначения, которые зарегистрированы в РФ именно как лекарственные средства. Проверить препарат можно по государственному реестру лекарственных средств.
2. Кто обязан наносить маркировку?
Это делает производитель или поставщик ЛП.
3. Каким образом проводится проверка подлинности препаратов в условиях клиники?
Проверку подлинности лекарственных средств при получении их от поставщика проводят путем сканирования маркировки (штрих-кода) специальным сканером, подключенным к системе учета ЛП через компьютер. При приемке препарата от поставщика ответственный сотрудник обязан отсканировать код на упаковке и либо принять препарат на баланс в клинику, либо забраковать его, если система покажет несоответствие информации на упаковке и в системе.
4. Что нужно сделать руководителю клиники для использования ИС МДЛС (пошаговая инструкция):
Как получить электронную цифровую подпись (ЭЦП)?
В соответствии с положениями Федерального закона от 6 апреля 2011 г.№ 63-ФЗ «Об электронной подписи» средства электронной подписи и квалифицированные сертификаты ключей проверки электронных подписей выдаются аккредитованными удостоверяющими центрами. Для получения электронной подписи необходимо обратиться в такой центр по месту нахождения организации. Ст. 5 № 63-ФЗ определяет следующие виды электронной подписи: простая электронная подпись и усиленная электронная подпись. Различаются усиленная неквалифицированная электронная подпись и усиленная квалифицированная электронная подпись. Таким образом, перед обращением в удостоверяющий центр для получения электронной подписи, заявителю следует определить вид электронной подписи, который необходим для осуществления различных правоотношений в электронном виде. Для работы с ФГИС МДЛП рекомендуется усиленная электронная подпись.
Выбор сканера: модели, отличия, цены
В данной статье мы приведем примеры наиболее популярных и уже проверенных моделей, но, ни в коем случае, не будем утверждать, что они идеальны. Право выбора всегда остается за самими пользователями.
Штрих-коды DataMatrix, которые с 1 января следующего года будут наноситься на упаковки всех ЛП, представляют собой двумерный матричный код. Для распознавания такого вида кодировки нужен специальный 2D сканер штрих-кода. Другая, более простая линейная модель (1D) не сможет распознать установленный код. Конечно, двумерные сканеры стоят дороже линейных, но, как правило, такие приборы считывают как двумерные (2D), так и линейные (1D) кодировки. Для предотвращения фальсификата идентификатор на упаковках лекарственных препаратов будет отличаться особой сложностью для сканирования. Это и картонные пачки, и блистерные упаковки с блестящим и матовым покрытием. Сканер для считывания таких маленьких, иногда трудночитаемых штрих-кодов должен быть высокочувствительным.
Цена – от 4 000 руб.
Цена – от 4 500 руб.
Недорогой сканер от АТОЛ. Легко справляется с поврежденными штрихкодами, считывает штрихкоды с любых поверхностей. Успешное считывание подтверждается звуковой и визуальной индикацией. Подключается через USB-интерфейс. Для начала работы нужно подключить сканер к компьютеру, драйвер установится сам. Имеет удобную рукоятку и малый вес — всего 125 г. Низкая цена.
Цена – от 3 800 руб.
Цена – от 3 900 руб.
CRM, готовые к работе с ФГИС МДЛП на данный момент
Решение от 1С
Решение от Клуба стоматологов
StomX – программа для стоматологических клиник (расписание, амбулаторные карты, отчеты, CRM и многое другое). Взаимодействие с ИС МДЛП поддерживает и приемку и выбытие лекарственных препаратов с поддержкой и без сканера штрихкодов, а также регистратора выбытия. (перейти на сайт программы).
Решение от Первый БИТ
БИТ.Управление медицинским центром — программа для управления клиникой на базе 1С. Регистратура. Аналитика и финансы. Медицинский учет и ЭМК. Склад. Маркетинг и СRM, МДЛП;
БИТ.Стоматология — программа для управления стоматологической клиникой на базе 1С. Регистратура. Аналитика и финансы. Медицинский учет и Зубная карта. Склад. Маркетинг и СRM, МДЛП.
Бизнес-процесс по приёму и выбытию лекарственного препарата в медицинском учреждении на примере Национального медико-хирургического Центра имени Н.И. Пирогова
Обновления
12 декабря 2019г.
Госдума приняла закон, который переносит на полгода срок вступления в силу положений законодательства об обязательной маркировке лекарственных средств. Вместо 1 января обязательная маркировка стартует 1 июля 2020 года.
10 января 2020г.
Правительство РФ установило особенности внедрения системы цифровой маркировки и прослеживания лекарств. С учетом успешного опыта по запуску маркировки препаратов группы 7ВЗН с 1 октября 2019 г., 31 декабря 2019 г. было подписано Постановление Правительства РФ №1954 определяющее оптимальный режим подготовки всех участников оборота к дате обязательной маркировки всех препаратов.
Основные этапы подключения к системе: