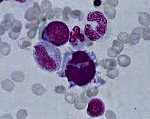
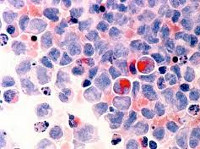
Мдс что это такое в медицине
Миелодиспластические синдромы
Вам поставили диагноз: Миелодиспластические синдромы
Наверняка Вы задаётесь вопросом: что же теперь делать?
Мы поможем вам справиться с болезнью и будем идти с вами рука об руку через все этапы вашего лечения.
Предлагаем вашему вниманию краткий, но очень подробный обзор данного заболевания.
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба и Отдела лекарственного лечения опухолей МНИОИ имени П.А. Герцена – филиалов ФГБУ «НМИЦ радиологии» Минздрава России под редакцией заведующих отделами, д.м.н. ФАЛАЛЕЕВОЙ Н.А. и д.м.н. ФЕДЕНКО А.А.
Филиалы и отделения, где лечат миелодиспластические синдромы
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения опухолей
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
тел: 8 (494) 150 11 22
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения злокачественных новообразований
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
тел: 8 (484) 399 – 31-30
Миелодиспластические синдромы
(МДС) – разнородная группа заболеваний системы кроветворения, сопровождающаяся нарушением созревания кроветворных клеток с нарушениями их строения (дисплазией) и функции, а также повышенным риском развития острого лейкоза. МДС чаще всего сопровождаются снижением показателей общего анализа крови – цитопенией. Снижение уровня гемоглобина и числа эритроцитов обозначают термином анемия; числа лейкоцитов/нейтрофилов – лейкопенией/нейтропенией; уровня тромбоцитов – тробоцитопенией. Изредка может быть и увеличение числа лейкоцитов и/или тромбоцитов.
Ежегодная заболеваемость МДС в среднем составляет 3-4 случая на 100000 населения и увеличивается с возрастом. Основной контингент больных МДС представлен пожилыми людьми (средний возраст – 70 лет). В отдельную группу относят МДС, развившиеся после химиотерапии и/или лучевой терапии предшествующих заболеваний (преимущественно онкологических). Они составляют 10-15% от ежегодно выявляемых случаев МДС и называются вторичными МДС.
В связи с гетерогенностью заболевания возникает вопрос о выборе оптимальной терапии. Одним из основных факторов для решения этой задачи является определение прогностической группы (группы риска), к которой относится конкретный больной.
Каждый прогностический признак оценивается в баллах. В соответствии с суммарным числом баллов больных объединяют в 4 группы: низкого (0 баллов), промежуточного-1 (0,5-1,0 балл), промежуточного-2 (1,5-2,0 балла) и высокого (2,5 балла и выше) риска. Первые 2 группы (низкого и промежуточного-1 риска) характеризуются принципиально благоприятным прогнозом, а 2 остальные (промежуточного-2 и высокого риска) — неблагоприятным прогнозом. Определение прогноза необходимо для выбора лечения.
Существует несколько основных направлений в лечении МДС:
Эпигенетическая терапия: при МДС помимо мутаций обнаружено гиперметилирование генов – присоединение метильных групп к ДНК, «запрещающее» нормальное функционирование генов, ответственных за подавление опухолевого роста (гены опухолевой супрессии). Азацитидин и децитабин относятся к группе противоопухолевых средств, обладающих гипометилирующей активностью. Оба препарата зарегистрированы в России для лечения МДС. Исследования децитабина и азацитидина продемонстрировали увеличение продолжительности жизни больных, увеличение времени до эволюции МДС в острый лейкоз и улучшение качества жизни.
Химиотерапия: на протяжении последних 20 лет для лечения больных МДС с увеличенным числом бластных клеток, то есть преимущественно в группе принципиально неблагоприятного прогноза, используются схемы терапии острого миелоидного лейкоза. Применение стандартной химиотерапии позволяет получить высокую частоту полных ремиссий – 50-70%. Однако продолжительность ремиссий относительно короткая (как правило, менее 1,5 лет), а лечение сопровождается высокой токсичностью.
Трансплантация гемопоэтических стволовых клеток (трансплантация костного мозга): единственным методом лечения, позволяющим существенно увеличить продолжительность жизни больных МДС, является аллогенная трансплантация гемопоэтических стволовых клеток (аллоТГСК). Аллогенная ТГСК также позволяет получить наилучшие результаты по сравнению с другими методами лечения при вторичных МДС. Однако выполнение аллоТГСК не всегда возможно в связи с пожилым возрастом большинства больных и отсутствием идентичного родственного донора.
Иммуносупрессивная терапия: использование иммуносупрессивных препаратов, таких как циклоспорин А, демонстрирует наибольшую активность при гипопластическом варианте МДС, при отсутствии увеличения числа бластных клеток в костном мозге, нормальном кариотипе (без отклонений в наборе хромосом), наличии лимфоидных узелков (очаговых скоплений лимфоидных клеток) в трепанобиоптате, наличии клона клеток, составляющих субстрат пароксизмальной ночной гемоглобинурии (ПНГ-клон), и у HLA-DR-15 – позитивных молодых больных.
Терапия колониестимулирующими препаратами: эритропоэз-стимулирующие препараты – эритропоэтины (препараты, направленные на лечение анемии) фигурируют практически во всех рекомендациях по лечению МДС. Практически все специалисты сходятся во мнении о необходимости определения уровня эндогенного (собственного, вырабатываемого организмом) эритропоэтина до начала лечения. При уровне эндогенного эритропоэтина свыше 500 ед/л лечение эритропоэтином не показано, большая эффективность наблюдается при уровне эндогенного эритропоэтина в пределах 200 ед/л.
Сопроводительная (симптоматическая) терапия : к сопроводительной терапии при МДС относят гемотрансфузии (переливания) эритроцитов и тромбоцитов, антимикробную терапию, в том числе в комбинации с Г-КСФ или ГМ-КСФ, использование комплексонов (хелаторов) железа.
Программа лечения МДС основана на риск-адаптированном подходе в зависимости от групп прогноза, возраста, общего состояния больного. Иными словами, назначается индивидуальная терапия в зависимости от результатов полностью проведенного обследования. В некоторых случаях, когда проявления заболевания незначительны, может быть предложено только наблюдение у врача. Лечение некоторыми препаратами может проводиться как в условиях стационара, так и дома.
Филиалы и отделения Центра, в которых лечат миелодиспластические синдромы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Отдел лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
8 (484) 399 – 31-30, г. Обнинск, Калужской области
Отдел лекарственного лечения опухолей МНИОИ имени П.А. Герцена –филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
Миелодиспластический синдром: причины, симптомы, лечение
Термин « миелодиспластический синдром » (сокращённо МДС) объединяет различные патологии, при которых обнаруживаются цитопения (понижение концентрации форменных элементов крови), дисплазия (неправильное развитие) гемоцитобластов (предшественников кровяных клеток), гипоклеточность или гиперклеточность костного мозга.
МДС встречается достаточно редко – 3-5 случаев на 100 тысяч населения. Но после 60 лет частота болезни повышается до 20-40 случаев ( https://www.eduherald.ru/pdf/2021/2/20538.pdf ).
Причины болезни
Точные причины МДС пока не удалось установить. Известно, что в 10-20% случаев патология развивается у людей, проходивших лучевую или химиотерапевтическую терапию ( https://cyberleninka.ru/article/n/mielodisplasticheskiy-sindrom/viewer ).
Ученые предполагают, что спровоцировать миелоидный синдром способен также парвовирус В19.
Повышают риск возникновения патологии постоянная работа с некоторыми химическими веществами (пестицидами, бензином, органическими растворителями), неблагоприятная экологическая ситуация, курение, некоторые врожденные и наследственные болезни.
Под влиянием повреждающих факторов в стволовых клетках возникают мутации, которые способствуют развитию МДС. Постепенно они накапливаются, способствуя переходу болезни в лейкоз.
Симптомы патологии
Признаки МДС зависят от того, дефицит каких кровяных клеток испытывает организм.
Выделяют 3 группы клинических проявлений:
У некоторых пациентов в число симптомов миелодиспластического синдрома входят увеличение размеров селезенки (спленомегалия) и печени (гепатомегалия).
Диагностика МДС
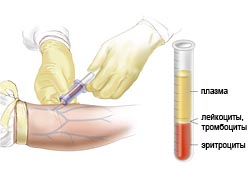
Основной метод диагностики миелодиспластического синдрома – исследование крови. При МДС возможно понижение как одного показателя, так и их комбинация. Диагноз ставят только при устойчивой (не менее полугода) цитопении, если не найдены другие причины.
Если возникает подозрение на миелодиспластический синдром, делают трепанобиопсию и пункцию костного мозга. Полученный биоматериал подвергают гистологическому и цитологическому исследованию.
Чтобы исключить другие причины цитопении, пациента направляют на дополнительные лабораторные и инструментальные исследования, которые могут включать:
Цитопения сопровождает различные заболевания. Поэтому важно исключить другие причины: рак, аутоиммунные заболевания, хронические инфекции, нарушение гемопоэза, отравление бензином или тяжелыми металлами, нехватку меди, избыток цинка, побочное действие лекарств.
Чтобы дифференцировать миелодиспластический синдром от миелоидного лейкоза, определяют число бластных клеток. Согласно ВОЗ, если показатель превышает 20%, то диагностируют острый лейкоз ( https://cyberleninka.ru/article/n/mielodisplasticheskiy-sindrom/viewer ).
Лечение МДС
Выбор способа лечения зависит от степени и прогрессирования цитопении, группы риска, имеющихся сопутствующих заболеваний.
Единственный действенный метод лечения, обеспечивающий лечение , – пересадка костного мозга.
Выделяют 3 основные способа лечения:
o Чтобы купировать либо предотвратить кровоточивость, прибегают к трансфузии тромбоцитов.
o При гипопластическом типе кроветворения эффективное действие оказывают иммунодепрессанты, которые защищают костный мозг от иммунной атаки.
В клинике Спиженко лечение подбирают индивидуально для каждого пациента в соответствии с международными рекомендациями и утвержденными протоколами.
Миелодиспластические синдромы (МДС)
Миелодиспластические синдромы (МДС) – разнородная группа хронических заболеваний крови, при которых происходит нарушение созревания клеток крови, с возможным переходом в лейкоз.
Ранее МДС имел различные названия (малопроцентный острый лейкоз, предлейкоз, тлеющая лейкемия и др.).
Заболеваемость МДС составляет 3-5 случаев на 100 тысяч населения в год. Более 85% пациентов старше 60 лет, причем риск развития заболевания с возрастом увеличивается. В 2/3 случаев МДС носит вторичный характер и развивается на фоне других заболеваний крови (множественная миелома, лимфогранулематоз, неходжкинские лимфомы, хронический лимфолейкоз) и после цитостатической терапии при ревматоидном артрите, системной красной волчанке, хроническом гломерулонефрите.
Причина заболевания окончательно не выяснена, определенную роль играют ионизирующее излучение, прием цитостатические препараты, производные бензола.
ДИАГНОСТИКА
Клинический анализ крови позволяет выявить анемию (малокровие), которая является самым частым симптомом МДС и обнаруживается в 85-90% случаев, лейкопению (снижение числа лейкоцитов), выявляемую у 50% больных и тромбоцитопению (снижение количества тромбоцитов), проводящую к кровотечениям.
Цитогенетический анализ позволяет определить изменения в хромосомном аппарате клеток крови и является ключевым методом диагностики и определения прогноза заболевания.
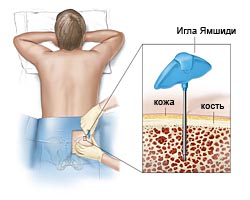
Аспирация (пункция костного мозга) и биопсия (трепанобиопсия) костного мозга – получение небольшого количества (0,2-0,5 мл) аспирата костного мозга и небольшого фрагмент кости. Процедура абсолютно безопасна и выполняется под местной анестезии в течение 2-5 мин. Может также проводиться амбулаторно. Исследования материала биопсий позволяют выявить изменения в костном мозге характерные для МДС.
У 20% пациентов можно выявить увеличение размеров селезенки, печени.
Выбор лечения определяется вариантом заболевания, прогнозом а также наличием сопутствующих заболеваний, которые могут существенно повлиять на терапию.
При благоприятном прогнозе и минимальных проявлениях заболевания можно ограничиться наблюдением за больным, пока показатели крови и костного мозга остаются стабильными.
При выраженном малокровии (анемии) показано переливание эритроцитарной массы, а при повышенной кровоточивости переливание тромбомассы. В ряде случаев возможно применение ростовых факторов (колониестимулирующие факторы).
Единственным методом лечения, позволяющим существенно увеличить продолжительность жизни больных МДС, является аллогенная трансплантация костного мозга/периферических стволовых клеток, Однако применение аллогенной трансплантации не всегда возможно в связи с пожилым возрастом большинства больных и отсутствием идентичного родственного донора.
До настоящего времени результаты лечения больных МДС остаются неудовлетворительными, в связи с этим не существует общепринятых стандартов лечения, а определены лишь общие подходы к терапии для разных групп больных при разных вариантах заболевания. Поэтому сохранение качества жизни пациентов с МДС в большинстве случаев, выходит на первый план при проведении лечения.
Миелодиспластический синдром
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
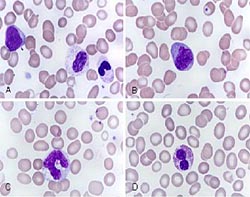
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Миелодиспластический синдром у взрослых
Общая информация
Краткое описание
Определение: Миелодиспластический синдром – группа гетерогенных клональных заболеваний, характеризующаяся наличием цитопении в периферической крови, дисплазии в костном мозге и риском трансформации в острый лейкоз [1].
| Название протокола: Миелодиспластический синдром у взрослых. |
| Код протокола: |
Шкала уровней доказательности[1].
| Уровень доказательность | Характеристика исследований, которые легли в основу рекомендаций |
| А | Высококачественный мета-анализ, систематический обзор рандомизированных клинических исследований (РКИ) или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых, могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых, могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых, могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или |
| Неконтролируемое исследование или | |
| Мнение экспертов |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Клиническая классификация 3:
Характеристики различных типов МДС по классификации ВОЗ, 2001 год.
| Тип МДС | Изменения в крови | Изменения в костном мозге |
| Рефрактерная анемия | Анемия, меньше 1% бластов | Дисплазия эритроидного ростка, меньше 5% бластов |
| Рефрактерная анемия с кольцевымисидеробластами (РАКС) | То же, что и РА | То же, что и РА, ≥ 15% кольцевых сидеробластов |
| Рефрактерная цитопения с мультилинейной дисплазией (РЦМД) | Цитопения по 2-3 росткам, меньше 1% бластов | Дисплазия,больше 10% клеток 2 или 3 ростков, меньше 5 % бластов, меньше 15 % кольцевых сидеробластов |
| Рефрактерная цитопения с мультилинейной дисплазией и кольцевыми сидеробластами (РЦМД-КС) | То же, что и РЦМД | То же, что и РЦМД, ≥ 15% кольцевых сидеробластов |
| Рефрактерная анемия с избытком бластов, тип I (РАИБ-1) | Цитопении, меньше 5 % бластов | 5-9% бластов |
| Рефрактерная анемия с избытком бластов, тип II (РАИБ-2) | Цитопении, 5-19% бластов | 10-19% бластов |
| Синдром 5q- | Анемия, нормальное или повышенное содержание тромбоцитов | Нормальное или увеличенное количество мегакариоцитов с гипосегментированными ядрами; изолированная делеция 5q31 |
| МДС неклассифицированный (МДС-Н) | Цитопения | Унилинейная дисплазия в нейтрофильном или мегакариоцитарном ростках, Бласты менее 5%, палочки Ауэра отсутствуют |
| Сумма баллов | Риск по IPSS | Срок до перехода в ОМЛ у 25 % пациентов (лет) | Медиана общей выживаемости (лет) | % Пациентов |
| 0 | Низкий | 9,4 | 5,7 | 31 % |
| 0,5-1,0 | Промежуточный-1 | 3,3 | 3,5 | 39 % |
| 1,5-2,0 | Промежуточный-2 | 1,1 | 1,2 | 22 % |
| ≥ 2,5 | Высокий | 0,2 | 0,4 | 8 % |
| Сумма баллов | Риск по IPSS | Срок до перехода в ОМЛ у 25 % пациентов (лет) | Медиана общей выживаемости (лет) | % Пациентов |
| ≤1.5 | Очень низкий | Не достигли | 8,8 | 13 % |
| >1,5≤3,0 | Низкий | 10,8 | 5,3 | 38 % |
| >3,0≤4,5 | Промежуточный | 3,2 | 3 | 20 % |
| >4,5≤6,0 | Высокий | 1,4 | 1,6 | 13 % |
| >6,0 | Очень высокий | 0,7 | 0,8 | 10 |
| Баллы | 0 | 1 | 2 | 3 |
| Вид МДС по классификации ВОЗ | РА, РАКС, 5q- | РЦМД, РЦМД-КС | РАИБ1 | РАИБ2 |
| Кариотип | Хороший | Средний | Плохой | – |
| Потребность в гемотрансфузиях | Нет | Регулярная | – | – |
Регулярные гемотрансфузии –переливание минимум 1 дозы эритроцитарной массы каждые 8 недель в течение 4 месяцев.
Диагностика
Перечень основных и дополнительных диагностических мероприятий:
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию:
· общий анализ крови (подсчет лейкоформулы, тромбоцитов в мазке);
· биохимический анализ крови (общий белок, альбумин, общий билирубин, прямой билирубин, креатинин, мочевина, АЛаТ, АСаТ, глюкоза, ЛДГ, С-реактивный белок);
· миелограмма;
· группа крови и резус фактор;
· УЗИ органов брюшной полости и селезенки;
· УЗИ органов малого таза – для женщин.
Диагностические мероприятия, проводимые на этапе скорой медицинской помощи:
· сбор жалоб и анамнеза заболевания;
· физикальное обследование (определение ЧД, ЧСС, оценка кожных покровов, определение размеров печени и селезенки).
Диагностические критерии постановки диагноза:
Жалобы на[2,5,6]:
— слабость;
— потливость;
— утомляемость;
— субфебрилитет;
— познабливание;
— снижение массы тела;
— геморрагические высыпания в виде петехий и экхимозов на коже;
— эпистаксис;
— меноррагии;
— повышенная кровоточивость.
Анамнез: следует обратить внимание на:
— длительно сохраняющуюся слабость;
— быструю утомляемость;
— частые инфекционные заболевания;
— повышенную кровоточивость;
— появление геморрагических высыпаний на коже и слизистых оболочках.
Физикальное обследование [5]:
— бледность кожных покровов;
— геморрагические высыпания – петехии, экхимозы;
— одышка;
— тахикардия;
— увеличение селезенки.
Диагностические критерии постановки диагноза [2,5,6]:
Минимальные диагностические критерии МДС включают обязательные диагностические условия (цитир. по NCCN, 2.2015):
· стабильная цитопения не менее 6 месяцев, (за исключением случаев, когда цитопения сопровождается специфическим кариотипом или дисплазией двух ростков кроветворения — в этих случаях длительность стабильной цитопении должна составлять не менее 2 месяцев);
· исключение других заболеваний, которые могут стать причиной развития дисплазии или/и цитопении.
В дополнение к этим двум диагностическим условиям для установления диагноза МДС необходимо соответствие хотя бы одному из трех основных критериев:
· дисплазия (≥ 10 % клеток одного или более из трех основных ростков кроветворения в костном мозге);
· содержание бластов в костном мозге 5-19 %;
· специфический кариотип, например, делеция (5q-), делеция (20q-), +8 или −7/делеция (7q-).
Инструментальные исследования[2,5]:
УЗИ органов брюшной полости: увеличение размеров селезенки.
КТ грудного сегмента: инфильтративные изменения легочной ткани.
ЭКГ: нарушение проводимости импульсов в сердечной мышце.
ЭхоКГ: признаки сердечной недостаточности (ФВ
· челюстно-лицевой хирург–инфекционно-воспалительные заболевания зубо-челюстной системы.
Дифференциальный диагноз
Дифференциальный диагноз[5]
Дифференциальная диагностика миелодиспластического синдрома проводится с:
· Мегалобластными анемиями (заболевания, характеризующиеся изменениями морфологии клеток костного мозга вследствие нарушения синтеза ДНК. Более 90 % — В-12 и фолиево-дефицитные анемии). После начала терапии витамином В-12 или фолиевой кислотой в анализе крови выявляется ретикулярный криз на 5-7 сутки и повышение показателей красной крови, что нехарактерно для больных рефрактерной анемией. Изменения кариотипа клеток костного мозга не встречаются при мегалобластных анемиях.
· Апластическая анемия может быть врожденной, приобретенной и идиопатической. Врожденная апластическая анемия — анемия Фанкони сочетается с другими генетическими аномалиями (кожная пигментация, гипоплазия почек, микроцефалия), приобретенная связана с действием химических и физических агентов, инфекциями, нарушениями обмена веществ. Для апластической анемии нехарактерны изменение кариотипа, гиперклеточный костный мозг.
· Анемии при хроническом гепатите характерно выявление маркеров вирусных инфекций, гепатоспленомегалия, клиническая картина хр. гепатита, изменения биохимических показателей крови (метаболизма билирубина, функции печени).
Лечение
Цели лечения:
· достижение полного или частичного ответа (критерии ответа см.п.15);
· снижение зависимости от трансфузий и регресс перегрузки железом, в случаях, когда не удается получить ответ (критерии ответа см.п.15).
Тактика лечения:
Немедикаментозное лечение:
Режим: общеохранительный.
Диета: Стол №15. Нейтропеническим пациентам не рекомендуется соблюдать определенную диету (уровень доказательности В). 7
Медикаментозное лечение [2,5,6]:
Иммуносупрессивная терапия при МДС (уровень доказательности В): 15
МДС может развиваться одновременно с некоторыми нарушениями иммунной системы. У пациентов с МДС часто наблюдаются нарушения в иммунной системе: аутоантитела, дисглобулинемия, аутореактивные клоны Т-клеток, дисбаланс между различными популяциями Т-клеток, NK-клеточные нарушения, увеличение популяции Т-регуляторов (CD4+25+; FoxP3+), увеличение продукции ИЛ-17 Т-клетками (провоспалительный, проапоптотический цитокин). У некоторых пациентов NK-клетки и другие лимфоциты принадлежат к МДС-клону.
Иммунная дисрегуляция может предшествовать или предрасполагать к развитию клональных гематологических заболеваний. Иммунные реакции, направленные против стволовых клеток костного мозга, могут сопровождать или лежать в основе МДС. Активированные цитотоксические лимфоциты и нарушение функции Т-клеток могут играть роль в развитии МДС. Цитотоксические лимфоциты могут вызывать апластические или диспластические изменения костного мозга, могут запускать апоптоз и могут вызывать хромосомные поломки.
При гипопластическом (гипопролиферативном) варианте МДС по аналогии с апластической анемией используется иммуносупрессивная терапия. Основными показаниями к использованию ИСТ является подтверждение гипоплазии кроветворения данными гистологического исследования костного мозга, низкий или промежуточный I риск по IPSS.
Основные препараты ИСТ при МДС:
Циклоспорин;
Иммуноглобулин антитимоцитарный.
Терапия Циклоспорином:
1) 3-5 мг/кг/ день в 2 приема per os;
2) Оптимальная концентрация циклоспорина в крови до 300 нг/мл;
3) Эффект у больных с гипоплазией костного мозга поликлональными скоплениями лимфоидных элементов в КМ, с нормальным кариотипом: 53- 83%.
Иммуноглобулин антитимоцитарный.
Представляют собой очищенные гамма-глобулины, в основном мономерные IgG, из сыворотки лошадей, кроликов и коз, иммунизированных соответственно тимоцитами или лимфоцитами человека.
Иммуноглобулин антитимоцитарный применяется в виде внутривенных капельных инфузий, как правило, в дозе 10-20-40 мг/кг массы тела в 500-1000 мл изотонического раствора натрия хлорида в течение 3-18 ч на протяжении 5 суток. При невысокой активности иммунокомпетентных клеток крови и костного мозга возможно применение АТГ в дозах 5-10 мг/кг.
МДС с делецией 5q-.
5q- был описан Vanden Berghe и соавт. в 1974 году. К клиническим признакам 5q-синдрома, описанным в первом сообщении, относились: макроцитоз, анемия, нормальное или повышенное количество тромбоцитов, гиполобулярные мегакариоциты в костном мозге.
Леналидомид.
Применение Леналидомида в лечении больных с МДС 5q- (уровень доказательности В) [17,18]. Леналидомид обладает как иммуномодулирующими, так и антиангиогенными свойствами. Рекомендуемая начальная доза составляет 25 мг 1 раз в день в 1–21-й дни повторных 28-дневных циклов. У 67% пациентов с МДС отмечено уменьшение зависимости от переливания крови.
Ингибиторы гиперметилирования.
Децитабин (уровень доказательности А) 25. Из группы ингибиторов гиперметиллирования для пожилых пациентов с низким и промежуточным-1 рисками (по шкале IPSS) предпочтительно использование децитабина. Как показали исследования, препарат увеличивает время до трансформации МДС в ОМЛ, уменьшает зависимость от трансфузий, однако, не влияет на общую выживаемость. Отмечена достаточно хорошая переносимость препарата. [32]
Режимы дозирования Децитабина (DACO-022)
| Режим | % Полных ремиссий |
| 20 мг/м2 в/в 1р/д x 5 дней | 39% (25/64) * |
| 10 мг/м2 п/к x 5 дней | 21% (3/14) |
| 10 мг/м2 в/в 1р/д x 10 дней | 24% (4/17) |
*Равная рандомизация до 45 пациентов. Цикл каждые 4-6 недель.
Также показанием для назначения гипометилирующих препаратов в группе «низкого риска» является отсутствие ответа на ИСТ.
Ингибиторы гиперметилирования.
Согласно проведенным исследованиям, из ингибиторов гиперметилирования для пациентов группы высокого риска (по шкале IPSS), и пациентам старше 75 лет, более предпочтителен азацитидин, поскольку, применение препарата в данной группе, не только положительно влияет на общую выживаемость (до 24 месяцев), но и увеличивает время трансформации МДС в ОМЛ (до 21 месяца). [33]
Азацитидин (уровень доказательности А) [26, 27, 28] предназначен для лечения пациентов с различными типами МДС высокого риска с избытком бластов. Согласно исследованиям, в группе высокого риска он не только увеличивает время до трансформации, но и общую выживаемость (до 6 месяцев). [33]
Для первого цикла терапии рекомендуемая начальная доза независимо от гематологических показателей составляет 75 мг/м 2 п/к или в/в, в течение 7 дней ежедневно. Для предотвращения тошноты и рвоты следует проводить премедикацию.
Последующие циклы терапии следует проводить каждые 4 недели. Дозу можно увеличить до 100 мг/м2 при отсутствии терапевтического эффекта после первых 2 циклов терапии и при отсутствии проявлений токсичности (кроме тошноты и рвоты). Рекомендуется проведение 4-6 циклов терапии. При полной или частичной эффективности препарата можно проводить дополнительные циклы терапии. Лечение можно продолжать до тех пор, пока будет наблюдаться терапевтический ответ.
Перед проведением повторных циклов терапии следует контролировать значение абсолютного числа нейтрофилов (АЧН) и количества тромбоцитов, а также токсические реакции (особенно со стороны почек) и соответственно корректировать дозу препарата.
В случае необъяснимого уменьшения содержания бикарбоната натрия до уровня
| Сопроводительная терапия | Основные принципы |
| Трансфузии | Трансформация эритроцитов при симптоматической анемии в основном лейкофильтрованными или трансфузиями тромбоцитов при геморрагических эпизодах. Тромбоциты не должны использоваться рутинно у пациентов с тромбоцитопенией и отсутствием кровотечений. Обязательно облучение компонентов крови, от родственных или HLA-совместимых доноров и у пациентов, которым планируется трансплантация костного мозга. |
| Анемия | Рекомендуется определение исходного уровня эритропоэтина. Ответ у пациентов 20-30%, в течении 1-2 месяцев. |
| Нейтропения/ инфекции | >50%больных. 30-35% больных имеют нейтрофилы |
| Тромбоцитопения | 25-50% больных. Тромбопоэтические агенты существенно не влияют на потребность в гемокомпонентах (TPO, MGDF, IL-11) |
Трансфузионая поддержка.
Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактических трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней.
Эритроцитарная масса/взвесь (уровень доказательности D) 33:
· Уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде;
· Существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, denovo депрессией или элевацией ST);
· Уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов;
· При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:
| Ø Возраст (лет) | Ø Триггерный уровень Hb (г/л) |
| Ø | Ø 35-45 |
| Ø 25-50 | Ø 40-50 |
| Ø 50-70 | Ø 55 |
| Ø >70 | Ø 60 |
Трансфузии эритроцитной массы больным МДС должны осуществляться при динамическом контроле за показателями обмена железа. Перегрузка железом в результате множественных гемотрансфузий является показанием к проведению хелаторной терапии
Концентрат тромбоцитов при МДС (уровень доказательноти D). 31:
· При снижении уровня тромбоцитов менее 30 х10 9 /л проводится трансфузия аферезных тромбоцитов с целью поддержания их уровня не ниже 30-50 х 10 9 /л в особенности в первые 10 дней курса.
· При наличии высокого риска геморрагических осложнений (возраст старше 60 лет, гиперлейкоцитоз (более 10х10 9 /л), повышение уровня креатинина более 140 мкмоль/л) необходимо поддерживать уровень тромбоцитов более 50х 10 9 /л.
Свежезамороженная плазма (уровень доказательноти D) 33:
· Трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств;
· Пациенты с МНО ³2.0 (при нейрохирургических вмешательствах ³1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур.
Медикаментозное лечение, оказываемое на амбулаторном уровне:
− перечень основных лекарственных средств с указанием формы выпуска (имеющих 100% вероятность применения) [1, 4-7]:
Антинеопластические и иммуносупрессивные лекарственные средства:
— циклоспорин*, 100мг, 50 мг, капсулы;
— ромиплостим 250 мг, 500 мг, порошок для приготовления раствора для подкожного введения.
− перечень дополнительных лекарственных средств с указанием формы выпуска (менее 100% вероятности применения):
Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов:
· деферазирокс*, таб. 250 мг;
· дефероксамин*, 500мг;
· филграстим, раствор для инъекций 0,3мг/мл, 1 мл;
· ондансетрон, раствор для инъекций 8 мг/4мл.
Антибактериальные средства:
· азитромицин, таблетка/капсула, 500 мг;
· амоксициллин/клавулановая кислота, таблетка, покрытая пленочной оболочкой, 1000мг;
· моксифлоксацин, таблетка, 400 мг;
· офлоксацин, таблетка, 400 мг;
· ципрофлоксацин таблетка, 500 мг;
· метронидазол, таблетка, 250 мг;
· эритромицин, таблетка 250мг;
· левофлоксацин, таблетка, 500 мг.
Противогрибковые лекарственные средства:
· анидулафунгин, лиофилизированный порошок для приготовления раствора для инъекций, 100 мг/флакон;
· вориконазол, таблетка, 50 мг;
· итраконазол, раствор для приема внутрь10мг/мл 150,0;
· каспофунгин, лиофилизат для приготовления раствора для инфузий 50 мг;
· клотримазол, раствор для наружного применения 1% 15мл;
· микафунгин, порошок лиофилизированный для приготовления раствора для инъекций 50 мг, 100 мг;
· флуконазол, капсула/таблетка 150 мг.
Лекарственные средства, применяемые при пневмоцистозе:
· сульфаметоксазол/триметоприм, таблетка 480 мг.
Растворы, применяемые для коррекции нарушений водного, электролитного и кислотно-основного баланса:
· вода для инъекций, раствор для инъекций 5мл;
· декстроза, раствор для инфузий 5% 250мл;
· натрия хлорид, раствор для инфузий 0,9% 500мл.
Другие лекарственные средства:
· амброксол, раствор для приема внутрь и ингаляций, 15мг/2мл, 100мл;
· амлодипин, таблетка/капсула 5 мг;
· атенолол, таблетка 25мг;
· ацетилцистеин, порошок для приготовления раствора для приема внутрь, 3 г;
· дексаметазон, капли глазные 0,1% 8 мл;
· дифенгидрамин, раствор для инъекций 1% 1 мл;
· дротаверин, таблетка 40 мг;
· кетопрофен, раствор для инъекций 100 мг/2мл;
· лактулоза, сироп 667г/л по 500 мл;
· лидокаин, раствор для инъекций, 2% по 2 мл;
· лизиноприл, таблетка 5мг;
· метилпреднизолон, таблетка, 16 мг;
· метилурацил, мазь для местного применения в тубе 10% 25г;
· метронидазол, гель стоматологический 20г;
· омепразол, капсула 20 мг;
· повидон– йод, раствор для наружного применения 1 л;
· преднизолон, таблетка, 5 мг;
· смектит диоктаэдрический, порошок для приготовления суспензии для приема внутрь 3,0 г;
· спиронолактон, капсула 100 мг;
· торасемид, таблетка 10мг;
· фентанил, система терапевтическая трансдермальная 75 мкг/ч; (для лечения хронических болей у онкологических больных)
· хлорамфеникол, сульфадиметоксин, метилурацил, тримекаин мазь для наружного применения 40г;
· хлоргексидин, раствор 0,05% 100мл;
· хлоропирамин, раствор для инъекций 20 мг/мл 1мл.
Лекарственные средства, применяемые при пневмоцистозе:
· сульфаметоксазол/триметоприм, таблетка 480 мг, концентрат для приготовления раствора для инфузий (80мг+16мг)/мл, 5 мл.
Дополнительные иммуносупрессивные лекарственные средства:
· дексаметазон, раствор для инъекций 4мг/мл 1 мл;
· метилпреднизолон, таблетка, 16 мг;
· метилпреднизолон, раствор для инъекций, 250 мг;
· преднизолон, раствор для инъекций 30 мг/мл 1мл, таблетка, 5 мг.
Медикаментозное лечение, оказываемое на этапе скорой неотложной помощи: не проводится.
Другие виды лечения:
Другие виды лечения, оказываемые на амбулаторном уровне: не применяются.
Другие виды лечения, оказываемые на стационарном уровне:
Аллогенная трансплантация костного мозга при МДС (уровень доказательности В). 29
Аллогенная трансплантация костного мозга является единственным радикальным методом лечения больных с миелодиспластическим синдромом. Отмечено увеличение общей выживаемости в группе пациентов со стандартным режимом кондиционирования.Общая и бессобытийнаявыживаемостьне зависят от возраста, типа донора, совместимости по системе HLA, источника стволовых клеток, количества бластов перед ТКМ.Полную ремиссию после аллоТКМ достигают 60-70% больных с МДС, однако, как правило, ремиссии непродолжительные.
Источником ГСК при аллоТКМ более предпочтительным является HLA-индентичный родственный донор, однако результаты эффективности трансплантации от HLA-индентичного неродственного донора сопоставимы с резульатами ТКМ от родственного.
При отсутвиии HLA-совместимых доноров, альтернативным источником ГСК может рассматриваться гаплоидентичный родственный донор (уровень доказательности D).
Пациентам из группы «низкого риска» ТКМ показана в случае отсутствия ответа на проводимую терапию и сохранении зависимости от трансфузий (переливание минимум 1 дозы эритроцитарной массы чаще чем каждые 8 недель в течение 4 месяцев).
Пациентам из группы «высокого риска» аллоТКМ рекомендуется проводить сразу после достижения полного или частичного ответа на проводимую терапию.
Другие виды лечения, оказываемые на этапе скорой медицинской помощи: не применяются.
Хирургическое вмешательство:
Хирургическое вмешательство, оказываемое в амбулаторных условиях: не проводится.
Хирургическое вмешательство, оказываемое в стационарных условиях: при развитии инфекционных осложнений и жизнеугрожающих кровотечений пациентам по экстренным показаниям могут проводиться хирургические вмешательства.
Дальнейшее ведение:
1) Д-учет у гематолога, контроль ОАК + тромбоциты 1 раз в 14 дней;
2) Трансфузия компонентов крови по строгим клиническим показаниям, максимально ограниченная;
3) Контроль ферритина (после каждых 10 трансфузий), сдать б/х анализ крови (ферритин).
Индикаторы эффективности лечения: [2]
| Категория | Критерии ответа |
| Полный ответ | В костном мозге ≤5 % миелобластов с |
| Отсутствие дисплазии. | |
| Показатели периферической крови: Гемоглобин больше 11 г/дл Тромбоциты > = 100 х 10 9/L Нейтрофилы > = 1х 10 9/L Бластные клетки = 0 % х 10 9/L | |
| Частичный ответ | В костном мозге количество бластных клеток снизилось на 50 % от исходного уровня, но остаются выше 5 % |
| Полная костно-мозговая ремиссия | В костном мозге ≤5 % миелобластов и снижение более чем на 50 % после лечения. В периферической крови: так же ответ получен ответ. |
| Неполная ремиссия | Неспособность достичь неполного ответа, но отсутствие признаков прогрессирования 8 недель. |
| Неудача лечения | Летальный исход во время лечения из-за прогрессирования болезни, нарастание цитопении, увеличение в костном мозге количества бластных клеток, прогрессия заболевания. |
| Рецидив после полного и частичного ответа | по крайней мере, 1 из следующих признаков: Обнаружение в костном мозге бластов>50% после ремиссии снижение гемоглобина >150 г/л и увеличение зависимости от трансфузий. |
| Цитогенетический ответ | Исчезновение хромосомных аномалий, без появления новых. Неполный ответ: Сокращение хромосомных аномалий, по крайней мере на 50 %. |
Препараты (действующие вещества), применяющиеся при лечении
Группы препаратов согласно АТХ, применяющиеся при лечении
Госпитализация
Показания для госпитализации:
Показания для экстренной госпитализации:
· впервые выявленный миелодиспластический синдром;
· геморрагический и анемический синдромы с выраженными клиническими проявлениями;
· фебрильная нейтропения.
Показания для плановой госпитализации:
· Проведение иммуносупрессивной терапии АТГ;
· Проведение химиотерапии;
· Аллогенная трансплантация гемопоэтических стволовых клеток.