Мегалобластная анемия что это такое у женщин
Мегалобластная анемия что это такое у женщин
Мегалобластическая анемия коренным образом отличается от гипохромной анемии, при которой нарушение касается клеточного созревания (за счет неполноценности синтезирования гемоглобина), равно как и от апластической анемии, при которой нарушается дифференциация «клеток-штамм» в кровяные клетки.
Мегалобластоз — патофизиологические рамки, морфология
Основным нарушением, обусловливающим мегалобластическую морфологию является недостаточное синтезирование ДНК (биохимическими механизмами, описанными далее). Результаты этого дефицита следующие:
а) Увеличивается межмитотическая фаза, во время которой продолжается синтез РНК и белков. Это объясняет утрату количественного равновесия между ДНК и РНК, что, в морфологическом плане проявляется изменением отношения ядро-цитоплазма в пользу последней.
б) Кровяные клетки не подвергаются нормальному числу делений (в основном это касается последних трех делений эритробластического ряда) (Weicker, Rohr), при этом ядро остается большим и выглядит как «молодое », в то время как в цитоплазме развивается характеристика зрелой клетки (асинхронизм созревания ядра и цитоплазмы).
Нарушение механизма деления ядра проявляется атипическими митозами (многополюсными, с тонкими хромосомами, под острым углом и неоднородно распределенными), тенденцией к почкованию ядра и чрезмерным сегментированием (в гранулоцитном и мегакариоцитном рядах), аспектами кариорексиса и ядерных остатков (в эритроидном ряде); при этом наличие полиплоидных клеток (4n, 8n или даже более, с единым или множественным ядром) отражают тяжелый дефицит.
в) Отмеченное мегалобластическое расстройство обусловливает усиленное внутрикостномозговое разрушение этих клеток, пропорционально степени дефицита (неэффективность кроветворения, отражающаяся в высоком уровне лактикодегидрогеназы и билирубина, и ростом «ранней фракции» последней). Показатель разрушения находящихся в кровообращении элементов также высок, а средняя продолжительность жизни эритроцитов равняется 1/2—1/3 нормы.
г) Последствием неполноценного кроветворения является анемия, которая (под стимулирующим влиянием эритропоэтина) способствует развитию эритробластической гиперплазии (при изменении отношения Э:Г, росте клеточной костаномозговой массы и гематопоэтической преобразовании жирного костного мозга), что усиливает дефицит фолиевой кислоты или витамина В12 (за счет увеличенного расхода) и замыкает порочный круг усугублением мегалобластоза и анемии.
В основе количественных и качественных изменений остальных двух костномозговых рядов находятся те же нарушения, которые поражают и эритробластный ряд. Неэффективный грапулоцитопоэз поддерживается не только морфологическими альтерационными изменениями, но также повышением уровня мурамидазы в сыворотке (Perillie).
Неэффективность мегакариопоэза, отмечаемая при мегалобластной анемии, которую подсказывал контраст между ростом общей массы мегакариоцитов костного мозга и периферической тромбоцитопзнией, была подтверждена работами Harker и Finch, установивших среднюю выработку, на ядерную единицу, шести тромбоцитов вместо сорока (норма). Рост разрушения гранулоцитов и тромбоцитов на периферии — возможно путем увеличенной секвестрации селезенкой — может способствовать, в различной степени, развивающейся при этом цитопении.
Подобные клеточные альтерационные изменения наблюдаются и в других клеточных системах, в основном у тех, характерной чертой которых составляет коэффициент быстрого деления, в том числе эпителий пищеварительного тракта (в отдельных случаях и клетки зародыша, плодных придатков). В этом следует искать объяснение некоторых клинических признаков или осложнений (глоссит, затруднения пищеварения, расстройство поглощения, перинатальные осложнения и пр.).
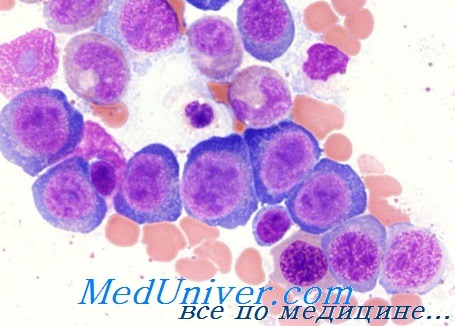
Общим диагностическим элементом мегалобластных анемий является определение мегалобластной морфологии всех кровяных клеток костного мозга и периферической крови.
Термином мегалобласт определяются предшественники эритроцитов. В принципе мегалобласт крупнее соответствующего нормального эритробласта с измененным отношением ядро-цитоплазма в пользу последней. Ядро промегалобласта (диаметром 20—30 u) объемистое, нередко расположено эксцентрично, хроматинная структура в виде жемчужин, содержит несколько крупных ядрышек синеватой окраски; цитоплазма синего цвета, наиболее ясная зона расположена вокруг ядра, причем может сохраниться и на последующих стадиях.
На стадии базофильного мегалобласта ядро уменьшается, отсутствуют ядрышка, хроматинная структура более плотная, однако не наблюдаются характерные для базофильного нормобласта скопления, базофильность цитоплазмы станитовся более резкой. На стадии полихроматофильного мегалобласта отражен наиболее ярко асинхронизм созревания между ядром (еще крупным, с едва начинающим организоваться в виде блоков хроматинном) и цитоплазмой (растянутой, полихроматофильной, нередко с наличием телец Жолли). Диаметр оксифильного мегалобласта колеблется от 10 до 18 u, его цитоплазма полностью оксифильная и хроматинная структура ядра еще выявима.
Мегалоцит характеризуется более крупными размерами (от 12 до 14 u), отсутствием ясной центральной зоны (большей толщиной) и часто чуть овальной формой.
Происходящие в гранулоцитном ряде мегалобластические изменения отражаются в увеличенном, в принципе, размере клетки и обильности цитоплазмы. Эти признаки проявляются более четко в гигантских метамиелоцитах, имеющих крупное ядро, весьма скудную хроматинную структуру, не соответствующей форме ядра, при этом цитоплазма продолжает оставаться базофильной. Наблюдается тенденция к гиперсегментированию в результате чего образуется форма гиперсегментированных гранулоцитов (6, 8, 10 и более сегментов), хроматинная структура которых, однако, менее плотная (в отдельных случаях сегментирование частичное, в виде надреза).
Изменения мегакариоцитов менее четкие, в некоторых случаях их размеры отклоняются от нормы, зернистость недостаточная. Хроматинная структура менее плотная, естественная тенденция к сегментированию ядра усиливается, появляются отделившиеся сегменты или сегменты в виде «виноградной грозди» или «взрывных» мегакариоцитов. Тромбоциты крупнее (макро- или даже мегатромбоциты) с лучше выраженной структурой, чем нормальная.
Что касается этиопатогенеза мегалобластической анемии отмечаем, что значительные достижения последних двух десятилетий в изучении этого заболевания привели к выделению следующих трех основных категорий, из них первые две включают случаи, обусловливаемые недостатком витамина В12 и фолиевой кислоты (с возможным их сочетанием при определенных обстоятельствах), а третья — более редкие случаи этого заболевания, независимые от первых двух недостатков, вызываемые известными или еще неизвестными причинами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Анемия (малокровие)
Содержание статьи:
Анемия (малокровие) – патология, для которой свойственно снижение уровня гемоглобина в крови, количества эритроцитов (красных кровяных телец), изменение их формы. Пониженный гемоглобин – обязательный признак анемии, изменение числа эритроцитов и их деформация присутствуют не всегда.
Анемия – распространенное заболевание. Ему подвержены более четверти всего населения мира – 27,9 % или 1,9 млрд человек. Ежегодный темп прироста анемий составляет 6,6 %. Чаще всего патология встречается у детей дошкольного возраста (47,4 % от всех случаев), женщин, особенно во время беременности, реже – у мужчин (12,7 %). В России анемия ежегодно диагностируется у более чем 1,5 млн пациентов.
Причины возникновения патологии
Железодефицитная анемия (ЖДА), самая частая форма малокровия, обусловлена тремя факторами: недостаток поступления железа, его усиленная потеря, высокая потребность в этом микроэлементе, не восполняемая в достаточной мере.
Одна из причин недостатка поступления железа – неполноценное питание (недоедание, однообразное меню с малым количеством белка и красного мяса, вегетарианство, искусственное вскармливание). Кроме того, поступлению необходимого объема микроэлемента препятствует нарушение его усвояемости. Это происходит из-за различных патологий, мешающих ионизации железа в желудке (гастрит с атрофией слизистой, резекция желудка, гипо- и авитаминоз витамина C), и затрудняющих его всасывание в кишечнике (дуоденит, энтерит, колит).
Потерю железа сверх нормы провоцируют кровотечения – из носа, десен, желудочно-кишечные, геморроидальные, маточные, почечные, геморрагические диатезы, частое донорство.
Гиперпотребность в железе вызывают физиологические и патологические состояния. К физиологическим относятся интенсивный рост и половое созревание, беременность и кормление грудью, профессиональные тренировки, тяжелые физические нагрузки. К патологическим – глистные инвазии.
Дефицит железа бывает связан с некоторыми инфекционными болезнями, также нехватка этого элемента фиксируется у детей, рожденных матерями с анемией.
Группы риска
Исходя из причин, можно выделить категории людей, подверженных развитию малокровия:
Патогенез болезни
Ведущее звено патогенеза ЖДА – нарушение синтеза гемоглобина вследствие снижения запасов железа, которое крайне необходимо для нормальной жизнедеятельности организма. Железо присутствует в составе гемоглобина и миоглобина, отвечает за транспортировку кислорода, различные биохимические процессы.
Железо всасывается в кровь из желудочно-кишечного тракта (ЖКТ), соединяется с трансферрином и либо накапливается в печени в составе белка ферритина, либо направляется в красный костный мозг, где с его участием идет синтез гемоглобина. Некоторая часть микроэлемента в составе трансферрина принимает участие в окислительно-восстановительных реакциях в тканях.
Симптомы анемии
Общие признаки:
Зачастую начальные симптомы заболевания при легкой стадии анемии пациенты списывают на усталость, недосып, тяжелый рабочий график. Человека должны насторожить такие признаки как слабость при незначительной нагрузке, чувство разбитости, сонливость даже после полноценного ночного сна. В этом случае следует сдать общий анализ крови, чтобы не пропустить начало заболевания.
При острых и тяжелых анемиях возможно резкое ухудшение самочувствия – тошнота, рвота, обмороки, вплоть до гипоксической комы.
Классификация
Разновидности анемии в зависимости от причины:
По качественным и количественным показателям:
В этой классификации применяется величина цветового показателя крови (ЦП), норма которого равна 0,86-1,1. При нормохромной анемии ЦП остается в допустимых пределах, при гипохромной – опускается ниже 0,86, при гиперхромной – поднимается выше 1,1.
По течению (для геморрагических анемий):
Стадии анемии
ЖДА развивается, последовательно проходя три этапа:
Для ЖДА выделяют три степени тяжести, каждой из которых соответствует определенный уровень гемоглобина. В норме показатель составляет от 110 до 130 г/л, нижняя граница допустима для детей и беременных женщин, верхняя – для мужчин.
| Степень тяжести | Уровень гемоглобина (г/л) |
|---|---|
| Легкая | 100-129 |
| Средняя | 70-109 |
| Тяжелая | менее 70-80 |
Диагностические мероприятия
Основа диагностики анемии – общий (ОАК) и биохимический анализ крови.
По биохимическому анализу оцениваются уровень сывороточного железа и ферритина, увеличение общей железосвязывающей способности сыворотки, коэффициент насыщения трансферрина железом.
Лечение анемии
Важный этап в лечении – устранение факторов, вызывающих недостаток железа. Одновременно больному назначается терапия для нормализации уровня этого микроэлемента. Диета – важная составляющая процесса лечения, но она является вспомогательным элементом, вылечить анемию без применения лекарств невозможно.
В основе лечения – препараты железа. Предпочтение отдается пероральному приему лекарств, инъекционно они вводятся только при тяжелом течении анемии, необходимости быстрого восстановления уровня железа, непереносимости или неэффективности пероральных препаратов, заболеваниях органов пищеварения, препятствующих всасыванию лекарственных средств.
Помимо препаратов железа рекомендованы витамины (B12, C), фолиевая кислота.
Для лечения отдельных видов анемий применяются специальные методы. При постгеморрагической анемии требуется восполнение объема циркулирующей крови, в том числе с помощью гемотрансфузий. При апластической анемии показаны гемотрансфузии, гормональная терапия и другие мероприятия, вплоть до трансплантации костного мозга.
Лечение железодефицитной анемии продолжается от 3 до 6 месяцев. Его нельзя прекращать сразу после восстановления уровня гемоглобина, в организме должен сформироваться запас железа.
Осложнения болезни
Последствия анемии возникают при ее долгом течении и отсутствии терапии. Дефицит железа в организме вызывает ослабление иммунитета, уменьшается сопротивляемость простудным, вирусным, бактериальным заболеваниям. Возможны осложнения со стороны нервной системы, нарушения функций печени, сбои менструального цикла. Из-за постоянной гипоксии возникают нарушения функций сердечно-сосудистой системы – дистрофия миокарда, застойные явления, развивается сердечно-сосудистая недостаточность. Наиболее тяжелым осложнением анемии является гипоксическая кома.
Прогноз и профилактика анемии
При своевременной диагностике и адекватной терапии прогноз благоприятный. Как правило заболевание лечится амбулаторно, госпитализация пациента не требуется.
Для профилактики ЖДА необходимо полноценное питание с достаточным поступлением белка, ежегодная сдача общего анализа крови, контроль за состоянием здоровья в целом и устранение заболеваний, которые могут стать источником пусть даже небольшой хронической кровопотери. Люди из групп риска по назначению врача могут ежегодно принимать курс препаратов железа, однако делать это самостоятельно недопустимо, так как бесконтрольный прием этих лекарств может вызвать тяжелые побочные эффекты.
Источники:
| Прием (осмотр, консультация) врача-гематолога первичный, лечебно-диагностический, амбулаторный |
* Ознакомиться подробнее с условиями можно здесь — Лечение в кредит или рассрочку.
Анемия пернициозная (В12-дефицитная, фолиеводефицитная, мегалобластная)
Терминология
Длинный, но не полный список диагнозов-синонимов, послуживший заголовком статьи, нуждается в комментарии; попутно прояснится и содержание этих терминов.
Из чего состоит наша кровь, в чем заключается ее биологическая роль, что такое анемия – этим вопросам посвящены материалы «Клинический анализ крови» и «Анемия. Кровь и бескровие». Более подробно о витаминах группы В можно узнать из статей «Витамин В. Гиповитаминоз» и «Витамин В. Гипервитаминоз».
Пернициозная в переводе с латыни на русский означает «опасная», а в переводе на медицинский – «тяжелая, протекающая злокачественно, прогностически неблагоприятная».
Мегалобластная (иногда пишут «мегалобластическая») означает, что в костном мозге находится большое количество крупных клеток, представляющих собой «недоэритроциты» – одну из промежуточных, незрелых форм красных кровяных телец.
В12 – это витамин (понятно, какой группы), иначе называемый фактором Касла и представленный четырьмя различными кобальтсодержащими веществами с одинаковыми биологическими свойствами, что и позволило выделить их в единую подгруппу витамина В.
Фолиевая (досл. «лиственная») кислота – витамин той же группы, а именно В9.
Таким образом, получаем: опасная, злокачественно протекающая В-витаминодефицитная незрело-эритроцитная анемия. Раньше ее так и называли: злокачественная анемия или злокачественное малокровие. Но еще ее называют болезнью Аддисона-Бирмера или бирмеровой анемией, и вот почему.
В 1822 году симптомы некоего тяжелого заболевания крови впервые упомянул английский врач Дж.С.Комб. В 1849 году его соотечественник, выдающийся врач и ученый Томас Аддисон дал более развернутое описание и толкование. Существенно позже, – в 1871 году, но независимо от Аддисона, – немецкий исследователь Микаэль Антон Бирмер в деталях изучил и охарактеризовал это заболевание, которому дал название прогрессирующая пернициозная анемия.
Позже лечение от анемии напряженно искал американец Уильям Мерфи (от анемии вообще, без нозологического деления), производя эксперименты на искусственно обескровленных собаках. Мерфи кормил их различными продуктами и сравнивал темпы восстановления; его внимание обратила на себя сырая печень. С 1920-х годов усилиями У.Мерфи, Дж.Уиппла и Дж.Майнота пернициозная анемия перестала быть однозначно и стопроцентно летальной болезнью: спасительное лекарство крылось именно в печени. А закончилось все тем, что Мерфи, Уиппл и Майнот в 1934 году получили Нобелевскую премию, – за то, что выделили вещество (группу соединений, как выяснилось), известное сегодня под названием витамин В12.
В серии статей о витаминах Лахта Клиника неоднократно обращала внимание на то, что история открытия и изучения этих удивительных веществ оказалась очень непростой, извилистой, порой драматичной. Но человечество вообще и медицина в частности отличаются невероятным самосохранительным упрямством, когда что-то угрожает нам по-настоящему. Сегодня на очереди сердечнососудистая патология, злокачественные опухоли, вирусные гепатиты, аутоиммунные и наследственные болезни. И никуда, образно говоря, эти убийцы от нас не спрячутся, – как не спрятались чума и лепра, авитаминозы и анемии: истинные причины будут изобличены, патогенез досконально изучен, лекарства найдены. Поскорее бы только, господа ученые. Поскорее бы. Мы знаем, что делается все мыслимое и немыслимое; знаем, что где-то в лабораториях, клиниках, университетских центрах морщат высокие лбы и трут воспаленные от бессонницы глаза современные Каслы, Аддисоны, Бирмеры, Дженнеры, Мечниковы, Флемминги. И все-таки – поторопитесь, пожалуйста…
Возвращаясь к запутанной проблеме В12-дефицитной анемии: анемия пернициозная – это не синоним, это частный случай. Как уже ясно из сказанного, недостаток кобальтсодержащих витаминов и фолиевой кислоты в организме может быть обусловлен двумя принципиально разными причинами.
Причины
Первая причина – дефицит внешнего фактора Касла, каковой фактор должен регулярно поступать с пищей. В сравнении с другими незаменимыми нутриентами, фолатов и витаминов В12 нужно не так много, но все-таки они жизненно необходимы. Соответственно, их дефицит может быть обусловлен недостаточным и несбалансированным питанием (в том числе вегетарианством, отказом от пищи ради «модельной фигуры», нервно-психической анорексией и т.п.).
Вторая группа причин значительно обширней: она охватывает множество заболеваний и состояний, снижающих концентрацию внутреннего фактора Касла, – желудочного мукопротеида, без которого даже при достаточном поступлении витаминов В9 и В12 невозможно их усвоение. К таким состояниям относится ряд желудочно-кишечных заболеваний, особенно тех, что поражают тонкий кишечник (в т.ч. инфекционные энтериты, болезнь Крона и мн.др.); постоперационные синдромы, связанные с частичной резекций желудка и/или кишечника; патология печени (в печени содержится депо данной группы витаминов, которого хватает на несколько лет). Недостаток транскобаламина (белка, осуществляющего транспорт витаминов В12) в редких случаях может быть наследственным. К нарушениям метаболизма внешнего фактора Касла приводит также избыточный и слишком продолжительный прием антибиотиков, антацидов, пероральных контрацептивов; гельминтозы; гиперактивность некоторых бактериальных культур; аутоиммунные расстройства; онкопроцессы; химические ожоги слизистой желудка; алкоголизм.
Потребность в фолатах и В12 возрастает при беременности.
Распространенность данной разновидности анемии в общей популяции оценивается на уровне 1%, с преобладанием женщин. В выборках пожилого и старческого возраста доля лиц с В12-дефицитной анемией возрастает до 10% и более, – за счет инволюционных изменений в тканях, секреторных процессах и общем метаболизме.
Симптоматика
Помимо общеанемической симптоматики, обусловленной хроническим кислородным голоданием тканей (астенический синдром, признаки дыхательной недостаточности, кардиальные нарушения), типичными симптомами пернициозной анемии выступают поражение желудочно-кишечного тракта, центральной и периферической нервной системы. Характерен «лакированный» малиновый язык (глоссит, воспаление), ахилия (пищеварительная несостоятельность желудочного сока), атрофия слизистых ЖКТ, мышечная слабость, нарушения координации, походки, чувствительности. В некоторых случаях развиваются энкопрез и энурез. При длительной анемии дегенеративно-дистрофические процессы поражают миокард, обнаруживается демиелинизация нейронных оболочек. Выраженные нарушения наблюдаются со стороны ЦНС – от депрессивной подавленности до галлюцинаторно-бредовых психозов и деменции. Повышается онкологический риск на фоне атрофических и воспалительных процессов.
Диагностика
Быстрое и доказательное установление точного диагноза требует от врача высокой квалификации, большого опыта, а также постоянной настороженности в отношении гиповитаминозов. Подозрение на анемию, вызванную дефицитом внутреннего фактора Касла (пернициозная форма) или алиментарным, пищевым фактором, вызывается сочетанием неспецифических и характерных симптомов на фоне сниженного гемоглобина в общеклиническом анализе крови. При наличии такого подозрения назначается батарея лабораторных анализов, производится инструментальное обследование органов ЖКТ (рентгенография, ФГДС, ирригография, УЗИ и др.); по мере необходимости к лечебно-диагностическому процессу привлекаются кардиолог, невролог и другие специалисты.
Лечение
Терапевтическая стратегия определяется установленной этиологией анемии. Обязательными являются нормализация рациона, специальная диета, интенсивное лечение основного заболевания (если оно есть). Заместительная терапия цианкобаламином должна тщательно рассчитываться с учетом всех индивидуальных особенностей случая. Иногда имеются показания к назначению гормональных средств. При развитии жизнеугрожающего состояния прибегают к гемотрансфузиям. Паллиативные меры принимаются в зависимости от конкретного симптомокомплекса. Категорически исключен алкоголь – безжалостный антагонист витаминов группы В.
При поздней диагностике, длительном течении и запоздалом начале терапии изменения со стороны нервной системы могут оказаться глубокими и необратимыми.
Некоторые больные получают поддерживающее лечение пожизненно. Необходим также регулярный онкоконтроль.
Мегалобластная анемия
Мегалобластная анемия является заболеванием крови, при котором в её составе наблюдается очень большое количество красных кровяных клеток.
Как известно, эритроциты переносят кислород по всему организму. Без достаточного количества кислорода ткани и органы тела страдают от кислородного голодания.
В случае мегалобластной анемии подобное расстройство вызвано неполноценным формированием красных кровяных клеток, что в свою очередь влечет за собой появление большого количества незрелых и не полностью развитых других клеток крови. Эти эритроциты не функционируют полноценно и вытесняют здоровые клетки, вызывая анемию. Поскольку эти клетки являются недостаточно развитыми, их срок жизни и качественная функция также весьма ограничены.
Мегалобластная анемия заставляет костный мозг производить меньше клеток, а иногда эти клетки умирают ранее, чем положено по их продолжительности жизни (120 дней). Вместо круглой или дискообразной формы эритроциты при этом заболевании имеют овальную форму.
Механизм развития и причины мегалобластной анемии
Мегалобластная анемия относится к гетерогенной группе заболеваний, для которых характерны общие морфологические характеристики: крупные клетки с нарушением созревания ядра. Незрелость ядер определяется отношением их состояния к зрелости цитоплазмы. Эти клетки, которые можно рассмотреть в клетках костного мозга, получили название мегалобластов. Эти аномалии преимущественно связаны с нарушением синтеза ДНК, в меньшей степени – с нарушением синтеза РНК и белков. Мегалобластные изменения более очевидны в быстро делящихся клетках, например, клетках крови и желудочно-кишечных клетках.
Аномальные изменения не ограничиваются эритроцитами. Мегалобластная анемия может быть связана с панцитопенией, желудочно-кишечной дисфункцией и глосситом, изменениями личности, психозом и неврологическими расстройствами. Мегалобластные изменения могут произойти в результате ВИЧ-инфекции и миелодиспастических заболеваний.
Кобаламин (или витамин В12) необходим человеку в количестве 5-7 мкг в сутки.
Две наиболее распространенных причины мегалобластной анемии:
Когда причина состоит в дефиците В12, такая мегалобластная анемия называется злокачественной. При фолиевом дефиците развивается обычная мегалобластная анемия.
Другие причины такого заболевания могут заключаться в злоупотреблении алкоголем, последствиях химиотерапии, лейкозе. Вызывают этот вид анемии и болезни органов пищеварения. Некоторые заболевания нижней части пищеварительного тракта могут привести к мегалобластной анемии.
Нарушение всасывания может произойти по причине унаследованной врожденной мальабсорбции фолиевой кислоты. Это генетическое состояние, при котором дети не могут усваивать фолиевую кислоту в кишечнике. Как следствие, развивается мегалобластная анемия. Это состояние требует раннего интенсивного лечения для предотвращения долгосрочных проблем, таких как интеллектуальная инвалидность.
Существует и врожденная форма мегалобластной анемии, вызванная генетическими нарушениями и отклонениями. Хотя этот вид анемии может быть диагностирован в любом регионе, наиболее часто он диагностируется у жителей северного полушария Европы.
Симптомы мегалобластной анемии, диагностика
Первые симптомы мегалобластной анемии это:
Дополнительные симптомы: аномальная бледность, трудности при ходьбе, гладкая поверхность языка, слабость мышц. Симптомы этого заболевания могут напоминать обычную анемию или другие заболевания. Чем раньше обратиться с ребенком за помощью к врачу, тем быстрее можно будет убрать последствия этого вида анемии.
Этот тест оценивает поглощение организмом витамина B12. После того, как пациент употребляет специальную порцию витамина В12, спустя некоторое время оценивается образец мочи. Если количество В12 в моче минимально или отсутствует вовсе, человек здоров. Если же больной не в состоянии перерабатывать этот элемент, в моче фиксируется повышенное его количество.
Лечение мегалобластной анемии
Лечение мегалобластной анемии зависит от основной причины анемии. Оно также учитывает возраст, общее состояние здоровья, ответ организма на лечение и степень тяжести заболевания. Лечение может быть довольно продолжительным, если необходимо обеспечить полное выздоровление и проконтролировать, чтобы анемия не возобновилась.
Мегалобластная анемия врожденная, вызванная отсутствием фолиевой кислоты в организме, так же лечится при помощи инъекций фолиевой кислоты и перорального приема этого вещества.
Её уровень также помогают повысить такие продукты, как апельсины, листовые овощи, арахис, чечевица, спаржа и другие овощные культуры зеленого и желтого (белого) цвета.
Важно начать лечить мегалобластную анемию как можно раньше. Если организм подвергается постоянному дефициту фолиевой кислоты, может произойти повреждение нервной системы.
5 вариантов завтрака, которые помогут избавиться от жира на животе
Неправильные формы микропластика разрушают клетки человека и вызывают аллергию
Бег в районах с плохой экологией так же опасен, как и низкий уровень физической активности
Ученые: Из-за устойчивости к антибиотикам будет ежегодно погибать 10 млн человек
Деятельность, которая может спровоцировать инсульт в течение следующих 60 минут
Исследование: Человек эволюционировал и стал жить долго благодаря постоянной физической нагрузке