Мембранная экспрессия в опухолевых клетках что это такое
Диагностика экспрессии PD-L1
Что представляет собой лиганд программируемой клеточной гибели PD-L1?
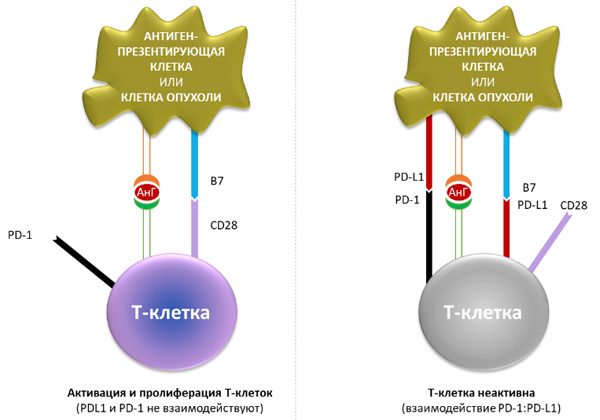
PD-L1 – лиганд рецептора программируемой клеточной гибели 1 (PD-1). Это трансмембранный белок с молекулярной массой 40 кДа, экспрессируемый на T- и B-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. PD-L1 способен связываться не только с рецептором PD-1, но и обладает сродством к CD80 (B 7.1) – белку, находящемуся на поверхности дендритных клеток, активированных B-клеток и моноцитов, который стимулирует активацию и выживаемость Т-лимфоцитов путем взаимодействия с CD28 на их поверхности. Лиганд PD-L1 способен угнетать этот процесс путем конкурентного связывания с CD80. На рисунке 1 представлены межклеточные взаимодействия (активирующие и ингибирующие сигналы) между Т-лимфоцитом и антигенпрезентирующей клеткой.
Рисунок 1. PD-1/PD-L1 сигнальный каскад в межклеточном взаимодействии иммунокомпетентных клеток. При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов.
Роль PD-L1 в патогенезе злокачественных образований
Воздействие на сигнальный путь иммунной контрольной точки PD-1:PD-L1 лежит в основе иммунной терапии рака легкого, молочной железы, уротелиального рака и других злокачественных новообразований. Воздействие направлено на рецептор PD-1 и его лиганды PD-L1 и PD-L2. Наиболее важная роль в ускользании опухоли от иммунного ответа отводится взаимодействию рецептора PD-1 и лиганда PD-L1.
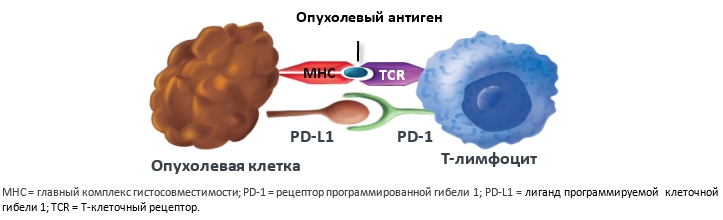
Длительная антигенная стимуляция, часто наблюдаемая при опухолевых заболеваниях, приводит к устойчивой экспрессии рецептора PD-1 на T-лимфоцитах и повышению экспрессии лигандов PD-L1 на опухолевых и иммунных клетках. Таким образом, опухоль вырабатывает механизм ускользания от иммунного ответа посредством гиперэкспрессии лиганда PD-L1, который, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность (рис.2).
Рисунок 2. Сигнальный путь PD-1:PD-L1, инактивирующий действие Т-лимфоцитов.
Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
Тест для определения экспрессии PD-L1 позволяет выделить группу пациентов с наибольшей вероятностью ответа на терапию ингибиторами иммунных контрольных точек. Важно учитывать, что для различных иммунных препаратов и показаний существуют отличия в методике проведения PD-L1 тестирования:
Вывод – перед проведением PD-L1 исследования необходимо удостовериться, что выбран правильный тест, на правильной культуре клеток и корректно интерпретировать полученные результаты.
Каким пациентам необходимо определение уровня PD-L1 экспрессии?
Анализ экспрессии PD-L1 в зависимости от планируемой к назначению терапии может быть рекомендован к назначению пациентам с:
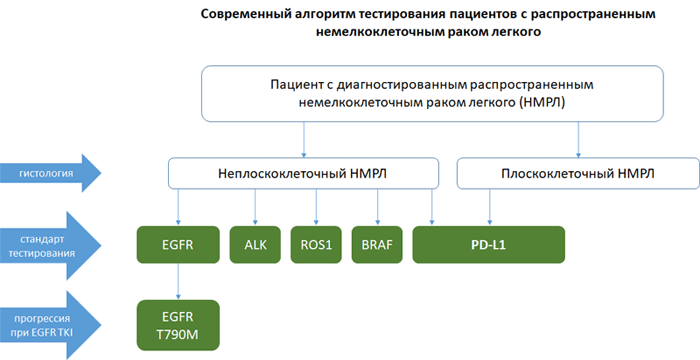
НМРЛ: методы определения экспрессии PD-L1
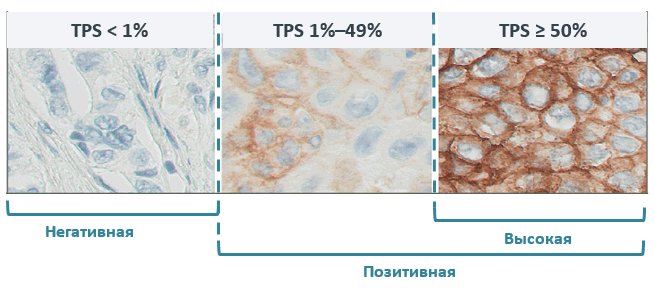
Экспрессия PD-L1 определяется методом иммуногистохимии. Оценка осуществляется путем подсчета соотношения опухолевых клеток с позитивным окрашиванием мембраны к общему количеству опухолевых клеток (TPS – tumor proportion score), результат выражается в процентах от 0 до 100.
В России зарегистрированы три диагностических набора для определения экспрессии PD-L1: производства Roche Diagnostics – PD-L1 sp142 и sp263, производства Dako – PD-L1 22C3. Тестирование проводится на платформах Ventana и Dako Autostainer Link 48 соответственно.
Экспрессия PD-L1 на опухолевых клетках
По уровню экспрессии PD-L1 выделяют следующие группы: отрицательная и позитивная экспрессия, в зависимости от количества окрашенных клеток.
Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин. Обязательным требованием является наличие в исследуемом образце не менее 100 живых опухолевых клеток.
Определение уровня экспрессии PD-L1 и персонализированный подход к выбору терапии, основанный на результатах иммуногистохимического тестирования, позволяет сделать лечение пациентов с немелкоклеточным раком легкого более эффективным и безопасным в 1 линии терапии.
Алгоритм тестирования при распространенном НМРЛ
УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
Стандартом терапии 1 линии пациентов с раком уротелия продолжают быть химиотерапевтические режимы на основе цисплатина [4]. Однако по данным литературы до 50% больных не подходят для назначения данной терапии [5]. Ситуация с лечением изменилась с появлением иммунотерапевтических анти-PD-L1 препаратов [7]. Сейчас для назначения иммунотерапии в первой линии распространенного уротелиального рака пациентам, которые не могут перенести ципсплатин, рекомендовано проведение PD-L1 диагностики. Для остальных групп пациентов диагностика PD-L1 не требуется (при невозможности проведения любой платиносодержащей химиотерапии и у пациентов с прогрессированием заболевания в ходе или после окончания любой платиносодержащей химиотерапии или в течение 12 месяцев после неоадъювантной или адъювантной химиотерапии).
Какой метод используется для определения экспрессии PD-L1 у пациентов с уротелиальным раком?
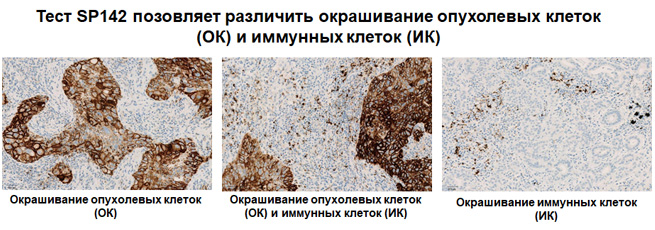
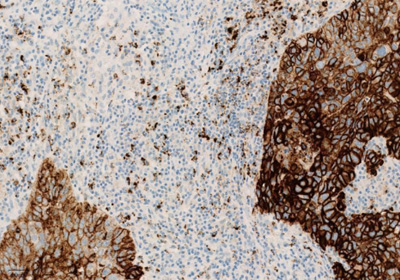
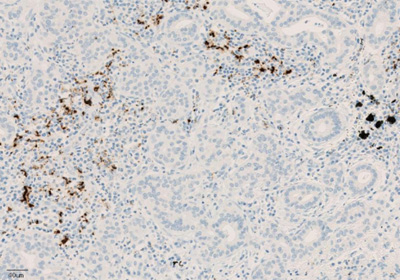
Экспрессия PD-L1 определяется методом иммуногистохимии. Для этих целей используется диагностический набор Ventana PD-L1 (SP142) Assay (Ventana Medical Systems, Inc.). Для тестирования используется ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. PD-L1 статус у пациентов с уротелиальной карциномой определяется как часть площади опухоли, занятая PD-L1 экспрессирующими иммунными клетками, инфильтрирующими опухоль, любой интенсивности окрашивания.
Рисунок 3. Окрашивание опухолевых и иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Рисунок 4. Окрашивание иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Определение уровня экспрессии PD-L1 иммуногистохимическим методом позволяет выделить группу пациентов для назначения анти-PD-L1 терапии.
Какой уровень PD-L1 экспрессии является основанием для назначения иммуннотерапии при уротелиальном раке?
Наличие у пациентов экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань уротелиальной карциномы, по данным клинических исследований ассоциирована с увеличением частоты объективного ответа на иммунную терапию.
ТНРМЖ: методы определения экспрессии PD-L1
Тройной негативный рак молочной железы – самая агрессивная форма среди рака молочной железы [4]. Традиционно применяемая химиотерапия не позволяла достичь значимого увеличения продолжительности жизни свыше медианы в 18 месяцев. Появление анти-PD-L1 терапии, с одной стороны, позволило преодолеть медиану общей выживаемости в 2 года, а с другой стороны – для назначения терапии необходимо выделить группу PD-L1 позитивных пациентов. В отличие от уротелиального рака, назначение анти-PD-L1 терапии обязательно требует тестирования пациенток с тройным негативным раком молочной железы.
Какой метод используется для определения экспрессии PD-L1 у пациентов с ТНРМЖ?
При определении статуса PD-L1 для решения вопроса об иммунотерапии важно выбрать оптимальный метод. Тест VENTANA PD-L1 (SP142) позволяет идентифицировать пациентов с тройным негативным раком молочной железы (ТНРМЖ), которые могут получать анти-PD-L1 терпию.
Ткани пациентов с ТНРМЖ, окрашенные с использованием теста VENTANA PD-L1 (SP142), оценивают по окрашиванию инфильтрирующих опухоль иммунных клеток (IC). IC – это иммунные клетки, присутствующие в интратуморальной и прилегающей перитуморальной строме. В это понятие включены лимфоциты, макрофаги, дендритные клетки и полиморфноядерные лейкоциты. IC оценивают как долю области опухоли, которую занимают иммунные клетки с окрашиванием PD-L1 любой интенсивности.
Какой уровень PD-L1 экспрессии является основанием для назначения иммунной терапии при ТНРМЖ?
Наличие у пациентов экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, по данным клинических исследований ассоциирована с увеличением общей выживаемости, выживаемости без прогрессирования и частоты объективного ответа на иммунную терапию.
О программе определения экспрессии PD-L1
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Исследование PD-L1
Для чего определяют PD-L1 и при каких опухолях?
Иммунотерапия является достаточно эффективным инструментом в борьбе с опухолями, особенно на поздних стадиях. Определять наличие PD-L1 в опухолевых клетках нужно заранее, чтобы узнать, будет ли работать терапия моноклональными антителами или нет.
Экспрессию PD-L1 определяют при:
В зависимости от уровня экспрессии PD-L1, результат может быть:
Что такое Т-лимфоциты и как они связаны с PD-L1?
Т-лимфоциты- это специальные клетки, которые уничтожают клетки-мишени (опухолевые, мутированые и др.), регулируют иммунный ответ. В том числе, они формируют иммунную память.
На поверхности Т-лимфоцитов есть белок PD1, который является рецептором.
На поверхности других клеток (как иммунных так и опухолевых) есть специальные молекулы (лиганды), в данном случае они называются PD-L1 и PD-L2. Эти структуры подходят друг к другу как “ключ и замок”.
Когда происходит их взаимодействие, “ключ вошел в замок”, Т-лимфоциты прекращают образовываться, снижается их активность и выживаемость. В ходе чего они перестают осуществлять свои основные функции защиты.
Поэтому этот путь PD1 — PD-L1 очень важен в противоопухолевом, трансплантационном иммунитете, аллергии и различный иммунопатологических состояниях.
Опухолевые клетки научились использовать этот механизм в свою пользу, чтобы обмануть иммунитет. Они “вооружаются” большим количеством PD-L1 и PD-L2, которые связываются с Т-лимфоцитами, тем самым активируют путь “обмана”. В ходе данной реакции иммунитет перестает видеть опухолевые клетки.
Иммунотерапия и PD-L1
В современной онкологии имеется понятие иммунотерапии рака.
В 2014 году были одобрены определенные препараты (моноклональные антитела), которые влияют на данный путь. Механизм иммунотерапии рака заключается в том, что препарат позволяет иммунитету «увидеть» опухоль и уничтожить её. Доказано, что антитела к белкам PD1 и PD-L1 борются с раком путем высвобождения Т-клеток организма. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
Как происходит исследование?
Нужно предоставить материал, который может быть биопсийным или операционным, в лабораторию UNIM. После чего он будет исследован методом иммуногистохимии.
Одним из обязательных условий является наличие достаточного материала (не менее 100 опухолевых клеток), чтобы адекватно оценить результат.
В ходе проведения исследования реакция будет оценена компетентным врачом-патоморфологом, после чего будет дан ответ.
Вести науки
Экспрессия PD-L1 связана с худшей выживаемостью при злокачественной мезотелиоме плевры
В настоящее время существует необходимость выявления прогностических биомаркеров для разработки подхода к лечению злокачественной мезотелиомы плевры (ЗМП), основанного на определении риска. Экспрессия лиганд‑1 программируемой гибели клеток (PD-L1) изучалась как прогностический биомаркер в ряде опухолей, учитывая его важную роль в уклонении от противоопухолевого иммунного ответа. В четырех ранее опубликованных анализах было обнаружено, что позитивность PD-L1 является неблагоприятным прогностическим фактором выживания при ЗМП. Это исследование направлено на дальнейшее изучение взаимосвязи между экспрессией PD-L1 в тканях мезотелиомы и результатами выживания.
Были проанализированы клинические данные пациентов ЗМП из одного учреждения в период с 2006 по 2016 год). Позитивность PD-L1 определялась как >1% мембранного окрашивания, независимо от интенсивности.
Были проанализированы данные пятидесяти восьми пациентов. Средний возраст составил 73 года, большинство из них были мужчинами (49, 84%) и имели ECOG между 0 и 2 (46, 79%). Наиболее распространенным гистопатологическим подтипом был эпителиоид (42, 72%), двухфазный подтип (9, 16%) и саркоматоид (7, 12%). Тридцать один пациент (53%) получил лучший поддерживающий уход, а двадцать семь пациентов (47%) получили химиотерапию или комбинированное лечение. Сорок два пациента (72,4%) имели положительную экспрессию PD-L1. Среднее время выживания для группы отрицательного PD-L1 составило 15,5 месяца и 6 месяцев для группы положительного PD-L1. Положительная экспрессия PD-L1 независимо коррелирует с худшим прогнозом (ОР = 2,02, 95%ДИ, 1,005-4,057, p = 0,0844).
Анализ показал более высокий процент пациентов с ЗМП с положительным PD-L1 (> 1%) по сравнению с другими исследованиями. Высокая положительная экспрессия PD-L1 ассоциировалась со статистически значимо более низким средним временем выживания.
Источник: PubMed
Nguyen BH1, Montgomery R2,3, Fadia M2,3, Wang J4, Ali S1,3.
PD-L1 expression associated with worse survival outcome in malignant pleural mesothelioma. // Asia Pac J Clin Oncol. 2018 Feb;14(1):69-73. doi: 10.1111/ajco.12788. Epub 2017 Nov 3.
Мембранная экспрессия в опухолевых клетках что это такое
PD-L1− это химическое вещество, лиганд, экспрессируемый опухолевыми клетками. На поверхности иммунокомпетентных клеток (Т-лимфоцитов) присутствует белок PD-1 (сокр. от Programmed cell Death-1). Когда Т-лимфоцит пытается прикрепиться к раковой клетке, чтобы разрушить ее, протеин PD-1 связывается с имеющимся на ее поверхности лигандом PD-L1. В результате функционирование иммунных клеток ингибируется: тормозится пролиферация, не происходит выделение цитокинов, губительных для злокачественных клеток. Таким образом, раковая опухоль отражает иммунную атаку и продолжает свой дальнейший рост. Оценка уровня экспрессии молекулы PD-L1 рассматривается как потенциальный биомаркер прогноза эффективности и продолжительности лечения злокачественных новообразований.
Лиганд PD-L1, лиганд рецептора программируемой клеточной смерти 1.
Какой биоматериал можно использовать для исследования?
Образец ткани (в парафиновом блоке).
Общая информация об исследовании
В онкологии иммуногистохимическое исследование помогает выявить молекулярные структуры опухолевых клеток, ассоциированные со степенью дифференцировки, способностью их к инвазии и метастазированию, чувствительностью к химиотерапии, иммунотерапии, с особенностями течения и прогнозом заболевания у конкретного пациента; определить источник метастазирования при невыясненном первичном очаге, прогноз опухолевого процесса на дооперационном этапе и коррекцию схемы лечения; выбрать адекватную патогенетическую и таргетную терапию, определить наличие в опухолевых клетках различные точки приложения.
Доказано, что антитела к белкам PD-1 и PD-L1 борются с раком путем высвобождения Т-клеток организма, особого типа иммунных клеток. Исследователи Stanford University School of Medicine доказали, что эта терапия также борется с раковыми клетками совершенно другим способом, направляя иммунные клетки, называемые макрофагами, для поглощения и пожирания раковых клеток.
Не так давно исследователи обнаружили, что раковые клетки научились использовать эту иммунную защиту для своих собственных целей. Опухолевые клетки разворачивают производство PD-L1-белков, которые распознаются PD-1-рецепторами, ингибируя атаку Т-клеток на опухоли. Больные раком лечатся антителами, блокирующими PD-1-рецепторы или фиксирующимися на обязательном партнере PD-L1, чтобы выключить «противоуничтожающий» сигнал и позволить Т-клеткам атаковать.
Также было обнаружено, что активация PD-1 ингибирует антираковую активность других иммунных клеток, макрофагов, и, когда PD-1 или PD-L1 рецепторы блокируются антителами, это заставляет эти макрофагиальные клетки атаковать рак.
В современной онкологии иммуногистохимическое исследование, в частности определение рецептора PD-L1 в ткани опухоли, играет важнейшую роль, так как при помощи этого онкологи определяют наличие тех или иных факторов в опухоли, которые позволяют грамотно и адекватно составить дальнейшее лечение пациента и говорить о прогнозах заболевания.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Заключение о позитивности/негативности опухоли по рецептору PD-L1.
Избыточная экспрессия PD-L1 выявляется в клетках более чем 50% опухолей человека, причем наиболее характерна для следующих новообразований:
— глиобластома и смешанная глиома (в 100% случаев),
— назофарингеальная карцинома (68-100%),
— множественная миелома (93%),
— опухоли мочевого пузыря (28-100%),
— немелкоклеточный рак легкого (35-95%),
— аденокарцинома кишечника (53%),
— гепатоцеллюлярная карцинома (45-93%),
— рак поджелудочной железы (39%),
— злокачественные опухоли желудка и пищевода (42%).
Повышенная экспрессия PD-L1 в опухоли ассоциирована с неблагоприятным прогнозом при различных типах рака, включая рак почки, рак мочевого пузыря, рак пищевода, рак желудка, рак поджелудочной железы, рак печени, рак яичников.
Кто назначает исследование?
Особенности экспрессии и прогностическое значение пептидных молекул, связанных с ключевыми свойствами почечно-клеточного рака
1 ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону; 2 МБУЗ «Городская больница скорой медицинской помощи», Таганрог
В настоящее время почечно-клеточный рак (ПКР) является значимой проблемой урологии. Он составляет 3 % злокачественных новообразований у взрослого населения. Заболеваемость ПКР растет за последние десятилетия в среднем на 3–4 % в год. Возможно, этот рост связан с широким распространением методов прижизненной визуализации почек (УЗИ, компьютерная томография, магнитно-резонансная томография) [1]. Существующие способы оценки прогноза, учитывающие клинические особенности новообразования, его стадию, степень дифференцировки, гистологические особенности, несмотря на высокую прогностическую способность, не могут с достаточной точностью предсказать течение опухолевого процесса у конкретного пациента, так как не учитывают индивидуальные свойства ПКР. Кроме того, затруднена оценка прогноза при разных стадиях новообразования. В связи с этим современный подход к прогнозированию клинического течения ПКР заключается в поиске биологических маркеров, определяющих ключевые свойства опухоли, такие как повышенная пролиферативная активность, резистентность к апоптозу, способность к инвазии и метастазированию, подавление иммунных реакций [2].
Целью нашей работы было оценить особенности экспрессии молекул, связанных с фенотипом раковой стволовой клетки (CD133, N-кадгерин): TGF-α — фактора роста для эпителия канальцев и карбоангидразы IX (CAIX) — одной из ключевых молекул, связанных с VHL-молекулярным путем канцерогенеза при ПКР.
Результаты исследования
1. TGF-α TGF-α — мультифункциональный клеточный регуляторный пептид с широким спектром эффектов, связанных с клеточным ростом и дифференцировкой. В почке он является стимулятором пролиферации эпителия проксимальных канальцев. Эффекты TGF-α реализуются через рецепторы к эпидермальному фактору роста [3, 4].
Экспрессия TGF-α встретилась в 36 наблюдениях (59 %) ПКР. Наиболее часто TGF-α выявляли при светлоклеточном раке (55,9 %) (рис. 1–3), папиллярной форме первого типа (100 %) (рис. 4), реже при хромофобном раке (23,1 %) (рис. 5). Преимущественно экспрессия TGF-α определялась в цитоплазме опухолевых клеток (59 %), реже вдоль клеточных мембран (32,8 %). При анализе возможных взаимосвязей между экспрессией TGF-α и клиническими характеристиками ПКР установлено, что пол, возраст, индекс массы тела пациентов, наличие в анамнезе артериальной гипертензии, симптомность ПКР, наличие лабораторных признаков хронической болезни почек не влияли на экспрессию TGF-α. При анализе экспрессии TGF-α и основных морфологических характеристик ПКР, имеющих прогностическое значение (табл. 1), выявлена связь между наличием в опухоли этого маркера и степенью дифференцировки новообразования (c2 = 6,816; p 2
2. N-кадгерин N-кадгерин — это мембранный белок из надсемейства кадгеринов, участвующий в образовании кальцийзависимых межклеточных контактов. Высокий уровень экспрессии этого кадгерина характерен для мезодермы эмбриона. Исследования последних лет указывают на то, что N-кадгерин может быть маркером эпителиально-мезенхимального перехода, определяющим приобретение опухолевыми клетками агрессивных свойств (инвазия и метастазирование) [5].
Экспрессия N-кадгерина встретилась в 38 наблюдениях рака почки (62,3 %). Достоверно часто N-кадгерин выявляли при светлоклеточном (80 %) (p 0,05
3. CD133 СD133, или проминин-1, — трансмембранный гликопротеин, который экспрессируется в гемопоэтических стволовых клетках [6]. Последние годы экспрессию этого белка используют для выделения пула так называемых раковых стволовых клеток. Гипоксия и активация HIF-1α могут индуцировать пролиферацию CD133+-клеток. Экспрессия CD133+ может быть динамичной и меняться в зависимости от состояния микроокружения клеток [7].
Экспрессия CD133 встретилась в 37 наблюдениях рака почки (60,6 %). Наиболее часто CD133 выявляли при светлоклеточном (80 %) (рис. 8, 9) и папиллярном (рис. 10) вариантах ПКР (69,2 %). При хромофобном раке экспрессия CD133 отсутствовала. Для CD133 характерна преимущественно цитоплазматическая экспрессия (60,6 %), реже — мембранная (44,3 %).
При оценке возможных ассоциаций между экспрессией CD133 и клиническими характеристиками опухоли выявлены взаимосвязи с возрастом пациентов (c2 = 17,467; p 2
4. Карбоангидраза IX Карбоангидраза IX (CA-IX) является HIF-1αрегулируемым трансмембранным белком, связанным с новообразованиями, агрессивным фенотипом опухоли и неблагоприятным прогнозом при светлоклеточном раке почки [8]. Принято считать, что CA-IX помогает в регулировании внутриклеточного и внеклеточного уровней рН в ответ на гипоксию ткани опухоли.
Экспрессия CA-IX выявлена в 35 наблюдениях (57,4 %), преимущественно при светлоклеточном варианте ПКР (97,1 %) (рис. 11, 12), при хромофобном раке в 1 наблюдении отмечено слабое очаговое окрашивание антителами к CA-IX, при папиллярном раке экспрессия отсутствовала. При симптомном ПКР достоверно чаще встречалась экспрессия CA-IX (c2 = 6,213; p 0,05
Обсуждение
Наше исследование продемонстрировало, что экспрессия TGF-α, N-кадгерина, CD133 и CA-IX отличается при разных гистогенетических формах ПКР, что отражает особенности молекулярно-биологических путей, лежащих в основе их развития. Так, экспрессия CA-IX присуща только светлоклеточному варианту ПКР, экспрессия N-кадгерина, CD133 характерна для светлоклеточных опухолей и папиллярного варианта ПКР первого типа и отсутствует при хромофобных раках. Наши результаты согласуются с данными литературы. Так, В. Knebelmann et al. (2009) указали, что экспрессию TGF-α может подавлять белок VHL. Ряд исследователей продемонстрировали повышенную экспрессию TGF-α по сравнению с нормальной тканью при светлоклеточном и папиллярном вариантах почечно-клеточного рака [9, 10]. При этом показано, что этот фактор роста — один из вероятных факторов, индуцирующих развитие рака почки уже на ранних стадиях. При хромофобном варианте рака почки отсутствует экспрессия TGF-α, что, возможно, определяет низкий злокачественный потенциал этой формы новообразований и их слабую васкуляризацию [11]. Экспрессия N-кадгерина при светлоклеточном и папиллярном вариантах почечно-клеточного рака описана в работах J. Markovic-Lipkovski et al. (2001), T. Shimazui et al. (2006), C.L. Behnes et al. (2012) [12–14]. Гистогенетическая связь экспрессии этих маркеров с разными вариантами ПКР может позволить использовать их для морфологической дифференциальной диагностики. Кроме того, выявление этих молекул в биологических жидкостях (кровь, моча) может дать возможность проводить скрининг и мониторинг рака почки у пациентов.
Участие исследованных нами молекул в основных молекулярных путях развития и прогрессии ПКР определяет их прогностическое значение. Так, показана роль N-кадгерина в трансэндотелиальной миграции раковых клеток, что является важным этапом в процессе метастазирования [5]. Повышенная экспрессия этого маркера может ассоциироваться с плохим прогнозом течения рака почки [12, 15, 16].
W.H. Costa et al. (2012) выявили, что около 50 % раков почки экспрессировали CD133. Y. Zhang et al. (2013) обнаружили экспрессию CD133 в 21 % случаев почечно-клеточных опухолей. Ряд исследователей указывают, что высокая экспрессия CD133 может быть благоприятным прогностическим фактором [16–19]. Однако G. Feng et al. (2014) отметили высокий риск рецидивирования и развития метастазов у пациентов с повышенным уровнем матричной РНК гена CD133 в крови [20]. Предполагается, что CD133-позитивные клетки в почечно-клеточном раке поддерживают клеточную популяцию опухоли и служат источником дифференцированных злокачественных клеток [21].
Высокая экспрессия CA-IX связана с благоприятным прогнозом при локализованном и метастатическом ПКР [22]. Было установлено, что уровень экспрессии CA-IX обратно пропорционален риску метастазирования (р = 0,036) и высокая экспрессия CA-IX предполагает лучшую выживаемость даже после учета таких факторов, как Т-стадия, шкала Fuhrman и общее состояние пациента (все р ≤ 0,005) [23]. Низкая экспрессия CA-IX (≤ 85 %) ассоциируется с неблагоприятным исходом у больных с метастатическим ПКР (отношение рисков [OR]: 3,10; р 3.0.co;2-e.
5. Ramis-Conde I, Chaplain MA, Anderson AR, Drasdo D. Multiscale modelling of cancer cell intravasation: the role of cadherins in metastasis. Phys Biol. 2009;6(1):016008. doi: 10.1088/14783975/6/1/016008.
6. Mizrak D, Brittan M, Alison M. CD133: molecule of the moment. J Pathol. 2008;214(1):3-9. doi: 10.1002/path.2283.
7. Li Z. CD133: a stem cell biomarker and beyond. Exp Hematol Oncol. 2013;2(1):17. doi: 10.1186/2162-3619-2-17.
8. Tostain J, Li G, Gentil-Perret A, Gigante M. Carbonic anhydrase 9 in clear cell renal cell carcinoma: a marker for diagnosis, prognosis and treatment. Eur J Cancer. 2010;46(18):3141-3148. doi: 10.1016/j.ejca.2010.07.020.
9. Knebelmann B, Ananth S, Cohen HT, Sukhatme VP. Transforming growth factor alpha is a target for the von Hippel-Lindau tumor suppressor. Cancer Res. 1998;58(2):226-231.
10. Ramp U, Reinecke P, Gabbert HE, Gerharz CD. Differential response to transforming growth factor (TGF)-alpha and fibroblast growth factor (FGF) in human renal cell carcinomas of the clear cell and papillary types. Eur J Cancer. 2000;36(7):932-941. doi: 10.1016/s0959-8049(00)00030-7.
11. Chudek J, Schullerus D, Wilhelm M, Kovacs G. Lack of interleukin 6 (IL-6) and transforming growth factor alpha (TGF-alpha) expression in chromophobe renal cell carcinomas. Br J Cancer. 1998;78(9):1162-1164. doi: 10.1038/bjc.1998.647.
12. Shimazui T, Kojima T, Onozawa M, et al. Expression profile of N-cadherin differs from other classical cadherins as a prognostic marker in renal cell carcinoma. Oncol Rep. 2006;15(5):1181-4. doi: 10.3892/or.15.5.1181.
13. Markovic-Lipkovski J, Brasanac D, Müller GA, Müller CA. Cadherins and integrins in renal cell carcinoma: an immunohistochemical study. Tumori. 2001;87(3):173-178. 14. Behnes CL, Hemmerlein B, Strauss A, et al. N-cadherin is differentially expressed in histological subtypes of papillary renal cell carcinoma. Diagn Pathol. 2012;7:95. doi: 10.1186/17461596-7-95.
15. Zhou N, Lu F, Liu C,etal. IL-8 inducestheepithelial-mesenchymal transition of renal cell carcinoma cells through the activation of AKT signaling. Oncol Lett. 2016;12(3):1915-1920. doi: 10.3892/ ol.2016.4900.
16. Conant JL, Peng Z, Evans MF, et al. Sarcomatoid renal cell carcinoma is an example of epithelial-mesenchymal transition. J Clin Pathol. 2011;64(12):1088-1092. doi: 10.1136/jclinpath-2011-200216.
17. Costa WH, Rocha RM, Cunha IW, et al. CD133 immunohistochemical expression predicts progression and cancer-related death in renal cell carcinoma. World J Urol. 2012;30(4):553-558. doi: 10.1007/s00345-011-0769-x.
18. Cheng B, Yang G, Jiang R, et al. Cancer stem cell markers predict a poor prognosis in renal cell carcinoma: a meta-analysis. Oncotarget. 2016;7(40):65862-65875. doi: 10.18632/oncotarget.11672.
19. Matak D, Szymanski L, Szczylik C, et al. Biology of renal tumour cancer stem cells applied in medicine. Contemporary Oncology. 2015;19(1A): A44-A51. doi: 10.5114/wo.2014.47128.
20. Feng G, Jiang F, Pan C, et al. Quantification of peripheral blood CD133 mRNA in identifying metastasis and in predicting recurrence of patients with clear cell renal cell carcinoma. Urol Oncol. 2014;32(1):44.e9-14. doi: 10.1016/j.urolonc.2013.06.003.
21. Al-Lamki RS, Wang J, Yang J, et al. Tumor necrosis factor receptor 2-signaling in CD133-expressing cells in renal clear cell carcinoma. Oncotarget. 2016;7(17):24111-24124. doi: 10.18632/ oncotarget.8125.
22. Zhang BY, Thompson RH, Lohse CM, et al. Carbonic anhydrase IX (CAIX) is not an independent predictor of outcome in patients with clear cell renal cell carcinoma (ccRCC) after longterm follow-up. BJU Int. 2013;111(7):1046-1053. doi: 10.1111/ bju.12075.
23. Bui MH, Seligson D, Han KR, et al. Carbonic anhydrase IX is an independent predictor of survival in advanced renal clear cell carcinoma: implications for prognosis and therapy. Clin Cancer Res. 2003;9(2):802-11.
24. Phuoc NB, Ehara H, Gotoh T, et al. Prognostic value of the co-expression ofcarbonicanhydraseIX and vascularendothelial growth factor in patients with clear cell renal cell carcinoma. Oncol Rep. 2008;20(3):525-530. doi: 10.3892/or_00000037.
25. Ingels A, Hew M, Algaba F, et al. Vimentin over-expression and carbonic anhydrase IX under-expression are independent predictors of recurrence, specific and overall survival in non-metastatic clear-cell renal carcinoma: a validation study. World J Urol. 2017;35(1):81-87. doi: 10.1007/s00345-016-1854-y
Статья опубликована в журнале «Урологические ведомости». Номер №4/2017 стр. 5-19