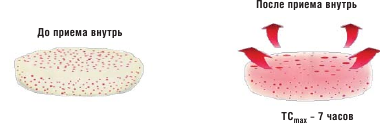Мерифатин или глюкофаж что лучше
Метформин с пролонгированным высвобождением (Глюкофаж Лонг) – высокоэффективный и безопасный препарат первой линии в лечении сахарного диабета 2 типа
Опубликовано в журнале:
Русский Медицинский Журнал, Том 19, No 12, 2011
Следует отметить, что метформин оказывает влияние на всасывание углеводов в желудочно-кишечном тракте, замедляя его скорость, а также снижает аппетит [10,13]. Интестинальные эффекты метформина вносят существенный вклад в предотвращение постпрандиальных гипергликемических пиков, ассоциированных с риском преждевременной смертности от ССЗ [12,16,20]. Полагают, что один их механизмов анорексигенного действия метформина связан с влиянием препарата на метаболизм глюкогоноподобного пептида-1 (ГПП-1), регулирующего пищевое поведение. Так, в работе Mannucci E. с соавт. (2001) определяли уровни ГПП-1 (7-36) амида/(7-37) исходно и через 15 дней терапии метформином (25-50 мг/сут.) у больных с ожирением до и после нагрузки глюкозой [13]. С целью устранения влияния инсулинемии и гликемии на секрецию ГПП-1 исследование проводилось в условиях эугликемического гиперинсулинемического клэмпа. Авторы не обнаружили изменений концентраций ГПП-1 у лиц контрольной группы. В то же время у больных с ожирением метформин вызывал существенное увеличение концентрации ГПП-1 (7-36)амида/(7-37) на 30 и 60-й минутах теста при неизмененном базальном уровне пептида. В смешанной плазме (после 30 мин. инкубации при 37°), а также в растворе буфера, содержащем дипептидил-пептидазу-4, метформин ингибировал деградацию ГПП-1. Согласно результатам экспериментальных исследований на животных моделях анорексигенный эффект метформина, по-видимому, также связан с центральным действием препарата на уровне гипоталамических нейронов [5]. Модулируя экспрессию орексигенного нейропептида Y, метформин способствует снижению массы тела. Другим важным эффектом метформина является уменьшение или стабилизация массы тела, а также снижение отложения висцерального жира [4,11,17].
Абсолютная биодоступность метформина, введенного per os, cоставляет 50-60%. Почти весь метформин, попадающий в кровоток, всасывается на ограниченном участке верхних отделов желудочно-кишечного тракта (рис. 1), и лишь незначительная часть метформина всасывается в более дистальных отделах пищеварительного тракта.
Рис. 1. Создание метформина пролонгированного действия с однократным приемом: сложная задача
Кроме того, всасывание метформина в тонком кишечнике является «насыщающимся». Это означает, что при увеличении концентрации метформина в просвете кишечника выше определенного порогового уровня происходит «насыщение всасывания», тем самым значительная часть препарата проходит мимо «окна абсорбции» и не всасывается вовсе. Таким образом, уровень всасывания метформина из ЖКТ зависит от скорости эвакуации метформина из желудка.
Эти особенности определяют сложность разработки таблеток метформина с замедленным высвобождением, пригодных для приема один раз в сутки.
Традиционно используемые для этого лекарственные формы основываются на простом замедлении высвобождения активного вещества из таблетки, а его всасывание происходит на всем протяжении кишечника. Но даже в этом случае нередко имеется период относительно быстрого поступления препарата в кровоток вскоре после приема таблетки.
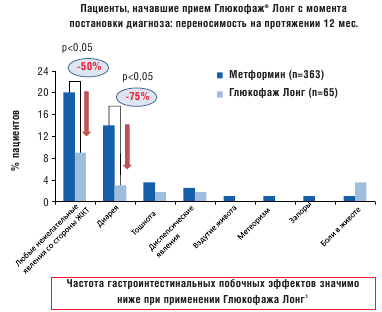
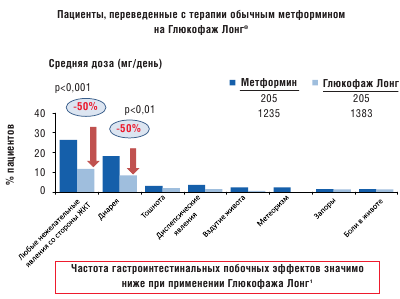
Такое традиционное строение таблетки нельзя применить для препарата Глюкофаж ® Лонг ввиду того, что метформин не будет всасываться после прохождения таблеткой абсорбционного окна. Кроме того, начальный период быстрого высвобождения вещества из таблетки может «насытить» абсорбционное окно и привести к потере активного ингредиента. После приема метформина с быстрым высвобождением пиковая концентрация препарата в крови наступает в течение 3 часов. Разработанная новая форма метформина XR (Глюкофаж Лонг) имеет целью устранить проблемы, связанные с желудочно-кишечной непереносимостью, с одной стороны, и многократным приемом препарата, с другой стороны. Замедленное высвобождение препарата увеличивает время достижения пиковой концентрации до 7 часов при снижении ее максимального уровня [19]. Таким образом, лекарственная форма Глюкофаж Лонг имеет сниженную пиковую концентрацию, но аналогичную с метформином быстрого высвобождения биодоступность. В рандомизированном двойном слепом исследовании в параллельных группах Глюкофаж Лонг показал такую же эффективность в снижении уровня гликированного гемоглобина, как и метформин быстрого высвобождения [7]. С целью сравнения гастроинтестинальной переносимости метформина с пролонгированным и быстрым высвобождением был проведен ретроспективный анализ медицинских карт пациентов с сахарным диабетом 2 типа в четырех центрах США, где было выявлено существенное снижение частоты желудочно-кишечных нежелательных явлений у пациентов, переведенных с терапии метформином быстрого высвобождения на Глюкофаж Лонг [2] (рис. 2 и 3).
Рис. 2. Сравнение частоты гастроинтестинальных побочных эффектов у пациентов, принимавших метформин и Глюкофаж Лонг с момента постановки диагноза
Рис. 3. Сравнение частоты гастроинтестинальных побочных эффектов у пациентов, принимавших метформин и переведенных с терапии обычным метформином на Глюкофаж Лонг
Пролонгированный эффект Глюкофажа Лонг обеспечивается оригинальной структурой таблетки (рис. 4), в которой создана система диффузии через гелевый барьер (рис. 5). Метформин содержится внутри двухслойного гидрофильного полимерного матрикса, что обеспечивает высвобождение препарата путем диффузии. Наружный, закрытый полимерный матрикс (без метформина) окружает внутренний полимер, содержащий суммарно 500 мг метформина в таблетке. При проглатывании, таблетка впитывает влагу и набухает, образуя слой геля на внешней стороне таблетки, что обеспечивает дозированное высвобождение метформина в кишечнике. Важно отметить, что скорость растворения метформина не зависит от перистальтики, уровня pH, что помогает свести к минимуму вариабельность поступления метформина в ЖКТ как у одного пациента, так и в группах пациентов.
Рис. 4. строение таблетки Глюкофаж Лонг
Рис. 5.Глюкофаж Лонг: инновационная технология производства
Всасывание метформина из таблетки с пролонгированным высвобождением медленное и более длительное по сравнению с обычной формой. В исследовании по фармакокинетике изучались метформин с пролонгированным высвобождением (2000 мг один раз в сутки) и обычный метформин (1000 мг два раза в сутки) после достижения равновесной концентрации. Время достижения максимальной концентрации в плазме (Tmax) после приема метформина с пролонгированным высвобождением было больше, чем после обычного метформина (7 часов по сравнению с 3-4 часами). Кроме того, максимальная концентрация препарата в плазме (Cmax) на фоне приема пролонгированной формы была на 25% меньше. Суммарное воздействие метформина на пациента было сходным. В действительности, анализ площади под кривой зависимости концентрация-время свидетельствует о биоэквивалентности данных препаратов.
Таким образом, фармакокинетический профиль метформина с пролонгированным высвобождением позволяет избежать быстрого подъема концентрации метформина в плазме, характерного для обычного метформина. Более плавное поступление метформина позволяет избежать появления нежелательных явлений со стороны ЖКТ, и может улучшать переносимость препарата.
Повышение приверженности пациентов к лечению, а также снижение нежелательных явлений со стороны желудочно-кишечного тракта являются важными достоинствами препарата, однако первостепенное значение имеет влияние на показатели гликемии у больных сахарным диабетом 2 типа. Полученные результаты подтверждают имеющиеся данные, что сахароснижающий эффект метформина с пролонгированным высвобождением при приеме 1 раз в сутки сравним с эффектом обычного метформина, назначаемого в несколько приемов в течение дня.
В исследовании по определению дозы Глюкофажа Лонг была показана его дозозависимая эффективность при приеме 1 раз в сутки. Максимальное действие этой формы препарата было достигнуто на дозе 1500-2000 мг/сут. В проведенном исследовании также изучалась эффективность Глюкофажа Лонг 1000 мг, назначаемым 2 раза в сутки по сравнению с однократным приемом той же формы, но в дозе 2000 мг 1 раз в сутки. Динамика уровня HbA1c (снижение в среднем на 1,2% при режиме 1000 мг 2 раза в сутки) была сходной с таковой для группы пациентов, получавших препарат 2000 мг 1 раз в сутки (снижение в среднем на 1%).
Перспективы использования пролонгированной формы метформина в лечении сахарного диабета 2-го типа
Рассмотрены особенности терапии больных сахарным диабетом 2-го типа метформином в обычной и пролонгированной форме. Создание пролонгированной формы метформина является крайне актуальной для практической диабетологии и может стать новой вехой в истории пре
Are examined the special features of therapy of patients by 2nd type diabetes mellitus with metformin in the usual and prolonged form. The creation of the prolonged form of metformin is extremely immediate for practical diabetology and can become new landmark in the history of the preparations of the class of biguanide.
Сахарный диабет (СД) 2-го типа имеет большое социально-экономическое значение. Силы множества исследователей и организаций направлены на создание новых фармакологических агентов, позволяющих компенсировать заболевание. В настоящее время, несмотря на обилие новых разработанных сахароснижающих средств, для лечения СД 2-го типа наиболее часто используется метформин.
Можно считать, что история клинического применения препаратов класса бигуанидов началась в средневековой Европе. В те времена для лечения чумы, гельминтозов, укусов змей, дизурии использовали растение Galega officinalis (французская лилия). Есть основания полагать, что это средство применяли в народной медицине для лечения симптомов, которые в настоящее время связываются с развитием СД [8].
В начале 20 века было описано несколько экстрактов Galega officinalis, снижающих гликемию (гуанидин, галегин (изоамилен гуанидин)), а также синтетическим путем были получены синталины (А и В), использовавшиеся для лечения пациентов на протяжении десятка лет. Метформин впервые был описан в 1922 году Эмилем Вернером и Джеймсом Беллом. Слотта и Чеше в 1929 году обнаружили его сахароснижающее действие у кроликов. С открытием инсулина и его широким внедрением в клиническую практику исследования бигуанидов прекратились и были забыты. Не был информирован о результатах этих исследований и Жан Стерн, клинический фармаколог, работавший в Париже. Он, независимо от немецких исследователей, предпринял ряд опытов над одним из экстрактов французской лилии — галегином. Стерн выделил метформин (диметилбигуанид) и предложил его в качестве фармакологического средства для лечения СД. Исследователь дал название препарату — «глюкофаг», что означало «пожирающий глюкозу». Результаты работы Ж. Стерна были опубликованы в 1957 году. В этом же году Унгар предложил использовать фенформин, а в 1958 году Менерт доложил о буформине [8].
Фенформин и буформин вызывали более выраженное снижение гликемии, чем метформин, однако при применении этих средств часто развивался лактацидоз. Это привело к тому, что препараты перестали использоваться в клинической практике к концу 70-х годов. Наиболее безопасным представителем этого класса в отношении развития лактат-ацидоза является метформин. Оригинальным препаратом метформина является Глюкофаж®.
Сахароснижающий эффект метформина связан с уменьшением всасывания углеводов в кишечнике, снижением продукции глюкозы печенью из-за подавления глюконеогенеза и гликогенолиза в печени, повышением чувствительности к инсулину периферических тканей и улучшением утилизации глюкозы в печеночных, мышечных, жировых клетках [2, 3]. Отмечено снижение повышенного систолического и диастолического давления у лиц с инсулинорезистентностью, как при наличии сахарного диабета, так и при его отсутствии [1, 9]. Снижение артериального давления при приеме метформина (Глюкофажа®) обусловлено нормализацией цикла сокращения/расслабления артериол и уменьшением проницаемости сосудистой стенки. Метформин прямо или косвенно воздействует на многие звенья липидного обмена, снижая проявления дислипидемии [5, 9]. Установлено, что препарат способствует снижению в крови триглицеридов, липопротеидов низкой плотности, повышению липопротеидов высокой плотности, снижению уровня свободных жирных кислот, угнетению липолиза в жировых и мышечных клетках. Метформин обладает легким анорексигенным эффектом, обусловленным прямым контактом препарата со слизистой оболочкой желудочно-кишечного тракта, что приводит к уменьшению аппетита и небольшому снижению массы тела. Не исключается его влияние на метаболизм глюкагоноподобного пептида-1 и воздействие на гипоталамические нейроны. В последнее время было установлено, что метформин повышает аффинность инсулиновых рецепторов и стимулирует рецепторные и пострецепторные пути передачи инсулинового сигнала, что приводит к увеличению поглощения глюкозы печеночными, мышечными и жировыми клетками. Кроме того, метформин может уменьшать неблагоприятное влияние окислительного стресса на развитие сосудистых осложнений [1].
Благоприятный эффект препарата на различные звенья метаболизма в организме позволил расширить показания к его применению у лиц с метаболическим синдромом с нарушением гликемии натощак и нарушенной толерантности к глюкозе для профилактики развития сахарного диабета и в качестве кардиопротективного средства [1, 7]. Препарат также можно применять больным с абдоминальным типом ожирения, если диетотерапия в течение 6 месяцев не привела к улучшению метаболических показателей [4], особенно у больных с нарушенной толерантностью к глюкозе и у больных с мягкой артериальной гипертензией с проявлениями инсулинорезистентности. Максимальная доза метформина при лечении метаболического синдрома 1500–1700 мг/сут [7]. У детей с сахарным диабетом разрешено лечение препаратом Глюкофаж® с 10-летнего возраста. Назначение препарата женщинам с синдромом поликистозных яичников и гирсутизмом приводит к снижению инсулинорезистентности, уровней тестостерона и андростендиона и повышению содержания глобулина, связывающего половые гормоны. Это способствует восстановлению нормального овуляторного менструального цикла и репродукции.
Противопоказаниями к назначению препаратов группы метформина являются наличие беременности, нарушение функции почек и гипоксии любой этиологии (тяжелые заболевания сердечно-сосудистой и дыхательной системы, острый инфаркт миокарда, нестабильная стенокардия, острые и тяжелые нарушения ритма сердца, острые стрессорные ситуации, хирургические вмешательства, тяжелые инфекции и травмы, острые и хронические нарушения мозгового кровообращения), заболевания печени с нарушением функции, злоупотребление алкоголем, фолиево-, В12— и железодефицитные состояния. Временная отмена метформина должна производиться перед исследованиями, сопровождающимися внутривенным введением йодсодержащих рентгеноконтрастных веществ [3, 5].
Механизм действия метформина в настоящее время хорошо изучен. Все ведущие мировые ассоциации по лечению СД (Американская диабетическая ассоциация (ADA), Европейская ассоциация по изучению диабета (EASD), Британский национальный институт здоровья и качества медицинской помощи (NICE), Российская ассоциация эндокринологов (РАЭ)) рекомендуют метформин в качестве препарата выбора при дебюте заболевания. В исследовании United Kingdom Prospective Diabetes Study (UKPDS) по лечению СД 2-го типа было доказано, что раннее назначение метформина (Глюкофажа®) пациентам с СД 2-го типа приводит к уменьшению смертности от сердечно-сосудистых осложнений [10]. При этом у метформина были обнаружены дополнительные положительные плейотропные эффекты.
На протяжении более полувека метформин используется в неизменном виде. Наиболее частым побочным эффектом препарата являются негативные явления со стороны желудочно-кишечного тракта (до 25% пациентов). Побочные эффекты метформина включают тошноту, рвоту, «металлический» привкус во рту, диарею, кишечные колики и метеоризм. Расстройства со стороны желудочно-кишечного тракта часто возникают в начале лечения или при повышении дозы препарата, но через несколько недель могут исчезать. Достаточно часто симптомы сохраняются длительно. Значительная доля больных с диспептическими расстройствами отказывается от приема метформина. Еще одной проблемой является необходимость приема препарата 2–3 раза в сутки, что снижает комплаентность. В случае хронических заболеваний, таких как СД 2-го типа, степень приверженности лечению у пациентов очень важна. Биодоступность обычных форм метформина при пероральном приеме составляет лишь 50–60% [6].
С целью преодоления этих барьеров и для оптимизации лечения пациентов с СД 2-го типа разработана инновационная форма метформина — Глюкофаж® Лонг — оригинальный препарат метформина в форме таблеток пролонгированного действия с возможностью применения один раз в сутки. Эта разработка является крайне актуальной для практической диабетологии и может стать новой вехой в истории препаратов класса бигуанидов.
Трудности разработки препарата метформина длительного действия связаны с тем, что активное вещество всасывается большей частью из верхних отделов кишечника. Кроме того, в тонкой кишке имеет место насыщаемость по отношению к метформину. Это означает, что при превышении определенного порогового значения концентрации в просвете кишки вещество перестает всасываться. Таким образом, традиционный подход, включающий разработку таблетки, из которой вещество будет высвобождаться на всем протяжении кишечника, в случае метформина не применим [6].
Таблетка Глюкофажа® Лонг создана благодаря уникальной запатентованной технологии — диффузионной системы ГельШилд (GelShield). Таблетка представляет собой двойную гелевую гидрофильную систему: внешний плотный аморфный полимер, не содержащий метформин, окружает расположенные в нем гранулы внутреннего полимера, содержащие метформин. После приема таблетки внешний полимер абсорбирует воду и набухает, вследствие чего таблетка в желудке превращается в гелеобразную массу. Метформин медленно проникает через внешний полимерный гель, высвобождаясь из таблетки, и попадает в кровоток. При этом таблетка дольше задерживается в желудке, обеспечивая контролируемое выделение метформина в желудочно-кишечный тракт посредством диффузии из гелевой таблетки. Таким образом система GelShield обеспечивает более медленное, ровное и длительное поступление Глюкофажа® без начального быстрого подъема концентрации препарата в плазме.
При исследовании фармакодинамики Глюкофажа® Лонг было доказано, что пиковая концентрация препарата в крови наступает позже (7 часов после приема таблетки Глюкофаж® Лонг и 2,5–3 часа при приеме метформина быстрого высвобождения), а также уменьшена по амплитуде по сравнению с таковой при приеме обычной формы метформина (при приеме Глюкофажа® Лонг она ниже на 25–30%). Площадь под кривой зависимости концентрация/время сравнима при приеме двух форм препарата. В клинических исследованиях было показано, что эффективность для компенсации СД 2-го типа при приеме обычной формы метформина, метформина с пролонгированным действием (Глюкофажа® Лонг) 1 раз в сутки, а также при двукратном приеме препарата пролонгированного действия одинакова. В исследованиях было показано, что риск развития любых нежелательных явлений со стороны желудочно-кишечного тракта, а также диареи у пациентов, принимающих Глюкофаж® Лонг, на 50% ниже, чем при приеме стандартной формы метформина. Однократный прием позволяет улучшить комплаентность пациентов [6].
Глюкофаж® Лонг применяется в дозе 500–2000 мг в сутки. Как правило, препарат назначают во время вечернего приема пищи один раз в день (стартовая доза — 500 мг). Титрация дозы осуществляется 1 раз в 10–15 дней до достижения целевых значений гликемии. Медленное повышение дозы метформина способствует снижению риска развития побочных эффектов. Перевод пациента с обычного метформина на пролонгированную форму можно осуществлять назначением пациенту дозы Глюкофажа® Лонг, идентичной суммарной дозе метформина быстрого высвобождения за сутки.
Применение метформина пролонгированного действия (Глюкофаж® Лонг) существенно оптимизирует лечение по сравнению с традиционной лекарственной формой метформина, так как позволяет значительно снизить выраженность гастроинтестинальных нежелательных явлений и сокращает частоту приема препарата до 1 раза в сутки.
Литература
Е. А. Волкова, кандидат медицинских наук, доцент
В. А. Колосков, кандидат медицинских наук, доцент
А. В. Федорова, кандидат медицинских наук, доцент
С. Н. Фогт
ГБОУ ВПО СЗГМУ им. И. И. Мечникова Минздравсоцразвития России, Санкт-Петербург
Инсулинорезистентность и пути ее коррекции при сахарном диабете 2 типа
Инсулинорезистентность — это недостаточный биологический ответ клеток на действие инсулина при его достаточной концентрации в крови. Биологические эффекты инсулина могут быть объединены в четыре группы: очень быстрые (секунды): гиперполяризация мембран
Инсулинорезистентность — это недостаточный биологический ответ клеток на действие инсулина при его достаточной концентрации в крови. Биологические эффекты инсулина могут быть объединены в четыре группы:
Таким образом, понятие инсулинорезистентности не сводится только к параметрам, характеризующим метаболизм углеводов, а включает также изменение метаболизма жиров, белков, функции эндотелия, экспрессии генов и др.
Можно выделить целый ряд заболеваний и физиологических состояний, сопровождающихся инсулинорезистентностью. Основные из них следующие (М. И. Балаболкин, 2001):
Термин «инсулинорезистентность» не следует отождествлять с «синдромом инсулинорезистентности» или «метаболическим синдромом», описанным G. Reaven (1988) и включающим в себя: нарушение толерантности к глюкозе (или СД 2 типа), артериальную гипертензию, гиперурикемию, гиперкоагуляцию, микроальбуминурию и некоторые другие системные нарушения.
Свое биологическое действие на уровне клетки инсулин осуществляет через соответствующий рецептор. Инсулиновый рецептор представляет собой белок, состоящий из двух α- и двух β-субъединиц. α-субъединица располагается на наружной поверхности клеточной мембраны, именно с ней связывается инсулин. β-субъединица является трансмембранным белком и обладает тирозинкиназной активностью, которая не проявляется при отсутствии инсулина. Присоединение инсулина к центру связывания на α-субъединицах активирует фермент, причем субстратом служит сам этот фермент, т. е. происходит аутофосфорилирование β-субъединицы рецептора инсулина по нескольким тирозиновым остаткам. Фосфорилирование β-субъединицы, в свою очередь, приводит к изменению субстратной специфичности фермента: теперь он способен фосфорилировать другие внутриклеточные белки — субстраты инсулинового рецептора (СИР). Известны СИР-1, СИР-2, а также некоторые белки семейства STAT (signal transducer and activator of transcription — переносчики сигнала и активаторы транскрипции). Фосфорилирование СИР ведет к плейотропной реакции клетки на инсулиновый сигнал. Мыши лабораторной линии, лишенные гена СИР-1, проявляют резистентность к инсулину и сниженную толерантность при нагрузке глюкозой. Инсулин при посредничестве СИР-1 активирует фосфатидилинозитол-3-киназу (ФИ-3-киназу). Активация ФИ-3-киназы является центральным звеном сигнального пути, стимулирующего транслокацию глюкозного транспортера ГЛЮТ-4 из цитозоля в плазматическую мембрану, а следовательно, и трансмембранный перенос глюкозы в мышечные и жировые клетки. Ингибиторы ФИ-3-киназы подавляют и базальное, и стимулированное инсулином потребление глюкозы; в последнем случае ингибируется транслокация ГЛЮТ-4 к мембране (M. Reaven Gerald, 1999).
Согласно современным представлениям резистентность периферических тканей (мышечной, жировой и ткани печени) к действию инсулина лежит в основе патогенеза СД 2 типа. Нарушения обменных процессов, наблюдаемые вследствие инсулинорезистентности при СД 2 типа, представлены в таблице 1.
Инсулинорезистентность мышечной ткани является наиболее ранним и, возможно, генетически определяемым дефектом, который намного опережает клиническую манифестацию СД 2 типа. Результаты исследований с применением ядерной магнитно-резонансной спектроскопии (NMR) показали (G. I. Shulman, D. L. Rothman, 1990), что синтез гликогена в мышцах играет принципиальную роль в инсулинобусловленном усвоении глюкозы как в норме, так и при СД 2 типа, вместе с тем нарушение синтеза гликогена является вторичным по отношению к дефектам транспорта и фосфорилирования глюкозы.
Снижение концентрации инсулина в печени характеризуется отсутствием его ингибирующего влияния на процессы глюконеогенеза, снижением синтеза гликогена, активацией процессов гликогенолиза, что в конечном итоге приводит к повышению продукции глюкозы печенью (R. A. DeFronzo, 1990).
Другим звеном, играющим значительную роль в развитии гипергликемии, является резистентность жировой ткани к действию инсулина, а именно резистентность к антилиполитическому действию инсулина. В результате неконтролируемого окисления липидов освобождается большое количество свободных жирных кислот (СЖК). Повышение их уровня ведет к ингибированию процессов транспорта и фосфорилирования глюкозы и, как следствие, к снижению окисления глюкозы и синтеза гликогена в мышцах (M. M. Hennes, E. Shrago, 1990). Таким образом, изменения жирового обмена, а именно метаболизма СЖК, способствуют нарушению утилизации глюкозы тканями.
Избыток СЖК активизирует процессы глюконеогенеза, влияет на синтез липопротеидов в печени, приводя к повышенному образованию липопротеинов очень низкой плотности (ЛПОНП) и триглицеридов, что сопровождается снижением уровня липопротеинов высокой плотности (ЛПВП) (R. H.Unger, 1995).
Длительное повышение уровня СЖК оказывает прямое повреждающее действие на β-клетки поджелудочной железы, что описано как эффект липотоксичности, результатом которого является снижение секреторной способности β-клеток панкреатических островков.
Состояние инсулинорезистентности и высокий риск развития СД 2 типа характерен для лиц с висцеральным, а не с периферическим характером распределения жировой клетчатки. Возможно, это связано с биохимическими особенностями висцеральной жировой ткани: она слабо реагирует на антилиполитический эффект инсулина. В висцеральной жировой ткани отмечено усиление синтеза фактора некроза опухолей, который снижает активность тирозинкиназы инсулинового рецептора и фосфорилирование СИР-белков. Гипертрофия адипоцитов при абдоминальном типе ожирения приводит к изменению конформации молекулы инсулинового рецептора и нарушению процессов связывания его с инсулином.
Пока β-клетки поджелудочной железы способны вырабатывать достаточное количество инсулина для компенсации перечисленных дефектов и поддерживать состояние гиперинсулинемии, гипергликемия будет отсутствовать. Однако при истощении резервов β-клеток возникает состояние относительной недостаточности инсулина, что проявляется повышением уровня сахара крови и манифестацией диабета. Как показали результаты исследований (Levy et al., 1998), у больных СД 2 типа находящихся только на диете, через 5–7 лет от начала заболевания происходит значительное снижение функции β-клеток, в то время как чувствительность тканей к инсулину практически не меняется. Существует немало клинических доказательств тому, что гиперинсулинемия является независимым фактором риска развития ишемической болезни сердца как у лиц, не имеющих СД 2 типа, так и у больных с СД 2 типа (S. Lebto et al., 2000).
Тактика лечения СД 2 типа должна быть направлена на нормализацию патогенетических процессов, лежащих в основе заболевания, т. е. на уменьшение инсулинорезистентности и улучшение функции β-клеток.
В настоящее время существуют нефармакологические и фармакологические методы коррекции инсулинорезистентности. К нефармакологическим методам относятся низкокалорийная диета, направленная на снижение массы тела, и физические нагрузки — фундамент на котором базируется лечение всех больных СД 2 типа с инсулинорезистентностью. Снижение веса может быть достигнуто при соблюдении низкокалорийной диеты, содержащей менее 30% жиров, менее 10% насыщенных жиров и более 15 г/ккал клетчатки, а также при регулярном режиме физических нагрузок.
Больным могут быть рекомендованы регулярные аэробные физические нагрузки средней интенсивности (пешие прогулки, плавание, равнинные лыжи, велосипед) продолжительностью 30–45 мин от 3 до 5 раз в неделю, а также любой посильный комплекс физических упражнений (J. Eriksson, S. Taimela, 1997). Физические нагрузки стимулируют инсулиннезависимое поглощение глюкозы, при этом индуцированное упражнениями увеличение потребления глюкозы не зависит от действия инсулина. Более того, во время физических нагрузок происходит парадоксальное снижение уровня инсулина в крови. Потребление глюкозы мышцами увеличивается, несмотря на падение уровня инсулина, при этом физическая нагрузка сопровождается перемещением ГЛЮТ-4 из другого пула, нежели под действием инсулина (N. S. Peirce, 1999).
В период дебюта заболевания, до формирования стойкого снижения секреторной функции β-клеток поджелудочной железы, особенно при избыточной массе тела или ожирении, препаратами выбора являются средства, снижающие инсулинорезистентность периферических тканей. К этой группе препаратов относятся бигуаниды и тиазолидиндионы (глитазоны).
В России, как и во всех странах мира, из группы бигуанидов применяется только метформин (сиофор, глюкофаж, глиформин).
Основной механизм действия метформина направлен на устранение продукции глюкозы печенью, а также на снижение инсулинорезистентности мышечной и жировой ткани. Препарат обладает способностью подавлять глюконеогенез, блокируя ферменты данного процесса в печени. В присутствии инсулина бигуаниды увеличивают периферическую утилизацию глюкозы мышцами, активируя тирозинкиназу инсулинового рецептора и транслокацию ГЛЮТ-4 и ГЛЮТ-1 в мышечных клетках. Бигуаниды повышают утилизацию глюкозы кишечником (усиливая анаэробный гликолиз), что проявляется в снижении уровня глюкозы в крови, оттекающей от кишечника. Длительное применение метформина положительно влияет на липидный обмен: приводит к снижению уровня холестерина и триглицеридов в крови. Механизм действия метформина — антигипергликемический, а не гипогликемический. Препарат не снижает содержание глюкозы в крови ниже ее нормального уровня — вот почему при монотерапии метформином отсутствуют гипогликемические состояния. По данным ряда авторов, метформин обладает аноректическим действием. У больных, получающих метформин, наблюдается снижение массы тела, преимущественно за счет уменьшения жировой ткани. Доказано положительное влияние препарата и на фибринолитические свойства крови за счет подавления ингибитора активатора плазминогена-1.
Результаты проспективного исследования, проведенного в Великобритании (UKPDS), показали, что применение метформина с момента установления диагноза снижает смертность от причин, связанных с СД, на 42%, общую смертность — на 36%, а частоту диабетических осложнений — на 32% (Lancet, 1998). Полученные данные свидетельствует о том, что прием метформина достоверно улучшает выживаемость и снижает риск развития осложнений СД 2 типа. При этом в исследовании UKPDS средняя суточная доза метформина (глюкофаж) составляла для большинства пациентов 2000 мг и выше. Именно доза 2000 мг/сут является оптимальной суточной дозой, при которой наблюдается лучший контроль сахара крови.
Показанием к назначению метформина является СД 2 типа на фоне избыточной массы тела или ожирения, при неудовлетворительной компенсации углеводного обмена на фоне диеты и физической нагрузки.
Начальная суточная доза метформина — 500 мг. Через 1 нед от начала терапии при отсутствии побочных эффектов дозу препарата увеличивают. Максимальная суточная доза препарата составляет 3000 мг. Принимают препарат 2–3 раза в день во время еды, что чрезвычайно важно для максимальной эффективности применения. Длительность действия препарата составляет 8–12 ч.
Среди побочных эффектов действия метформина следует отметить диарею, диспепсические расстройства, металлический вкус во рту. Побочные эффекты обычно исчезают при снижении дозы препарата. Упорная диарея является противопоказанием для отмены препарата.
Угнетая глюконеогенез, бигуаниды способствуют увеличению содержания лактата, пирувата, аланина (веществ, являющихся предшественниками глюкозы в процессе глюконеогенеза), что в крайне редких случаях может привести к развитию лактацидоза. Риск развития лактацидоза увеличивается при приеме чрезмерно больших доз препарата, у больных с почечной и печеночной недостаточностью, а также при наличии состояний, сопровождающихся гипоксией тканей.
Противопоказаниями к назначению метформина являются нарушения функций почек (снижение клиренса креатинина ниже 50 мл/мин или повышение креатинина в крови выше 1,5 ммоль/л), злоупотребление алкоголем, беременность, лактация, а также гипоксические состояния любой природы: недостаточность кровообращения, дыхательная недостаточность, анемия, острые инфекции, острый инфаркт миокарда, шок, внутривенное введение йодсодержащих контрастных веществ.
Исследования последних лет показали, что частота летального повышения в крови уровня молочной кислоты на фоне длительного лечения метформином составляет лишь 0,084 случая на 1000 больных в год. Соблюдение противопоказаний к назначению метформина исключает риск развития данного осложнения.
Метформин может применяться как монотерапия или в сочетании с препаратами сульфонилмочевины у больных СД 2 типа. Комбинация бигуанидов и производных сульфонилмочевины является рациональной, поскольку влияет на оба звена патогенеза СД 2 типа: стимулирует секрецию инсулина и улучшает чувствительность тканей к инсулину. В настоящее время разработаны и активно используются комбинированные препараты с фиксированной дозой метформина и производных сульфонилмочевины:
Комбинированные препараты имеют ряд преимуществ. За счет более низких терапевтических доз комбинируемых препаратов отмечается лучшая их переносимость, а также наблюдается меньшее количество побочных эффектов, чем при монотерапии или при раздельном назначении комбинируемых препаратов. При приеме комбинированных препаратов отмечается более высокая комплаентность, поскольку уменьшается количество и кратность приема таблетированных препаратов. Использование комбинированных препаратов дает возможность назначения трехкомпонентной терапии. Наличие различных дозировок препаратов, входящих в состав комбинированного препарата (как для препарата глюкованс), делает возможным более гибкий подбор именно оптимального, нужного соотношения комбинируемых препаратов. Однако строго фиксированная доза препаратов вызывает вместе с тем и ряд трудностей при необходимости изменения дозы только одного из комбинируемых препаратов.
Также у больных СД 2 типа метформин может применяться в комбинации с инсулином в случае выраженной инсулинорезистентности, что позволяет улучшить компенсацию углеводного обмена.
Активация PPARγ изменяет экспрессию генов, вовлеченных в такие метаболические процессы, как адипогенез, передача инсулинового сигнала, транспорт глюкозы (Y. Miyazaki еt al., 2001), что приводит к снижению резистентности тканей к действию инсулина в клетках-мишенях. В жировой ткани действие глитазонов приводит к торможению процессов липолиза, к накоплению триглицеридов, результатом чего является снижение уровня СЖК в крови. В свою очередь, снижение уровня СЖК в плазме способствует усилению процессов поглощения глюкозы мышцами и уменьшает глюконеогенез. Поскольку СЖК оказывают липотоксическое действие на β-клетки, их снижение улучшает функцию последних.
Глитазоны способны увеличивать экспрессию и транслокацию глюкозного транспортера GLUT4 на поверхности адипоцита в ответ на действие инсулина, что усиливает утилизацию глюкозы жировой тканью. Глитазоны оказывают влияние на дифференцировку преадипоцитов, что приводит к увеличению доли более мелких, но более чувствительных к действию инсулина клеток. In vivo и in vitro глитазоны уменьшают экспрессию лептина, влияя таким образом опосредованно на массу жировой ткани (B. M. Spiegelman, 1998), а также способствуют дифференцировке бурой жировой ткани.
Глитазоны улучшают утилизацию глюкозы в мышцах. Как известно, у больных СД 2 типа наблюдается нарушение инсулинстимулированной активности ФИ-3-киназы инсулинового рецептора в мышцах. В сравнительном исследовании было показано, что на фоне терапии троглитазоном инсулинстимулированная активность ФИ-3-киназы возросла почти в 3 раза. На фоне же терапии метформином изменения активности данного фермента не наблюдалось (Yoshinori Miyazaki et al., 2003).
Результаты лабораторных исследований позволили предположить, что глитазоны (росиглитазон) обладают защитным эффектом в отношении β-клеток, препятствуют гибели β-клеток путем усиления их пролиферации (P. Beales еt al., 2000).
Действие глитазонов, направленное на преодоление инсулинорезистентности и улучшение функции β-клеток, приводит не только к поддержанию удовлетворительного гликемического контроля, но и предотвращает прогрессирование заболевания, дальнейшее снижение функции β-клеток и прогрессирование макрососудистых осложнений. Оказывая воздействие практически на все компоненты метаболического синдрома, глитазоны потенциально снижают риск развития сердечно-сосудистых заболеваний.
Рецепторы PPARγ присутствуют во всех клетках сосудистой стенки и участвующих в развитии атеросклероза: в эндотелиальных клетках, в гладкомышечных клетках сосудов (VSM), моноцитах и макрофагах. PPARγ лиганды ингибируют дифференцировку, пролиферацию и миграцию всех видов клеток. PPARγ лиганды ингибируют рост и миграцию VSM-клеток путем остановки клеточного цикла в фазу G1. Они также ингибируют два процесса, необходимые для движения VSM-клеток: миграцию, индуцированную хемоатрактантами и продукцию матриксной металопротеиназы. Помимо ингибирования миграции моноцитов, индуцированной белком хемотаксиса моноцитов (MCP)-1, PPARγ лиганды ингибируют экспрессию молекул адгезии в эндотелиальных клетках, что приводит к снижению адгезии моноцитов на эндотелиальных клетках и уменьшению воспалительного действия макрофагов (A. Greenberg et al., 2001).
В настоящее время зарегистрированы и разрешены к применению два препарата из группы тиазолидиндионов: пиоглитазон (актос) и росиглитазон (авандия).
Показанием к применению глитазонов в качестве монотерапии является впервые выявленный СД 2 типа с признаками инсулинорезистентности при неэффективности диеты и режима физических нагрузок. Глитазоны показаны в качестве комбинированной терапии в случае отсутствия адекватного гликемического контроля при приеме метформина или производных сульфонилмочевины. Для улучшения гликемического контроля может использоваться и тройная комбинация (глитазоны, метформин и производные сульфонилмочевины).
Рекомендуемые дозы тиазолидиндионов представлены в таблице 2. Препараты могут приниматься как вместе с едой, так и между приемами пищи 1 или 2 раза в день. Уровень глюкозы понижается постепенно, максимальный эффект развивается через 6–8 нед. Препараты являются эффективными и хорошо переносимыми также у пожилых больных СД 2 типа (старше 65 лет).
Противопоказаниями к применению тиазолидиндионов являются: СД 1 типа, беременность и лактация, кетоацидоз, повышение печеночных трансаминаз более чем в 2,5 раза, сердечная недостаточность III–IV класса.
Ни пиоглитазон, ни росиглитазон не обладают гепатотоксичностью.
Вместе с тем при назначении препаратов из группы глитазонов необходимо мониторировать функцию печени до начала лечения. Повышение уровня аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (АСТ) более чем в 2,5 раза является противопоказанием для назначения глитазонов. Регулярный контроль ферментов АЛТ, АСТ в ходе лечения не показан, однако может проводиться по рекомендации врача при индивидуальных показаниях. Увеличение активности АЛТ на фоне лечения более чем в 3 раза требует прекращения дальнейшего приема препаратов.
Прием глитазонов сопровождался умеренной прибавкой массы тела, однако при этом отмечалось улучшение гликемического контроля и улучшение утилизации глюкозы тканями. В среднем при приеме росиглитазона отмечается увеличение массы тела на 1–4 кг в течение первого года. При приеме росиглитазона в комбинации с метформином прибавка массы тела была, как правило, меньше. Важно отметить, что увеличение массы тела происходит за счет увеличения подкожной жировой клетчатки, при этом масса абдоминального жира снижается.
У небольшого числа больных прием глитазонов может сопровождаться развитием анемии и отеками.
Представителем нового поколения глитазонов является росиглитазон (авандия). В отличие от пиоглитазона росиглитазон является более селективным в отношении PPARγ-рецепторов, обладает несравненно более высоким связующим сродством с PPARγ-рецепторами (в 40–100 раз выше, чем пиоглитазон) при меньшей концентрации препарата в крови. Различны и механизмы метаболизма этих двух препаратов. Росиглитазон метаболизируется изоферментными системами цитохрома P450, в основном CYP3С8, в меньшей степени — CYP2C9, в то время как пиоглитазон метаболизируется CYP3A. При терапевтических концентрациях росиглитазона в крови другие изоферменты цитохрома P450, включая CYP3A4, не угнетаются. Это означает, что вероятность взаимодействия росиглитазона с другими препаратами низка. В отличие от пиоглитазона росиглитазон не влияет на формакокинетику дигоксина, нифедипина, ранитидина, этинилэстрадиола, норэтиндрона.
Гипогликемическое действие глитазонов проявляется только в присутствии инсулина. При приеме глитазонов в качестве монотерапии наблюдается достоверное снижение не только базальной гликемии, но и постпрандиальной, при этом, что является несомненно важным, не отмечалось увеличения постпрандиальной гиперинсулинемии (G. Grunberger, W. M. Weston, 1999). Интересны данные, указывающие на более стойкий гипогликемический контроль, достигаемый при приеме росиглитазона, в сравнении с монотерапией глибенкламидом. Было показано, что при монотерапии росиглитазоном уровень НвА1с сохранялся неизменным в течение 30 мес без изменения терапии (B. Charbonnel, F. Lonnqvist, 1999). В проведенных исследованиях было показано, что росиглитазон улучшает функцию β-клеток и тем самым способен замедлять прогрессирование заболевания. Росиглитазон благоприятно влияет на функцию эндотелия и обладает способностью предупреждать развитие рестеноза после оперативных вмешательств на сосудах (T. Yoshimoto et al., 1999).
Сегодня получено много данных, указывающих на то, что применение глитазонов не только компенсирует углеводный обмен для больных диабетом, но и создает условия для блокирования механизмов, приводящих к развитию макро- и микроангиопатий, а значит, расширяются показания для применения этого препарата в клинических целях.
Эффективной и целесообразной является комбинация глитазонов и метформина. Оба препарата обладают сахароснижающим и гиполипидемическим действием, однако механизм действия росиглитазона и метформина различен (V. A. Fonseca et al., 1999). Глитазоны прежде всего усиливают инсулинобусловленное усвоение глюкозы в скелетных мышцах. Действие же метформина направлено на подавление синтеза глюкозы в печени. Как было показано в исследованиях, именно глитазоны, а не метформин способны увеличивать более чем в 3 раза активность ФИ-3-киназы, одного из основных ферментов передачи инсулинового сигнала. Помимо этого добавление глитазонов к терапии метформином приводит к значительному улучшению функции β-клеток в сравнении с терапией метформином.
Фирмой ГлаксоСмитКляйн разработан новый комбинированный препарат — авандамет. Предполагается две формы данного препарата с различной фиксированной дозой росиглитазона и метформина: росиглитазон 2 мг и 500 мг метформина и росиглитазон 1 мг в комбинации с 500 мг метформина. Рекомендуемый режим приема — 1–2 таблетки 2 раза в сутки. Препарат обладает не только более выраженным сахароснижающим действием по сравнению с действием каждого компонента в отдельности, но и уменьшает объем подкожной жировой клетчатки. В 2002 г. авандомет зарегистрирован в США, в 2003 г. — в странах Европы. В ближайшее время ожидается появление этого препарата в России.
Комбинация глитазонов с производными сульфонилмочевины позволяет воздействовать на два основных звена в патогенезе СД 2 типа: усиливать секрецию инсулина (производные сульфонилмочевины) и повышать чувствительность тканей к действию инсулина (глитазоны). В ближайшее время ожидается появление комбинированного препарата компании ГлаксоСмитКляйн — авандарила (росиглитазон и глимепирид).
Комбинация глитазонов и инсулина на сегодняшний день одобрена и рекомендована к применению во многих странах, в том числе и в России (P. Raskin, J. F. Dole, 1999). Вместе с тем результаты ряда исследований свидетельствуют об усилении проявления хронической сердечной недостаточности у больных СД 2 типа, получавших инсулин при добавлении к терапии росиглитазона, что требовало более частых обращений к врачу и коррекции проводимой терапии. Наиболее часто наблюдалось появление отеков нижних конечностей. Поэтому необходим более тщательный контроль состояния сердечно-сосудистой системы у больных с хронической сердечной недостаточностью при добавлении росиглитазона к инсулинотерапии. Глитазоны противопоказаны больным с хронической сердечной недостаточностью III и IV класса.
Воздействуя практически на все компоненты метаболического синдрома, глитазоны способствуют снижению риска развития и прогрессирования сердечно-сосудистых заболеваний.
Успешно разрабатываются препараты новой группы — глитазары. В отличие от глитазонов эти соединения являются двойными агонистами, т. е. стимулируют не только PPARγ-, но и PPARα-рецепторы. Препараты активно влияют на восстановление углеводного и жирового обмена у больных СД 2 типа, оказывают благоприятное воздействие на профилактику и течение сосудистых осложнений. Проведенные клинические исследования по применению тезаглитазара и мураглитазара показали их хорошую эффективность.
И. В. Кононенко, кандидат медицинских наук
О. М. Смирнова, доктор медицинских наук, профессор
ЭНЦ РАМН, Москва