Метаболическая активность что это при онкологии
Метаболическая активность что это при онкологии
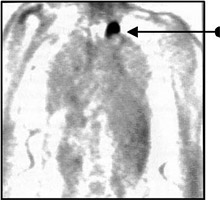
Исследование «всего тела» заключается в сканировании пациента от уха до верхней трети бедра. Т.е. в область исследования будут включены голова (частично, от козелка уха, без захвата головного мозга), шея, органы грудной полости, брюшной полости, малого таза и костная система (без верхних и нижних конечностей).
Сканирование нижних конечностей проводится за дополнительную плату.
Вопрос №2. Что такое радиофармпрепарат?
Радиофармпрепарат (РФП) – это соединение, состоящее из специального вещества и радионуклида (изотопа, радионуклидной метки). Специальное вещество отвечает за то, в каком органе накопится РФП, а радионуклидная метка позволяет врачу-диагносту увидеть это накопление на изображении.
В настоящее время для производства РФП используется очень широкий спектр как специальных веществ, так и радионуклидных меток. Во всем мире самым часто используемым у онкологических больных соединением специального вещества и радионуклидной метки является 18 F-фтордезоксиглюкоза ( 18 F-ФДГ). В данном соединении 18 F выполняет функцию радионуклидной метки, ФДГ – специального вещества.
Вопрос №3. Что такое физиологическое накопление РФП?
Физиологическое накопление (гиперфиксация) РФП – это повышенное накопление РФП, определяющееся в различных органах и системах в норме.
Физиологическое накопление наблюдается при исследованиях со всеми РФП: 18 F-ФДГ, 11 С-холином, 11 С-метионином, 68 Ga-ПСМА и т.д. В зависимости от типа РФП меняется лишь местоположение физиологической гиперфиксации. Например, при ПЭТ и ПЭТ/КТ с самой часто используемой 18 F-ФДГ физиологическое накопление РФП определяется в коре головного мозга, ротоглотке, носоглотке, мышцах гортаноглотки, миокарде левого желудочка, чашечно-лоханочных системах почек, фрагментарно по ходу петель толстой кишки, мочевом пузыре.
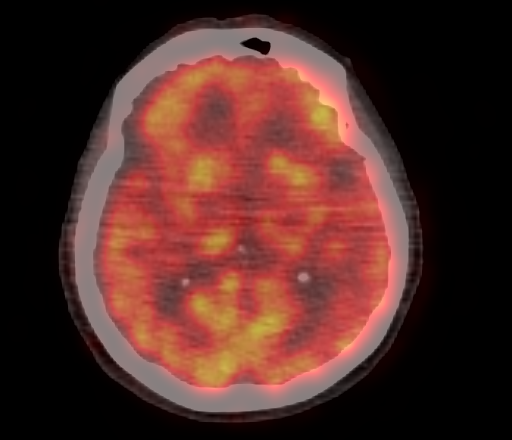 |  |
| Физиологическое накопление 18 F-ФДГ в коре головного мозга. | |
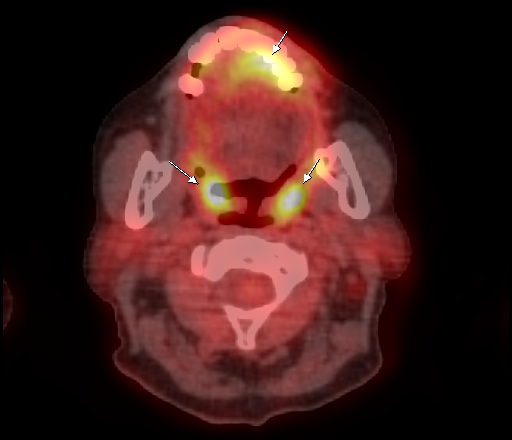 |  |
| Физиологическое накопление 18 F-ФДГ в ротоглотке. | |
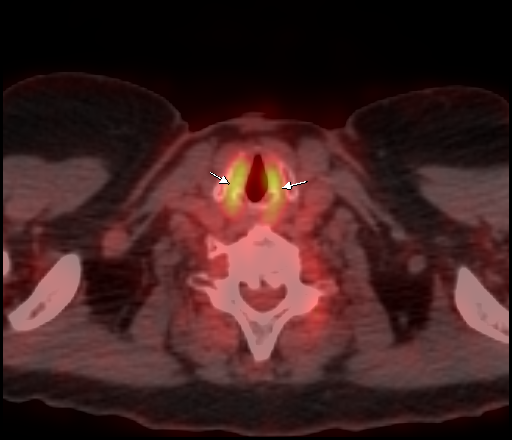 |  |
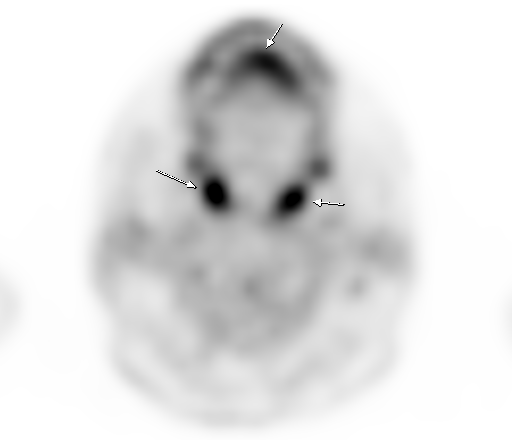
| Физиологическое накопление 18 F-ФДГ в мышцах гортаноглотки. | |
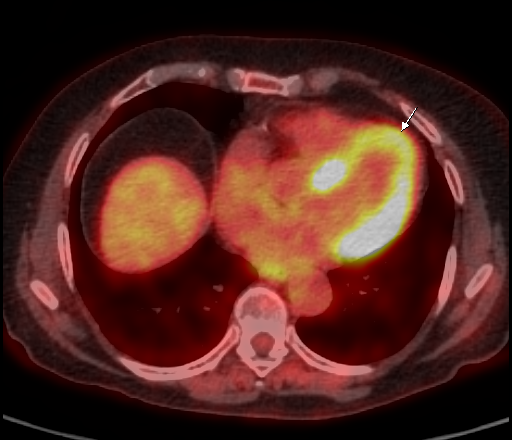 |  |
| Физиологическое накопление 18 F-ФДГ в миокарде левого желудочка. | |
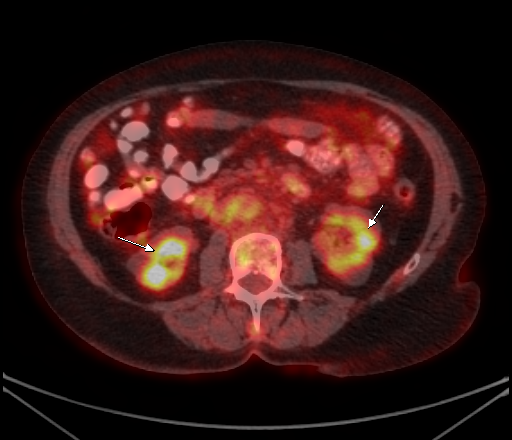 |  |
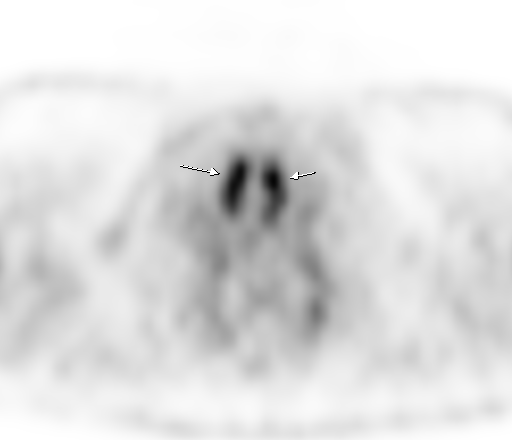
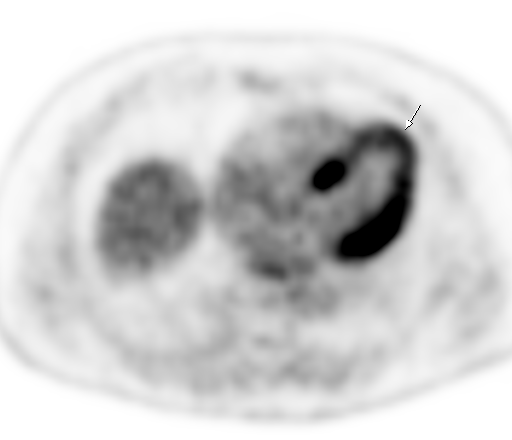
| Физиологическое накопление 18 F-ФДГ в чашечно-лоханочных системах почек. | |
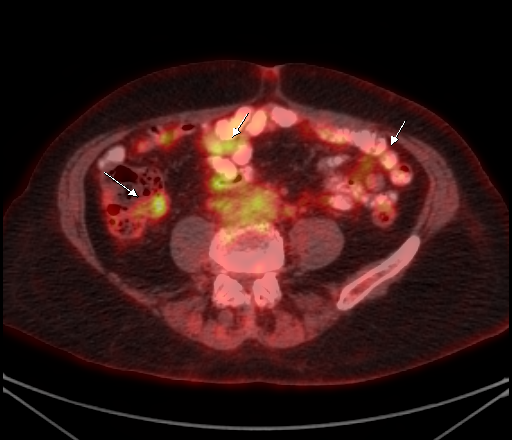 | 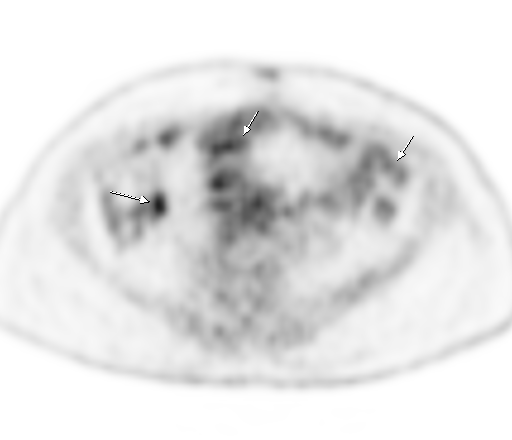 |
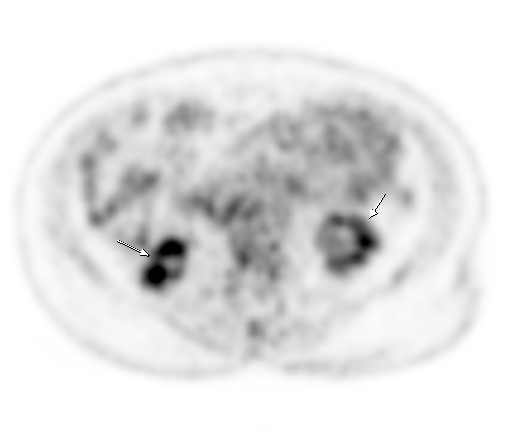
| Физиологическое накопление 18 F-ФДГ по ходу петель толстой кишки. | |
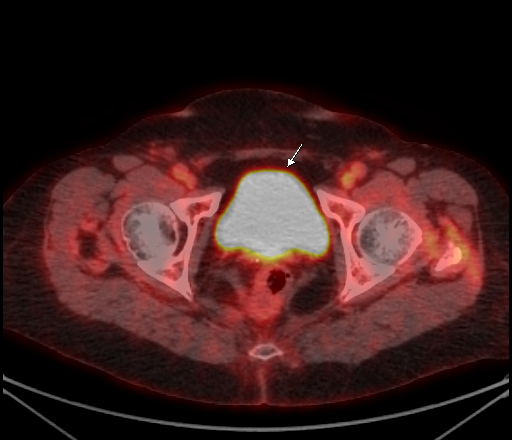 | 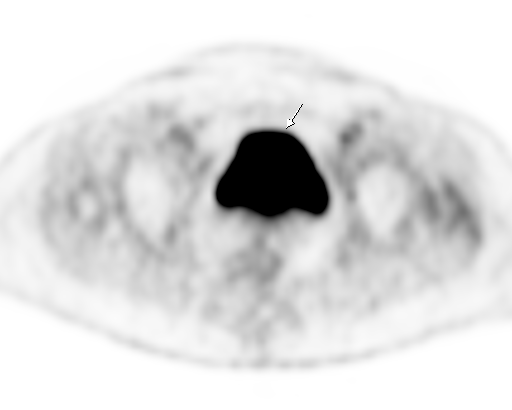 |
| Физиологическое накопление 18 F-ФДГ в мочевом пузыре. | |
Вопрос №4. Что такое патологическое накопление РФП?
Патологическое накопление РФП – это повышенное накопление РФП в органах и тканях, регистрирующееся при заболеваниях, чаще всего в злокачественных опухолях.
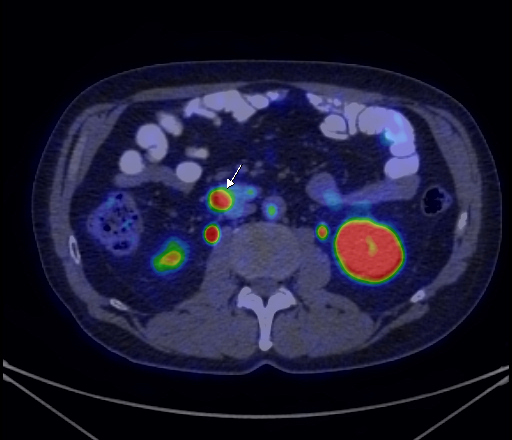 |
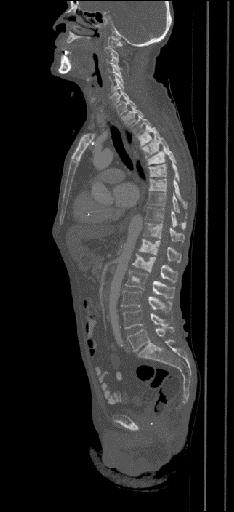
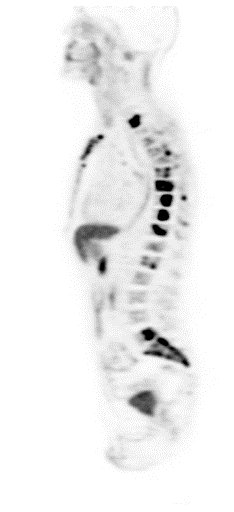
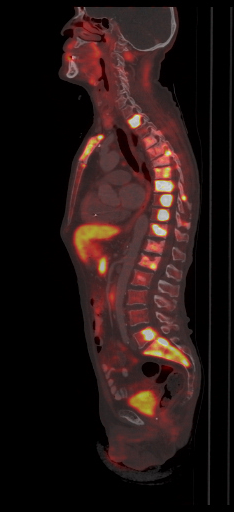
| Данные ПЭТ/КТ с 68 Ga-DOTA-TATE у пациента с нейроэндокринной опухолью тощей кишки. В проекции злокачественной опухоли, расположенной в тощей кишке, определяется очаг патологической гиперфиксации РФП. |
 |  |  |
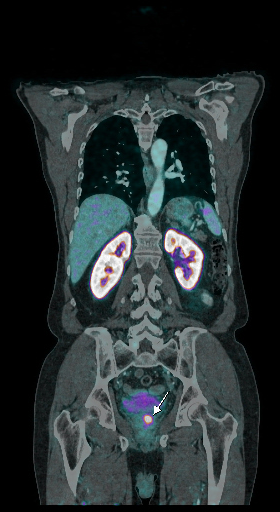
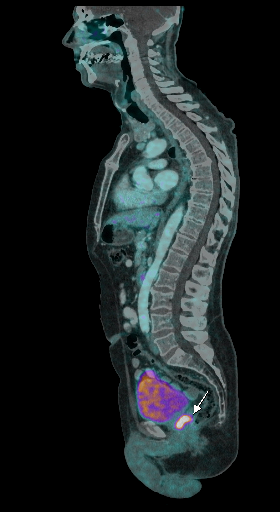
| Данные ПЭТ/КТ с 11 С-холином у пациента с раком предстательной железы. Состояние после простатэктомии. В костях скелета визуализируются множественные очаги патологического накопления РФП (метастазы). | ||
 |  | 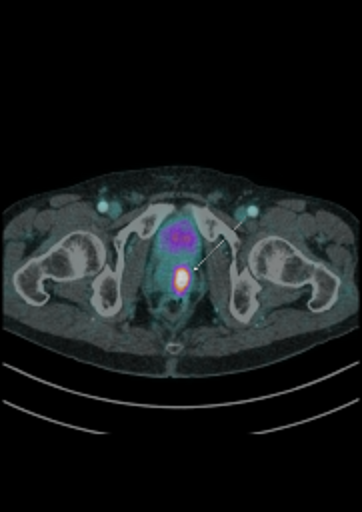 |
| Данные ПЭТ/КТ с 68 Ga-ПСМА у пациента с местным рецидивом рака предстательной железы. Состояние после лучевой терапии. В левых отделах предстательной железы определяется очаг патологического накопления РФП. | ||
Вопрос №5. Что такое метаболически активное и метаболически неактивное образование?
Метаболически неактивное образование – это образование, которое не накопило РФП. Чаще всего отсутствие повышенного накопления РФП в опухоли свидетельствует о ее доброкачественной природе.
Метаболически активное образование – это образование, в котором накопился РФП в повышенном количестве. Повышенное накопление РФП в опухоли чаще всего свидетельствует о ее злокачественном характере.
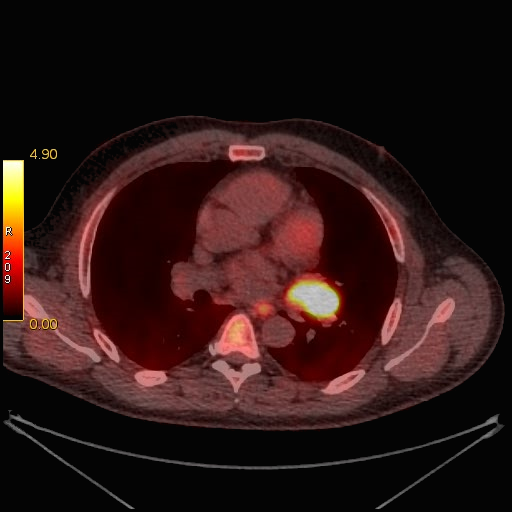 |
| Данные ПЭТ/КТ с 11 С-метионином у больного с метаболически активным образованием корня левого легкого (типичный карциноид). |
Вопрос №6. Что такое SUV?
SUV (Standardized Uptake Value, стандартизированный уровень захвата) – это величина, отражающая интенсивность накопления РФП в зоне интереса, например, в опухоли.
Показатель SUV рассчитывается программным комплексом автоматически и измеряется в различных единицах. В нашем Центре, как и в большинстве отечественных и зарубежных медицинских учреждений, где проводится позитронная эмиссионная томография, в качестве единиц измерения показателя SUV принято использовать г/мл (g/ml).
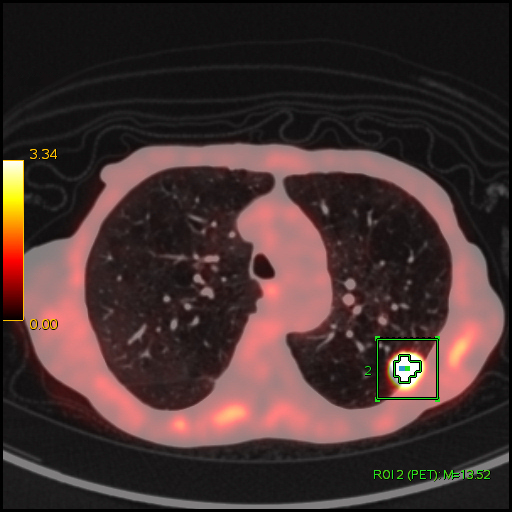 |
| Данные ПЭТ/КТ с 18 F-ФДГ. Оконтуривание метаболически активной злокачественной опухоли левого легкого для измерения показателя SUV. В данном случае величина SUV в опухоли определяется на уровне 13,52 g/ml. |
Вопрос №7. Для чего используется величина SUV?
Величина SUV в основном используется для оценки ответа злокачественной опухоли на проведенное лечение. Важно подчеркнуть, что в ряде клинических ситуаций показатель SUV в опухоли является единственным критерием, позволяющим оперативно получить информацию о чувствительности образования к только что начатой терапии.
Если опухоль чувствительна к лечению, то уровень SUV в ней при повторном ПЭТ-исследовании будет снижаться, если нечувствительна или малочувствительна (резистентна, устойчива) – значение SUV останется без изменений или увеличится. Следует помнить, что своевременная диагностика устойчивости опухоли к лечению позволит скорректировать план лечения, а в некоторых случаях и радикально его изменить.
Как уже было сказано выше, для оценки эффективности терапии врач-радиолог оценивает динамику показателя SUV до и после лечения.
Существует четыре варианта метаболического ответа опухоли на проведенное лечение:
Результаты ПЭТ с 18 F-ФДГ у пациента с диффузной В-клеточной крупноклеточной лимфомой до лечения (а), после 2 курса ПХТ (б) и через 13 месяцев после окончания терапии (в).
а – до лечения в средостении визуализируется массивное метаболически активное образование с уровнем SUV=12,6;
б – после 4 курса ПХТ отмечается значительное уменьшение метаболического объема опухоли и снижение показателя SUV до 3,4 (достигнут частичный метаболический ответ, т.е. опухоль чувствительна к выбранной ПХТ);
в – через 13 месяцев после окончания ПХТ очагов патологической гиперфиксации РФП в проекции органов средостения не обнаружено (достигнут полный метаболический ответ).
3 августа 2018 года были опубликованы результаты исследования, осуществленного международной группой ученых. Принимали участие 35 специалистов из 17 американских, бразильских и европейских институтов; объем обследованной выборки составил 1200 пациентов. Важнейшие выводы заключаются в том, что клетки раковой опухоли вырабатывают и используют энергию иначе, нежели нормальные клетки. Показано, что рак по сути является метаболическим, обменным расстройством, и это идет вразрез с традиционным приоритетом генетических исследований, предпринимаемых в течение многих десятилетий.
«Рак не является генетической болезнью, проистекающей, как всех нас учили, исключительно из клеточных мутаций; это патология метаболизма, развивающаяся в силу депривации клеточного питания,
– утверждает доктор медицины Роберт Нагурни, старший автор публикации.
– Клетки, которые не могут генерировать достаточное количество энергии из-за дефицита кислорода, сахаров или протеинов (что типично для многих видов рака), в целях выживания начинают использовать модифицированные способы метаболизма. К сожалению, успешное выживание раковых клеток обеспечивается за счет организма пациента-хозяина»,
Используя масс-спектрометрию для измерения микроскопических концентраций сахаров, аминокислот и липидов, исследователи обнаружили определенные метаболические сигнатуры (комплексы признаков), которые четко, с достоверностью свыше 95%, идентифицировали пациентов с раком молочной железы. У пациентов изначально имелись изменения в обмене веществ, что и предрасполагало к развитию онкозаболевания.
Результаты подтверждают новую концепцию канцерогенеза, согласно которой рак не вызывается мутациями, а заимствует мутировавшие (или даже условно-нормальные) способы клеточного питания для компенсации дефицита питательных веществ. Поскольку рак все чаще ассоциируется с ожирением, особая ценность исследования состоит в научных доказательствах того, что рацион и образ жизни относятся к стрессовым факторам или триггерам, которые у предрасположенных лиц могут приводить к малигнизации и, в конечном счете, к смерти. Уже более ста лет известно, что метаболизм раковой опухоли отличается от нормального обмена веществ, однако лишь современная количественная масс-спектрометрия смогла предоставить врачам и ученым точные измерения и квантификацию указанных различий. Изучая циркуляцию около 200 биохимических соединений в кровотоке и сравнивая выборку онкопациентов с контрольной группой, коллектив исследователей обнаружил поразительные отличия, четко дифференцирующие здоровых лиц от онкологических больных.
Полученные результаты чрезвычайно глубоки и значимы, поскольку создают совершенно новую платформу для разработки методов ранней диагностики, обеспечивают прогностическую информацию, важнейшую для терапевтического ответа и выживаемости пациентов, а также открывают путь к внедрению принципиально новых стратегий профилактики рака. В настоящее время разворачиваются дополнительные исследования, целью которых является изучение применимости указанных выводов к прочим формам рака. Масс-спектрометрия, отметим, является методом точного измерения состава биологических жидкостей, – таких, например, как кровь или моча. Использование метода «ионного испарения» позволяет объективно и достоверно квантифицировать чрезвычайно малые объемы метаболитов: достаточно 10 микролитров (одной капли).
Рак молочной железы является формой рака, наиболее распространенной среди американских женщин (и российских тоже; Лахта Клиника рассказывала об этом заболевании в соответствующей статье). Ежегодно диагностируется более 250 тысяч новых случаев; 40 тысяч ассоциированных летальных исходов зарегистрировано в 2017 году (комментарий Лахта Клиники: официальные эпидемиологические оценки в России гораздо ниже, что вызывает определенные сомнения в их достоверности). Применение скрининговых методов раннего выявления увеличило выживаемость при данном заболевании, однако маммография и ультразвуковое исследование не способны обнаружить онкопроцесс на начальной, наиболее курабельной стадии.
Радионуклидная диагностика в онкологии
ГУ – Медицинский радиологический научный центр РАМН,
Обнинск, ул. Королева 4, 249036 г., Калужская область, Российская Федерация
Адрес для переписки: Герман Анатольевич Давыдов; e-mail:
Ключевые слова: онкология, диагностика, радионуклиды.
Ранняя диагностика злокачественных новообразований остается одной из наиболее актуальных задач современной медицины. Возможности методов ядерной медицины в онкологии основаны в первую очередь на выявлении метаболических нарушений в опухолях и окружающих тканях. Принцип функциональной визуализации опухолей отличает методы ядерной медицины от анатомо-топографических методов лучевой диагностики (ультразвуковой томографии, рентгеновской компьютерной томографии и магнитно-резонансной томографии), которые оценивают динамику новообразований по изменению их размеров и структуры. Особенности радионуклидных методов позволяют использовать их для выявления опухолевых поражений в ситуациях, когда структурные изменения не определяются или неспецифичны, а также для оценки раннего ответа опухоли на специфическую терапию, в целях прогнозирования результатов лечения.
Наряду с однофотонной эмиссионной компьютерной томографией (ОФЭКТ), основанной на использовании гамма-излучающих радионуклидов, все большую диагностическую роль в онкологии играет позитронная эмиссионная томография (ПЭТ). Использование в качестве метки биологически важных ультракороткоживущих позитрон-излучающих радионуклидов ( 11 C, 13 N, 15 O, 18 F), позволило создать радиофармпрепараты, обладающие уникальными свойствами (РФП). ПЭТ обеспечивает лучшие возможности для дифференциальной диагностики злокачественных и доброкачественных новообразований, определения распространенности опухолевого процесса, раннего выявления рецидивов и оценки эффективности проводимого лечения.
Основными задачами радионуклидной диагностики при исследовании онкологических больных являются следующие:
РФП для сцинтиграфической диагностики опухолевого процесса
Применяемые для диагностики опухолей РФП разделяют на следующие группы:
РФП, способные накапливаться в интактных тканях, окружающих опухоль
РФП этой группы отличаются тропностью к той или иной ткани организма, что позволяет выявить наличие опухоли как область пониженного накопления индикатора – «дефект накопления». К ним относятся: 99m Тс-коллоид, который аккумулируется в купферовских клетках печени. 99m Тс-пертехнетат и изотопы йода ( 123 I или 131 I), использующиеся для диагностики опухолей щитовидной железы. Недостатком методик с использованием этих препаратов является невысокая специфичность, так как любое объемное поражение (например, киста) визуализируется аналогичным образом.
РФП, способные накапливаться в тканях, подверженных неспецифическим изменениям со стороны опухоли
Использование РФП данной группы основано на свойстве их повышенного включения в участки ткани, окружающие новообразование. Так, окружающие костную опухоль ткани реагируют на ее рост повышенной остеобластической активностью. Фосфатные комплексы 99m Тс, накапливаясь в остеобластах этих участков, позволяют визуализировать костные метастазы и первичные опухоли костей на самой ранней стадии их развития как очаги гиперфиксации РФП. Метод остеосцинтиграфии обладает высокой чувствительностью, однако специфичность его невысока. Высокое накопление указанных РФП в костной ткани может наблюдаться также при травмах, воспалительных и дистрофических заболеваниях.
С целью паллиативной терапии метастазов в кости применяются меченный самарием-153 этилендиаминтетраэтиленфосфонат и меченный рением-186 этидронат, накапливающиеся в участках с повышенной остеобластической активностью.
РФП, тропные к мембранам опухолевых
клеток по реакции «антиген-антитело»
В основе диагностического применения РФП данной группы в онкологии лежит реакция связывания меченых моноклональных антител с антигенами мембран раковых клеток. В радионуклидной диагностике нашли применение как целые антитела типа IgG, так и их фрагменты (Fab-fragments of antibody). Для диагностики колоректального рака применяется препарат на основе целых антител – 111 In-Онкосцинт, а также фрагментов антител – 99m Tc-КЭА-Скан. Преимуществом фрагментов меченых антител является более высокая онкоспецифичность. Однако ускоренный клиренс фрагментов антител из крови за счет более быстрого, по сравнению с большими молекулами иммуноглобулинов, выведения почками может снижать соотношение «опухоль/фон» в злокачественных новообразованиях с обедненным кровотоком. Кроме того, технология получения Fab является достаточно трудоемкой и дорогостоящей.
РФП, тропные к мембранам опухолевых
клеток по механизму клеточной рецепции
Применение таких РФП для сцинтиграфической диагностики основано на их тропности к некоторым рецепторам мембран опухолевых клеток.
Из индикаторов такого типа наиболее часто используются аналоги соматостатина – окреотид, меченный 111 In, и 99m Тс-депреотид (NeoSpect). Соматостатин представляет собой тетрадекапептид, секретируемый гипоталамусом, который подавляет выделение нейроэндокринных гормонов (гормон роста, глюкагон, инсулин и гастрин). Во многих злокачественных опухолях и при некоторых воспалительных заболеваниях плотность рецепторов соматостатина значительно повышается. Гиперэкспрессия рецепторов соматостатина наблюдается в большинстве нейроэндокринных опухолей, включая мелкоклеточный рак легкого, а также в перитуморальных венах некоторых опухолей человека.
Меченые аналоги соматостатина нашли применение для диагностики ряда нейроэндокринных опухолей (карциноид, феохромацитома, параганглиома, меланома), мелкоклеточного рака легких, новообразований центральной нервной системы и лимфом. Чувствительность и специфичность сцинтиграфического выявления таких злокачественных новообразований с применением 111 In-окреотида превышает 80%. Вместе с тем, диагностика онкологических поражений печени и селезенки с этим РФП существенно затруднена по причине высокого уровня неспецифической аккумуляции данного индикатора в указанных органах. Депреотид, меченный 99m Тс, используется преимущественно для выявления рака легкого. При этом чувствительность диагностики злокачественных солитарных легочных новообразований в комбинации сцинтиграфии с КТ или рентгенографией грудной клетки достигает 97% при специфичности 73% [1].
В последние годы в онкологической практике нашли применение меченные 123 I пептиды, которые также способны связываться с мембранами опухолевых клеток. Среди них следует отметить 123 I-вазоактивные кишечные пептиды для визуализации злокачественных новообразований желудочно-кишечного тракта и поджелудочной железы; 123 I-ά-меланоцитостимулирующий гормон для диагностики меланом; 123 I-инсулин, накапливающийся в гепатомах, и 123 I-нейропептиды для выявления мелкоклеточного рака легкого.
Специфические РФП, проникающие в опухолевые клетки
Радиофармпрепараты указанной группы включаются в специфический метаболизм опухолей. К ним относятся изотопы йода 123 I и 131 I, 123 I-метайод-бензил-гуанидин ( 123 I-МИБГ) и пятивалентный 99m Тс (V)-ДМСА.
Йод-131 уже более 50 лет успешно используется для диагностики метастазов фолликулярного и папиллярного рака щитовидной железы, поскольку дифференцированные опухоли щитовидной железы сохраняют способность захватывать йод и включать его в синтез тиреоидных гормонов. Метастазы раковой опухоли обнаруживаются в виде участков экстратиреоидного эктопического накопления.
В последние годы для выполнения радиодиагностических процедур все чаще вместо 131 I используют 123 I, который имеет ряд преимуществ: оптимальный для регистрации спектр энергетического излучения (159 кэВ) и короткий период полураспада (13,2 часа), способствующий уменьшению лучевой нагрузки на пациента.
К специфическим опухолетропным препаратам относится также 123 I-МИБГ, который через норэпинефриновый механизм поглощения превращается в катехоламины адренергических нервных окончаний и клеток мозгового слоя надпочечников, позволяя тем самым визуализировать надпочечники. Наряду с этим была показана высокая эффективность использования указанного РФП для диагностики и терапии нейроэндокринных опухолей, особенно феохромоцитом, нейробластом, карциноида, медуллярного рака щитовидной железы и параганглиом. Для радиотерапевтических целей используется МИБГ, меченный 131 I.
К РФП этой группы также относят пятивалентный 99m Тс(V)-ДМСА, специфично накапливающимся в клетках медуллярного рака щитовидной железы. Однако механизм аккумуляции 99m Тс(V)-ДМСА в опухоли остается неизученным [1, 7].
Неспецифические РФП, проникающие в опухолевые клетки
Цитрат галлия-67 ( 67 Ga-цитрат) уже много лет успешно используется как туморотропный радиофармпрепарат. 67 Ga после внутривенного введения образует комплекс с трансферрином крови, который связывается с рецепторами некоторых опухолевых клеток. Посредством инвагинации целлюлярной мембраны 67 Gа-трансферрин попадает внутрь клетки и, образовав комплекс с лактоферрином, остается в ней [1, 7].
67 Ga-цитрат хорошо зарекомендовал себя в качестве РФП для радионуклидной диагностики лимфом и мелкоклеточного рака легких. В литературе описаны случаи применения этого РФП и для выявления других злокачественных образований. В то же время, неспецифическая аккумуляция 67 Ga-цитрата в печени и экскреция в желудочно-кишечный тракт ограничивают его использование для диагностики опухолей брюшной полости. Специфичность метода снижает также аккумуляция 67 Ga-цитрат в зонах инфекции и воспаления. Сцинтиграфия с этим РФП особенно эффективна для динамического наблюдения за больными с верифицированными злокачественными новообразованиями в динамике химио- или лучевой терапии.
Изотопы таллия ( 201 Тl и 199 Тl), являясь биологическим аналогом калия, поступают внутрь клетки с помощью натрий-калиевого АТФ-зависимого насоса и локализуются в митохондриях. Эти РФП аккумулируются преимущественно в тканях с интенсивным энергетическим обменом (к числу которых относятся атипичные клетки) и широко используются для диагностики самых разнообразных опухолей, включая новообразования бронхов, лимфомы, рак щитовидной железы, костей и головного мозга. Как и цитрат 67 Ga, изотопы таллия успешно применяют для динамической оценки противоопухолевой терапии.
В последнее время в ядерной онкологии стали активно использоваться комплексы технеция-99m с метокси-изобутил-изонитрилом ( 99m Тс-МИБИ) и тетрофосмином (миовью), благодаря способности этих РФП к усиленной аккумуляции в митохондриях злокачественных клеток. Наиболее активно эти индикаторы используют для выявления рака молочной железы, опухолей легких, лимфом и миеломной болезни [1, 7].
РФП для позитронно-эмиссионной томографии
Позитронно-излучающий РФП 18 F-фтордезоксиглюкоза ( 18 F-ФДГ) позволяет с высокой чувствительностью выявлять самые разнообразные злокачественные новообразования.
Аккумуляция этого индикатора в клетке прямо пропорциональна эффективности функционирования белкового переносчика глюкозы и коррелирует с активностью гексокиназы II – фермента, реализующего обмен гидроксильной группы глюкозы на фосфатный комплекс АТФ. Фосфорилированный метаболит 18 F-фтордезоксиглюкозы теряет способность к транспорту через мембрану клетки и остается интрацеллюлярно. Таким образом, ФДГ в отличие от обычной глюкозы, попадая внутрь клетки, участвует только в начальных этапах гликолиза, поэтому не распадается, за счет чего и происходит ее прогрессивное накопление в клетке (феномен «метаболической ловушки»). Высокое соотношение концентрации РФП «опухоль/фон» достигается, таким образом, за счет заметно более высокой активности гексокиназы II в малигнизированных клетках. Визуализация опухолей осуществляется за счет повышенной гликолитической активности клеток опухолевой ткани и повышенной активности глюкозных транспортеров на мембранах опухолевых клеток, осуществляющих захват глюкозы внутрь клетки. При этом биологическая активность опухоли прямо пропорциональна степени метаболического захвата глюкозы 3.
Применение другого неспецифического позитронно-излучающего РФП 11 С-метионина для диагностики опухолей базируется на высоком уровне аминокислотного обмена в активно пролиферирующих клетках злокачественных опухолей. Этот индикатор используется при выявлении лимфом, злокачественных новообразований шеи и головы.
Для диагностики новообразований методом ПЭТ применяется ряд туморотропных РФП, визуализирующих злокачественные опухоли как очаги нарушения метаболизма. Для изучения нарушений углеводного обмена (клеточная энергетика) применяется 18F-фтордеоксиглюкоза (18F-ФДГ); клеточного транспорта аминокислот – 11С-метионин; процессов клеточного синтеза белков – 11С-тирозин, 11С-лейцин; скорости клеточной пролиферации – 11С-тимидин (как маркер синтеза ДНК) и 11С-холин (участвующий в биосинтезе клеточной мембраны); синтеза липидов – (11С-ацетат); степени гипоксии опухолевой ткани – 18F-фтормизонидазол [4].
Индикаторы гипоксии являются перспективными РФП для сцинтиграфической диагностики злокачественных новообразований. Визуализация малигнизированных тканей в этом случае становится возможной потому, что в центральных областях опухоли имеют место обеднение кровотока и сопутствующая гипоксия. Нитроимидазол путем диффузии проникает внутрь клетки за счет липофильности своей молекулы, образуя в условиях гипоксии ряд недоокисленных продуктов своего превращения. Эти метаболиты связываются с компонентами клетки и, в отличие от нормы, фиксируются интрацеллюлярно [2, 8].
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ПЭТ В ОНКОЛОГИИ
ПЭТ в настоящее время нашла широкое применение во многих областях медицины. Первый опыт использования этого метода был посвящен функциональным исследованиям головного мозга. В дальнейшем ПЭТ стала успешно использоваться для диагностики различных форм деменции, очаговых форм эпилепсии.
В кардиологии ПЭТ-исследования сердца дают уникальную информацию о жизнеспособности миокарда, таким образом определяя целесообразность кардиохирургических вмешательств. Однако самым востребованным метод ПЭТ оказался в онкологии. Этому способствовало появление и начало серийного изготовления установок для ПЭТ «всего тела», а также разработка большого ассортимента позитронно-излучающих туморотропных РФП. Ценнейшая информация, получаемая при исследованиях больных злокачественными новообразованиями, сделала ПЭТ одним из ведущих диагностических методов. Это обстоятельство привело к резкому возрастанию относительной доли онкологических ПЭТ-исследований, которая в настоящее время составляет около 90%.
Самой распространенной и наиболее освоенной методикой является ПЭТ с 18F-фтордеоксиглюкозой (18F-ФДГ). Количество этих исследований приобрело такой размах, что, по мнению ведущих специалистов ядерной медицины, 18F-ФДГ завоевала в 1990-х гг. номинацию «молекулы века» [4, 6].
Применение ПЭТ в диагностике рака легких
ПЭТ c ФДГ высоко эффективна в дифференциальной диагностике первичных опухолей у больных с солитарными легочными узлами: прогностическая ценность положительного результата – 90%, отрицательного результата – до 100%.
Ложноотрицательный результат может наблюдаться при поражениях менее 1 см, опухолях с низкой метаболической активностью (например, карциноидных), бронхоальвеолярном раке. Повышенное включение ФДГ возможно при различных воспалительных заболеваниях. В сомнительных случаях поражения с повышенным захватом ФДГ должны считаться злокачественными, пока не будет доказано обратное.
Оценка региональных лимфоузлов средостения у потенциально операбельных больных немелкоклеточным раком легкого превышает результаты КТ и составляет: чувствительность 89%, специфичность 92% и точность 90%. Лучшие результаты ПЭТ объясняются тем, что размеры лимфоузлов являются относительным критерием метастатического поражения. Лимфоузлы могут быть увеличены вследствие воспаления или инфекции, а мелкие узлы могут содержать метастазы.
При выявлении внутригрудных метастазов ПЭТ несколько точнее КТ. По сравнению со стандартной остеосцинтиграфией с 99m Tc-метилендифосфонатом, ПЭТ имеет большую специфичность (98% против 61%) при аналогичной чувствительности (до 90%) при визуализации метастазов в кости. Интерпретация сцинтиграфии костей с МДФ затруднена из-за ложноположительных результатов при воспалительных и дистрофических изменениях костей и суставов.
Отмечается высокая эффективность ФДГ-ПЭТ в выявлении рецидивов немелкоклеточного рака легкого. При подозрении КТ на рецидив ПЭТ способна дифференцировать посттерапевтические рубцы и опухоли с чувствительностью 97-100%, специфичностью 62-100% и точностью 78-98% (Рис.1). Чтобы избежать ложноположительных результатов ПЭТ вследствие лучевого пневмонита или гликолиза макрофагов внутри опухолевого некроза, исследование рекомендуется проводить через 4-6 месяцев по окончании лечения.
Показаниями к проведению ПЭТ с ФДГ у больных немелкоклеточным раком легкого являются: дифференциальная диагностика первичной опухоли, определение распространенности опухолевого процесса, выявление рецидивов.
Рис. 1. Результат ПЭТ-исследования. Выявление рецидивной опухоли верхушки левого легкого.
Применение ПЭТ в диагностике рака толстой кишки
Основными задачами ПЭТ с ФДГ при исследовании больных раком толстой кишки являются:
Метод ПЭТ недостаточно эффективен при диагностике регионарных лимфоузлов. Причина низкой чувствительности объясняется расположением большинства лимфоузлов вблизи первичной опухоли или наличием в них микрометастазов. Однако отсутствие вовлечения лимфоузлов не вызывает изменения в лечении, поскольку удаление брыжейки без первичного поражения является частью лечебной процедуры. ПЭТ является наиболее чувствительным (90-95%) методом выявления метастазов в печень колоректального рака, в чем превосходит КТ, при специфичности 88-100%. Исключение отдаленных метастазов до операции и повторных резекциях является важным показанием ФДГ-ПЭТ у больных колоректальным раком.
Показаниями к ПЭТ у больных с выявленным или подозреваемым рецидивом являются: увеличение опухолевых маркеров, аномальное поражение при стандартной визуализации (КТ и МРТ), дифференциальная диагностика местных рецидивов и посттерапевтических (хирургических, лучевых и химиотерапевтических) изменений. ПЭТ позволяет дифференцировать рецидив опухоли от захвата ФДГ вследствие лучевой терапии (спустя 6 месяцев после лечения). По данным ПЭТ выявляется больше поражений, чем при КТ, что приводит к серьезным изменениям в лечении у 48% больных.
Примером успешной дифференциальной диагностики между рецидивом опухоли и послеоперационной рубцовой тканью является выявление, по данным ПЭТ, рецидива рака прямой кишки после брюшно-промежностной экстирпации прямой кишки, когда эндоскопия оказалась невозможной, а УЗИ и КТ не позволяли дифференцировать рецидив и послеоперационные рубцовые изменения (Рис.2).
Рис. 2. ПЭТ с 18F-ФДГ. Визуализация рецидива рака прямой кишки (а) на фоне физиологического накопления
радиофармпрепарата в головном мозге и почках.
Применение ПЭТ в диагностике гемобластозов
При исследовании больных злокачественными лимфомами перед ФДГ-ПЭТ ставятся задачи по определению стадии опухолевого процесса, оценке эффективности лечения, выявлению рецидивов заболевания. Диагностическое обследование больных злокачественными лимфомами является одним из наиболее значимых показаний для проведения ПЭТ с ФДГ.
При стадировании злокачественной лимфомы ФДГ-ПЭТ имеет одинаковую специфичность с РКТ (90%), однако превосходит ее в чувствительности (92% и 65% соответственно). Точность оценки состояния селезенки при первичном стадировании злокачественной лимфомы для ФДГ-ПЭТ составляет около 100% (для КТ –57%), а точность диагностики поражения костного мозга посредством ФДГ-ПЭТ сопоставима с таковой при биопсии костного мозга.
ПЭТ с ФДГ успешно применяется для оценки эффективности проводимого лечения. Контроль ответа на химиотерапию обычно проводится через 3-4 цикла лечения. По данным некоторых исследователей, прогностическая информация может быть получена уже после первого цикла химиотерапии (Рис.3).
Рис. 3. ПЭТ-исследование при злокачественной лимфоме:
а) до лечения (поражение правых шейно-надключичных и медиастинальных лимфоузлов);
б) после эффективного лечения (отсутствие активных очагов специфической ткани).
Применение ПЭТ в диагностике метастазов меланомы
Меланома относится к опухолям с наиболее выраженным гликолизом, высоким захватом ФДГ и соотношением «опухоль-кровь». Основными задачами ПЭТ с ФДГ при обследовании больных меланомой являются: диагностика местной и региональной распространенности опухолевого процесса у больных меланомой высокого риска (толщина первичной опухоли больше 4,0 мм с прорастанием в подкожные ткани), выявление отдаленных метастазов и рецидивов опухоли.
В диагностике первичной опухоли и пораженных регионарных лимфоузлов в стадиях 1-2 метод ПЭТ с ФДГ обладает низкой чувствительностью, большая по величине опухоль выявляется отчетливо. В стадии 3 визуализируются практически все метастазы в регионарные лимфоузлы размерами более 10 мм, 83% метастазов размерами 6-10 мм и 13% метастазов меньших размеров.
В диагностике метастазов во внутренние органы общая чувствительность ПЭТ с ФДГ составляет 80-100%. Наиболее полезна ПЭТ у больных с наличием метастазов в брюшной полости (чувствительность – до 100%). По сравнению со стандартной КТ, ПЭТ более чувствительна и специфична в визуализации метастазов в кости, тонкую кишку и лимфоузлы, в то время как метастазы в легкие выявляются хуже. В диагностике метастазов в печень ПЭТ более чувствительна, чем УЗИ, КТ и МРТ.
Применение ПЭТ в диагностике
распространенности рака пищевода и желудка
Основными задачами исследования ПЭТ с ФДГ у больных раком пищевода и желудка являются: стадирование лимфоузлов и выявление отдаленных метастазов у больных с резектабельной опухолью.
Первичные опухоли пищевода и желудка, ограниченные слизистой оболочкой, с помощью ФДГ-ПЭТ визуализируются плохо. Их выявление становится возможным только при инвазии опухоли в подслизистый слой. Специфичность ПЭТ в стадировании лимфоузлов выше, чем у других методов лучевой диагностики (КТ, эндоскопической сонографии). В оценке отдаленных метастазов (в лимфоузлах, печени, плевре, грудной клетке и костях) ПЭТ с ФДГ имеет большую точность по сравнению со стандартным использованием СКТ и УЗИ. ПЭТ обладает высокой диагностической эффективностью в выявлении рецидивов рака пищевода, однако в диагностике перианастомотических рецидивов часто дает ложноположительные результаты из-за накопления ФДГ в участках воспаления. Отмечается высокая эффективность ПЭТ с ФДГ в оценке ответа на лучевую и химиотерапию опухолей пищевода и желудка.
Применение ПЭТ в диагностике
распространенности опухолей головы и шеи
Эффективность лечения больных раком органов головы и шеи в существенной мере зависит от точности оценки местной и регионарной распространенности опухолевого процесса.
Первичные опухоли, региональные и отдаленные метастазы характеризуются интенсивным захватом ФДГ. Метастазы в лимфоузлы характеризуются высоким захватом ФДГ и хорошо контрастируются. Установлено, что в выявлении метастатического поражения шейных лимфатических узлов у больных раком органов головы и шеи чувствительность и специфичность ПЭТ с ФДГ составили 90 и 94%, в то время как аналогичные показатели для КТ были 82 и 85%, МРТ – 80 и 79%.
ПЭТ с ФДГ также является эффективным и объективным инструментом оценки эффективности химиотерапии и лучевого лечения злокачественных опухолей головы и шеи. Метод позволяет дифференцировать жизнеспособную опухолевую ткань от фиброзно-склеротического процесса после лучевой терапии (Рис.4).
Рис. 4. ФДГ-ПЭТ и МРТ при плоскоклеточном раке слизистой левой щеки: А, B – до лечения; С, Д – после химиорадиотерапии.
При ФДГ-ПЭТ констатирован полный эффект в виде исчезновения гиперметаболического очага (истинно отрицательный результат), хотя на МРТ визуализируется остаточный субстрат (ложноположительный результат).
ФДГ позволяет эффективно выявить пораженные ЛУ средостения, а также отдаленные метастазы в легкие, печень, кости. Отсутствие захвата ФДГ обычно исключает остаточную или рецидивную опухоль.
При обследовании больных дифференцированным раком щитовидной железы наиболее важной задачей ФДГ-ПЭТ является выявление рецидивов у больных с повышенным уровнем опухолевого маркера (тиреоглобулина) на фоне отрицательного скана «всего тела» с 131 I. По мнению большинства исследователей, ФДГ-ПЭТ является эффективным методом выявления йод-негативного метастатического поражения шейно-надключичных, медиастинальных лимфоузлов и легких.
Применение ПЭТ в диагностике
распространенности рака молочной железы
Основной задачей ФДГ-ПЭТ при исследовании больных раком молочной железы является прогностическая оценка биологической активности первичной опухоли, диагностика регионарных и отдаленных метастазов, оценка эффективности проводимого противоопухолевого лечения и выявление местных рецидивов заболевания. Некоторые исследователи при наблюдении за группой больных местно-распространенным раком молочной железы отметили, что при высокой метаболической активности первичной опухоли, определяемой ФДГ-ПЭТ, можно прогнозировать низкую эффективность неоадъювантной химиотерапии. Что касается предоперационного стадирования рака молочной железы, то, по данным ряда зарубежных авторов, чувствительность ФДГ-ПЭТ при диагностике мультифокального поражения оказалась вдвое выше, чем при комбинированном применении маммографии и ультразвукового метода (63 и 32% соответственно). Чувствительность и специфичность ФДГ-ПЭТ при диагностике метастатического поражения аксиллярных лимфатических узлов составили 79 и 92% соответственно.
Влияние результатов ФДГ-ПЭТ на установление стадии заболевания и выбор тактики лечения рака молочной железы проанализировано в ряде зарубежных работ. Авторы указывают, что с учетом находок ФДГ-ПЭТ клиническая стадия была изменена в 36% наблюдений (28% – в сторону увеличения, 8% – в сторону уменьшения), вид лечения был скорректирован у 28%, а объем лечения – у 30% больных. Диагностическая чувствительность и специфичность ФДГ-ПЭТ при обследовании пациентов с подозрением на рецидив рака молочной железы, имеющих асимптоматическое повышение уровня опухолевых маркеров, составляют 96 и 90% соответственно [2, 4, 5].
Позитронные томографы обладают сравнительно невысоким пространственным разрешением, что затрудняет визуальный анализ ПЭТ-изображений. В связи с этим ПЭТ-сканеры производятся в конфигурации со сканерами рентгеновской компьютерной томографии (КТ), совмещенными в одной установке. Совмещение метаболических (ПЭТ) и анатомо-топографических (КТ) данных позволяет повысить точность локализации опухоли и определения распространенности заболевания. Совмещенная ПЭТ/КТ-технология позволяет получать более информативные изображения по сравнению с изображениями, получаемыми КТ- и ПЭТ-методами (Рис.5).
Рис. 5. КТ-изображение (А) и ПЭТ-изображение (В) плоскоклеточного рака левого легкого с метастазами в лимфоузлы средостения. Совмещенное КТ-ПЭТ-изображение (С) позволяет констатировать в рентгенологически выявленном очаге в легком наличие активной опухолевой ткани по периферии образования и очаг некроза в центре опухоли (помечено стрелкой).
Проблемы применения ПЭТ c ФДГ в онкологии
Клиническое применение ПЭТ с ФДГ выявило ряд ограничений, обусловленных, в частности, неспособностью эффективно выявлять опухоли малых размеров (до 10 мм), визуализировать некоторые опухоли мозга и опухоли мочеполовой системы, а также неспособностью дифференцировать злокачественные заболевания от воспалительных изменений. Поэтому задача разработки новых альтернативных ФДГ радиофармпрепаратов с более высокой туморотропностью и специфичностью является актуальной.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.